Chemie 17
Werbung

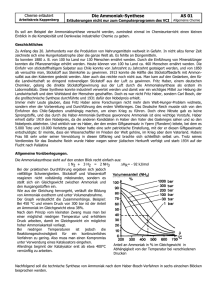
Chemie 17.01.2004 Die Beeinflussung vom Gleichgewicht Wir können das Gleichgewicht beeinflussen: durch Konzentrationsänderung, durch Temperaturänderungen und durch die Veränderung des Druckes. Druckveränderung Beispiel: Ammoniaksynthese Die Ammoniaksynthese ist exotherm! 3H2 + N2 2NH3 Die Ammoni Wie verändern sich das ganze Teil beim vermehrten Druck? (S. 34 im Buch) Wenn wir den Druck auf Ammoniak erhöhen, so verschiebt sich das Gleichgewicht auf die rechte Seite. Bei Drucksenkung verschiebt sich das Gleichgewicht nach links. Warum passiert das? Das System weicht immer aus nach dem Prinzip auf der Suche nach dem kleinsten Zwang! Wenn wir einen Druck ausüben auf so ein System, so wird es so sein, dass das ganze ausweichen will auf einen möglichst geringen Druck. Wenn wir ein Gemisch haben aus NH3, H und N und daraus einen Druck ausüben! Wie könnte das System ausweichen? Was ist zuerst Druck? Die Teilchen stossen an die Wände und das verursacht einen Druck. Und wenn es viele Teilchen sind, dann stossen mehr Teilchen an die Wand und es gibt einen höheren Druck. Wie kann die Teilchenzahl in diesem System abnehmen? Am Anfang der Reaktion hatten wir 4 mol Teilchen und nachher haben wir rechts 2 mol Teilchen. Je mehr Ammoniak gebildet wird, umso kleiner wird der Druck. d. h. Das System verschiebt den Gleichgewicht nach rechts, wo insgesamt weniger Teilchen vorhanden sind. Das ist genau der Prozess, der bei der Ammoniaksynthese statt findet. 2 Deutsche konnten als erste Ammoniak flüssig herstellen. Das waren Haber(Wissenschaft im Krieg für das Vaterland und im Frieden für die Menschheit) und Bosch. Haber hatte als erster Ammoniak flüssig hergestellt. Bosch war ein Industrieller, der innerhalb von 6 Monaten Ammoniak auf industrielle Weise Ammoniak herstellte. Um 1900 stieg die Bevölkerungszahl und es gab immer weniger Stickstoffdünger. Man wollte als Stickstoffdünger synthetisch herstellen. Vorher war man auf Salzlager in Südamerika angewiesenwo Kaliumnitrat vorkam. Man wollte also Ammoniak künstlich herstellen. Ammoniak stellt man durch künstliche Nitratsynthese. 1 NaNO3 ist auch ein Salpeter und wurde im grossen Still aus Südamerika importiert. Es kam zum Salpeter-Krieg zwischen Chile gegen Peru und Bolivien. Film: Die Leute hatten Angst vor einer Hungersnot, weil die Bevölkerungszahl wuchs. Die Geschichte von Bosch und Haber. Haber wollte Ammoniak aus Gasen Stickstoff und Wasserstoff produzieren, weil die produzierte Menge vom Bosch sehr gering war. Ein Molekül Stickstoff und 3 Moleküle Wasserstoff reagieren zu 2 Molekülen Ammoniak. Formel: Es werden sehr hohe Temperaturen gebraucht, um das chemisch stabile Stickstoffmolekül zu spalten. Bei zu hohen Temperaturen zerfallen die gebildete Ammoniak-Moleküle in die Ausgangsstoffe Wasserstoff und Stickstoff Die Konzentration an Ammoniak mit zunehmender Temperatur geht wieder zurück. Man wollte durch Druckerhöhung bei der Reaktion zwischen Wasserstoff und Stickstoff mehr Ammoniak herstellen. Damit Stickstoff und Wasserstoff auch bei den niedrigen Temperaturen reagieren, verwendete Haber ein Katalysator. Der Katalysator, der bei der Reaktion nicht verbraucht wird, ermöglicht bei den mässigen Temperaturen In Deutschland gab es erste Ammoniakfabrik! 1. Weltkrieg blablabla........ohne Haber-BoschVerfahren hätte Deutschland das 1. Weltkrieg verloren. Die beiden erhielten Nobelpreis. Haber war Jude und musste am Schluss Deutschland verlassen. (Erklärungen) Hier muss alles bei höher Temperatur passieren, aber das Gleichgewicht wird bei der exothermen Reaktion nach links verschieben und die endotherme Reaktion wird dann begünstigt. Unter hohem Druck verschiebt sich das Gleichgewicht nach rechts, aber unter Zugabe eines Katalysators kann bei den tieferen Temperaturen auch Ammoniak gebildet werden. Ammoniak wird dazugegeben und auf der anderen scheidet man Ammoniak ab, durch spülen. Am Schluss verschieben wir das Gleichgewicht mit Hilfe von Konzentrationsänderungen und damit erhält man eine grosse Ausbeutung an Ammoniak. Alle vier Faktoren sind bei dieser Synthese dabei, die eine Rolle spielen für die Gleichgewichtslage. Reaktionsbedingungen der Ammoniaksynthese Siehe Buch die Abbildung Wir brauchen relativ hohe Temperatur um Stickstoff zu spalten. Wenn wir eine hohe Temperatur um Stickstoff zu spalten haben, auf welche Seite verschiebt sich das Gleichgewicht? Auf die linke Seitedenn die endotherme Reaktion wird bei einer Temperaturerhöhung begünstigt. z. B. Bei der Temperatur von 700 Grad Celsius und einem tiefen Druck hat man kein Ammoniak mehr. Wenn man den Druck erhöht, dann kann man bei einer bestimmten hohen Temperatur ebenfalls Ammoniak haben. Mit der Druckerhöhung wirkt man der Temperaturerhöhung entgegen! Das Gleichgewicht verschiebt sich bei einer Druckerhöhung wieder auf die rechte Seite. Das wurde bei der Ammoniaksynthese ausgenützt: Druckerhöhung als Antwort auf die Temperaturerhöhung und das Gleichgewicht verschiebt sich dann auf die rechte Seite. 2 Das Blatt: Zusammenfassung: O2 und N2 strömen hinein, sowie auch CH4 und H2O und daraus ergeben sich schlussendlich N2, H2 und CO und die werden weiter verarbeitet. Dann erhält man N2, H2 und CO2, wobei CO2 wird ausgeschiedenman erhält hier reines N2 und H2. Jetzt wird das ganze erhitzt und gelangt unter hohem Druck in einen Katalysator. Wir haben dann hohe Wärme und Druck und einen Katalysator, der die Temperatur von 700 Grad auf 450 Grad sinkt. Damit liegt das Gleichgewicht nicht vollkommen rechts, sondern wir haben ca. 20-30% Ammoniak auf der rechten Seite. Aber weil man ständig N2 und H2 dazu geben, aber das kondensierte Dampf NH3 immer herausnehmen kann. Wenn wir das ganze kühlen, so wird NH3 zuerst flüssig und wird weggenommen. Das überschüssige N2 und H2 werden unter hohem Druck über den Katalysator gelassen Neues N2 und H2 kommen heraus und auf diese Art und Weise verschiebt man das Gleichgewicht durch Konzentrationsänderungen auf die rechte Seite. d.h. Auf die Ammoniakseite. Alle 4 Möglichkeiten werden hier angewendet um das Gleichgewicht zu ändern bzw. um Ammoniak zu erhalten. Steckbrief zum Ammoniak: -ein starkes Gift, gasförmig, stark und ist gefährlich für uns. In unserem Körper wird Ammoniak ständig gebildet und wirt als Harnstoff aus dem Körper transportiert. Gebrauch vom Ammoniak: in den Kühlmitteln, Kunstbahnen Ammoniak reagiert mit Wasser zu harmlosen Ammoniumion. 3