PSE_Teamknobeln_Erklaerungen_Stickstoff 1 / 2
Werbung

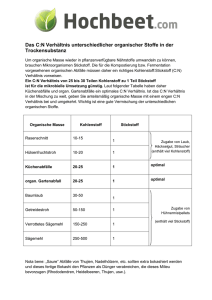
PSE_Teamknobeln_Erklaerungen_Stickstoff.doc 1/2 Teamknobeln Elemente Stickstoff 14u Ein paar Eigenschaften vorab: Schmelztemperatur: -210,1°C Siedetemperatur: -195,79°C Dichte: 0,001250 g/cm3 Den deutschen Namen erhielt das Element nach seiner erstickenden Wirkung, das Symbol „N“ kommt von »nitrogenium« = Salpeterbildner. Salpeter ist eine bedeutende Verbindung von Stickstoff mit Sauerstoff (s.u.). Stickstoff ist ein farb-, geruch- und geschmackloses Gas. Es bildet mit einem Anteil von 78,09 Volumenprozent den Hauptteil der Luft und die kleinsten Teilchen des Stickstoffgases sind „Moleküle“ die aus zwei Atomen bestehen (N2). Die extrem starke Bindung zwischen diesen zwei Atomen ist nur schwer zu spalten und daher ist Stickstoff sehr reaktionsträge. Dennoch kann man zahlreiche Stickstoffverbindungen herstellen und auch in der Natur tauchen eine Reihe davon auf. Gebunden findet er sich in z.B. Salpeter (NaNO3 bzw. KNO3), in Lebewesen (Eiweiß, Nukleinsäuren, Harnstoff, Harnsäure). Da die Lebewesen zum Aufbau der Eiweiße keinen Stickstoff aus der Luft brauchen können, sind sie auf Stickstoffverbindungen angewiesen. Dabei „hilft“ die Natur: Wichtige Stickstoffverbindungen Name der Verbindung Formel Salpeter Nitrat Ammoniak KNO3 NO3NH3 Es gibt verschiedene Bakteriensorten, die in der Lage sind, Stickstoff aus der Luft im Boden zu „fixieren: Die in den Wurzelknöllchen der Schmetterlingsblütler (Leguminosen) in einer Symbiose mit der Pflanzenwurzel lebenden Bakterien können Ammoniak (eine Wasserstoffverbindung des Stickstoffs, NH3) herstellen Andere Bakterien bilden aus dem Ammoniak sogenannte Nitrate (Sauerstoffverbindungen, enthalten alle NO3-) Die Nitrate werden von Menschen ebenso in Düngemitteln wie in Sprengstoffen benötigt (s.u.). Anderer Stickstoffoxide (NO und NO2) aus Abgasen, sind Mitverursacher des »Sauren Regens«. Stickstoff dient als Schutzgas beim Umgang mit leicht- bzw. hochentzündlichen Stoffen. Flüssiger Stickstoff hat eine Temperatur von -196 C und wird als Kühlmittel für Lebensmittel oder in der Medizin zum Schockgefrieren von Embryonen, Gewebeteilen (bei Operationen), Blut, Antibiotika, Bakterienkulturen oder Impfstoffen genutzt. Das Schockgefrieren geht sehr schnell, so dass sich keine großen Eiskristalle bilden, die Zellen von innen zerstören könnten. Werden Stoffe oder Gegenstände in flüssigen Stickstoff gehalten, ändern sie durch die Abkühlung ihre Eigenschaften. Bis zu Beginn des letzten Jahrhunderts konnte man den in Nitrate, die man zur Herstellung von Dünger und Schießpulver brauchte, nur in solchen Gegenden finden, in denen es sehr trocken war. Dies liegt daran, dass Salpeter gut wasserlöslich ist. Ein Fundort war eine Wüste in Chile, von wo aus Chilesalpeter (= Natriumnitrat) auch nach Deutschland exportiert wurde. PSE_Teamknobeln_Erklaerungen_Stickstoff.doc 2/2 Es war eine der bedeutendsten Errungenschaften der Chemie, als es Anfang des 20. Jahrhunderts gelang, Ammoniak, den Ausgangsstoff für Stickstoffdünger, industriell herzustellen. Der war zu dieser Zeit bitter nötig, damit die Landwirtschaft ausreichend Nahrungsmittel für die explosionsartig wachsende Bevölkerung produzieren konnte. Denn erst jetzt konnte die Nährstoffmenge, die die Pflanzen dem Boden entziehen, in gleichem Umfang ersetzt werden. Ab 1904 begann Fritz Haber sich mit der Herstellung von Ammoniak zu befassen, aus dem man wiederum Salpeter herstellen kann. 1908 begann Carl Bosch die Vorschläge in der Praxis erproben. Die technische Verwirklichung des inzwischen »Haber-Bosch-Verfahren« genannten Prozesses gelang schließlich 1912 nach großen Schwierigkeiten. Fritz Haber erhielt für seine Verdienste um die Ammoniaksynthese im Jahr 1918 den Nobelpreis, Carl Bosch 1931. Heute beträgt die Weltproduktion von Ammoniak rund 125 Millionen Tonnen jährlich, große Anlagen erzeugen bis zu 2 000 Tonnen Ammoniak pro Tag. Zusatzaufgaben: 1. Was hat Tiefkühlpizza mit Stickstoff zu tun? 2. Was wird beim Haber-Bosch-Verfahren hergestellt? 3. Erkläre seine Bedeutung für die Menschen.