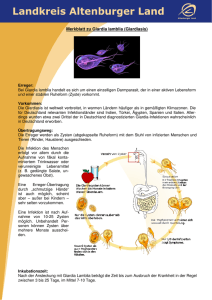
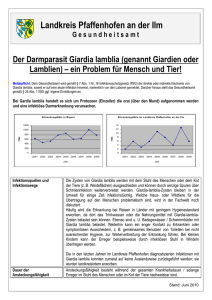
Protozoonosen 1.2 Flagellaten = Geißeltierchen Trichomonas vaginalis Erreger von Kolpitis, Urethritis Lamblia intestinalis (= Giardia lamblia) Durchfallerreger Trypanosomen Erreger der - Schlafkrankheit - Chagas-Erkrankung Leishmanien Erreger der - „Orientbeule“ - Kalar Azar Trichomonas vaginalis - Übertragung Vorkommen: weltweit Prävalenz in Industrienationen: Frauen: 5-20% Mäner: < 5% Trichomonas - Morphology T. vaginalis • Diagnostik: – Nativpräparat aus dem Urogenitaltrakt • Therapie: – Metronidazol • Sexualpartner mitbehandeln (Wasserfloh-artige (PING-PONG) Bewegungen) Protozoonosen 1.2 Flagellaten = Geißeltierchen Trichomonas vaginalis Erreger von Kolpitis, Urethritis Lamblia intestinalis (= Giardia lamblia) Durchfallerreger Trypanosomen Erreger der - Schlafkrankheit - Chagas-Erkrankung Leishmanien Erreger der - „Orientbeule“ - Kalar Azar Giardia – Lebenszyklus Verbreitung: weltweit Prävalenz: Europa: 3-4% Entwicklungsländer: > 50% Giardia lamblia = Lamblia intestinalis Giardia lamblia (= Lamblia intestinalis) • Übertragung – durch kontaminiertes Wasser – Schmierinfektion • Klinik – häufig symptomlos – wässriger Durchfall – leichtes Fieber – Erbrechen Giardia lamblia (= Lamblia intestinalis) • Diagnostik – Erregernachweis im Stuhl (IFT) • Therapie – Metronidazol • Prophylaxe – Vermeide ungekochtes Wasser Kinetoplastid pathogens Wichtige humanpathogene Leishmanien Alte Welt Verbreitung L. donovani L. infantum L. major L. tropica L. aethiopica Ostafrika, China, Indien Mittelmeerländer Vorderer Orient, Afrika Vorderer Orient Äthiopien, Kenia Krankheit viszeral viszeral cutan cutan cutan Neue Welt L. mexicana Zentralamerika L. chagasi Lateinamerika L. brasiliensis Zentral- und Südamerika cutan viszeral cutan, mucocutoan Viszerale Leishmaniose Kutane und mukokutane Leishmaniosen Lutzomyia Stadien von Kinetoplastiden Opsonization mediated Uptake Leishmania promastigote fibronectin C3b hypothetical parasite molecules eg. LPG, proteases C3b receptor fibronectin receptor Phagocytosis Macrophage Intracellular compartments exploited by parasitic protozoa Leishmania promastigote form Phagocytosis early endosome pH 6.2 passive invasion amastigote form phagolysosome late endosome pH 4.7-5.2 Oberflächenmoleküle der Leishmanien Protease, Aktivitätsoptimum bei saurem pH auf Promastigoten mehr als auf Amastigoten verhindert Fusion mit Lysosom Nutrient acquisition by Leishmania Host Cell Cytosol pH 7 Vacuole pH 5 Receptor mediated endocytosis Proton Pumps Solutes: ions sugars amino acids nucleosides Nutrient Transporters Parasite pH 7 hydrolytic, nutrient-rich Es gibt unterschiedliche Helfer-Zellen 2. Entweder werden IL-12/IFNγ oder IL-4 sezerniert (häufig je nach Herkunft des Antigens (intrazelluläre Erreger bzw. Würmer/Allergene) Es gibt unterschiedliche Helfer-Zellen 2. Entweder werden IL-12/IFNγ oder IL-4 sezerniert (häufig je nach Herkunft des Antigens (intrazelluläre Erreger bzw. Würmer/Allergene) Es gibt unterschiedliche Helfer-Zellen 8. Manche intrazellulären Krankheitserreger (z.B. Leishmanien) inhibieren die Aktivierung von TH1-Zellen Kinetoplastid pathogens Chagas Megakolon Stadien von Kinetoplastiden Intracellular compartments exploited by parasitic protozoa Leishmania passive invasion Phagocytosis phagolysosome early endosome pH 6.2 late endosome pH 4.5 T. cruzi Parasite induced uptake into Lysosomes T. cruzi Ca 2+ agonist Receptor signalling Ca 2+ Endosomes Nucleus ER Lysosomes Parasite induced uptake into Lysosomes T. cruzi Ca 2+ agonist Receptor signalling Ca 2+ 30 min Endosomes Nucleus Lysosome ER Sleeping Sickness African Trypanosomiasis Sleeping sickness • Affects about 500,000 Africans especially in Sudan, Uganda, Angola. In same villages 20% or more are infected • Lives in the blood. Transmitted by Tsetse flies • Early stage fever, malaise, treatable with about three drugs • Late stage - brain - mental disorder, disrupted sleep-wake cycle. Main drug treatments arsenicals with 2% lethality. Alternative DFMO. Permanent damage. • No immunity possible due to infinite capacity for antigenic variation • Varieties also affect cattle, horses, camels, pigs Geographic distribution of African trypanosomiasis Trypanosoma brucei: the parasite that does it all Westafrika: palpalis-Gruppe, Feuchtbiotope Ostafrika: morsitans-Gruppe, Savannenbiotope Trypanosoma brucei T. brucei brucei T. brucei gambiense Nagana Viehseuche W-Afrika chron. Schlafkrankheit T. brucei rhodesiense O-Afrika akute Schlafkrankheit Trypomastigotes in human blood Die Glycolyse findet in Glycosomen statt Parasitendichte im Blut Variation and parasitaemia Variation and parasitaemia Variation and parasitaemia Structure of the Variant Surface Glycoprotein (VSG) Structure of VSG Variation via promoter switch Example: Plasmodium falciparum var genes Antigenic variation in trypanosomes VSG VSGs Trans-splicing in Trypanosoma brucei Unterscheidung T. brucei brucei von anderen Subspezies T. b. brucei T. b. rhodesiense T. b. gambiense Unterscheidung T. brucei brucei von anderen Subspezies T. b. brucei T. b. rhodesiense + human. Serum T. b. gambiense ⇒humanes Serum enthält einen trypanolytischen Faktor für T. b. brucei Der trypanolytische Faktor ist vermutlich das LDL-1 Lipoprotein LDL-Low Density Lipoprotein Particle (generelle Struktur, es gibt unterschiedliche LDL‘s) LDL-Rezeptor vermittelte Endozytose In T. b. brucei: der trypanolytische Faktor zerstört das Lysosom der Parasiten In T. b. rhodesiense und T. b. gambiense: Beide Parasiten besitzen ein Protein, das vermutlich den trypanolytischen Faktor im Lysosom inaktiviert. Deletion des Gens: Parasiten werden sensitiv für humanes Serum