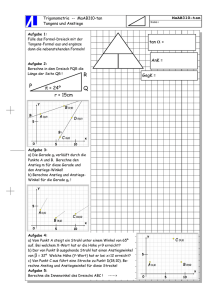
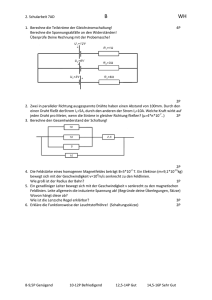
Ubung und Anwendung -kalorimetrische Aufgaben 1. In einem Kalorimeter wurden 100 ml HCl und 100 ml NaOH neutralisiet (Stoffmengenkonzentration je 1 M) Die Temperaturerhöhung wurde mit 6,7 K gemessen. Neutralisationsenthalpie! Berechne die molare 2. In einem Kalorimeter werden 3 g Lithiumoxid in 100 ml Wasser von 20°C gelöst. Die Lösung erwärmt sich dabei auf 52,3°C. Es entsteht eine basische Lösung. Formuliere für die Reaktion die Reaktionsgleichung und berechne die molare Reaktionsenthalpie! 3. Bei der Herstellung von Soda (Natriumcarbonat) wird als Zwischenprodukt Ammoniumhydrogencarbonat gebildet: NHs+ H0+ CO2 Zur NHaHCO3 AH -88 KJ/mol Begünstigung der exothermen Reaktion wird gekühlt Berechne, welches Volumen an Kühlwasser in m* zur Herstellung von einer Tonne Ammoniumhydrogencarbonat erforderlich ist, wenn sich das Kühlwasser a) b) im Winter von +10°C auf +45°C im Sommer von +20°C auf +45°C erwärmt! Berechne den Kühlwasserverbrauch in Kubikmeter! 4.1. In einem Kalorimeter werden 50 ml 0,5 M Salpetersäure und 50 ml einer 0,5 M Kaliumhydroxid gegeben. Die dabei ermittelte molare Reaktionsenthalpie betrug- 56 kJ/mol. Berechne die Temperaturänderung! 4.2. Der gleiche Versuch wurde mit 20 ml einer 1 M Salzsäuresäure und 5 ml einer 2M Natriumhydroxidlösung durchgeführt. Die Temperaturdiferenz betrug 5,3 °C. Berechne daraus die molare Reaktionsenthalpie und runde den Wert auf! (Anforderungsniveau lI) 4.3. Vergleiche die molaren Reaktionsenthal pie-Werte aus 4.1. und 4.2.! 4.4. Formuliere die Reaktionsgleichungen für beide Reaktionen! Trage alle Oxidationszahlen ein und bestimme den vorliegenden Reaktionstyp! Achte auf den korrekt geführten Lösungsweg mit Angabe der Einheiten!