Suszeptibilitätsgewichtete Bildgebung in der neuroradiologischen
Werbung
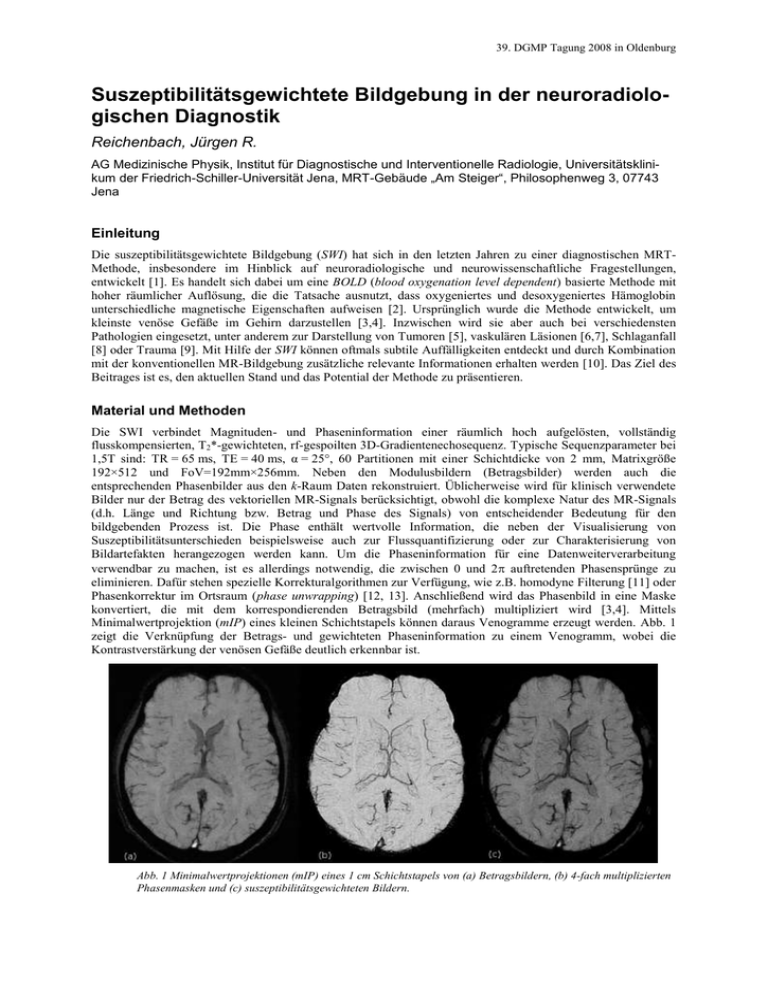
39. DGMP Tagung 2008 in Oldenburg Suszeptibilitätsgewichtete Bildgebung in der neuroradiologischen Diagnostik Reichenbach, Jürgen R. AG Medizinische Physik, Institut für Diagnostische und Interventionelle Radiologie, Universitätsklinikum der Friedrich-Schiller-Universität Jena, MRT-Gebäude „Am Steiger“, Philosophenweg 3, 07743 Jena Einleitung Die suszeptibilitätsgewichtete Bildgebung (SWI) hat sich in den letzten Jahren zu einer diagnostischen MRTMethode, insbesondere im Hinblick auf neuroradiologische und neurowissenschaftliche Fragestellungen, entwickelt [1]. Es handelt sich dabei um eine BOLD (blood oxygenation level dependent) basierte Methode mit hoher räumlicher Auflösung, die die Tatsache ausnutzt, dass oxygeniertes und desoxygeniertes Hämoglobin unterschiedliche magnetische Eigenschaften aufweisen [2]. Ursprünglich wurde die Methode entwickelt, um kleinste venöse Gefäße im Gehirn darzustellen [3,4]. Inzwischen wird sie aber auch bei verschiedensten Pathologien eingesetzt, unter anderem zur Darstellung von Tumoren [5], vaskulären Läsionen [6,7], Schlaganfall [8] oder Trauma [9]. Mit Hilfe der SWI können oftmals subtile Auffälligkeiten entdeckt und durch Kombination mit der konventionellen MR-Bildgebung zusätzliche relevante Informationen erhalten werden [10]. Das Ziel des Beitrages ist es, den aktuellen Stand und das Potential der Methode zu präsentieren. Material und Methoden Die SWI verbindet Magnituden- und Phaseninformation einer räumlich hoch aufgelösten, vollständig flusskompensierten, T2*-gewichteten, rf-gespoilten 3D-Gradientenechosequenz. Typische Sequenzparameter bei 1,5T sind: TR = 65 ms, TE = 40 ms, α = 25°, 60 Partitionen mit einer Schichtdicke von 2 mm, Matrixgröße 192×512 und FoV=192mm×256mm. Neben den Modulusbildern (Betragsbilder) werden auch die entsprechenden Phasenbilder aus den k-Raum Daten rekonstruiert. Üblicherweise wird für klinisch verwendete Bilder nur der Betrag des vektoriellen MR-Signals berücksichtigt, obwohl die komplexe Natur des MR-Signals (d.h. Länge und Richtung bzw. Betrag und Phase des Signals) von entscheidender Bedeutung für den bildgebenden Prozess ist. Die Phase enthält wertvolle Information, die neben der Visualisierung von Suszeptibilitätsunterschieden beispielsweise auch zur Flussquantifizierung oder zur Charakterisierung von Bildartefakten herangezogen werden kann. Um die Phaseninformation für eine Datenweiterverarbeitung verwendbar zu machen, ist es allerdings notwendig, die zwischen 0 und 2 auftretenden Phasensprünge zu eliminieren. Dafür stehen spezielle Korrekturalgorithmen zur Verfügung, wie z.B. homodyne Filterung [11] oder Phasenkorrektur im Ortsraum (phase unwrapping) [12, 13]. Anschließend wird das Phasenbild in eine Maske konvertiert, die mit dem korrespondierenden Betragsbild (mehrfach) multipliziert wird [3,4]. Mittels Minimalwertprojektion (mIP) eines kleinen Schichtstapels können daraus Venogramme erzeugt werden. Abb. 1 zeigt die Verknüpfung der Betrags- und gewichteten Phaseninformation zu einem Venogramm, wobei die Kontrastverstärkung der venösen Gefäße deutlich erkennbar ist. Abb. 1 Minimalwertprojektionen (mIP) eines 1 cm Schichtstapels von (a) Betragsbildern, (b) 4-fach multiplizierten Phasenmasken und (c) suszeptibilitätsgewichteten Bildern. 39. DGMP Tagung 2008 in Oldenburg Ergebnisse Die Abbildungen 2-5 zeigen einige Beispiele, die das Potenzial der suszeptibilitätsgewichteten Bildgebung illustrieren sollen. Abb. 2. T1-gewichtete Bilder (TR = 575 ms, TE = 14 ms, = 70° (a) vor und (b) nach Applikation eines T 1-verkürzenden Kontrastmittels (Gd-DTPA). (c) Die Heterogenität des Tumors wird mit der suszeptibilitätsgewichteten Bildgebung besser als in (a) und (b) dargestellt. Gut erkennbar sind die Tumorgefäße, die zu der in (b) sichtbaren Signalanreicherung durch das Kontrastmittel führen. Abb. 3. 14-jähriger Patient mit akuter lymphozytischer Leukämie (ALL). Das suszeptibilitätsgewichtete Bild (Projektion über 7 Schichten) zeigt multiple Hämorrhagien. Abb. 4. 12-Monate alter Patient mit Sturge-Weber Syndrom. Man beachte die gute Darstellung der internen Venen, die mit konventioneller diagnostischer MR-Bildgebung nicht erkennbar sind. Abb. 5. Mittelwertprojektion über mehrere Phasenbilder eines Probanden. Verschiedene anatomische Strukturen werden gut abgrenzbar dargestellt. Diskussion Die suszeptibilitätsgewichtete Bildgebung (SWI) hat sich zwischenzeitlich zu einer bedeutenden nicht-invasiven diagnostischen MR-Methode für die neuroradiologische Bildgebung entwickelt. Sie liefert nicht nur wertvolle zusätzliche diagnostische Information, die für eine umfassende Beurteilung hilfreich ist, sondern kann selbst Läsionen nachweisen, die unter Einsatz konventioneller MR-Techniken nicht oder nur eingeschränkt dargestellt werden können. Beispielsweise sind damit kleinste Hirnblutungen erkennbar, so dass eine drohende Ischämie ggf. schneller diagnostiziert werden kann und Therapien früh eingeleitet werden können. Aufgrund der Empfindlichkeit für desoxygeniertes Blut oder im Gefäßsystem liefert sie genauere Informationen über Hämorrhagien, venöse und arteriovenöse Missbildungen. Als mögliche weitere klinische Einsatzgebiete sind neben zerebrovaskulären Erkrankungen ebenfalls neurodegenerative Erkrankungen zu nennen. Zukünftige klinische Anwendungen werden die Methode in zunehmenden Maß bei höheren Feldstärken (≥ 3T) nutzen [14]. 39. DGMP Tagung 2008 in Oldenburg Referenzen [1] Haacke EM, Xu Y, Cheng YC, Reichenbach JR. Susceptibility weighted imaging (SWI). Magn Reson Med 2004;52(3): 612-8. [2] Pauling L, Coryell CD. The Magnetic Properties and Structure of Hemoglobin, Oxyhemoglobin and Carbonmonoxyhemoglobin. Proc Natl Acad Sci U S A 1936;22(4):210-6. [3] Reichenbach JR, Venkatesan R, Schillinger DJ, Kido DK, Haacke EM. Small vessels in the human brain: MR venography with deoxyhemoglobin as an intrinsic contrast agent. Radiology 1997;204(1):272-7. [4] Reichenbach JR, Essig M, Haacke EM, Lee BC, Przetak C, Kaiser WA, Schad LR. High-resolution venography of the brain using magnetic resonance imaging. MAGMA 1998;6(1):62-9. [5] Barth M, Nöbauer-Huhmann IM, Reichenbach JR, Mlynárik V, Schöggl A, Matula C, Trattnig S. High-resolution threedimensional contrast-enhanced blood oxygenation level-dependent magnetic resonance venography of brain tumors at 3 Tesla: first clinical experience and comparison with 1.5 Tesla. Invest Radiol 2003;38(7):409-14. [6] Lee BC, Vo KD, Kido DK, Mukherjee P, Reichenbach J, Lin W, Yoon MS, Haacke M. MR high-resolution blood oxygenation level-dependent venography of occult (low-flow) vascular lesions. AJNR Am J Neuroradiol 1999;20(7):123942. [7] Reichenbach JR, Jonetz-Mentzel L, Fitzek C, Haacke EM, Kido DK, Lee BC, Kaiser WA. High-resolution blood oxygenlevel dependent MR venography (HRBV): a new technique. Neuroradiology 2001;43(5):364-9. [8] Hermier M, Nighoghossian N. Contribution of susceptibility-weighted imaging to acute stroke assessment. Stroke 2004;35(8):1989-94. [9] Ashwal S, Holshouser BA, Tong KA. Use of advanced neuroimaging techniques in the evaluation of pediatric traumatic brain injury. Dev Neurosci 2006;28(4-5):309-26. [10] Sehgal V, Delproposto Z, Haacke EM, Tong KA, Wycliffe N, Kido DK, Xu Y, Neelavalli J, Haddar D, Reichenbach JR. Clinical applications of neuroimaging with susceptibility-weighted imaging. J Magn Reson Imaging 2005;22(4):439-50. [11] Noll DC, Nishimura DG, Macovski A. Homodyne detection in magnetic resonance imaging. IEEE Trans Med Imaging 1991;10(2):154-63. [12] Xu W, Cumming I. A region growing algorithm for InSAR phase unwrapping. IEEE Tran Geosci Remote Sensing 1999;37:124–134. [13] Rauscher A, Barth M, Reichenbach JR, Stollberger R, Moser E. Automated unwrapping of MR phase images applied to BOLD MR-venography at 3 Tesla. J Magn Reson Imaging 2003;18(2):175-80. [14] Noebauer-Huhmann IM, Pinker K, Barth M, Mlynarik V, Ba-Ssalamah A, Saringer WF, Weber M, Benesch T, Witoszynskyj S, Rauscher A, Reichenbach JR, Trattnig S. Contrast-enhanced, high-resolution, susceptibility-weighted magnetic resonance imaging of the brain: dose-dependent optimization at 3 tesla and 1.5 tesla in healthy volunteers. Invest Radiol 2006;41(3):249-55.