Praktikum
Werbung

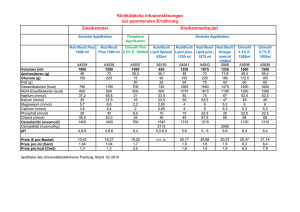
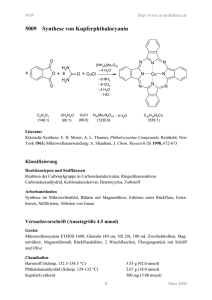
Praktikum Anorganische Chemie I 7. November – 21. Dezember 2007 Labor 312 Einführungsveranstaltung: Mittwoch, 7. November 2007, 13.15 Uhr, Raum S 379 Ricarda Berger, Raum N 418/420, Tel. 4289, e-mail: [email protected] Dr. Gaëtan Couderc, Raum N 418/420, Tel. 4289, e-mail: [email protected] Carmen Blum, Raum N 413/427, Tel. 3274, e-mail: [email protected] Organisation des Praktikums Laborzeiten Mittwoch 13.00 Uhr – 18.00 Uhr Donnerstag 10.00 Uhr – 18.00 Uhr (9 – 17 Uhr) Freitag 10.00 Uhr – 17.00 Uhr (9 – 16 Uhr) Vorbereitung Die Anleitungen müssen aus dem Internet ausgedruckt und gelesen werden. Die darin enthaltenen Aufgaben müssen durchgearbeitet und verstanden sein. Sie sind Bestandteil des Vorgespräches. Praktikum Vor jedem Versuch wird ein Gespräch mit dem jeweiligen Assistenten geführt. Dafür muss ein komplett ausgefüllter Protokoll-Schein vorliegen, welcher nach Beendigung des Gespräches vom Assistenten unterzeichnet wird. Inhalt des Gesprächs sind unter anderem die Aufgaben aus der Anleitung, Sicherheitsvorschriften für den Versuch, die Durchführung des Versuches und die Kenntnis der Apparatur. Vor Beginn einer Reaktion ist die Apparatur dem Assistenten zu zeigen. Bericht Für jeden Versuch muss ein Bericht verfasst werden. Dieser muss spätestens am Montag nach Abschluss des Versuches beim Assistenten abgegeben werden. Die pünktliche Abgabe des Berichts fliesst in die Bewertung ein! Der Bericht muss folgende Punkte beinhalten: Den Protokoll-Schein als Deckblatt, Thema des Versuches, exakte Reaktionsgleichungen, experimentelle Durchführung, Beobachtungen, Ausbeuteberechnung, Diskussion, Lösung der Aufgaben, Literaturreferenzen, sämtliche Spektren als Anhang. Noten Das Praktikum wird benotet. Dabei werden die praktische Arbeit im Labor und der Bericht berücksichtigt. Weiterhin wird als Abschluss des Praktikums eine Klausur geschrieben. Die Noten werden wie folgt gewichtet: Laborarbeit 2 Vorgespräch 1 Berichte 1 Klausur 2 Ordnung im Labor Ordnung im Labor trägt zur Arbeitssicherheit bei! Dies gilt sowohl am eigenen Arbeitsplatz als auch bei den Waagen, in den Kapellen und für Lösungsmittelabfälle. Verbrauchsmaterial Geht Verbrauchsmaterial aus, so ist dies rechtzeitig den Assistenten zu melden (Öffnungszeiten der Ausgabe beachten!). Literatur: für alle Versuche gültige Literaturempfehlungen C. E. Mortimer, Chemie – Das Basiswissen der Chemie, Thieme, 9. Auflage, 2007. A. F. Hollemann, E. Wiberg, Lehrbuch der Anorganischen Chemie, de Gruyter, 101. Auflage, 1995. C. E. Housecroft, A. G. Sharpe, Inorganic Chemistry, 2. Auflage, 2005, Pearson Education Ltd, Essex. D. F. Shriver, P. W. Atkins, C. H. Langford, Anorganische Chemie, 1992, VCH, Weinheim. www.roempp.com (Uni-Lizenz) Kristallzüchtung von Aluminiumalaun und Herstellung von Thénard’s Blau Reaktionsgleichungen: Durchführung: 1) Zur Herstellung des Alauns löst man Al2(SO4)3·18 H2O in 25 ml heissem Wasser und gibt eine warme Lösung der äquimolaren Menge an K2SO4 in 50 ml Wasser hinzu. Diese Lösung lässt man langsam abkühlen, wobei sich Alaunkristalle abscheiden werden. Für die gezielte Kristallzüchtung werden 16 g Alaun in 100 ml Wasser gelöst und kurz auf 60 °C erwärmt. Daraufhin lässt man auf Raumtemperatur abkühlen, das überschüssige Salz auskristallisieren, bringt nach dem Abfiltrieren einen Keimkristall ein und lässt die Lösung bei konstanter Temperatur langsam verdampfen. 2) Zur Darstellung des Spinells werden äquimolare Mengen (Stöchiometrie beachten!) an Alaun und CoSO4·7 H2O sowie die 1.5-fache Gewichtsmenge an KCl als Lösungsmittel gemischt und anschliessend in einem Porzellantiegel mit Deckel für ca. 3 h auf 1100 °C in einem Muffelofen erhitzt. Die erkaltete Lösung wird im Mörser zerkleinert und mit heissem Wasser ausgewaschen, bis die Reaktion auf Chlorid negativ ausfällt. Abschliessend trocknet man bis zur Gewichtskonstanz. Ansatz: 100 mmol Alaun 6 mmol Thénard’s Blau Analysen: IR-Spektroskopie Pulverdiffraktion Morphologie der erhaltenen Kristalle Aufgaben: 1. Beschreiben Sie thermodynamisch an Hand eines Zweikomponenten-Phasendiagrammes, wie die Kristallisation von Alaun auszuführen ist. 2. Wie stellen Sie sich einen Kristallkeim vor? 3. Was bedeutet Übersättigung? 4. Beschreiben Sie die Solvatation von Al3+ und Co2+ in KCl (l). 5. Wie erklären Sie den Verlust an KCl durch Erhitzen? 6. Wie könnten Sie prüfen, ob sich in der zugegebenen Menge KCl alles Edukt aufgelöst hat? 7. Wie kann man die Abwesenheit von Chlorid prüfen? 8. Nennen Sie Beispiele natürlicher Spinelle. 9. Diskutieren Sie den Aufbau einer Spinellstruktur und geben Sie Besetzungsmodelle in Spinellen an. 10. Beschreiben Sie die physikalischen Eigenschaften von Spinellen und nennen Sie eine technische Anwendung. Literatur: A. R. West, Solid State Chemistry and its Applications, John Wiley & Sons, 1992. J. Hulliger, Angew. Chem. 1994, 106, 151. Wilke, K-Th., Kristallzüchtung, 2. Auflage, Deutsch Harri-Verlag, 1988. Bariumtitanat Reaktion 1: Titantetrabutylat und Bariumacetylacetonat Durchführung: 5 mmol Titan(IV)butylat werden mit 20 ml 2-Butanol verdünnt und langsam zu einer Emulsion von 5 mmol Bariumacetylacetonat in 20 ml 2-Butanol getropft. Nach 2 h Rühren werden 30 ml dest. Wasser dazugegeben und weitere 30 Min. lang gerührt. Das nun gelbliche Gemisch wird zur besseren Trennung in einen 100 ml Messzylinder gegeben und über Nacht stehen gelassen. Die wässrige Phase wird danach abpipettiert und das gelbe Gel über Nacht in einer Kristallisationsschale bei 100 °C getrocknet. Der Feststoff wird anschliessend vermörsert und in einem Tiegel einen Tag bei 800 - 900 °C im Muffelofen zur Reaktion gebracht. Reaktion 2: Oxalsäure, Bariumchlorid und Titantetrachlorid Durchführung: 17.1 mmol Titantetrachlorid werden mit einer Spritze in einen eisgekühlten Erlenmeyerkolben gegeben. (Achtung: Beim Öffnen der Flasche entstehen HCl-Dämpfe, nur unter dem Abzug arbeiten, doppelte Handschuhe tragen!). Zum TiCl4 werden 17.3 mmol BaCl2·2H2O gegeben und tropfenweise mit 85 ml Wasser versetzt, bis sich das Salz fast vollständig aufgelöst hat (Kühlen im Eisbad). Die farblose Lösung wird zu einer auf 80 °C erhitzten Oxalsäurelösung (37.6 mmol in ca. 50 ml Wasser) tropfenweise zugegeben (Temperatur nicht über 85 °C). Der erhaltene weisse Niederschlag wird abgenutscht, mit Wasser gewaschen und an der Luft bei RT getrocknet. Das so erhaltene Bariumtitanyloxalat wird zur thermischen Zersetzung einen Tag lang bei 800 - 900 °C im Muffelofen zur Reaktion gebracht. Analysen: Pulverdiffraktometrie Elektrische Polung SHG Nachweis Aufgaben: 1. Welche prinzipiellen Herstellungsverfahren gibt es für Bariumtitanat? 2. Was sind Sol-Gel-Verfahren? Nennen Sie Vor- und Nachteile. 3. Welche Kristallstruktur hat Bariumtitanat? Diskutieren Sie die Struktur gemäss Kugelpackungsmodell. 4. Diskutieren Sie die Caesiumchlorid-Struktur im Vergleich zu jener von Kochsalz. 5. Was ist ein Ferroelektrikum? 6. Was verstehen Sie unter dem pyroelektrischen und dem piezoelektrischen Effekt? 7. Wo werden diese Effekte im Alltag eingesetzt? 8. Geben Sie eine Strukturformel für sämtliche Reaktanden von Reaktion 1 an. Was bedeutet „Keto-Enol-Tautomerie“? Literatur: D. Hennings, M. Klee, R. Waser, Adv. Mater. 1991, 3, 334. R. Marder, J. E. Sohn, G. D. Stucky, Materials for Nonlinear Optics: Chemical Perspectives, ACS, 1991. F. Agullo-Lopez, J. M. Cabrera, F. Agullo-Rueda, Electrooptics, Phenomena, Materials and Applications, 1994, Academic Press, London. Extraktion von Chlorophyll aus Grünpflanzen Durchführung: In einem Mörser werden 100 g grüne Blätter mit etwas Seesand verrieben. Mit dem erhaltenen Brei wird eine Soxhlet-Extraktion mit Ethanol durchgeführt. Die resultierende Lösung wird am Rotationsverdampfer eingeengt und die Blattfarbstoffe werden säulenchromatographisch mittels Kieselgel 60 aufgetrennt. Als Elutionsmittel wird Petrolether / Aceton = 3 : 2 oder 2 : 1 oder Petrolether (60/80) / Toluol = 4 : 1 dann Toluol / Aceton = 4 : 1 oder Hexan verwendet. Analysen: Dünnschichtchromatographie UV/VIS-Spektroskopie Aufgaben: 1. Was ist Chlorophyll? Wie viele verschiedene Chlorophylle gibt es? Was sind die Unterschiede? Wo sind diese enthalten? 2. Welches Zentralmetall ist in Chlorophyll enthalten? 3. Welche Funktion übt Chlorophyll in den Lebewesen aus? 4. Porphyrine und Phthalocyanine sind bekannte Liganden. Diskutieren Sie Unterschiede und Gemeinsamkeiten. 5. Wie funktioniert eine Soxhlet-Extraktion? Woher stammt der Name Soxhlet? Literatur: P. Nuhn, Naturstoffchemie, 4. Auflage, 2006, S. Hirzel Verlag, Stuttgart. Autorenkollektiv, Organikum – Organisch-chemisches Grundpraktikum, Wiley-VCH, Weinheim, 21. Auflage, 2001. (für Extraktion und Chromatographie) Tris-(ethylendiamin)-cobalt(III)-chlorid Reaktionsgleichung: ... CoCl2 + ... C2H4(NH2)2 + ... C2H4(NH2)2·HCl + ... O2 Durchführung: 100 mmol 1,2-Ethylendiamin wird in Wasser zur einer Lösung verdünnt, deren Konzentration (an Amin) 30% beträgt und anschliessend teilweise mit 10 mmol 6 molarer Salzsäure neutralisiert. Diese Mischung gibt man zu einer Lösung von 10 mmol Cobalt(II)-chloridHexahydrat in 7.5 ml Wasser. Durch diese gemeinsame Lösung wird für etwa 3 h lang ein Luftstrom geleitet. Anschliessend wird die Lösung am Ölbad eingeengt, bis sich eine Kruste bildet, zu der 1.5 ml konzentrierte Salzsäure und 3 ml Ethanol gegeben werden. Nach dem Abkühlen werden die Kristalle mit der Zentrifuge von der Mutterlauge abgetrennt und mit Ethanol gewaschen, bis die Waschlösung farblos ist. Die Kristalle werden im Ofen bei 100 °C bis zur Gewichtskonstanz getrocknet. Analysen: UV-VIS-Spektrum in Wasser, Bestimmung von IR-Spektrum (in KBr) 1H-NMR-Spektrum (in D2O) Aufgaben: 1. Worin besteht der Unterschied in der Ligandaustauschkinetik für Co2+(aq) und Co3+(aq)? 2. Warum wird hier nicht von Co3+(aq) ausgegangen? 3. Co2+(aq), und solvatisiertes Ethylendiamin sind beide achiral. Was für eine Ligandanordnung erwarten Sie für [Co(en)3]3+(aq)? 4. Nennen Sie alle Strukturvarianten von oktaedrischen, tetraedrischen und quadratisch planaren Metallkomplexen. Literatur: J. B.Work, J. P.McReynols, Inorg. Synth. 1946, 2, 221–222. K. Rasmussen, Spectrochim. Acta 1974, 30A, 1763–1770. B. M. Fung, S. C. Wei, T. H. Martin, I-Wei, Inorg. Chem. 1973, 12, 1203–1205. Kupfer(I)-chlorid Reaktionsgleichung: Durchführung: In eine 60-70°C warme wässrige Lösung von 12.5 g CuSO4·5H2O gibt man das Doppelte der äquivalenten Menge NaCl und leitet gasförmiges SO2 (Vorsicht, Sicherheit beachten!) ein, bis die Menge des ausgefallenen CuCl sich nicht weiter vermehrt. Der Niederschlag wird abgesaugt, mit Eisessig gewaschen, bei 110 °C getrocknet und unter Ausschluss von Luft und Feuchtigkeit aufbewahrt. Analysen: Pulverdiffraktometrie Oxidation Aufgaben: 1. Wie kann man im Labor gasförmiges SO2 herstellen? 2. Wie sieht der Versuchsaufbau für die Gaseinleitung aus? 3. Wozu wird CuCl verwendet? 4. Diskutieren Sie die Reaktionsgleichung zur Bildung von CuCl an Hand von Halbzellenreaktionen und Standard-Reduktionspotenzialen. 5. Welche Ähnlichkeiten / Unterschiede bestehen zwischen AgCl (s) und CuCl (s)? Literatur: G. Brauer, Handbuch der Präparativen Anorganischen Chemie, 3. Auflage, 1978, Ferdinand Enke Verlag Stuttgart. G. Jander, E. Blasius; Lehrbuch der analytischen und präparativen anorganischen Chemie, Band 2, 9. Auflage, 1970, S. Hirzel Verlag, Stuttgart. Eisen mittels Aluminothermie Reaktionsgleichung: Durchführung: 1) Eisenoxid und Aluminiumpulver in einem Becherglas vorsichtig mischen und dann in einen Tontopf füllen. Den gefüllten Topf in einen zweiten, leeren Topf stellen, den unteren Topf mit Filterpapier auslegen. In die Mitte des Pulvers ein Magnesiumband zum Zünden einstecken. Reaktion unter dem Abzug durchführen. Ansatz: 2 g Eisen Analysen: Qualitativer Eisennachweis Quantitativer Eisennachweis: Bestimmung des Eisengehaltes in Metall und Schlacke a. Photometrisch b. Mittels Titration Pulverröntgen: Vergleich reines Eisen und dargestelltes Eisen Elektronenmikroskopie Magnetisches Verhalten Aufgaben: 1. Thermodynamische Diskussion dieser Reaktion. Berechnen Sie HR°(T), SR°(T), GR°(T). Ist die Reaktion bei allen zugänglichen Temperaturen spontan? 2. Wozu kann diese Reaktion technisch eingesetzt werden? 3. Schätzen Sie die sich einstellende Reaktionstemperatur ab. 4. Formulieren Sie die Reaktionsgleichungen für die Eisenherstellung mittels C, CO und CO2. Welches der Verfahren liefert die tiefste Reaktionstemperatur? Literatur: Barin Ihsan, Thermochemical Data of Pure Substances, Part I, II, VCH, 1989 A.-I. Vogel, Quantitative Inorganic Analysis, 4. Auflage, 1978, Longman, London. Handbook of Physics and Chemistry (CRC). G. Jander, Neuere Massanalytische Methoden, 4. Auflage, 1956, Enke-Verlag, Stuttgart. Magneteisenstein (Magnetit) Reaktionsgleichung: Durchführung: Man löst je 10 mmol FeSO4·7 H2O und Fe2(SO4)3·6 H2O in 100 ml Wasser, filtriert und gießt diese Lösung in 100 ml siedende 1 M KOH. Es fällt sofort ein schwarzer Niederschlag aus, der durch Dekantieren mit heißem Wasser gewaschen wird. Anschliessend filtriert man ab, trocknet an der Luft und pulverisiert. Analysen: Pulverdiffraktometrie Magnetismus Aufgaben: 1. Wie ist eine inverse Spinellstruktur aufgebaut? Was sind die Unterschiede zum normalen Spinell? 2. Wo findet der Magnetit Verwendung? 3. Welche Oxidationsstufen kommen beim Eisen vor? 4. Zeichnen Sie eine ferromagnetische Hysterese und geben Sie zu jedem Abschnitt eine Domänenstruktur an. Ferrocen, Fe(-C5H5)2 Reaktionsgleichungen: (3 Stück) Durchführung: Wasserfreies Eisen(III)-chlorid wird in absolutem Tetrahydrofuran (50 mL) suspendiert und in Gegenwart der äquimolaren Menge Eisenpulver durch Erhitzen zum Rückfluss reduziert. Das dabei entstandene Gemisch wird im Vakuum bis zur völligen Trockenheit eingedampft. Unter Eiskühlung und kräftigen Rühren lässt man zu diesem Rückstand ein Gemisch aus zwei Moläquivalenten Cyclopentadien, welches durch thermische Spaltung von Dicyclopentadien bei 180 °C erhalten wird, und vier Moläquivalenten Diethylamin via Tropftrichter zufliessen und über Nacht bei Raumtemperatur rühren. Nach Einengen im Vakuum verarbeitet man den Rückstand mittels Soxhlet-Extraktion mit Petrolether. Der Extrakt wird auf −35 °C abgekühlt. Nach wenigen Stunden wird die Hauptmenge des Produktes in langen Nadeln auskristallisiert sein. Durch Einengen der Mutterlauge kann weiteres Ferrocen gewonnen werden. Zur Reinigung kann das Produkt im Hochvakuum bei 80–100 °C sublimiert werden. Ansatz: 75 mmol Ferrocen Analysen: Schmelzpunkt UV-VIS-Spektrum (in Hexan) IR-Spektrum (in KBr) 1H-NMR-Spektrum Aufgaben: 1. Wie kann man Cyclopentadien herstellen? 2. Was verstehen Sie unter einer die Diels-Alder-Reaktion? 3. Welche Bedeutung hat der Cyclopentadienyl-Ligand? 4. Welche Konformationen kann Ferrocen einnehmen? 5. Wie kühlen Sie im Labor eine Probe auf - 35 °C ab? Nennen Sie weitere Kühlmöglichkeiten im Labor. 6. Was ist „absolutes“ THF? Wie kann dieses hergestellt werden? 7. Welche anderen Metallocene sind möglich? 8. Ist Ferrocen diamagnetisch oder paramagnetisch? Literatur: Georg Brauer: Handbuch der Präparativen Anorganischen Chemie, Band 3, Ferdinand Enke Verlag, Stuttgart, 3. Auflage, 1981. E. R. Lippingcott, R. D. Nelson: “The vibrational spectra and structure of ferrocene and ruthenocene.” Spektrochim. Acta 1958, 10, 307–329. Projekt “Vernetztes StudiumChemie” Lerneinheit “Ferrocen”; Web-Adresse: http://www.vsc.de/vsengine/ Kupfer(I)-tetraiodomercurat(II) Reaktionsgleichung: 1) 2) 3) Gesamt: Durchführung: 10 mmol Kaliumiodid löst man in 20 ml Wasser. In diese Lösung trägt man unter Rühren 2.5 mmol Quecksilber(II)-iodid ein (ACHTUNG: Giftig!!!). Zur klaren Lösung gibt man unter Rühren eine Lösung von 5 mmol CuSO4·5H2O. Nach etwa 10 Minuten filtriert man den leuchtend roten Niederschlag ab, wäscht ihn mit Wasser und trocknet ihn an der Luft. Die erhaltene Verbindung ist thermochrom. Sie färbt sich beim Erhitzen auf 70°C schokoladenbraun unter Änderung der Kristallstruktur. Analysen: Schmelzpunktbestimmung Pulverdiffraktometrie Aufgaben: 1. Was bedeutet „thermochrom“? 2. Nennen Sie weitere thermochrome Verbindungen. 3. Informieren Sie sich ausführlich über das Element Quecksilber (Stichworte: Oxidationsstufen, Anwendungen, Kalomel, Amalgam, Giftigkeit)! 4. Was für ein Gleichgewicht geht I-(aq) mit I2(aq) ein? 5. Diskutieren Sie die Gesamtreaktion nach dem Pearson-Konzept. Literatur: G. Jander, E. Blasius; Lehrbuch der analytischen und präparativen anorganischen Chemie, 9. Auflage, 1970, S. Hirzel Verlag Stuttgart. Darstellung eines Hochtemperatur-Supraleiters YBa2Cu3O7- Reaktionsgleichung: Y2O3 (s) + 4 BaO2 (s) + 6 CuO (s) + ½ O2 (g) YBa2Cu3O7- (s) + 4 CO2 (g) Durchführung: Yttrium(III)-oxid, Bariumperoxid und Kupfer(II)-oxid werden gemischt und im Mörser unter Zugabe von iso-Octan ca. 10 min fein zerrieben. Das Pulver wird für 12 h auf 940 °C erhitzt, wobei ein Überschreiten dieser Temperatur vermieden werden muss. Nach Abkühlung wird das schwarze Rohprodukt abermals zu einem feinen Pulver gemörsert und in einer mechanischen Presse zu zwei Tabletten verarbeitet. Diese werden für 12 h auf 940 °C unter einem schwachen Sauerstoffstrom erhitzt. Die Abkühlung auf Raumtemperatur erfolgt ebenfalls unter Sauerstoffatmosphäre mit einer Rate von ca. 100 °C / h. Ansatz: 5 mmol YBa2Cu3O7- Analysen: Pulverdiffraktometrie Demonstration des Meissner-Effektes Qualitativer Temperaturverlauf der elektrischen Leitfähigkeit Aufgaben: 1. Was bedeutet 7- in der stöchiometrischen Formel von YBa2Cu3O7- (YBCO)? 2. Wie ist die Kristallstruktur von YBCO aufgebaut? Wo befinden sich die Cu-Atome? 3. Welche Stöchiometrie hat die so genannte „grüne Phase“? Wie wird diese erhalten? 4. Was sind die bestimmenden Merkmale von Supraleitern? 5. Worauf beruht der Meissner-Effekt? 6. Nennen Sie drei andere bekannte Cuprat-Supraleiter. Literatur: K. Roth “Das Experiment: Hochtemperatur-Supraleiter – do it yourself” in Chem. Unserer Zeit 1988, 22, 30–32. W. Buckel, Supraleitung. Grundlagen und Anwendungen, VCH, 5. Auflage, 1994. R. J. Cava, “Keramische Supraleiter” in Spektrum der Wissenschaft, 1990, 118-126. A. Simon “Supraleitung und Chemie” in Angew. Chem. 1997, 109, 1872–1891.