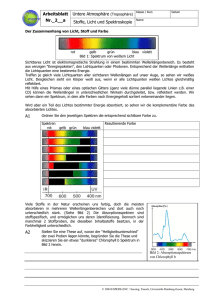
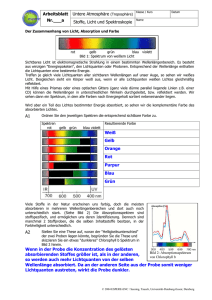
Weichmacher_Protokoll_2
Werbung

4.2.Quantifizierung mittels HPLC: 4.2.1. Probenaufarbeitung: verwendete Chemikalien/Geräte: - Rundkolben (250ml) Rückflusskühler (Dimroth – Kühler) Wasserbad Heizplatte Filtriergestell/Faltenfilter/Trichter Rotationsverdampfer Tetrahydrofuran Methanol Durchführung: Eine definierte Menge (ca. 0,5 g) der Probe und eine definierte Menge des Internen Standards Dibutylphthalat (ca. 125 mg) wird in einem Rundkolben mit 20 ml Tetrahydrofuran für 24 min. unter Rückfluss gekocht. Für eine gleichmäßige Siedetemperatur im Kolben wurde dieser in einem Wasserbad erhitzt. Zur entstanden Lösung wird mittels einer Bürette tropfenweise Methanol (80 ml) zugegeben, hierbei fällt das PVC in weißen Flocken aus, die Weichmacher bleiben in Lösung zurück. Anschließend wird filtriert, der Filterrückstand wird erneut in Tetrahydrofuran gelöst und die Heißextraktion damit wiederholt. Das Filtrat beider Extraktionsschritte wird gesammelt und am Rotationsverdampfer eingeengt. Die mit dem Rotationsverdampfer eingeengte Lösung der Weichmacher wurde mit je 10 ml Tetrahydrofuran aufgenommen und zur Verdünnung vor der Einspritzung in die HPLCAnlage verwendet. Einwaagen der Probe: Probe 1: m1 = 0,4971 g Probe 2: m2 = 0,5243 g Einwaagen von Dibutylphthalat (DBP): Probe 1: m1 = 132,7 mg Probe 2: m2 = 127,4 mg 4.2.2. Messung mittels HPLC: verwendete Chemikalien/Geräte: - Acetonitril - Tinuvin P als Einspritzstandard 5 ml – , 10 ml – und 25 ml – Messkolben einstellbare Eppendorfpipette Vials für HPLC-Anlage Analysendaten: DBP-Stammlösung: Einwaage von DBP: m = 25,8 mg Der Messkolben wurde mit Acetonitril auf 5 ml aufgefüllt. Konzentration der Stammlösung: CDBP = 5,16 mg/ml DINP-Stammlösung: Einwaage von DINP: m = 30,3 mg Der Messkolben wurde mit Acetonitril auf 5 ml aufgefüllt. Konzentration der Stammlösung: CDINP = 6,06 mg/ml DEHP-Stammlösung: Einwaage von DEHP: m = 28,0 mg Der Messkolben wurde mit Acetonitril auf 5 ml aufgefüllt. Konzentration der Stammlösung: CDEHP = 5,6 mg/ml Tinuvin P-Stammlösung: Einwaage von Tinuvin P: m = 20,8 mg Der Messkolben wurde mit Acetonitril auf 50 ml aufgefüllt. Konzentration der Stammlösung: CTinuvin P = 0,416 mg/ml Zur Orientierung wie die Kalibrierung zu wählen ist, wurden die Proben 1:50 verdünnt und in die HPLC-Anlage eingespritzt. Hierfür wurden 200µl der wie oben beschrieben aufgearbeiteten Probe in einem 10 ml-Messkolben gegeben, 350µl Tinuvin P-Stammlösung zugegeben und der Messkolben mit Acetonitril aufgefüllt. 1 Es ergab sich folgendes Chromatogramm für Probe 1: Probe 1 (1:50) 100 90 80 70 UV in mV 60 50 40 30 20 10 0 0 5 10 15 20 25 30 35 -10 Zeit t in min. Probe 1 (1:50) Und für Probe 2: Probe 2 (1:50) 100 90 80 70 UV in mV 60 50 40 30 20 10 0 0 5 10 15 20 -10 Zeit t in min. Probe 2 (1:50) 2 25 30 35 Die erhaltenen Retentionszeiten und die ermittelten Peakflächen ergeben sich wie folgt: Probe 1 Probe 2 Retentionszeit Peakfläche Retentionszeit Peakfläche in min. in FE in min. in FE 9,46 2125180 9,51 2110773 13,08 1469229 13,14 1503343 18,59 437531 18,67 437349 30,15 151149 29,47 154475 Zur Identifizierung der einzelnen Peaks und zur Festlegung der Kalibrierung wurden die vier einzelne Stammlösungen definiert verdünnt und in die HPLC-Anlage eingespritzt. Von der DBP-Stammlösung wurden 150µl in einen 5ml-Messkolben gegeben und dieser mit Acetonitril bis zur Marke aufgefüllt. Diese Lösung wurde in die HPLCAnlage eingespritzt. Daraus ergab sich folgendes Chromatogramm: Identifizierung DBP 60 50 UV in mV 40 30 20 10 0 0 2 4 6 8 10 12 14 -10 Zeit t in min. Identifizierung DBP Die Retentionszeit des charakteristischen Peaks betrug 5,09 Minuten und die Peakfläche wurde mit 980772 FE bestimmt. Von der Tinuvin P-Stammlösung wurden 250µl in einen 5ml-Messkolben gegeben und dieser mit Acetonitril bis zur Marke aufgefüllt. Diese Lösung wurde in die HPLCAnlage eingespritzt. 3 Daraus ergab sich folgendes Chromatogramm: Identifizierung Tinuvin P 30 25 UV in mV 20 15 10 5 0 0 2 4 6 8 10 12 14 -5 Zeit t in min. Identifizierung Tinuvin P Die Retentionszeit des charakteristischen Peaks betrug 6,56 Minuten und die Peakfläche wurde mit 534142 FE bestimmt. Von der DEHP-Stammlösung wurden 150µl in einen 5ml-Messkolben gegeben und dieser mit Acetonitril bis zur Marke aufgefüllt. Diese Lösung wurde in die HPLCAnlage eingespritzt. Daraus ergab sich folgendes Chromatogramm: Identifizierung DEHP 30 25 UV in mV 20 15 10 5 0 0 2 4 6 8 -5 Zeit t in min. Identifizierung DEHP 4 10 12 14 Die Retentionszeit des charakteristischen Peaks betrug 8,85 Minuten und die Peakfläche wurde mit 643044 FE bestimmt. Von der DINP-Stammlösung wurden 150µl in einen 5ml-Messkolben gegeben und dieser mit Acetonitril bis zur Marke aufgefüllt. Diese Lösung wurde in die HPLCAnlage eingespritzt. Daraus ergab sich folgendes Chromatogramm: Identifizierung DINP 8 7 6 UV in mV 5 4 3 2 1 0 0 2 4 6 8 10 12 14 -1 Zeit t in min. Identifizierung DINP Die Retentionszeit des charakteristischen Peaks betrug 11,49 Minuten und die Peakfläche wurde mit 436343 FE bestimmt. Aus den für die Proben erhaltenen Peakflächen und den Peakflächen aus den Identifizierungen konnte nun die Menge an Stammlösung für die einzelnen Kalibrierpunkte abgeschätzt werden. Die DINP-Stammlösung wurde hierfür nochmals 1:10 verdünnt und diese Verdünnung konnte dann zur Kalibrierung herangezogen werden. Für die Kalibrierung ergaben sich folgende Volumina der einzelnen Stammlösungen. Kalibrierpunkt 1 2 3 4 5 VDBP in µl VTinuvin P in µl VDEHP in µl VDINP in µl 150 200 250 300 350 250 300 350 400 450 200 250 300 350 400 250 300 350 400 450 Diese Volumina wurden für jeden Kalibrierpunkt in einen 5 ml Messkolben gegeben und dieser mit Acetonitril aufgefüllt. 5