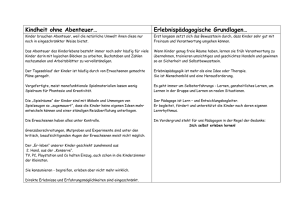
ChiS_2014_6_OE_Hermanns
Werbung
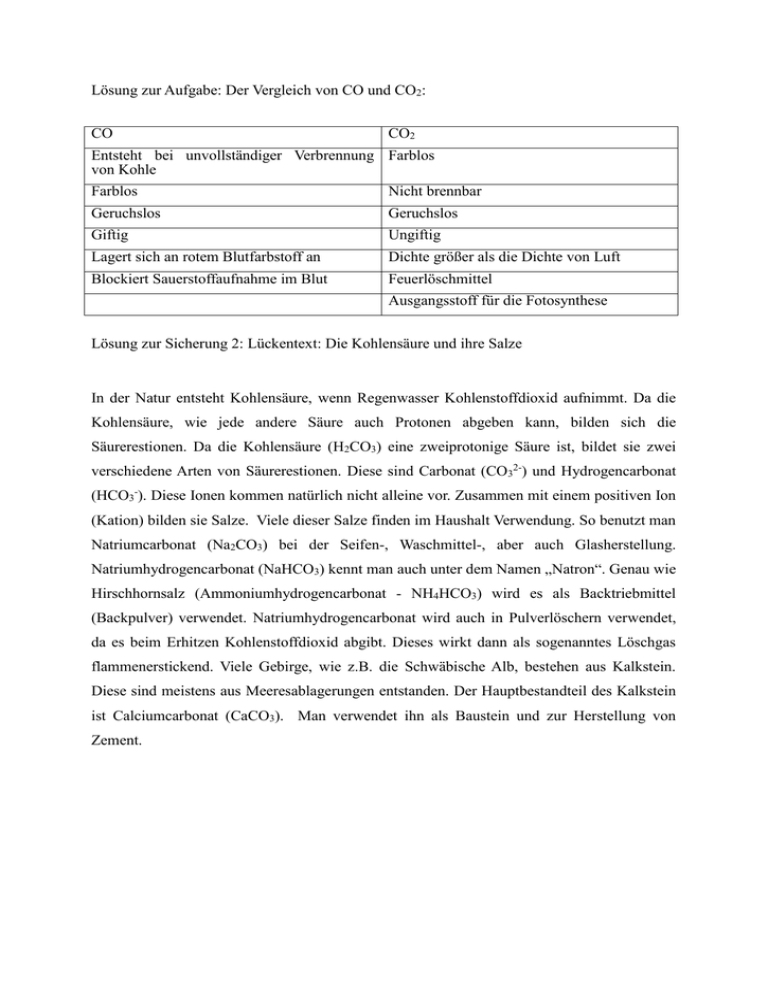
Lösung zur Aufgabe: Der Vergleich von CO und CO2: CO CO2 Entsteht bei unvollständiger Verbrennung Farblos von Kohle Farblos Nicht brennbar Geruchslos Geruchslos Giftig Ungiftig Lagert sich an rotem Blutfarbstoff an Dichte größer als die Dichte von Luft Blockiert Sauerstoffaufnahme im Blut Feuerlöschmittel Ausgangsstoff für die Fotosynthese Lösung zur Sicherung 2: Lückentext: Die Kohlensäure und ihre Salze In der Natur entsteht Kohlensäure, wenn Regenwasser Kohlenstoffdioxid aufnimmt. Da die Kohlensäure, wie jede andere Säure auch Protonen abgeben kann, bilden sich die Säurerestionen. Da die Kohlensäure (H2CO3) eine zweiprotonige Säure ist, bildet sie zwei verschiedene Arten von Säurerestionen. Diese sind Carbonat (CO32-) und Hydrogencarbonat (HCO3-). Diese Ionen kommen natürlich nicht alleine vor. Zusammen mit einem positiven Ion (Kation) bilden sie Salze. Viele dieser Salze finden im Haushalt Verwendung. So benutzt man Natriumcarbonat (Na2CO3) bei der Seifen-, Waschmittel-, aber auch Glasherstellung. Natriumhydrogencarbonat (NaHCO3) kennt man auch unter dem Namen „Natron“. Genau wie Hirschhornsalz (Ammoniumhydrogencarbonat - NH4HCO3) wird es als Backtriebmittel (Backpulver) verwendet. Natriumhydrogencarbonat wird auch in Pulverlöschern verwendet, da es beim Erhitzen Kohlenstoffdioxid abgibt. Dieses wirkt dann als sogenanntes Löschgas flammenerstickend. Viele Gebirge, wie z.B. die Schwäbische Alb, bestehen aus Kalkstein. Diese sind meistens aus Meeresablagerungen entstanden. Der Hauptbestandteil des Kalkstein ist Calciumcarbonat (CaCO3). Man verwendet ihn als Baustein und zur Herstellung von Zement. Lösung zur Rechercheaufgabe: Die Modifikationen des Kohlenstoffs Graphit Diamant Fulleren Elektrisch leitend Bohrerspitzen erstmals 1985 nachgewiesen in Bleistiften Geschliffen: klar Fußballähnliche Struktur Schmiermittel kristallin Hohlräume schuppig nicht elektrisch leitend können Atome anderer Elemente einschließen schwarzgrau sehr hart in unpolaren Lösungsmitteln löslich weich zum Schleifen von hartem kristallin Material Lösung zum Lückentext: Die Entstehung von Kohle Vor 300 Millionen Jahren war das Gebiet des heutigen Deutschland von einem flachen Gewässer überflutet. Dieses Gebiet verlandete teilweise. Dadurch entwickelte sich eine Waldsumpfmoorlandschaft. Das Holz abgestorbener Bäume versank im Schlamm und wurde dadurch luftdicht abgeschlossen. Durch das Fehlen von ausreichend Sauerstoff wurden die Pflanzenreste nicht vollständig ersetzt, sondern blieben als Torf erhalten. Dieser Prozess wird als Inkohlung bezeichnet. Der Massenanteil an Kohlenstoff ist im Torf deutlich höher als im Holz. In den folgenden Jahrmillionen wurde die Sumpfmoorlandschaft völlig mit Wasser überspült. Die Torfschichten wurden mit Sand und Geröll bedeckt. Durch die nachfolgende Verlandung dieser Gewässer entwickelten sich wieder Wälder. Diese verschiedenen Phasen von Vegetation, Überflutung, Absenkung und Überlagerung durch Geröll wechselten sich in der Folgezeit immer wieder ab. Aus den Torfschichten wurde das Wasser unter dem Druck der darüber liegenden Gesteinsschichten herausgedrückt. Braunkohle entstand durch weitere Inkohlung. Da die Gesteinsschichten über der Braunkohle oft mehrere Hundert Meter dick waren, entwickelte sich auf Grund hoher Drücke und Temperaturen Steinkohle. Diese wird fast ausschließlich unter Tage abgebaut. Braunkohle fördert man im Tagebau, z.B. in Brandenburg. Lösung zu: Die Atombindung Sauerstoff-Molekül: Zwei Bindungen Fluor-Molekül: Eine Bindung Stickstoff-Molekül: Drei Bindungen Lösung zu: Säuren, Laugen und Salze Magnesiumiodid: MgI2 (Salz; besteht aus dem Magnesiumkation und zwei Iodidanionen) Salpetersäure: HNO3 (Säure; besitzt als reaktives Teilchen ein H+-Ion) Natriumsulfat: Na2SO4 (Salz; besteht aus zwei Natriumkationen und ein Sulfatanion) Kalilauge: KOH (Lauge; besitzt als reaktives Teilchen ein OH--Ion) Info: Der Umgang mit der Interaktionsbox Chemiebaukästen oder Bausatzsystemen wie z.B. „Lego“ sind uns aus unserer Kindheit wohl bekannt. Die Übertragung dieser erfolgreichen Idee für den Unterricht ist die Interaktionsbox. Alle Materialien, die für den Unterricht benötigt werden, befinden sich in einer Kiste, der Interaktionsbox. Arbeitsaufträge, Fragestellungen, Info-Texte, aber auch Geräte und Chemikalien finden hier ihren Platz. Die Frage ist nun, wie geht man mit dieser Fülle an Materialien sinnvoll um? Folgende Tipps sollen beim Arbeiten mit der Box helfen: - Vor der Arbeit die Materialliste durchlesen und die entsprechenden Materialien in der Box suchen. - Erstellen eines Arbeitsplanes. Brauchen alle Gruppenmitglieder die Wiederholung? Kann einer aus der Gruppe die Wiederholung erarbeiten und den anderen vorstellen? Welche Reihenfolge ist bei der Erarbeitung sinnvoll? Legt man die Präsentationsart vorher fest oder erst, wenn man fertig ist? - Bestimmen eines Protokollanten. Es ist sinnvoll, einen aus der Gruppe zu bestimmen, der alle Ergebnisse festhält. Wichtig ist, dass hier auch die Vorgehensweise bei der Erarbeitung dokumentiert wird. Für die spätere Präsentation ist es sinnvoll, z.B. Experimente, fotographisch zu dokumentieren. - Sinnvolle und gleichmäßige Aufteilung der durchzuführenden Arbeiten. Es ist darauf zu achten, dass alle Gruppenmitglieder im gleichen Umfang mitarbeiten können. Vor allem die Arbeitsprozesse sollen allen zu jeder Zeit transparent sein. Kurze Arbeitsbesprechungen vor Beginn und am Ende eines Arbeitsabschnittes (z.B. Unterrichtsstunde) sind hierbei von Vorteil. - Präsentationsart auswählen. Nach Beendigung der Arbeiten sollen die Ergebnisse den Mitschülern präsentiert werden. Die Präsentation soll auch die Vorgehensweise bei der Durchführung beinhalten. Bilder und weitere Visualisierungen (z.B. Tafelanschrieb, Folie) sollen Bestandteil der Präsentation sein. Da die Mitschüler ebenfalls mit der Interaktionsbox gearbeitet haben, ist darauf zu achten, dass keine Inhalte wiedergegeben werden, die den anderen bereits sehr gut bekannt sind, wie z.B. die Durchführung der Experimente. - Beim Experimentieren auf die Einhaltung der Sicherheitsvorschriften achten. Die Entsorgungshinweise für die Chemikalien sollen ebenfalls befolgt werden. Laufzettel Kategorie Material Erledigt am Einleitung / Fragen Einleitungstext mit Fragen Info Der Umgang mit der Interaktionsbox Wiederholung Die Atombindung Wiederholung Säuren, Laugen und Salze Theorie Lückentext: Die Entstehung von Kohle Theorie Rechercheaufgabe: Die Modifikationen des Kohlenstoffs Theorie Aufgabe: Der Vergleich von CO und CO2 Experimente Experiment 1a: Die Wirkung eines Entkalkers Experimente Experiment 1b: Eine Nachweisreaktion mit Hilfe von Kalkwasser Experimente Experiment 2: Sprudel in Getränken Experimente Experiment 3: Die Wirkung von CO2 Sicherung Sicherung 1: Eine Begriffslandkarte zu Kohlenstoff-Verbindungen Sicherung Sicherung 2: Lückentext: Die Kohlensäure und ihre Salze