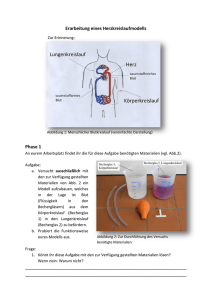
CD Material
Werbung

Projekt „Erfrischungsgetränke – eine saure Angelegenheit“ Einführung in das Thema Säuren finden im Alltag zahlreiche Anwendungen: Ob in der Autobatterie in Form von „Batteriesäure“, in vielen Badreinigern oder beim Zahnarzt, wenn mal wieder eine Füllung eingesetzt werden muss – überall werden die besonderen Eigenschaften von Säuren ausgenutzt. Neben diesen Anwendungsmöglichkeiten sind Säuren auch in vielen Erfrischungsgetränken enthalten, die viele von uns täglich zu sich nehmen – doch welche und wie viel Säure ist zum Beispiel in Cola eigentlich enthalten? Ist diese Säure für uns gesundheitsschädlich? Warum enthalten Erfrischungsgetränke eigentlich Säure? Organisation des Projektes Mit diesen und euren eigenen, weiterführenden Fragen werden wir uns in den kommenden Wochen beschäftigen und dazu als Klasse ein Projekt zu dem Thema „Säuren in Erfrischungsgetränken“ gemeinsam gestalten: Dabei werden wir arbeitsteilig vorgehen - so können wir möglichst viele verschiedene Erfrischungsgetränke untersuchen. Grundlage für eure Arbeit sind zwei Experimente: Ein Experiment zu eurem Thema ist bereits fertig geplant und wird mit Hilfe der Versuchsanleitung ( vorne abholen) von euch durchgeführt und ausgewertet. Ein weiteres Experiment plant ihr selbst und führt es in Eigenverantwortung durch: Entweder: ein Zusatzexperiment zum ersten Experiment ………………… . oder: ein ganz neues Experiment zu eurem Thema. Eure Ergebnisse werden für die Mitschüler in Form eines Wiki-Artikels (siehe Info-Box) aufbereitet. Dieser fließt in die Leistungsbewertung ein. Gutes Gelingen! 1 Wie sieht ein guter Wiki-Artikel aus? Inhaltsverzeichnis Überschrift Inhaltsverzeichnis Überschriften und Absätze Illustrationen Überschrift Eine Frage zu eurem Erfrischungsgetränk. Inhaltsverzeichnis Alle Überschriften werden hier aufgeführt. Begriffsdefinition und Einleitung: Beschreibt kurz, über was schreibt ihr – keine Details! Hier wird euer Erfrischungsgetränk vorgestellt. Was ist es? Welche Säuren konntet ihr in dem Erfrischungsgetränk genauer untersuchen. Nennt eure beiden (oder mehr) Experimente und bauen sie aufeinander auf? Überschriften und Absätze Nach der Einleitung beginnt der Hauptteil des Artikels, der mit Überschriften gegliedert wird. Die erste Überschrift sollte euer Getränk vorstellen: Wo kann man es kaufen? Wie schmeckt es? Welche Firma stellt es her? Wie lange gibt es das Getränk? Was könnte andere an dem Getränk interessieren? (versetzt euch in die Perspektive anderer – eure Freunde, Eltern, den Supermarktbesitzer – wer hat ein Interesse an diesem Getränk?) Woraus besteht das Getränk? Weitere Absätze Beschäftigen sich mit euren Experimenten und deren Auswertungen. Länge eines Artikels Der Artikel sollte eine dem Thema angemessene Länge haben und nicht zu detailliert sein. Gegebenenfalls lassen sich Teile des Artikels (z.B. über wichtige Bestandteile des Getränks) in weiterführende Artikel verlinkt werden. In diesem Fall sollte eine knappe Zusammenfassung des ausgelagerten Textes aufgeführt sein. Illustrationen Die Bebilderung eines Artikels im Wiki sollte immer dem besseren Verständnis des Textes dienen, nie allein der Zierde. Jede Abbildung benötigt eine Bildunterschrift – Was ist zu sehen? Wichtige Schlagworte Kennzeichnet in eurem Artikel wichtige Schlagworte und Fachbegriffe durch fette Schrift. Diese Schlagworte sollen später mit anderen Artikeln verlinkt werden. Die Bewertung eures Wiki-Artikels wird nach folgenden Gesichtspunkten stattfinden: sachliche Angemessenheit sprachliches Niveau strukturiert – nicht strukturiert Planung und Durchführung der Experimente Sinnvolle Schlussfolgerungen der Auswertung 2 Ein paar Tipps: Worauf kommt es bei der Arbeit an dem Projekt an? Planung des Arbeitens in der Gruppe: Einzelaufgaben verbindlich und möglichst früh unter den Gruppenmitgliedern aufteilen: Was ist erforderlich, um zu einem gelungenen Ergebnis zu kommen? (Besprechung in der Gruppe) Wer soll wofür verantwortlich sein? Bis wann soll ein Arbeitsschritt erledigt sein? Planung des eigenen Experimentes: Ist das von euch selbst geplante Experiment auch mit den uns in der Schule zur Verfügung stehenden Mitteln durchführbar? An die Leser denken: Wie können wir unsere Ergebnisse so erklären, dass auch eine Person ohne großes Vorwissen unsere Beschreibungen und Erklärungen verstehen kann? Verwendete Quellen von Ergebnissen bei Recherchen immer angeben. (z.B. in Form eines Quellenverzeichnisses am Ende des Wiki-Artikels). Leitfragen Leitfragen für die Auswertung Erfrischungsgetränk“: - - des Versuchs der Gruppe „Apfelessig- Welche Voraussetzungen müssen erfüllt sein, damit eine Lösung den elektrischen Strom leitet? Was passiert auf Teilchenebene, wenn destilliertes Wasser zu dem reinen Essig gegossen wird? Warum steigt die elektrische Leitfähigkeit bei der Reaktion von Wasser-Molekülen mit Essigsäure-Molekülen an? Was versteht man unter einer Brönstedt-Säure (Modellwelt)? Leitfragen für die Auswertung des Versuchs der Gruppe „Cola“: - Wie schafft es die Aktivkohle im ersten Versuchsteil, dass die Cola teilweise entfärbt wird? Welche besonderen Eigenschaften der Aktivkohle sind dafür verantwortlich? Was wird durch die Rotfärbung des Universalindikators, der zu der entfärbten Cola gegeben wurde, angezeigt? Warum schlägt die Farbe des Universalindikators nach grün um, wenn man eine bestimmte Menge Natronlauge hinzugetropft hat? Welche besonderen Eigenschaften hat Natronlauge im Vergleich zu Säuren? Wie kann man die Methode des zweiten Versuchsteils (= Zugeben von Natronlauge zu einer genau abgemessenen Cola-Portion bis zum Farbumschlag des Indikators) benutzen, um den Säuregehalt bzw. die Säurekonzentration von Cola zu bestimmen? 3 Leitfragen für die Auswertung des Versuchs der Gruppe „Iso-Sportgetränke“: - Was bedeutet der Begriff „isotonisch“ genau? - Sind isotonische Getränke für Leistungssportler besser als nicht isotonische Getränke? Falls ja, warum? - Warum kann das rohe Hühnerei (ohne Schale) aus dem Versuch als Modell für menschliche Körperzellen angesehen werden? Welche Parallelen bestehen? - Warum wird das Ei größer bzw. kleiner, wenn man es über einen längeren Zeitraum in destilliertem Wasser bzw. konzentrierter Kochsalzlösung einlegt? - Warum bleibt das Ei gleich groß, wenn man es in isotonischer Flüssigkeit einlegt? - Was versteht man unter Osmose? Welcher Zusammenhang besteht zu dem Versuch? Leitfragen für die Auswertung des Versuchs der Gruppe „Brause“: - Wie viele verschiedene Komponenten sind in Brause aus dem Supermarkt enthalten? - Wofür sind die einzelnen Brause-Komponenten jeweils wichtig? Welche Funktion haben sie? - Welches Gas entsteht bei der Zugabe von Wasser zur Brause? Wie kann man einzelne Gase nachweisen (z.B. Sauerstoff, Kohlenstoffdioxid)? - Was passiert auf Teilchenebene, wenn Natron und eine Säure miteinander vermischt werden? - Was versteht man unter einer Brönstedt-Säure (Modellwelt)? Leitfragen für die Auswertung des Versuchs der Gruppe „Eistee“: - Was versteht man in der Chemie unter einem Indikator? - Was zeigt der Farbumschlag der verschiedenen Tee-Sorten jeweils an? - Was versteht man unter dem sogenannten Umschlagspunkt eines Indikators? - Wie ist die Funktionsweise eines Mischindikators? 4 Leitfragen für die Auswertung des Versuchs der Gruppe „Fruchtsäfte“: - Was zeigt der Farbumschlag des Universalindikators von grün nach gelb in der Nähe des Gummibärchens in der Petrischale an? - Welche Inhaltsstoffe sind in Gummibärchen enthalten? - Welcher dieser Inhaltsstoffe ist für den Farbumschlag von grün nach gelb verantwortlich? - Welches Teilchen haben alle Fruchtsäuren gemeinsam (Modellwelt)? - Was versteht man unter einer Brönstedt-Säure? Leitfragen für die Auswertung des Versuchs der Gruppe „Sprudelgetränke“: - Was passiert auf Teilchenebene, wenn Kohlendioxid in das Wasser gepresst wird (Wassersprudler)? Welche Reaktion findet statt? Warum ändert sich die Farbe des Indikators dabei? Was wird angezeigt? - Welche Molekül- und Strukturformel besitzt Kohlensäure? - Warum ändert sich die Farbe des Universalindikators, wenn man das gesprudelte Wasser erhitzt, wieder zurück zur Ausgangsfarbe? - Was versteht man unter einer Brönstedt-Säure (Modellwelt)? Hilfestellung zur Organisation: Wer macht was bis zur nächsten Stunde ??? Name Datum: Datum: Datum: Datum: 5 Arbeitsblätter Versuchsdurchführungen Name des Versuchs: „Leitet der Apfelessig-Trank Strom?“ Warum wir den Versuch machen: Welches Material brauchen wir? Chemikalien: Apfelessig Trank, Eisessig, Essigsäure, dest. Wasser Leitfähigkeitsmessgerät, 3 Bechergläser je 150 ml, Spatel Durchführung: Lasse dir zunächst von deinem Lehrer das Leitfähigkeitsmessgerät erklären. Gib danach 50 ml von dem Apfelessig Trank in ein Becherglas, überprüfe dessen Leitfähigkeit und notiere deine Beobachtungen. Anschließend führst du nach dem gleichen Prinzip die Leitfähigkeitsmessung sowohl mit Eisessig (=konzentrierte Essigsäure) als auch mit destilliertem Wasser durch und notierst dir ebenfalls deine Beobachtungen. Im nächsten Schritt gibst du in das Becherglas mit dem Eisessig 5ml Wasser. Rühre danach um und messe erneut die Leitfähigkeit. Führe diesen Schritt mindestens 10mal durch und notiere dabei immer wieder deine Beobachtungen. Vielleicht hilft es dir, wenn du dir dazu eine Tabelle anfertigst. Gib nun in das Becherglas mit dem destillierten Wasser tropfenweise verdünnte Essigsäure. Nach umrühren misst du auch hier die Leitfähigkeit, wiederholst den Versuchsteil 10mal und schreibst deine Beobachtungen auf. 6 Name des Versuchs: Untersuchung isotonischer Sportgetränke Warum wir den Versuch machen: Welches Material brauchen wir? Chemikalien: 3 rohe Eier, Essigsäure-Lösung, Kochsalz, isotonisches Sportgetränk, Leitungswasser, Vaseline 3 Bechergläser (100 ml oder 150 ml) 3 Bechergläser (200 ml) Waage Durchführung: Stelle drei Eier zur Hälfte in jeweils ein schmales Becherglas (100 ml oder 150 ml), das Haushaltsessig enthält. Du beobachtest, wie die Essigsäure die Schale unter Gasbildung zersetzt. Die Schale besteht aus Kalk (= Calciumcarbonat, eine Ionenverbindung), und der löst sich in Säuren auf. Damit sich nur eine Hälfte der Schale zersetzt, reibst du die andere Hälfte vorher mit einer dünnen Schicht aus Vaseline ein. Nun lässt du das so vorbereitete Ei mindestens einen Tag in der Essigsäure stehen, damit sich die äußere Eierschale langsam auflösen kann. Wenn die Schale weggelöst ist, fühlt sich diese Eihälfte ganz weich an. Nun musst du damit umgehen wie mit dem sprichwörtlichen „rohen Ei“, also: ganz vorsichtig (besonders in Gegenwart von scharfen Gegenständen und Fingernägeln)!!! Die Eier werden nun in drei große Bechergläser (200 ml) gelegt, die vorher mit folgenden Lösungen zur Hälfte befüllt werden: Becherglas 1: destilliertes Wasser Becherglas 2: gesättigte Kochsalzlösung (Die gesättigte Kochsalzlösung stellst du vorher mit Hilfe von 45 Gramm Kochsalz und 150 ml Leitungswasser selbst her.) Becherglas 3: isotonisches Sportgetränk Vergesst nicht, die Bechergläser mit einem Folienstift zu markieren, damit ihr in der nächsten Stunde noch wisst, welches Becherglas welche Lösung enthält. Die Bechergläser müssen nun mindestens einen Tag stehen gelassen werden. Entsorgung: Die im ersten Schritt verwendete Essigsäure wird wieder zurück in das Vorratsgefäß gegeben (nicht in den Ausguss schütten!). 7 Name des Versuchs: „Brause – das besondere Prickeln“ Warum wir den Versuch machen: Welches Material brauchen wir? Chemikalien: Brausepulver, Natron, Zitronensäure, Puderzucker Filmdose (oder ähnliche verschließbare Dose aus Plastik) Zahnstocher oder Pinzette und Löffel Teller oder Petrischale und Plastikwanne Lupe Pipette mit Pipettierhütchen Durchführung: Teil 1: Untersuchung von Brause Leere ein Brausepäckchen auf einem Teller (wenn möglich schwarz) aus. Betrachte das Brausegemisch nun durch die Lupe. Du wirst ganz unterschiedliche Formen und Größen an Kristallen und verschiedenen Farben (Farb- und Aromastoffe) entdecken. Versuche nun, die wichtigsten Bestandteile mit einem Zahnstocher zu trennen und an verschiedene Seiten des Tellers zu schieben. Gib nun jeweils ein paar Tropfen Wasser auf die kleinen Pulverberge und beobachte, um herauszufinden, welcher Bestandteil für das „Sprudeln“ der Brause verantwortlich ist. . . Formuliere eine begründete Vermutung: Welche Aufgabe erfüllen die anderen einzelnen Bestandteile der Brause. Du kannst deine Vermutung testen, indem du eine Geschmacksprobe der einzelnen Bestandteile durchführst (außerhalb des Chemieraumes!). Teil 2: Brause selbst herstellen (zu Hause durchführen, sonst nicht essbar!) Brausepulver kannst du aus mehreren Bestandteilen auch selbst mischen. Nimm ein Trinkgefäß und einen Teelöffel und mische wie folgt: Gib einen Löffel Natron und zwei Löffel Apfel-, Wein- oder Zitronensäure in den Becher. Gib für den süßen Geschmack noch zwei Löffel Puderzucker hinzu. Als Aroma kannst du fünf Tropfen ätherisches natürliches Zitronen- oder Orangenöl hinzugeben. Und, je nach Belieben, noch eine Prise Speisefarbenpulver. Was fehlt noch? Logo, das Wasser. Fülle den Becher noch mit Wasser auf und schon beginnt Deine leckere Brause zu sprudeln. Teil 3: Noch 'ne Rakete? Führe folgenden unter dem Abzug durch: Gib zwei bis drei Löffel fertiger oder selbst gemischter Brause in eine Filmdose. Fülle sie anschließend bis zur Hälfte mit Wasser auf und setze sofort danach den Deckel auf und stelle die Dose schnell auf den Deckel in der Plastikwanne. Verschließe den Abzug! 8 Name des Versuchs: „Schwarz und schwarz = weiß“ Warum wir den Versuch machen: Welches Material brauchen wir? Chemikalien: Cola, Aktivkohle Stativ, Klemme, Stativring, Trichter, Rundfilter, Spatel, zwei Bechergläser, Heizrührer Durchführung: Gib in ein Becherglas zu 100 ml Cola so viel Aktivkohle bis eine dicke, schwarze Suspension entsteht. Koche diese mit Hilfe des Heizrührers auf. Je nach Adsorptionskraft der Aktivkohle wartest du ca. 15 min und rührst gelegentlich um. Filtriere anschließend die Suspension über ein Filterpapier und fange das Filtrat in einem weiteren Becherglas auf. Die Aktivkohle staubt extrem! Daher sehr vorsichtig Arbeiten. Information Aktivkohle ist ähnlich wie ein Schwamm porös und hat eine besonders große Oberfläche. An dieser können andere Stoff wie Farbstoff oder Geruchsstoffe adsorbiert d.h. aufgenommen werden. Aktivkohle wird in Dunstabzugshauben, in Gasmasken und bei der Trinkwasseraufbereitung verwendet. Eventuell kennst du Kohletabletten, welche bei MagenDarm-Infekten manchmal geschluckt werden. 9 Name des Versuchs: „Neutralisation von Cola“ Warum wir den Versuch machen: Welches Material brauchen wir? Chemikalien: „Cola-Filtrat“ aus Versuch „schwarz+ schwarz = weiß“, Universalindikator, Natronlauge, dest. Wasser Bürette, Magnetrührer mit Rührfisch, 50 ml Becherglas, Stativ, Klemme Durchführung: Gib zu 20 ml „Cola-Filtrat“ einige Tropfen Universalindikator und notiere deine Beobachtungen. Pipettiere anschließend 50 ml von dem gewonnenen farblosen Filtrat in ein Becherglas und fülle es mit 50 ml destilliertem Wasser auf. Stelle das Becherglas nun auf den Magnetrührer und gib einige Tropfen Indikator und den Rührfisch hinzu. Baue anschließend den Versuch entsprechend der Abbildung auf, wobei du 50 ml der 0,1 mol NaOH in die Bürette fließen lässt. Lasse unter Rühren tropfenweise NaOH zu dem farblosen Filtrat und beobachte. Bevor du aufräumst frage deinen Lehrer nach der Entsorgung und der Reinigung der Bürette!!! 10 Früchte - machen gesund? Warum wir den Versuch machen: Chemikalien: Univesalindikator, Lackmuspapier, Vitamin C Welches Material brauchen wir? Leitungswasser (kein destiliertes Wasser), Gummibärchen. 2 Petrischalen, weißes Papier, Becherglas, Spatel Overhead-Projektor Durchführung: Teil A: Vitamin C Gebe zu einem Becherglas mit dest. Wasser (50 ml) ca. 2 Spatel voll Vitamin C. Schüttele die Lösung, bis der größte Teil des Pulvers gelöst ist. Untersuche die Lösung und etwas destiliertes Wasser mit Lackmuspapier Teil B: Fruchtsäuren in Gummibärchen: In den meisten handelsüblichen Gummibärchen sind Fruchtsäuren enthalten. Je nach Hersteller wird meistens entweder Zitronen- oder Apfelsäure verwendet. In diesem Versuch kannst du mit Hilfe der farblichen Veränderung eines so genannten Indikators überprüfen, welche Gummibärchen Säure enthalten und welche nicht: Beide Petrischalen werden etwa 2 – 3 Millimeter hoch mit Leitungswasser befüllt. In beide Schalen gibst Du die gleiche Menge (4 Tropfen) Universalindikator hinzu, so dass die Lösung intensiv grün gefärbt ist. Lege je ein farbloses Gummibärchen in die Mitte von jeder Petrischale und stelle die Schalen auf den eingeschalteten OverheadProjektor. Nach etwa einer Minute wird die Petrischale mit dem Gummibärchen leicht geschwenkt. Das Schwenken wird etwa 10 Minuten lang jeweils nach einer Minute wiederholt. Die zweite Petrischale wird ohne sie zu berühren auf dem OverheadProjektor stehen gelassen. Vergleiche nach 10 Minuten den Inhalt der beiden Petrischalen. Was fällt dir auf? Entsorgung: Den Inhalt der Petrischalen kannst Du im Müll oder am Wasserhahn entsorgen. 11 Eistee – Untersuchung eines nichtsprudelnden Getränks Chemikalien: Schwarzer Tee, Hibiskus (Malve) Teebeutel, Zitronensäure, Kaiser Natron, Zucker Wasserkocher 3 Bechergläser (ca. 300 ml) mind. 3 Reagenzgläser Reagenzglasständer, 2 Spatel Durchführung: Teil A: Herstellen eines Eistees (Rezept nach Inhaltsangabe eurer EisteePackung) Stellt in 2 Bechergläser je einen starken Malve- und einen starken Schwarztee her. Beide Teesorten mischt ihr Vorsichtig im Verhältnis 1:1. Dieses Teegemisch verteilt ihr vorsichtig auf 3 Reagenzgläser. In die Reagenzgläser kommen nun noch die anderen Zutaten. In das erste Reagenzglas gibst Du etwas Zitronensäure. Wird zu viel Zitronensäure zugegeben schmeckt der Eistee sehr sauer! Hausfrauen /-männer -Tipp: „Etwas Natron hilft die überschüssige Säure „wegzunehmen“. Gebe also in das zweite Reagenzglas etwas Natronpulver. Das dritte Reagenzglas dient eurer Kontrolle. Um den Eistee fertig zu machen, gebe in jedes Reagenzglas noch einen Spatel Zucker. Teil B: Untersucht eure Beobachtung aus Versuch A, indem ihr die Versuche mit den beiden Teesorten getrennt durchführt. Teil C: Eistee selbst herstellen (zu Hause durchführen, sonst nicht essbar!) Kocht euch zuhause einen Tee (Schwarzertee möglichst mit Hibiscustee gemischt.) Lasst das ganze abkühlen und probiere deinen Tee. Nun gebe noch etwas Zitronensäure oder Zitronensaft zu. Wieder probieren. Zum Schluss kannst Du den Zucker hinzufügen und nochmal probieren. Sei vorsichtig mit der Zitrone, denn der Tipp mit dem Natron ist für Eistee nur bedingt geeignet (Warum, siehst du in dem Versuch im Unterricht) Schaue Dir folgenden Video-clip im Internet an: http://podcast.3sat.de/mediathek/?display=1&mode=play&obj=9679 12 Experimente mit dem Wassersprudler Chemikalien: Kohlendioxidkartusche, destilliertes Wasser, Universalindikator, PhenolphthaleinIndikator Wassersprudler, Wasserflasche, 2 Bechergläser (250-300ml) Wasserkocher, Leitfähigkeitsmesser, Farbtabelle zum Indikator. Durchführung: Teil A: Herstellung eines Mineralwassers: Fülle die Wasserflasche des Wassersprudlers fast voll mit dest. Wasser,und gebe einige Tropfen Universalindikator hinzu. Vermische den Indikator gut. Etwas von dem Wasser wird nun in ein Becherglas gegeben, so dass die Wasserflasche nur noch bis zur Markierung gefüllt ist. Befestige die Flasche am Wassersprudler und schließe die Tür. Erst jetzt kannst Du den Knopf oben auf dem Wassersprudler betätigen. Du kannst 2-3-mal auf den Knopf drücken, aber dazwischen immer wieder etwas abwarten. Nun die Flasche wieder entnehmen. Vergleiche dein Wasser aus dem Sprudler mit einer Probe des Wassers, das nicht im Sprudler war. Teil B: Abgestandenes Wasser entsteht… wenn Mineralwasser längere Zeit offen steht oder es wenn es sehr warm ist. Simuliert dieses Verhalten mit eurem Wasser aus Teil A und einem Wasserkocher und vergleicht die beiden Proben miteinander. Behaltet einen Teil eures Wassers aus Versuch A als Vergleich zurück. Teil C: Wiederholt Versuch A mit Phenolphthalein anstatt mit Universalindikator. 13