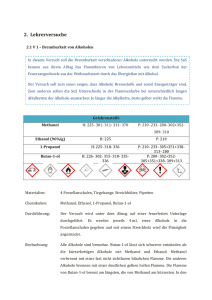
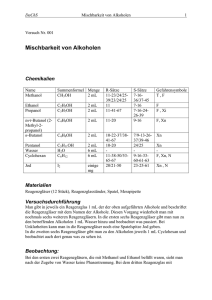
Alkanole
Werbung
Alkohole Experimentalvortrag von Volker Wenke 1 Inhalt 1. Struktur und Eigenschaften 2. Herstellung 3. Reaktionen 4. Verwendung 2 1. Struktur und Eigenschaften • Alkohole im Lehrplan nach reinen Kohlenwasserstoffen (Alkane, Alkene, Alkine, Erdöl, etc) • Wo ist der Unterschied? – Struktur eines Alkoholmoleküls? – resultierende Eigenschaften? 3 1. Struktur und Eigenschaften Strukturaufklärung am Beispiel Ethanol: Verbrennung: H2O und CO2 nachweisbar Magnesium wird von Ethanoldampf oxidiert Ethanol: C, H, O im Verhältnis 2:6:1 Mögliche Strukturformeln: 4 1. Struktur und Eigenschaften Versuch 1: Strukturaufklärung von Ethanol 5 1. Struktur und Eigenschaften Versuch 1: Strukturaufklärung von Ethanol Reaktion von Ethanol mit Natrium: Beobachtung: • Wasserstoff entsteht (nicht aus C-H-Bindungen) 6 1. Struktur und Eigenschaften Versuch 1: Strukturaufklärung von Ethanol Reaktion von Ethanol mit Natrium: Beobachtung: • Wasserstoff entsteht (nicht aus C-H-Bindungen) 7 1. Struktur und Eigenschaften Versuch 1: Strukturaufklärung von Ethanol Bildung von Natriumethanolat: 1 0 2 C2H5O H(l) 2 Na(s) 2 C2H5O (aq) 1 2 Na (aq) 0 H2(g) Knallgasprobe: 0 0 1 -2 2 H2(g) O2(g) 2 H2O (g) Δ 8 1. Struktur und Eigenschaften Homologe Reihe der Alkohole: Methanol Propanol Ethanol Butanol ... 9 1. Struktur und Eigenschaften Demo1: Hydrophilie & Volumenkontraktion 10 1. Struktur und Eigenschaften Demo1: Hydrophilie & Volumenkontraktion Ethanol: • kurze C-Kette, hoher Einfluss der polaren OH-Gruppe, hydrophil • Volumenkontraktion durch Wasserstoffbrückenbindungen 1-Octanol: • lange C-Kette, kaum Einfluss der OH-Gruppe, hydrophob (lipophil) • keine Volumenkontraktion 11 1. Struktur und Eigenschaften Demo 1: Hydrophilie & Volumenkontraktion Erklärung der Hydrophilie / Hydrophobie: • Energiegewinn aus Enthropie Durchmischung • Energieverlust durch fehlende H-Brücken zwischen Wasser und hydrophoben Teil des Alkohols Verkleinerung der Grenzfläche, Entmischung 12 1. Struktur und Eigenschaften Werte für Alkane in Klammern 13 1. Struktur und Eigenschaften Isomerien der Alkohole ab Propanol: 1-Propanol (primär) 2-Propanol (sekundär) 2-Methyl-2-propanol (tertiär) Mehrwertige Alkohole: 1,2-Ethandiol (Glycol) 1,2,3-Propantriol (Glycerin) 14 2. Herstellung von Alkoholen Screenshot Feuerzangenbowle H6P5O11 15 2. Herstellung von Alkoholen • Fermentation (durch Bioorganismen): Enzyme aus Hefezellen wandeln Zucker in Ethanol um: C6H12O6(aq) Hef e 2 C2H5OH(aq) 2 CO2(g) Vorgang muss anaerob verlaufen C6H12O6(aq) O2(g) Hef e 6 H2O(l) 6 CO2(g) 16 2. Herstellung von Alkoholen 1. Batch-Fermentation • Substrat, Hefe und entstehendes Ethanol in einem Gefäß • Nachteile: - aufwendige Trennung - Biokatalysator schlecht wiederverwertbar - Hemmung der Hefe durch hohen Ethanolgehalt 17 2. Herstellung von Alkoholen 2. Kontinuierliche Fermentation • Hefe in einem Durchflussreaktor • Substratlösung wird kontinuierlich zu- und abgeführt • Nachteil: - teure Spezialmembranen 18 2. Herstellung von Alkoholen 3. Fließbett-Fermentation • immobilisierte Hefe auf Fließbett • Substratlösung läuft von unten nach oben durch • Nachteil: - chemische Labilität - geringe mechanische Belastbarkeit 19 2. Herstellung von Alkoholen Versuch 2: Herstellung eines Schaumweins 20 2. Herstellung von Alkoholen Versuch 2: Herstellung eines Schaumweins Alginat: Polysaccharid aus Braunalgen Freie Elektronenpaare koordinieren an das Calcium 21 2. Herstellung von Alkoholen Versuch 2: Herstellung eines Schaumweins Sol – Gel – Übergang: Calcium-Ionen Hefe 22 2. Herstellung von Alkoholen Versuch 2: Herstellung eines Schaumweins Alkoholische Gärung mit immobilisierter Hefe: C6H12O6(aq) Hef e 2 C2H5OH(aq) 2 CO2(g) CO2 teilweise am Alginat adsorbiert, Nachweis durch Niederschlag mit Ca(OH)2 Ca(OH) 2(aq) CO2(g) CaCO3(s) H2O(l) 23 2. Herstellung von Alkoholen • Gewinnung aus Synthesegas (Methanol): 0 2 1 - 2 1 2 H2(g) CO(g) H3COH (g) p, T, [ZnO / Cr2O3 ] • Oxosynthese mit Alkenen (z.B. Propanol): 2 0 2 C2H4(g) H2(g) CO (g) 1 [Co] H2 / 180 C CH3CH2CHO (g) -3 1 -2 CH3CH2CHO 0 CH3CH2CH2OH(g) • Elektrophile Addition von Wasser (z.B. Ethanol): -2 [H ] -3 -1 C2H4(g) H2O CH3CH2OH(aq) 24 3. Reaktionen der Alkohole 25 3. Reaktionen der Alkohole 26 3. Reaktionen der Alkohole 3.1 Vom Alkohol zum Alkan Reduktionsmittel: • Wasserstoff: im Gasstrom oder nascierend • Hydriddonatoren (z.B. NaBH4, LiAlH4, DIBAL) 27 3. Reaktionen der Alkohole 3.2 Vom Alkohol zum Ester Mechanismus der Veresterung (Kondensation): 28 3. Reaktionen der Alkohole Versuch 3: Veresterung Rizinusöl Zitronensäure 29 3. Reaktionen der Alkohole 3.3 Vom Alkohol zum Halogenalkan Nucleophile Substitution • Entfernung der OH-Gruppe • Einführung eines Halogens 30 3. Reaktionen der Alkohole Versuch 4: Chlorierung von tert-Butanol 31 3. Reaktionen der Alkohole Versuch 4: Chlorierung von tert-Butanol tert-Butanol und Salzsäure (SN1) 32 3. Reaktionen der Alkohole 3.4 Vom Alkohol zum Alken oder Ether säurekatalytische Reaktion • Alkoholüberschuss • hohe Temperatur Ether Alken 33 3. Reaktionen der Alkohole 3.4 Vom Alkohol zum Alken oder Ether 34 3. Reaktionen der Alkohole 3.5 Oxidationsprodukte der Alkohole Durch Oxidation mögliche Produkte: • • • • Aldehyde Carbonsäuren Ketone Kohlendioxid + Wasser 35 3. Reaktionen der Alkohole Versuch 5: Oxidation verschiedener Alkohole 36 3. Reaktionen der Alkohole Versuch 5: Oxidation verschiedener Alkohole Durch Oxidation mögliche Produkte: • • • • Aldehyde (aus primären Alkoholen) Carbonsäuren (aus primären Alkoholen) Ketone Kohlendioxid + Wasser 37 3. Reaktionen der Alkohole Versuch 5: Oxidation verschiedener Alkohole 38 3. Reaktionen der Alkohole 3.5 Oxidationsprodukte der Alkohole Durch Oxidation mögliche Produkte: • • • • Aldehyde (aus primären Alkoholen) Carbonsäuren (aus primären Alkoholen) Ketone (aus sekundären Alkoholen) Kohlendioxid + Wasser 39 3. Reaktionen der Alkohole Versuch 6: Oxidation von Methanol Oxidation am Platindraht: 2 0 0 -2 2 H3COH(g) O2(g) 2 HCHO(g) 2 H2O [Pt] Zündpunkt 455°C: -2 0 4 - 2 2 H3COH(g) 3 O2(g) 2 CO 2(g) 4 H2O(g) Δ 40 4. Verwendung der Alkohole 41 4. Verwendung der Alkohole 4.1 Kraftstoff „E-85“ reines Ethanol als Kraftstoff Vorteile: • • • • Nachteile: Oktanzahl 110 • hoher Verbrauch höhere Motorleistung • schlechte Kaltstarteigenschaften ca. 90% weniger Abgase, kein SO2, keine Aromaten Ethanol-“Super“-Gemisch (85 % : 15 %) 42 4. Verwendung der Alkohole 4.2 Alkohole in der chemischen Industrie Einsatz als Lösemittel in: • chemischen Synthesen • Medikamenten • Hygieneartikel, Duftstoffe Einsatz in Synthesen von: • Formaldehyd, Essigsäure, Aceton, Esterkomponenten 43 4. Verwendung der Alkohole 4.3 mehrwertige Alkohole Glykol: • Frost- und Korrosionsschutzmittel Glycerin: • Kunststoffe, Harze, Schmiermittel, Feuchthaltemittel, Sprengstoffe • Frostschutzmittel • Grundbaustein für Fette Glucitol: • Zuckerersatzstoff in Süßigkeiten • Medizin: bakterielle Nährböden, Diuretika 44 4. Verwendung der Alkohole 4.4 Ethanol als Genussmittel Nichtdestillierte Getränke: • Bier (Hopfen, Malz) • Wein (Trauben) Destillierte Getränke: • Kornbranntwein (Weizen, Roggen) • Rum (Rohrzucker) • Whiskey (Mais) • Obstbranntwein (diverse Obstsorten) 45 Zwei Worte: NACH FEIERABEND !!! 46