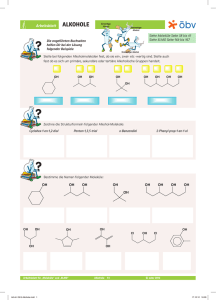
Oxidation von primären, sekundären und tertiären Alkoholen mittels
Werbung

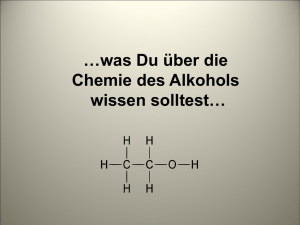
Ch-Protokoll Alkohole & Carbonylderivate (=Aldehyde, Ketone) Oxidation von primären, sekundären und tertiären Alkoholen mittels Kaliumpermanganat Reagenzgläser, 1-Propanol, 2-Propanol, 2-Methyl-2-propanol, 20%ige H2SO4, KMnO4-Lsg, Bunsenbrenner, Dreifuß, Gitter Durchführung Fülle in je ein Reagenzglas die oben angegeben Alkohole. Gib jeweils 0,5ml 20%ige H2SO4 und dann 0,5- 1ml verdünnte KMnO4-Lsg. Stelle die Reagenzgläser in ein warmes Wasserbad. Es reagieren alle drei Substanzen. Selbst der tertiäre Alkohol reagiert, obwohl Beobachtung er eigentlich nicht sollte (tertiäre Alkohole können nicht oxidiert werden). Aufgaben/ Welche Produkte entstehen bei dieser Reaktion aus den untersuchten Fragen Alkoholen? Oxidation unter Beibehaltung des Kohlenstoffgerüstes: Durch geeignete Oxidationsmittel können viele Alkohole oxidiert werden. Das Kohlenstoffgerüst bleibt erhalten ( bei der Verbrennung bleibt es nicht!).Je nach Stellung der OH-Gruppe (Hydroxylgruppe) werden unterschiedliche Oxidationsprodukte gebildet. Material Reaktionsverhalten allgeimein: Primäre und sekundäre Alkohole lassen sich leicht oxidieren. Tertiäre Alkohole hingegen lassen sich nicht mit schwachen Oxidationsmitteln oxidieren. Versucht man sie mit starken Oxidationsmitteln zu oxidieren, so führt die zum Abbau des Moleküls. Primärer Alkohol: Durch Oxidation entsteht ein Aldehyd. Aldehyde sind reduktionsmittel und können weiter zu Carbonsäuren oxidiert werden. (Carbonsäuren= mehr als 12C`s). Sekundärer Alkohol: Durch Oxidation sekundärer Alkohole entsteht ein Keton. Ketone sind zum Unterschied von Aldehyden nicht weiter oxidierbar. Aus 2-Propanol entsteht durch Oxidation das einfachste Keton, Propanon (Aceton) welches ein wichtiges Lösungsmittel is. Tertiäre Alkohole: Sie können unter Beibehaltung des Kohlenstoffgerüsts nicht oxidiert werden. „Unsere“ tertiärer hat reagiertnicht sauber gearbeitetfalsches Ergebnis 1 Welche Funktion hat KMnO4. Kaliumpermanganat Tiefpurpurrote fast schwarze Prismen; Lsg. als starkes Oxidationsmittel, dass heißt er nimmt die Elektronen des Alkohols auf und gibt leicht Sauerstoff ab; Bei den Oxidationsvorgängen entstehen oft braune Flecken von Braunstein. Unter Entflammung reagiert es z.B.: mit Glycerol. Mit mehrwertigen Alkoholen, reagiert der Stoff unter spontaner Entzündung. Nachweis von Alkoholen mit Cerammoniumnitrat, Natrium und Kaliumdichromat Durchführung Beobachtung Durchführung Beobachtung Durchführung Beobachtung a) Verdünne zuerst die Cerammoniumnitratlösung bis sie gel gefärbt ist und befülle fünf RG`s mit einigen ml-ern dieser Lösung. Gib in das erste RG ein paar Tropfen Ethanol und schüttle es Teste in den anderen RG`s zwei andere Alkohole Teste zwei Altagsprodukte Substanz Reaktion Alkohol enthalten Lsg.+ Ethanol orange Farbe ja Lsg.+ Butanol orange Farbe ja Lsg.+ 1.Propanol rot/ braun ja Lsg.+ Parfum milchig bis gelb ja (nicht viel) Lsg.+ Rasierschaum keine kurzkettigen nein („jein“ nur langkettige) Alkohole b) UNTER DEM ABZUG & SCHUTZBRILLE Je ein wenig Ethanol, Butanol, Resorcin wird in ein RG gegeben. Mit der Pinzette nimmt gibt man ein Natriumstück in die RG`s. Substanz Reaktion Ethanol+ Na reagiert, sprudelt und Na löst sich auf (Blasen) Butanol+ Na Blasen Resorcin+ Na Stärkste Reaktion, Schaumbildung, Flamme und Rauch, Flüssigkeit wird Dunkel-grün, bzw. glüht c) In ein RG gibt man ca. 1ml Cromatlsg., versetzt sie mit 2 bis 3 Tropfen konz. Schwefelsäure, fügt etwas Ethanol dazu und stellt das RG in ein Wasserbad. (Rektion dauert einige Minuten!) Die Schwefelsäure reagiert grüne-Färbung Welche der untersuchten Alltagsprodukte enthalten einen Alkohol? Um welchen Alkohol könnte es sich handeln? Im Parfum war Alkohol nachzuweisen, im Rasierschaum gab es zwar Alkohol der war aber langkettig. In Alltagsprodukten werden eher kurzkettige Alkohole, als langkettige verwendet. Alkohole bis zu einer Kettenlänge von 10 Kohlenstoffatomen sind flüssig. Kurzkettige Alkohole lassen sich sehr leicht entzünden und sind brennbar. Welche Funktion hat der jeweilige Alkohol im entsprechenden Alltagsprodukt? Glycerol= Propantriol ist in sehr vielen Kosmetik, Hygiene und Putzmitteln enthalten. Sicherlich auch in unseren Proben. Funktion: Zur Desinfektion, Sterilisation, in Cremen entzieht der 2 Umgebung Wasser (hygroskopisch), wasserlöslich, leicht Sauer (pHWert5-6) gut für die Haut (Haut: saures Milieu) 70%iger Ethanol ist ein ausgezeichnetes Desinfektionsmittel. Alle Bakterien werden innerhalb einer Minute durch Denaturierung der Bakterienzellwand abgetötet.; Als Reinigungsmittel; Ethanol ist ein sehr gutes Lösungsmittel für Harz. Gib zu den verwendeten Alkoholen jeweils Strukturformeln und Stoffeigenschaften an. Ethanol: C2H5OH klare, farblose Flüssigkeit; leichtentzündliche; hygroskopisch (Wasser anziehend), gut wasserlöslich und löst auch die meisten anderen organischen Lösungsmittel, Genussmittel, wichtigstes Lösungsmittel für Duftstoffe (Parfüms, Rasierwasser, Haarwasser), Brennspiritus (ungenießbar), Desinfektionsmittel in der Medizin. [Oxidation von Ethanol Ethanal (Acetaldehyd) ox.Essigsäure (Ethansäure)] Butanol:C4H10O farblose Flüssigkeit mit charakteristischem, stechendem Geruch, brennbar, in Wasser nur begrenzt lösbar, gesundheitsschädlich 1.Propanol:C3H8O ist eine farblose, leicht entzündliche, nach Alkohol riechende, mit Wasser, Alkohol und Ether mischbare Flüssigkeit. zur Herstellung von Aceton, Lösungs- und Desinfektionsmittel Schreibe die Reaktionsgleichungen für Ethanol mit Natrium. Alkohole sind wie Wasser schwache Säuren bzw. Basen. Sie können im prinzip als Wasserderivate aufgeffat werden. Ein Wsser-Atom des WasserMoleküls ist durch eine Alkylgruppe ersetzt. Bei weitgehend wasserfreien Alkoholen wird das Oxonium-Ion bei der Reaktion mit starken Säuren gebildet. Das Alkoholat-Ion entsteht beim Einwirken von Alkohol auf unedle Metalle. 2 H3C-CH2-OH + 2 Na 2 H3C-CH2-ONA + H2 Natrium und alle anderen Alkalimetalle reagieren mit Alkoholen zu Alkoholaten unter Wasserstoffabgabe. Das Alkoholat-Ion ist eine starke Base, die bei zahlreichen SWynthesen von Bedeutung ist. Durch die negative Ladung ist das Alkohol-Ion ein nucleophiles Teilchen(Atome die von positiven Ladungen angezogen werden), das mit einem seiner nicht bindenden Elektronenpaare eine Atombindung ausbilden kann. 3 Erkläre bei allen drei Nachweißreaktionen was passiert und warum diese Versuche Nachweise für Alkohol darstellen. Cerammoniumnitrat-Reagenz: Oxidation (Redoxreaktion) Mit Cerammoniumnitrat-Reagenz lassen sich Alkohole (kurzkettige) nachweisen. Ein positiver Nachweis von Alkoholen wird durch die Orangefärbung der Probenlösung angezeigt. Cer-Verbindung: Cer (IV)-ammoniumnitrat [Ammoniumhexanitratocerat(IV), CeAN] (NH4)2Ce(NO3)6 Orange Kristalle dient als Oxidationsmittel in der organischen Chemie Kaliumdichromat: Oxidation (Redoxreaktion) K2Cr2O7; giftig K. wirkt als starkes Oxidationsmittel, weshalb beim Kontakt mit brennfähigen organischen Stoffen Vorsicht geboten ist. K. oxidiert mit Schwefelsäure primäre Alkohole zu Aldehyden bzw. Carbonsäuren, wobei das Dichromat in grünes dreiwertiges Chromatsulfat übergeht. Natrium: Säure-Base-Reaktion Reaktion siehe: vorige Frage! Carbonylderivate= Aldehyde, Ketone 1.) Nachweiß mit Fehling Lösung Fehling`sche Lösungen (I+II), NaOH, Aceton (Propanon), Butanal, Benzylaldehyd, Glucose RG`s, 450ml Becherglas+ H2O, Bunsenbrenner, Dreifuß, Gitter Material Durchführung „Achtung auf Siedeverzüge! Diese treten auf, wenn nur der untere Teil der Flüssigkeit im Reagenzglas stark erhitzt wird. Die Reagenzglasöffnung sollte niemals auf Personen gerichtet sein!“ In ein RG wird gleich viel Fehling I+ II gegeben, wenige Tropfen NaOH und mit der den Proben versetzt. RG`s im Wasserbad erhitzen Beobachtung Substanzen vorher naher Fehling I+II + Aceton (Propanon) blau trüb grün+ eine blaue untere Schicht Fehling I+II + Butanal grün oben: orange- Schicht (soll Butanal sein); unten: orangebraune- Schicht Fehling I+II + Benzylaldehyd blau oben: sehr geringe dunkelblaue Schicht; mitte: klar; unten: dunkelblau Fehling I+II + Sacherose / hellblau/ Falsches Ergebnis Chemikalien 2.) Tollens Probe (Silberspiegel) Silbernitratlösung (AgNO3), NaOH, stark verdünnte Ammoniaklsg., Aceton (Propanon), Butanal, Benzylaldehyd, Glucose RG`s, 450ml Becherglas+ H2O, Bunsenbrenner, Dreifuß, Gitter Geräte Durchführung „Silbernitratlsg. braune Flecken auf der Haut“ Chemikalien 4 Beobachtung Aufgaben Tollens Reagenz: In ein RG werden 2ml AgNO3-Lsg. und 1 Tropfen verdünnte NAOH gegeben. Es fällt ein brauner Niederschlag von Silberoxid aus. Vorsichtig wird NH3Lsg. unter gutem Schütteln hinzubegeben, bis der Niederschlag wieder in Lösung geht. (Überschuss vermeiden!) Nun wird das Tollens Reagenz mit der Probelösung versetzt. Mit Wasser verdünnt, gut durchmischt und in ein Wasserbad gestellt. Reagenz + 2ml AgNO3+ 1ml Reaktion NaOH+… Aceton (Propanon) reagiert nicht Butanal helles Silber, Cremefarben Benzylaldehyd, dunkles Silber Glucose falsches Erbegniss (Sacherose) Informiere sich über Aceton (Propanon), Butanal, Benzylaldehyd und Glucose. Gib jeweils Summen und Strukturformeln an und Stoffeigenschaften. Aceton (Propanon): CH3–CO-CH3 Eigenschaften: aromatisch riechende Flüssigkeit; reizend; Verursacht Kopfschmerzen und Müdigkeit; narkotisierend; Keton ist ein gutes Lösungsmittel z.B. für Öle, Fette, Harze,… Verwendung: Lack- und Klebstoffindustrie als universelles Lösungs- und Extraktionsmittel für Cellulose; Abbeizmittel für Öl- und Lackfarben; Tränengas; Herstellung von Sprengstoffen Butanal: C4H8O Eigenschaften: leichtentzündlich; reizend; chemische Verbindung, die zu den niederen Aldehyden gehört; farblose Flüssigkeit; stechender Geruch Verwendung: zur Herstellung von Kunstharzen und Weichmachern benötigt Grundlage synthetischer Riechstoffe. reagiert mit Oxidationsmitteln, starken Säuren und starken Basen Benzylaldehyd: C7H6O Eigenschaften: Gesundheitsschädlich; farblose Flüssigkeit; riecht ähnlich wie Marzipan; einfachste aromatische Aldehyd; Verbrennung: Benzaldehyd wird bei vollständiger Verbrennung zu Kohlendioxid und Wasser oxidiert. Glucose: Traubenzucker, D-Glucose, einfacher Zucker (Monosaccharid), Summenformel von Traubenzucker ist C6H12O6, 5 Sacherose: Haushalts- oder Kristallzucker, gehört zu den Kohlenhydraten, ein Disaccharid (Zweifachzucker). Erkläre die beiden Nachweisreaktionen. Nachweiß mit Fehling: Fehling-Probe: Die Fehling-Probe dient zum Nachweis einer Aldehydgruppe (-CHO) in Aldehyden und reduzierenden Zuckern. Zur Durchführung der Fehling-Probe verwendet man zwei Lösungen als Nachweisreagenzien, die Fehlingsche Lösungen bezeichnet werden. Die hellblaue Fehling-Lösung I ist eine verdünnte Kupfer(II)-sulfat-Lösung (CuSO4), die farblose Fehling-Lösung II eine Lösung von Kaliumnatriumtartrat (einem Salz der Weinsäure) in verdünnter Natronlauge. Nach Zusammenführen beider Fehling-Lösungen besitzt das Fehling-Reagenz eine charakteristische dunkelblaue Farbe. Aldehyde werden nach Zugabe von Fehling-Reagenz zu Carbonsäuren oxidiert, während das Kupfersulfat (CuSO4) zu Kupfer(I)-oxid (Cu2O) reduziert wird und als rotbrauner Niederschlag ausfällt. Bei längerem Erhitzen oder bei einfacheren Aldehyden wie Methanal (Formaldehyd) oder Ethanal (Acetaldehyd) kann auch elementares Kupfer entstehen. Die Fehlingprobe eine Redoxreaktion: Alkanone (Ketone) werden von der Fehlingschen Lösung nicht oxidiert. Der Nachweis erlaubt folglich eine Unterscheidung zwischen Alkanon (Ketone sind Oxidationsprodukte sekundärer Alkohole. Weil man sie von Alkanen ableiten kann, nennt man sie auch Alkanone) und Alkanal (Aldehyde/ Alkanale sind chemische Verbindungen, die als funktionelle Gruppe eine Aldehydgruppe (-CHO) enthalten). Nachweiß mit der Tollens-Probe (Silberspiegel): Tollensprobe: Die Tollensprobe/ Silberspiegelprobe ist ein Nachweis für Aldehyde (bzw. reduzierende funktionelle Gruppen). Der Nachweis ist positiv, wenn sich durch Fällung von elementarem Silber die Lösung schwarz verfärbt und sich an der Innenwand des Reagenzglases Silber abscheidet, was zur Bildung eines spiegelnden Belages führt. Mit der Tollensprobe lässt sich auch leicht die Aldehydgruppen reduzierender Zucker wie Glucose nachweisen. Die Tollensprobe eine Redoxreaktion Da die Oxidation der Probesubstanz durch Reduktion der Silber(I)-Ionen erfolgt, kann die Gesamtreaktion wie bei allen Redoxreaktionen in eine Oxidations- und Reduktionsreaktion zerlegt werden. 6 7