Arb.bl. 09-S Alkohole.indd
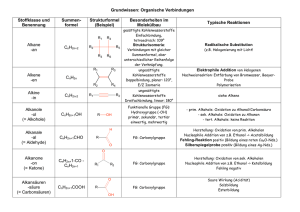
Werbung
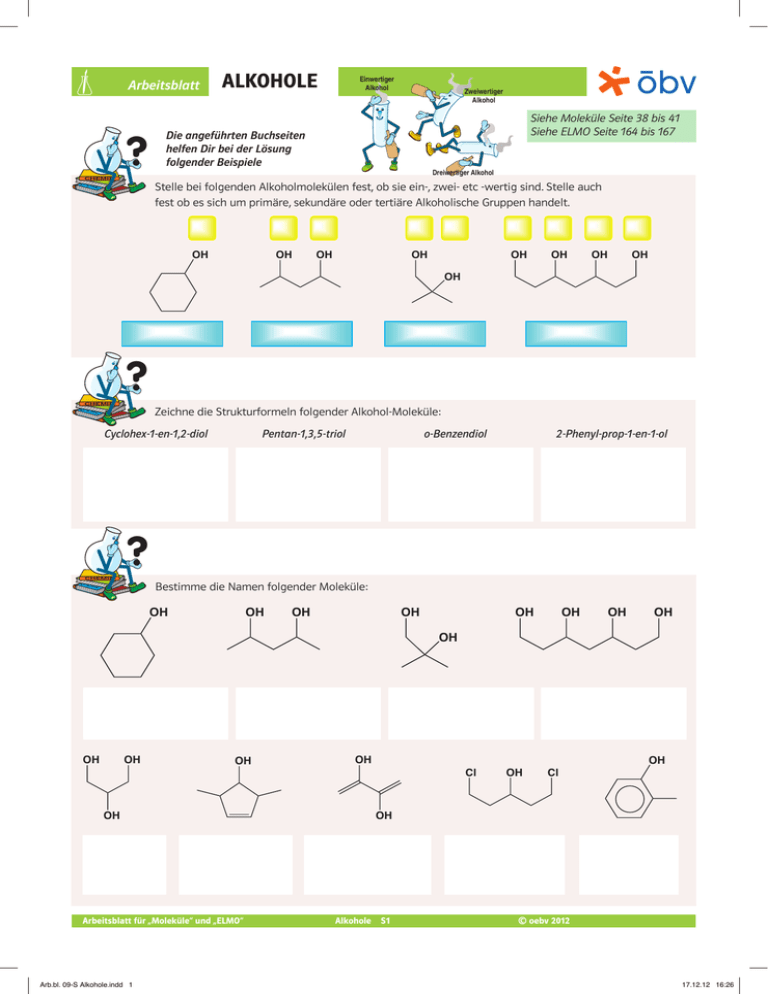
Arbeitsblatt ? Einwertiger Alkohol Zweiwertiger Alkohol Siehe Moleküle Seite 38 bis 41 Siehe ELMO Seite 164 bis 167 Die angeführten Buchseiten helfen Dir bei der Lösung folgender Beispiele Dreiwertiger Alkohol C H E M IE CHEMIE CHEMIE ALKOHOLE Stelle bei folgenden Alkoholmolekülen fest, ob sie ein-, zwei- etc -wertig sind. Stelle auch fest ob es sich um primäre, sekundäre oder tertiäre Alkoholische Gruppen handelt. CH EM IE OH OH OH OH OH OH OH OH OH ? H E M Zeichne die Strukturformeln folgender Alkohol-Moleküle: IE CHEMIE C CHEMIE CH EM IE Cyclohex-1-en-1,2-diol Pentan-1,3,5-triol o-Benzendiol 2-Phenyl-prop-1-en-1-ol ? M Bestimme die Namen folgender Moleküle: IE CHEMIE C H E CHEMIE CH EM IE OH OH OH OH OH OH OH OH OH OH OH OH OH OH Arbeitsblatt für „Moleküle“ und „ELMO“ Arb.bl. 09-S Alkohole.indd 1 Cl OH Cl OH OH Alkohole S1 © oebv 2012 17.12.12 16:26 Oxidation verschiedener Alkohole VS Fülle in eine Proberöhre ca. 1 mL Butan-1-ol, in eine zweite 1 mL Butan-2-ol sowie in eine dritte Proberöhre 1 mL 2-Methyl-propan-2-ol (alle C4H10O). Tropfe jetzt das Reagenz Kaliumdichromat/Schwefelsäure zu den Alkoholen und beobachte die Verfärbungen, die eine Reaktion anzeigen. [K2Cr2O7/H2SO4 = Oxidationsmittel] K2Cr2O7/H2SO4 Tertiärer Alkohol Sekundärer Alkohol Primärer Alkohol ? H E M Notiere, welche Produkte die Oxidation verschiedener Alkohole ergibt: IE CHEMIE C CHEMIE CH EM IE Oxidation primärer Alkohole ––> ..................................... Oxidation Tertiärer Alkohole ––> ............................................... ? H ––> ............................................. Notiere die Reaktionsgleichung für die Oxidation von Butan-2-ol: IE E M CHEMIE C CHEMIE Oxidation sekundärer Alkohole CH EM IE (Oxidationsmittel: CuO wie in VS 41.2. bzw. 167.2) Notiere die Reaktionsgleichung für die Oxidation von Phenyl-methanol: Notiere die Reaktionsgleichung für die Oxidation von Cyclopent-1-en-3-ol: Herstellung eines Esters VS ca. 2 mL Alkohol ca. 2 mL Säure Fülle in eine Proberöhre ca. 2 mL Ethanol und anschließend 2 mL Buttersäure (Butansäure). Gib 2 mL konz. Schwefelsäure zu und schüttle vorsichtig. Gib danach noch ein Siedesteinchen in die Proberöhre und erwärme vorsichtig über einer kleinen Brennerflamme. Nachdem der Inhalt der Proberöhre kurz gesiedet hat, gieße ihn vorsichtig – tropfenweise – auf ein Uhrglas, auf dem Du vorher etwas Natriumhydrogencarbonat (Natriumbicarbonat oder auch Speisesoda genannt) platziert hast. Der charakteristische Geruch des gebildeten Esters steigt Dir schnell in die Nase. 1 2 Siedesteinchen H2SO4 3 4 NaHCO3 Arbeitsblatt für „Moleküle“ und „ELMO“ Arb.bl. 09-S Alkohole.indd 2 Alkohole S2 © oebv 2012 17.12.12 16:26