Hydroxyl
Werbung

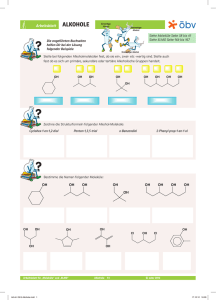
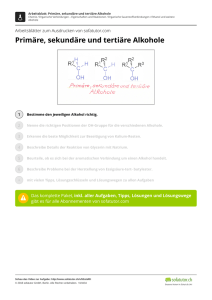
Funktionelle Gruppen Alkohol Unter Alkohol versteht man (als Chemiker) alle Verbindungen, in denen eine Hydroxyl-Gruppe an ein aliphatisches oder alicyclisches Kohlenstoffgerüst gebunden ist. H H C O H Hydroxylgruppe: funktionelle Gruppe der Alkohole H Methanol Benennung der Alkohole: Die Endung –ol wird an den Namen des C – Grundgerüstes gehängt Einteilung der Alkohole Nach der Stellung der OH – Gruppe werden primäre, sekundäre, tertiäre Alkohole unterschieden; Anzahl der OH – Gruppen gibt die Wertigkeit an. 6 Funktionelle Gruppen Alkohol Die Wertigkeit eines Alkohols wird durch die Anzahl der OH (Hydroxyl) Gruppen ausgedrückt. einwertiger Alkohol: Butan-1-ol CH3 CH2 CH2 CH2 OH zweiwertiger Alkohol: Butan-1,2-diol CH3 CH2 CH CH2 OH OH dreiwertiger Alkohol: Butan-1,2,4-triol CH2 CH2 CH CH2 OH OH OH 8 Funktionelle Gruppen Synthese von Alkohol Halogen Alkane sind geeignete Ausgangsstoffe für die Herstellung (Synthese) von Alkoholen. Setzt man einem Halogen-Alkan konzentrierte Natronlauge zu, wird das Halogen-Atom durch eine Hydroxyl Gruppe ersetzt. Es findet eine Substitution statt. Beispiel: CH3Cl + NaOH CH3OH + NaCl Reaktionstyp: Nucleophile Substitution (primäre Alkohole) Das OH- -Ion der Natronlauge (Nucleophil) sucht eine positive Ladung, die von dem C– Atom, an das das Halogen gebunden ist, angeboten wird. Dadurch entsteht ein Übergangszustand mit 5 Bindungen am C-Atom. Dieser ist instabil und führt zur Abspaltung des Halogenid-Ions. R - O + C R R Br O C Br O C + Br 9 Funktionelle Gruppen Eigenschaften von Alkohol Ist das Halogen-Atom an ein tertiäres C-Atom gebunden, wird es als Halogenid-Ion abgespalten. Das C-Atom wird positiv (Carbenium-Ion) und reagiert mit dem OH- Ion. Eigenschaften der Alkohole Schmelz- und Siedepunkte: Alkohole werden mit zunehmender Kettenlänge immer dickflüssiger. Ab C12H25OH (Laurylalkohol) sind sie fest. Alkohole sind polar O-Atom der OH- -Gruppe bildet Wasserstoffbrücken zu andern OH- -Gruppen Siedepunkte der Alkohole sind viel höher als beim entsprechenden Alkan. Alkohole bestehen aus einem polaren Hydroxyl-Anteil, durch den eine Wasserlöslichkeit des Alkohols entsteht und einen unpolaren Alkyl-Rest. Mit zunehmender Kettenlänge nimmt die Löslichkeit in polaren Lösungsmitteln (Wasser) ab. 10 Funktionelle Gruppen Phenol Benzenringe mit Hydroxyl-Gruppen werden als Phenole bezeichnet. (Phen = alter Begriff für Benzen) OH Die einfachste aromatische Hydroxy-Verbindung ist Phenol. Die Verbindung ist giftig und kann über die Haut aufgenommen werden. Früher wurden wässrige Phenollösungen als Desinfektionsmittel unter dem Namen Carbolsäure verwendet. Phenol ähnelt einem einwertigen Alkohol. Er reagiert aber stärker sauer weil die nichtbindenden Elektronenpaare des Sauerstoffs mit der Elektronenwolke des Rings in Wechselwirkung treten. Dadurch vergrößern sie das mesomere System des Aromaten und erhöhen seine Stabilität. Die Abgabe des H+-Ions wird dadurch unter Bildung eines Phenolat-Ions erleichtert. 13 Funktionelle Gruppen Verwendung von Phenol Phenol wird zur Herstellung von Phenoplaste und Epoxidharx sowie Herbiziden verwendet. Bei zwei Hydroxyl-Gruppen (Benzendiole) werden 3 Isomere unterschieden: OH OH OH OH OH OH Benz-1,2-diol Benz-1,3-diol Benzcatechin Recorcin leicht oxidierbar, gute Oxidationsmittel Benz-1,4-diol Hydrochinon Phenole entstehen auf natürliche Weise in Eichenrinde oder als Gerbstoffen im Tee. 14