Vorlesung Massenspektrometrie
Werbung

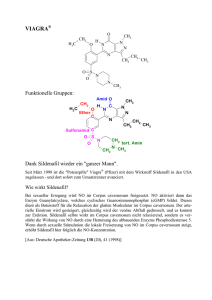
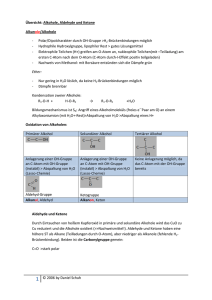
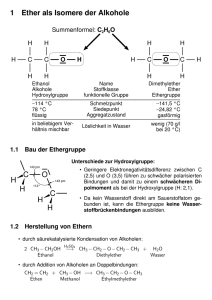
2 Massenspektrometrie 2.1 Grundlagen • • • • relative Atommasse Massenzahl Summe relative Molekülmasse M Isotope – ein Element – gleiche Protonenzahl, aber verschiedene Neutronenzahl Isobare – Teilchen gleicher Masse, aber verschiedener Zusammensetzung Verhältnis Masse / Ladung (m/z) Massenspektrum: • x-Achse: m/z-Verhältnis (Ionenmasse / Ionenladung) • y-Achse: relative Häufigkeit der detektierten Ionen (intensivster Peak 100 %) • Strichspektrum (aus einem vereinfachten aufgenommenen Spektrum) 2.2 Was kann Massenspektrometrie? • • • Moleküle in Bruchstücke zerlegen Rückschlüsse auf Probenmolekül Probenmenge: 1 - 50 μg Spurenanalytik: pg-Bereich (10-12 g) Messung von Gasen, Flüssigkeiten, Lösungen, Feststoffen geeignet für: • verdampfbare organische Moleküle • Reinsubstanzen (95-98%) • Strukturaufklärung organischer Verbindungen (ggf. in Kombination mit anderen Methoden) nicht oder bedingt geeignet für • Gemische • verunreinigte Verbindungen • thermisch instabile Verbindungen • stark polare Substanzen (vor der Aufnahme methylieren) Begriffe: • Molekül-Peak - durch das ionisierte Molekül-Ion M+ - relative Molekülmasse der Verbindung • Basis-Peak - Peak mit der höchsten Intensität (= 100%) • Isotopen-Peaks - rechts vom Molekül-Peak - durch natürliche Häufigkeit der Isotope • Fragment-Peaks - durch Zefallsreaktionen (Fragmentierungsreaktionen) - links vom Molekül-Peak 2.3 Spektrenauswertung natürliche Häufigkeit stabiler Isotope: Molekülpeak M M+1 M+2 Wasserstoff 99,99 % 0,01 % Kohlenstoff 98,93% 1,07% Sauerstoff 99,76% 0,04% Stickstoff 99,64% 0,36% Schwefel 94,99% 0,75% 4,25% Phosphor 100% Silicium 92,22% 4,68% 3,09% 0,20% Fluor 100% Chlor 75,76% 24,24% Brom 50,69% 49,31% Iod 100% M+4 0,01% Fragmentierungsmöglichkeiten • hauptsächlich Molekül AB + e AB•+ + 2 e in geringerem Maße AB + e AB2+ + 3 e AB + e AB•• AB•+ A + B•+ AB•+ A• + B+ • Massenspektrum – Registrierung der Ionen – Radikale und Moleküle als Differenzen Aliphatische Kohlenwassestoffe • • • m/z Fragment-Ion Bemerkung 15 CH3 + geringe Intensität (oder gar nicht zu sehen) 29 CH3-CH2 + 43 CH3-CH3-CH2 + energetisch begünstigt meist Basispeak + 57 CH3-CH2-CH2-CH2 71 CH3-CH2-CH2-CH2-CH2 + energetisch begünstigt verzweigte Kohlenwasserstoffe Ionen mit größerer Intensität als die ihrer homologen Nachbarn cyclische Kohlenwasserstoffe m/z Fragment-Ion Cyclohexan 56 C4H8 + Cyclohexen 54 CH2=CH-CH=CH2 + Beispiel: Cyclohexen Alken und Dien m/z = 28 m/z = 54 Bemerkung Retro-Diels-Alder-Spaltung Aromatische Kohlenwasserstoffe m/z Fragment-Ion Bemerkung 91 Tropyliumion C7H7 + energetisch begünstigt meist Basispeak 77 C6H5 + energetisch begünstigt 65 C5H5 + 51 C4H3 + Halogenkohlenwasserstoffe m/z Fragment-Ion Bemerkung 35 und 37 35 Chlorverbindungen 36 und 38 H35Cl + / H37Cl + Chorverbindung (Isotopenmuster beachten) 79 und 81 79 Bromverbindung (Isotopenmuster beachten) 127 Cl +/ 37 Cl + Br + / 81Br + 127 + I (Isotopenmuster beachten) Iodverbindung (oder Naph-thylverbindung C 10H7 +) Sauerstoffverbindungen • Alkohole: in der Regel kein Molekülpeak leichte Abspaltung von Wasser m/z Fragment-Ion Bemerkung 31 CH2=OH+ primäre Alkohole 45 CH3-CH=OH + sekundäre Alkohole 59 CH3-CH2-CH=OH + tertiäre Alkohole McLafferty-Umlagerung • • • bei Verbindungen ab 4 C-Atomen mit mindestens einer Doppelbindung (C=C, C=O, C=N) interne Umlagerung H-Atom wird auf Heteroatom übertragen Heterokation und neutrales Alken m/z Molekül-Ion Aldehyde 44 CH2=CHOH• + Ketone 58 CH2=C(CH3)OH• + Säureamide 59 CH2=C(NH2)OH• + Carbonsäuren 60 CH2=C(OH)2 • + • Phenole, Carbonsäuren, Säureamide leichte Abspaltung von Wasser • langkettige Carbonsäuren m/z Fragment-Ion Bemerkung 73 CH2=CH-C(OH)=OH + Spaltung am γ-C-Atom Stickstoffverbindungen • Stickstoffregel – enthält eine Verbindung eine ungerade Zahl von N-Atomen, erscheint der Molekülpeak bei ungeradem m/z-Verhältnis m/z Fragment-Ion Bemerkung 30 CH2=NH2 + oder CH3-NH+ primäre oder sekundäre Amine 30 NO + 44 46 Nitroverbindungen + CH2=CH-NH2 oder CH3-CH2-NH + primäre oder sekundäre Amine O=C=NH2 + primäre Amide NO2 + Nitroverbindungen Schwefelverbindungen m/z 32 47 Fragment-Ion + Bemerkung Thiole, Thioether (Isotopenmuster beachten) S + CH =SH Thiole, Thioether (Isotopenmuster beachten) 2 Massendiffenzen (Auswahl) ∆m mögliches abgespaltenes Fragment M-1 H. M-15 CH3 . Methylgruppe M-16 NH2 . Amine, aromatische Säureamide M-17 OH . Alkohole, Phenole, Carbonsäuren, -amide NH3 . Amine H2O . Alkohole, Phenole, Aldehyde, einige Ketone M-18 Hinweis auf H in fragmentierungsgünstiger Stellung 2.4 Spektrometeraufbau Messprinzip • Moleküle werden in der Gasphase ionisiert und zerfallen in • Molekül-Ionen, geladene Bruchstücke (hauptsächlich Kationen, teilweise Ionen aus Umlagerungen, selten Anionen) • Radikale • Neutralteilchen • geladene Teilchen werden in einem elektrischen Feld beschleunigt, • in einem magnetischen Feld auf eine Kreisbahn abgelenkt und • detektiert 2.4.1 Probeneinlasssystem • • Gase, Flüssigkeiten direkter Einlass bei niedriger Temperatur feste Substanzen mit Fp oberhalb der Raumtemperatur direkter Einlass auf einer Schubstange – thermisch unbeständige Substanzen mit gekühlter Schubstange – schwerflüchtige Substanzen mit geheizter Schubstange 2.4.2 Ionenquelle • ein Elektron aus der äußersten besetzten Schale des Moleküls wird herausgeschlagen – Elektronenstoßionisation EI – Feldionisation FI – Felddesorption FD – thermische Ionisation TIMS – chemische Ionisation CI – Fotoionisation – weitere • matrixunterstützte Laserdesorption/-ionisation MALDI • Elektronensprayionisation ESI • fast atom bombardment FAB Elektronenstoßionisation • • Moleküle im Gaszustand (10-4 Pa) Elektronen aus einer Heizwendel werden auf ca. 70 eV beschleunigt Feldionisation • elektrische Spannung zwischen feinen Nadelspitzen (Wolframdraht-“Flaschenbürste“) und Gegenelektrode Chemische Ionisation • • ähnlich Elektronenstoß-Ionisation Reaktandgas wird durch Elektronen (50-100 eV) ionisiert – Deprotonierung, Protonierung, Adduktbildung, Ladungsaustausch – Methan, i-Butan, Ammoniak – Beispiel: Deprotonierung CH4 + e CH4•+ + 2 e CH4•+ CH3+ + H• H-M + CH3+ CH4 + M+ 2.4.3 Massenanalysator • • Beschleunigung der Ionen im elektrischen Feld Auftrennung im magnetischen Feld – Sektorfeld – Quadrupol Sektorfeld-Massenanalysator • Ablenkung um 60 oder 90° • Auftrennung abhängig von – m/z-Verhältnis – magnetischer Feldstärke – Beschleunigungsspannung Quadrupol-Massenanalysator • gegenüberliegende Elektrodenpaare an einer Spannungsquelle (Gleich- und Wechselspannung) • Teilchen auf Spiralbahnen (Trajektorien) • Variation von Frequenz und Amplitude der Wechselspannung 2.4.4 Detektor • ortsauflösend – Fotoplatte – Array-Detektor • zeitauflösend – Faraday-Auffänger – Szintillationsdetektor – Sekundärelektronenvervielfacher SEV • Die Massenspektrometrie selbst ist ein Detektionssystem für Gemischbestandteile (Kopplung mit Gaschromatographie GC-MS).