Herstellung von 1-Hexyliodid
Werbung

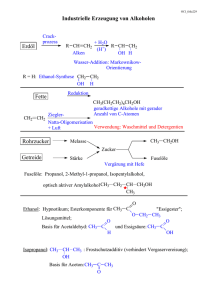
Org. chemisches Laborpraktikum Herstellung von 1-Hexyliodid Laufende Laborversuch-Nr.: 5 1.0 Ansatzgröße Einsatz : 10,22g Hexanol (102,18 g/mol) = 0,1 mol 12,7 g Jod (126,9 g/mol) = 0,05 mol 1,08 g roter Phospor (30,97 g/mol) = 0,035 mol 10 mL Na2S2O4-Lsg, 1,0 g Na2SO4 , H2O, 30 mL Ether 2.0 Reaktion und Mechanismus 2 Prot 3J2 3C6 H13OH 2 PJ 3 PJ 3 3C6 H13 J H3 PO3 Primäre und sekundäre Alkohole reagieren mit Phosphortrijodid, welches äußerst reaktiv ist und am besten frisch hergestellt werden sollte, zu Iodalkanen und Phosphoriger Säure. Dieses Verfahren dient generell zur Darstellung von Iodalkanen aus Alkoholen. Phosphortriiodid kann alle drei Iodatome übertragen. Dieses Verfahren ist besondes gut zur Darstellung von Iodalkanen geeignet, da dadurch ein Überschuß an Iodwasserstoff vermieden wird, der Iodalkane reduzieren kann, was zur Folge hätte, daß der jeweilige Kohlenwasserstoff entsteht. Diese Reaktion tritt besonders leicht bei tertiären Alkyliodiden ein, die man daher besser nach [ 1.] herstellt. Die treibende Kraft ist die Ausbildung einer starken Phosphor- SauerstoffDoppelbindung. Im ersten Schritt reagieren die Phosphorverbindung unter Ausbildung einer Verbindung, die man als protoniertes anorganisches Esterderivat der Phosphorigen Säure auffassen kann: H I CH3(CH2)4CH2OH + P I CH3(CH2)4CH2O + PI2 + I I HOPI2 ist eine gute Abgangsgruppe und wird durch Iodid ( nukleophile Substitution) verdrängt, das im esterbildenden Schritt entsteht. H I + CH3(CH2)4CH2O + PI2 CH3(CH2)4CH2I + HOPI2 HOPI2 reagiert daraufhin nacheinander mit zwei weiteren Alkoholmolekülen nach dem gleichen Schema wie bei dem ersten esterbildenden Schritt. Seite 1 von 4 Org. chemisches Laborpraktikum H CH3(CH2)4CH2OH + HOPI2 CH3(CH2)4CH2O + POH I + CH3(CH2)4CH2O + POH CH3(CH2)4CH2I I I H I + + HO P OH I CH3(CH2)4CH2OH + (HO)2PI CH3(CH2)4CH2I + H3PO3 Das Gelingen der Umsetzung beruht darauf, daß die Hydroxygruppe zu Beginn der Reaktion in eine gute Abgangsgruppe umgewandelt wird, wie es auch bei der Reaktion von z.B. Alkoholen mit Iodwasserstoff zu Iodalkanen der Fall ist. Dieses letztere Verfahren wird jedoch durch die stark sauren Reaktionsbedingungen und durch mögliche Umlagerungen kompliziert. Wenn diese Substitution nach einem SN2- Mechanismus verläuft ( nur bei primären Alkoholen) und das Reaktionszentrum chiral ist, tritt Inversion der Konfiguration des Alkyl-Restes (Walden´sche Umkehr) ein. 3.0 Geräte und Apparatives Geräte: Rundkolben. Tropftrichter, Magnetrührer, Dimrothkühler, Hebebühne, Scheidetrichter, Becherglas (klein), Messzylinder, Thermometer, Stativ und Klammern, Korkringe Destillationsbrücke , Faltenfilter, Trichter, Vakuumvorstoß und Vorlagen Aufbau der Rühr- und Destillationsapparatur: KPG-Rührer Dimroth-Kühler Stabthermometer Dreihalsrundkolben Pilzheizhaube Seite 2 von 4 Org. chemisches Laborpraktikum Stabthermometer mit Quickfit Claisen-Aufsatz Siedekapillare Liebigkühler 100ml ZweinhalsRundkolben Vakkumvorstoß Spinne Pilzheizhaube 50ml Spitzkolben 4.0 Versuchsdurchführung In einen 100ml Dreihalsrundkolben wurden nacheinander eingewogen und sofort mit einem laufenden Rückflußkühler bestückt, da die Reaktion stark exotherm anlief. Unter starkem Rühren wurde das Reaktionsgemisch nun ca. 50min unter Rückfluß gekocht. Nach beendeter Reaktion wurde das Reaktionsgemisch mit 10ml Wasser zum Entfernen der entstandenen phosphorigen Säure und Reste von nicht umgesetztem Alkohol und Phosphortriiodid versetzt. Dabei wurde die organische Phase von der wäßrigen in einem Scheidetrichter abgetrennt. Die wäßrige Phase wurde anschließend 3 mal mit ca. 10 ml Diethylether extrahiert, um mögliche Reste des entstandenen Iodalkans in die organische Phase zu überführen. Anschließend wurde die organische Phase mit 10 ml einer 0,05%igen Na2S2O5Lösung versetzt (um Reste von nicht umgesetztem Iod zu entfernen) und durch Schütteln mit dieser entfärbt. Zur Entfernung von gelöstem SO2 wurde anschließend erst mit 10 ml einer 0,1M NaOH dann mit 10 mL Wasser extrahiert. Die vereinigten organischen Extrakte wurden anschließend mit wasserfreiem Natriumsulfat getrocknet und über einen Faltenfilter filtriert. In einer Destillationsapparatur wurde erst bei Normaldruck der Diethylether abdestilliert, anschließend wurde das Rohprodukt einer fraktionnierenden Destillation unter vermindertem Druck unterworfen. Man erhielt eine leicht orange gefärbte Flüssigkeit. Von diesem Reindestillat wurde der Brechungsindex mit Hilfe eines AbbeRefraktometers und die Ausbeute bestimmt. Seite 3 von 4 Org. chemisches Laborpraktikum 5.0 Brechungsindex: Theoriewert Brechungsindex von 1- Iodhexan : nD20= 1,4926 gemessener Praxiswert: nD20= 1,4910 6.0 Ausbeutebestimmung Als Berechnungsgrundlage dient die theoretische Ausbeute von Hexyliodid bezogen auf den Einsatz Hexanol (0,10 mol) bei einer Annahme von 100% Umsatz; dies entspricht bei der Molmasse von 212,07 g/mol für Hexyliodid = 21,20 g Berechnung der Ausbeute in % Auswaage 16,50 g Ausbeute Auswaage( g ) *100% Theoretische. Ausbeute( g ) Ausbeute 16,50 g *100% 21,20 g 77 ,83 % Laut Literatur wird eine Ausbeute von 70 80 % Benzoesäure erwartet. 7.0 Sicherheitsdaten Stoff Hexanol Diethylether Jod Na2SO4 Na2S2O4 Roter Posphor NaOH Hexyliodid Gefahrenbezeichnun g F,Xn F;Xn Xn Xi F Xn Xi 8.0 Literaturquellen Laborvorschrift Organikum, org.-chemisches Grundpraktikum 9.0 Anlage Notizen Seite 4 von 4 R-Sätze S-Sätze 11-20 22-36 20/21 36 36/37/38 11-16 36/37/38 10 16-25-29-33 24 23-25 2-5 50 7-43 16-25 23-24/25