1.2.3 - IOC
Werbung
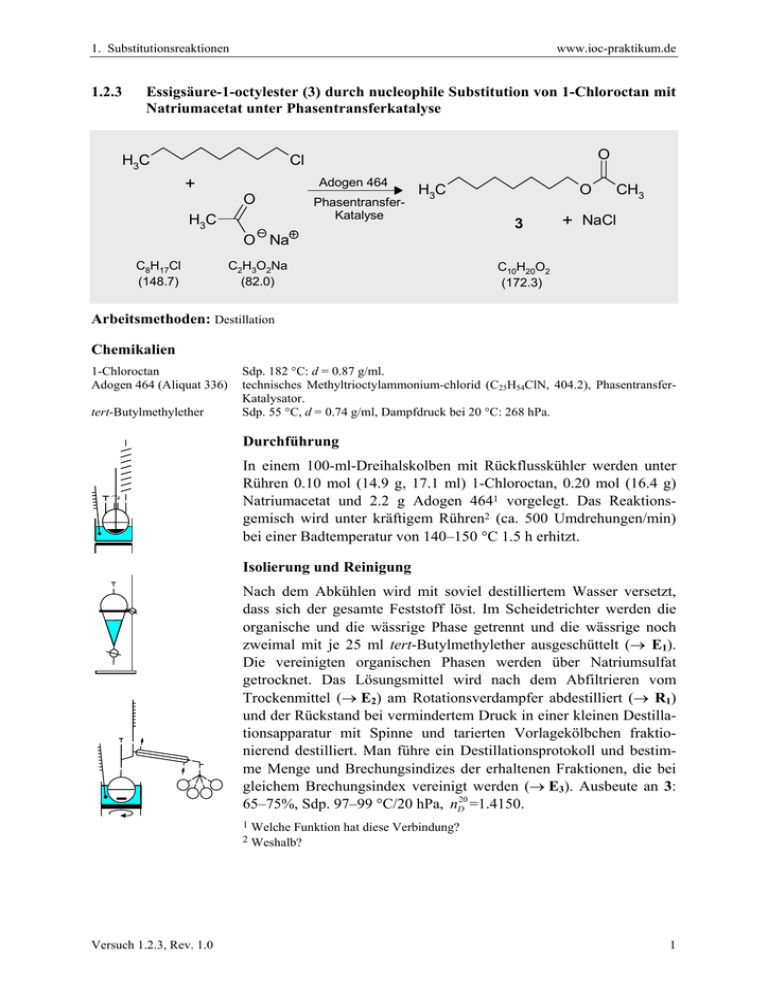
1. Substitutionsreaktionen 1.2.3 www.ioc-praktikum.de Essigsäure-1-octylester (3) durch nucleophile Substitution von 1-Chloroctan mit Natriumacetat unter Phasentransferkatalyse O Cl H3C + Adogen 464 O H3C PhasentransferKatalyse O H3C 3 CH3 + NaCl O Na C8H17Cl (148.7) C2H3O2Na (82.0) C10H20O2 (172.3) Arbeitsmethoden: Destillation Chemikalien 1-Chloroctan Adogen 464 (Aliquat 336) tert-Butylmethylether Sdp. 182 °C: d = 0.87 g/ml. technisches Methyltrioctylammonium-chlorid (C25H54ClN, 404.2), PhasentransferKatalysator. Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa. Durchführung In einem 100-ml-Dreihalskolben mit Rückflusskühler werden unter Rühren 0.10 mol (14.9 g, 17.1 ml) 1-Chloroctan, 0.20 mol (16.4 g) Natriumacetat und 2.2 g Adogen 4641 vorgelegt. Das Reaktionsgemisch wird unter kräftigem Rühren2 (ca. 500 Umdrehungen/min) bei einer Badtemperatur von 140–150 °C 1.5 h erhitzt. Isolierung und Reinigung Nach dem Abkühlen wird mit soviel destilliertem Wasser versetzt, dass sich der gesamte Feststoff löst. Im Scheidetrichter werden die organische und die wässrige Phase getrennt und die wässrige noch zweimal mit je 25 ml tert-Butylmethylether ausgeschüttelt (→ E1). Die vereinigten organischen Phasen werden über Natriumsulfat getrocknet. Das Lösungsmittel wird nach dem Abfiltrieren vom Trockenmittel (→ E2) am Rotationsverdampfer abdestilliert (→ R1) und der Rückstand bei vermindertem Druck in einer kleinen Destillationsapparatur mit Spinne und tarierten Vorlagekölbchen fraktionierend destilliert. Man führe ein Destillationsprotokoll und bestimme Menge und Brechungsindizes der erhaltenen Fraktionen, die bei gleichem Brechungsindex vereinigt werden (→ E3). Ausbeute an 3: 65–75%, Sdp. 97–99 °C/20 hPa, nD20 =1.4150. 1 2 Versuch 1.2.3, Rev. 1.0 Welche Funktion hat diese Verbindung? Weshalb? 1 1. Substitutionsreaktionen www.ioc-praktikum.de Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel Wässrige Lösung mit Spuren organischen Verbindungen → Entsorgung (H2O mit RHal/Halogenid). Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe). Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton lösen → Entsorgung (RHal). Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether). E1: E2: E3: R1: Auswertung des Versuchs H-NMR-Spektrum von 3 (300 MHz, CDCl3): δ = 0.88 (3 H) 1.22–1.40 (10 H), 1.62 (2 H), 2.14 (3 H), 4.05 (2 H). 1 a) b) a) 5.0 c) b) 4.0 3.0 2.0 c) 1.0 [ppm] 0.0 C-NMR-Spektrum (75.5 MHz, CDCl3) von 3: δ = 14.12 (CH3), 20.98 (CH3), 22.72 (CH2), 26.01 (CH2), 28.70 (CH2), 29.28 (CH2), 29.32 (CH2), 31.88 (CH2), 64.68 (CH2), 171.17 (C). 13 LM 180 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 3 (Film): 100 T [%] 50 2855 2955 2930 0 4000 * 1745 3000 2000 1500 1000 -1 ~ ν [cm ] Formulieren Sie den zu 3 führenden Reaktionsmechanismus. Versuch 1.2.3, Rev. 1.0 2 1. Substitutionsreaktionen www.ioc-praktikum.de Weitere denkbare Reaktionsprodukte: CH2 H3C A CH2OH H3C B * Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A und B ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Die nucleophile Substitution von Alkylhalogeniden R'X mit Carboxylationen RCO2 zu Estern RCO2R' ist weniger üblich, im Gegensatz zur normalen Veresterung stammen beide Sauerstoffatome des Esters aus der Carbonsäure. Zum Einsatz der Phasentransferkatalyse siehe: [1] H.A. Zahalka, Y. Sasson, Synthesis, 1986, 763–765. [2] E.V. Dehmlow, S.S. Dehmlow, Phase Transfer Catalysis, 3. Aufl., VCH Weinheim, 1993. Versuch 1.2.3, Rev. 1.0 3



![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)