1.1.1: 1-Bromoctan - IOC
Werbung

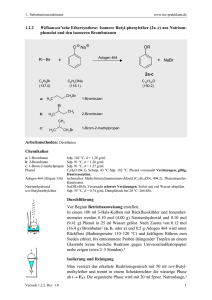
1. Substitutionsreaktionen 1.1.1 www.ioc-praktikum.de Umsetzung von 1-Octanol mit Bromwasserstoffsäure zu 1-Bromoctan (1) OH H3C H2SO4 konz. Rückfluß + HBr C8H18O (130.2) Arbeitsmethoden: (80.9) Br H3C 1 (98.1) + H2O C8H17Br (193.1) Destillation Chemikalien 1-Octanol Bromwasserstoffsäure Konz. Schwefelsäure Cyclohexan Sdp. 195 °C, d = 0.83 g/ml. 48proz. wässrige Lösung, d = 1.49 g/ml. Verursacht Verätzungen. Sofort mit viel Wasser abspülen. 95–98proz., d = 1.84 g/ml. Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen. Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa. Durchführung Vor Beginn Betriebsanweisung erstellen. In einem 100 ml-Rundkolben mit Rückflusskühler wird die Mischung von 0.10 mol (13.0 g, 15.7 ml) 1-Octanol, 0.50 mol (5.0 g, 2.7 ml) konz. Schwefelsäure1 und 0.15 mol (25.3 g, 17.0 ml) 48proz. Bromwasserstoffsäure in einem Heizbad 5 h unter schwachem Rückfluss zum Sieden erhitzt (Badtemperatur ca. 140–160 °C). Isolierung und Reinigung Nach dem Abkühlen gießt man die Mischung in einem Scheidetrichter auf 60 ml Eiswasser, fügt 50 ml Cyclohexan zu,2 schüttelt gut durch und trennt die Phasen. Die wässrige Phase wird mit weiteren 20 ml Cyclohexan ausgeschüttelt (→ E1). Die organischen Phasen werden vereinigt und mit je 15 ml konz. Schwefelsäure und Wasser gewaschen (→ E1). Danach wird die organische Phase bis zur neutralen Reaktion über festem Kaliumcarbonat gerührt (→ E2).3 Nach dem Abdestillieren des Lösungsmittels am Rotationsverdampfer (→ R1) wird das Rohprodukt bei vermindertem Druck in einer kleinen Destillationsapparatur mit Spinne und tarierten Vorlagekölbchen fraktionierend destilliert. Man führe ein Destillationsprotokoll und bestimme Menge und Brechungsindizes der erhaltenen Fraktionen, die bei gleichem Brechungsindex vereinigt werden (→ E3). Ausbeute an 1: 65–75%, Sdp. 81 °C/16 hPa, nD20 =1.4524. Das 1-Bromoctan 1 kann in Versuch 1.4.2 weiter zu 1-Chloroctan umgesetzt werden. 1 Wozu dient die Schwefelsäure? Weshalb ist Cyclohexan hier geeignet, nicht z.B. Diethylether? 3 Welchen Zweck hat das Rühren über Kaliumcarbonat? 2 Versuch 1.1.1, Rev. 1.0 1 1. Substitutionsreaktionen www.ioc-praktikum.de Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: E2: E3: R 1: Wässrige Phasen mit Spuren organischen Verunreinigungen → Entsorgung (H2O mit RHal/Halogenid). Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe). Verunreinigte Fraktionen und Destillationsrückstand → Entsorgung (RHal). Abdestilliertes Lösungsmittel → Recycling (Cyclohexan). Auswertung des Versuchs H-NMR-Spektrum von 1 (300 MHz, CDCl3): δ = 0.88 (3 H), 1.17–1.36 (8 H), 1.36–1.50 (2 H), 1.85 (2 H), 3.40 (2 H). 4 .0 3 .0 541.4 Hz 548.2 Hz 556.1 Hz 563.0 Hz 569.9 Hz 1014.6 Hz 1021.4 Hz 1028.3 Hz 1 2 .0 1 .0 [p p m ] 0 .0 C-NMR-Spektrum (75.5 MHz, CDCl3) von 1: δ = 14.08 (CH3), 22.63 (CH2), 28.20 (CH2), 28.75 (CH2), 29.12 (CH2), 31.77 (CH2), 32.87 (CH2), 34.01 (CH2). 13 40 30 20 10 [ppm] 0 IR-Spektrum von 1 (Film): 100 T [%] 50 2960 2855 2925 0 4000 Versuch 1.1.1, Rev. 1.0 3000 2000 1500 1000 ~ [cm-1] ν 2 1. Substitutionsreaktionen * www.ioc-praktikum.de Formulieren Sie den zu 1 führenden Reaktionsmechanismus. Weitere denkbare Reaktionsprodukte: CH2 H3C A OSO3H H3C B H3C(CH2)7O(CH2)7CH3 C * Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–C ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Diese Arbeitsvorschrift kann allgemein zur Umsetzung von n-Alkoholen (ca. C4–C12) zu primären Bromalkanen verwendet werden. Sekundäre und tertiäre Alkohole unterliegen leicht – insbesondere bei höheren Temperaturen – Umlagerungen und Eliminierungen zu Alkenen. Versuch 1.1.1, Rev. 1.0 3