4.1.2.4 - IOC
Werbung

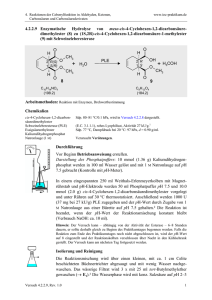
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de 4.1.2.4 Umsetzung von 2,4-Pentandion (Acetylaceton) mit Hydroxylamin zu 3,5Dimethylisoxazol (4) O CH3 O CH3 H3C + H2NOH • HCl C5H8O 2 (100.1) Ethanol H4ClNO (69.5) H3C O N + 2 H2O 4 C5H7NO (97.1) Arbeitsmethoden: Destillation Chemikalien 2,4-Pentandion (Acetylaceton) Hydroxylaminhydrochlorid Ethanol tert-Butylmethylether Sdp. 139 °C, d = 0.97 g/ml. Schmp. 157 °C. Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 59 hPa. Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa. Durchführung Vor Beginn Betriebsanweisung erstellen. In einem 250-ml-Rundkolben mit Rückflusskühler werden 215 mmol (14.94 g) Hydroxylaminhydrochlorid in 30 ml Wasser gelöst und 200 mmol (20.02 g, 20.64 ml) Acetylaceton in 20 ml Ethanol zugegeben. Die Reaktionsmischung wird etwa 1 h unter Rückfluss zum Sieden erhitzt. Das Ende der Reaktion wird durch einen negativen Eisen(III)-chlorid-Farbtest angezeigt.1 Isolierung und Reinigung Die abgekühlte Reaktionsmischung wird im Scheidetrichter auf 120 ml Eiswasser gegossen und 4-mal mit je 50 ml tert-Butylmethylether extrahiert (Wasserphase → E1). Die organischen Phasen werden vereinigt und über Natriumsulfat getrocknet. Nach dem Absaugen vom Trockenmittel (Büchnertrichter) (→ E2) wird das Lösungsmittel mit einer einfachen Destillationsapparatur unter Normaldruck abdestilliert (→ R1). Die zurückbleibende Flüssigkeit wird in einen 50 ml-Kolben überführt und über eine kleine Vigreux-Kolonne (20 cm) mit einer kleinen Destillationsapparatur mit Spinne und tarierten Vorlagekölbchen fraktionierend destilliert (Destillationsprotokoll führen!). Bestimmen Sie Ausbeute und Brechungsindex des Reinprodukts (→ E3). Ausbeute an 4:. 60–70%, Sdp. 141–143 °C, nD20 = 1.4440. 1 Versuch 4.1.2.4, Rev. 1.0 Welche Verbindung wird durch den Eisen-(III)-chlorid-Farbtest nachgewiesen? 1 4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de Hinweise zur Entsorgung (E) , Reycling (R) der Lösungsmittel E1: E2: E3: R1: Wässrige Phase → Entsorgung (H2O/RHal). Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe). Destillationsrückstand in wenig Aceton lösen, verunreinigte Fraktionen → Entsorgung (RH). Abdestilliertes Lösungsmittel → Redestillation (tert-Butylmethylether). Auswertung des Versuchs H-NMR-Spektrum von 4 (300 MHz, CDCl3): δ = 2.25 (3 H), 2.37 (3 H), 5.81 (1 H). 1 6.0 5.0 4.0 3.0 2.0 1.0 [ppm] 0.0 C-NMR Spektrum von 4 (75.5 MHz, CDCl3): δ = 11.36 (CH3), 12.13 (CH3), 102.29 (CH), 159.92 (C), 169.07 (C). 13 LM 180 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 4 (Film): 100 T [%] 3130 50 2930 2970 0 4000 1610 3000 2000 1500 1000 ~ [cm-1] ν * Formulieren Sie den zu 4 führenden Reaktionsmechanismus. Versuch 4.1.2.4, Rev. 1.0 2 4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de Weitere denkbare Reaktionsprodukte: OH N OH N H3C CH3 OH N O H3C N CH3 O N N H3C O OH CH3 H3C CH3 H H H H H H H H A B C D * Mit welchen spektroskopischen Daten lassen sich A–D ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Der Versuch basiert auf A.O. Fitton, R.K. Smalley, Practikal Heterocyclic Chemistry, Academic Press, London 1968, S. 28. Siehe auch: Th. Eicher, S. Hauptmann, Chemie der Heterocyclen, G. Thieme Verlag, Stuttgart-New York 1994, S. 141. Versuch 4.1.2.4, Rev. 1.0 3
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)