4.2.2.9 - IOC
Werbung

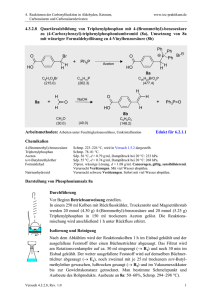
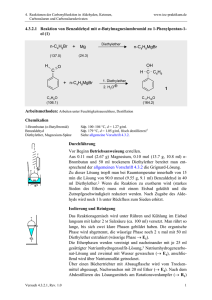
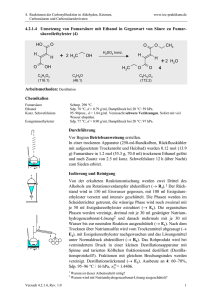
4. Reaktionen der Cabonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de 4.2.2.9 Enzymatische Hydrolyse von meso-cis-4-Cyclohexen-1,2-dicarbonsäuredimethylester (8) zu (1S,2R)-cis-4-Cyclohexen-1,2-dicarbonsäure-1-methylester (9) mit Schweineleberesterase H O 2 R(S) 1 S(R) H O H O O CH3 + H2O PLE CH3 C10H14NO4 (198.2) OH 2 R 1 S H 8 O O O + H3COH CH3 9 C9H12O4 (184.2) Arbeitsmethoden: Reaktion mit Enzymen, Drehwertbestimmung Chemikalien cis-4-Cyclohexen-1,2-dicarbonsäuredimethylester Schweineleberesterase (PLE) Essigsäureethylester Kaliumdihydrogenphosphat Natronlauge (1 M) Sdp. 80–81 °C/0.1 hPa, wird in Versuch 4.2.2.8 dargestellt. (E.C. 3.1.1.1), rohes Lyophilisat, Aktivität 27 kU/g.1 Sdp. 77 °C, Dampfdruck bei 20 °C: 97 hPa, d = 0.90 g/ml. Verursacht Verätzungen. Durchführung Vor Beginn Betriebsanweisung erstellen. Darstellung des Phosphatpuffers: 10 mmol (1.36 g) Kaliumdihydrogenphosphat werden in 100 ml Wasser gelöst und mit 1 M Natronlauge auf pH 7.5 gebracht (Kontrolle mit pH-Meter). In einem eingespannten 250 ml Weithals-Erlenmeyerkolben mit Magnetrührstab und pH-Elektrode werden 50 ml Phosphatpuffer pH 7.5 und 10.0 mmol (2.0 g) cis-4-Cyclohexen-1,2-dicarbonsäuredimethylester vorgelegt und unter Rühren auf 30 °C thermostatisiert. Anschließend werden 1000 U (37 mg bei 27 kU/g) PLE zugegeben und der pH-Wert durch Zugabe von 1 M Natronlauge aus einer Bürette auf pH 7.5 gehalten.2 Die Reaktion ist beendet, wenn der pH-Wert der Reaktionsmischung konstant bleibt (Verbrauch NaOH: ca. 10 ml). Hinweis: Der Versuch kann – abhängig von der Aktivität der Esterase – 6–8 Stunden dauern, er sollte deshalb gleich zu Beginn des Praktikumtages begonnen werden. Falls die Reaktion zum Ende des Praktikumstages noch nicht abgeschlossen ist, wird der pH-Wert auf 8 eingestellt und der Reaktionskolben verschlossen über Nacht in den Kühlschrank gestellt. Der Versuch kann am nächsten Tag fortgesetzt werden. Isolierung und Reinigung Die Reaktionsmischung wird über einen kleinen, mit ca. 1 cm Celite beschichteten Büchnertrichter abgesaugt und mit wenig Wasser nachgewaschen. Das wässrige Filtrat wird 3 x mit 25 ml tert-Butylmethylether gewaschen (→ E1).3 Die Wasserphase wird mit konz. Salzsäure auf pH 2–3 Versuch 4.2.2.9, Rev. 1.0 1 4. Reaktionen der Cabonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de gebracht und dreimal mit je 50 ml tert-Butylmethylether extrahiert (→ E2). Die vereinigten organischen Phasen werden über Natriumsulfat getrocknet. Nach dem Absaugen vom Trockenmittel (→ E3) wird das Lösungsmittel am Rotationsverdampfer abdestilliert (→ R1), Lösungsmittelreste bei vermindertem Druck entfernt; das ölige Produkt kristallisiert langsam im Eisbad. Eine weitere Reinigung ist nicht nötig. Ausbeute Reinprodukt (g, %)? Man bestimme den spezifischen Drehwert von 9 und berechne den Enantio20 merenüberschuss (ee). Ausbeute an 9: 75–85%, Schmp. 28 °C, [ a ] D = +11.0° (c = 1.0, Aceton). 1 2 3 Die übliche Mengeneinheit bei Einsatz von Enzymen ist 1 U (Unit). Die Aktivität eines Substrats wird in U/g (Units per g) angegeben, was bei verschiedenen Enzymqualitäten eine Umrechnung ermöglicht und somit der Reproduzierbarkeit dient. Die hier verwendete Schweineleberesterase ist bei SIGMA erhältlich (Best.-Nr. E3019). Protokollieren Sie den Verbrauch in Abhängigkeit von der Zeit, graphische Darstellung! Was bewirkt dieser Reinigungsschritt? Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: E2: E3: R 1: Organischer Extrakt → Entsorgung (RH). Wässrige Phasen → Entsorgung (H2O mit RHal/Halogenid). Trockenmittel → Entsorgung (Anorg. Feststoffe). abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether). Auswertung des Versuchs H-NMR-Spektrum von 9 (300 MHz, DMSO-d6): δ = 2.20–2.47 (4 H), 2.90–3.00 (2 H), 3.57 (3 H), 5.55–5.67 (2 H), 12.28 (1 H). 1 3.0 13.0 12.0 11.0 10.0 2.8 9.0 2.6 8.0 2.4 2.2 7.0 6.0 5.0 4.0 3.0 2.0 [ppm] 0.0 13 C-NMR-Spektrum von 9 (300 MHz, DMSO-d6): 25.21 (CH2), 25.57 (CH2), 38.54 (CH), 38.66 (CH), 51.26 (CH3), 124.89 (CH), 125.20 (CH), 173.23 (C), 174.23 (C). LM 40 180 160 140 Versuch 4.2.2.9, Rev. 1.0 120 100 38 80 60 40 20 [ppm] 0 2 4. Reaktionen der Cabonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de IR-Spektrum von 9 (KBr): 100 T [%] 50 2960 3030 1735 0 4000 3000 1710 2000 1500 1000 -1 ~ ν [cm ] * Formulieren Sie den zu 9 führenden Reaktionsmechanismus. Weitere denkbare Reaktionsprodukte: O O O OH OH OH OH O O O O A B C * Mit welchen spektroskopischen Daten lassen sich A–C ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Literatur, auf der dieser Versuch beruht: [1]. Schweineleberesterase (Pig Liver Eserase, PLE) kann zur stereoselektiven Hydrolyse einer Vielzahl von Estern eingesetzt werden.[2–4] Esterasen sind Enzyme (biologische Katalysatoren), die aus pflanzlichen und tierischen Organismen bzw. Organen (z.B. Schweineleber) isoliert werden können. Sie katalysieren die Hydrolyse von Carbonsäureestern, mit chiralen Estern reagieren sie enantioselektiv: O C OR R H C Me H S C Me C O OR meso- [1] [2] [3] [4] O Me C S C H H C Me S O C O OR OR Schweineleberesterase H2O C O OH R H C Me H C Me S O C OR + Me C S OR C H H S C Me O C OR rac- H.-J. Gais, K.L. Lukas, W.A. Ball, S. Braun, H.J. Lindner, Liebigs Ann. Chem. 1986, 687–716. L.M. Zhu, M.C. Tedford, Tetrahedron, 1990, 46, 6587–6611. M. Ohno, M. Otsuka, Org. React. 1989, 37, 1–55. C.-H. Wong, G.M. Whitesides, “Enzymes in Synthetic Organic Chemistry” Pergamon Verlag, 1994. Versuch 4.2.2.9, Rev. 1.0 3







![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)
