4.3.2.8 - IOC
Werbung

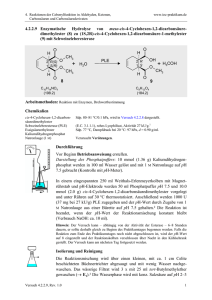
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de 4.3.2.8 Quartärsalzbildung von Triphenylphosphan mit 4-(Brommethyl)-benzoesäure zu (4-Carboxybenzyl)-triphenylphosphoniumbromid (8a), Umsetzung von 8a mit wässriger Formaldehydlösung zu 4-Vinylbenzoesäure (8b) Ph O HO H H P Ph Br O Br + Ph3P Aceton Ph HO H H 8a C8H7O2Br (215.0) C18H15P (262.3) C26H22BrO2P (477.4) H H 8a + NaOH O H H O + Ph3P=O H HO 8b CH2O (30.0) (40.0) C9H8O2 (148.2) Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Umkristallisation Edukt für 6.2.1.1 Chemikalien 4-(Brommethyl)-benzoesäure Triphenylphosphan Aceton tert-Butylmethylether Formaldehyd Natriumhydroxid Schmp. 223–226 °C, wird in Versuch 1.5.2 dargestellt. Schmp. 78–81 °C. Sdp. 56 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 233 hPa. Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa. 35proz. wässrige Lösung, d = 1.08 g/ml. Cancerogen, giftig, sensibilisierend. Verursacht Verätzungen. Mit viel Wasser abspülen. Verursacht schwere Verätzungen. Sofort mit viel Wasser abspülen. Darstellung von Phosphoniumsalz 8a Durchführung Vor Beginn Betriebsanweisung erstellen. In einem 250 ml Kolben mit Rückflusskühler, Trockenrohr und Magnetrührstab werden 20 mmol (4.30 g) 4-(Brommethyl)-benzoesäure und 20 mmol (5.25 g) Triphenylphosphan in 150 ml trockenem Aceton gelöst. Die Reaktionsmischung wird anschließend 1 h unter Rückfluss erhitzt. Isolierung und Reinigung Nach dem Abkühlen wird der Reaktionskolben 1 h im Eisbad gekühlt und der ausgefallene Feststoff über einen Büchnertrichter abgesaugt. Das Filtrat wird am Rotationsverdampfer auf ca. 50 ml eingeengt (→ R1) und noch 30 min im Eisbad gekühlt. Der weiter ausgefallene Feststoff wird auf demselben Büchnertrichter abgesaugt (→ E1), noch zweimal mit je 25 ml trockenem tert-Butylmethylether gewaschen, lufttrocken gesaugt (→ R2) und im Vakuumexsikkator bis zur Gewichtskonstanz getrocknet. Man bestimme Schmelzpunkt und Ausbeute des Rohprodukts. Ausbeute an 8a: 50–60%, Schmp. 294–298 °C). Versuch 4.3.2.8, Rev. 1.0 1 4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de Das Phosphoniumsalz 8a kann ohne weitere Reinigung weiter umgesetzt werden. 1 Weshalb muss unter Feuchtigkeitsausschluss gearbeitet werden? Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel E1: Lösungsmittelgemisch mit halogenhaltigen Verunreinigungen → Entsorgung (RHal). R1: Abdestilliertes Lösungsmittel → Recycling (Aceton). Wittig-Olefinierung von 8a mit wässriger Formaldehydlösung Durchführung In einem 100 ml Kolben mit Tropftrichter und Magnetrührstab werden 10 mmol (4.77 g) (4-Carboxybenzyl)-triphenylphosphoniumbromid in 15 ml Wasser suspendiert und mit 50 ml 35proz. wässriger Formaldehydlösung versetzt. Unter kräftigem Rühren wird innerhalb von 30 min eine Lösung von 80 mmol (3.20 g) Natriumhydroxid in 15 ml Wasser bei Raumtemperatur zugetropft.2 Nach beendeter Zugabe wird noch 1 h bei Raumtemperatur weiter gerührt. Isolierung und Reinigung Der ausgefallene Niederschlag wird über einen Büchnertrichter abfiltriert und der Filterrückstand noch dreimal mit je 25 ml Wasser gewaschen (Filterrückstand → E2). Die vereinigten Filtrate werden durch langsames Zutropfen von halbkonz. Salzsäure angesäuert (pH 1).3 Das ausgefallene Produkt wird abgesaugt, dreimal mit je 5 ml Eiswasser gewaschen (→ E3) und lufttrocken gesaugt. Das Produkt wird im Exsikkator über Phosphorpentoxid bis zur Gewichtskonstanz getrocknet. Man bestimme Schmelzpunkt und Ausbeute des Produkts. Ausbeute an 8b: 50–60%, Schmp. 142–145 °C. 2 3 Was ist zu beobachten? Erläutern Sie die Aufarbeitung! Was wird bei der ersten Filtration abgetrennt? Hinweise zur Entsorgung (E) E2: Filterrückstand → Entsorgung (Org. Feststoffe). E3: Wässrige Lösung mit organischen und halogenhaltigen Verbindungen → Entsorgung (H2O mit RHal/Halogenid). Versuch 4.3.2.8, Rev. 1.0 2 4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de Auswertung des Versuchs H-NMR-Spektrum von 8b (300 MHz, DMSO-d6): δ = 5.40 ( 1 H), 5.97 (1 H), 6.80 (1 H), 7.58 (2 H), 8.78 (2 H), 12.95 (1 H). a) a) b) b) c) c) 1615.6 Hz 1614.8 Hz 1626.6 Hz 1625.8 Hz 1783.4 Hz 1782.6 Hz 1801.1 Hz 1800.3 Hz 2027.2 Hz 2044.9 Hz 2038.2 Hz 2055.9 Hz 1 d) d) LM 14.0 12.0 10.0 8.0 6.0 4.0 2.0 [ppm] 0.0 C-NMR Spektrum von 8b (75.5 MHz, DMSO-d6): δ = 116.84 (CH2), 126.10 (CH), 129.57 (CH), 129.85 (C), 135.74 (CH), 141.17 (C), 166.95 (C). 13 LM 160 140 120 100 80 60 40 20 [ppm] 0 IR-Spektrum von 8b (KBr): 100 T [%] 50 1605 0 4000 1680 3000 2000 1500 1000 ~ [cm-1] ν * Formulieren Sie den zu 8b führenden Reaktionsmechanismus. Versuch 4.3.2.8, Rev. 1.0 3 4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, Carbonsäuren und Carbonsäurederivaten www.ioc-praktikum.de Weitere denkbare Reaktionsprodukte: O P Ph Ph H H O HO A O CH3 Ph3P O HO B C * Mit welchen spektroskopischen Daten lassen sich A–C ausschließen? * Diskutieren Sie die denkbaren Reaktionsmechanismen. Literatur, allgemeine Anwendbarkeit der Methode Der Wittig-Reaktion kommt in der präparativen organischen Chemie eine große Bedeutung zu. Eine Übersicht über die vielfältigen Einsatzmöglichkeiten bietet (siehe auch Übersicht zu Kap. 4.3.2): H. J. Bestmann, O. Vostrowsky, Top. Curr. Chem. 1983, 109, 85–163. B.E. Maryanoff, A. B. Reitz, Chem. Rev. 1989, 89, 863–927. Versuch 4.3.2.8, Rev. 1.0 4