PowerPoint-Präsentation - Lehrstuhl für Organische Chemie I
Werbung

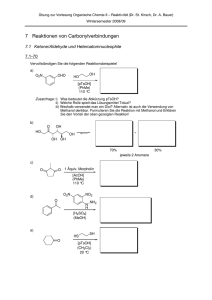
Technische Universität München Aufgaben 7.1-70 und 7.2-72 O2N CHO HO OH [pTsOH] (PhMe) 110 °C Zusatzfrage: i) Was bedeutet die Abkürzung pTsOH? ii) Welche Rolle spielt das Lösungsmittel Toluol? iii) Weshalb verwendet man ein Diol? Alternativ ist auch die Verwendung von Methanol denkbar. Formulieren Sie die Reaktion mit Methanol und Erklären Sie den Vorteil der oben gezeigten Reaktion! Formulieren Sie einen detaillierten Mechanismus für die Umsetzung von L,L-(+)-Weinsäure zu L,L-(+)-Diethyltartrat mit Ethanol und einer Protonenquelle (H+) in Chloroform. Welche Rolle spielt das Lösungsmittel Chloroform? Welchen Unterschied müssen Sie im Vergleich zu Toluol (siehe 7.1-70) beachten? Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 1 Technische Universität München Azeotropdestillation – Grundlagen Die Azeotropedestillation wird in der organischen Chemie oft eingesetzt um eine Komponente, in der Regel ein (Neben-)-Produkt zusammen mit dem Lösungsmittel abzutrennen. Vorraussetzung dafür ist, dass die Verbindung mit dem Lösungsmittel ein Azeotrop bildet. [Definition Azeotrop:] Azeotrope sind flüssige Gemische aus zwei oder mehr Komponenten, dessen Dampf die gleiche Zusammensetzung wie die flüssige Phase aufweist. Eine Stofftrennung durch gewöhnliche Destillation ist somit nicht möglich. [Beispiele für Azeotrope:] - Ethanol / Wasser: 96% / 4% - Toluol / Wasser: 81.4% / 18.6% - Chloroform / Wasser / Ethanol (ternäres Azeotrop): 92.5 % / 3.5 % / 4% [Anwendungen:] - Wasserabscheider (Azeotrop-veresterung, -acetalisierung, Darstellung von Iminen und Enaminen) - Wasserdampfdestillation (Isolierung von „wasserdampfdestillierbaren Verbindungen“ aus komplexen Mischungen, z.B. Naturstoffisolierung, Gewinnung von ätherischen Ölen) Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 2 Technische Universität München Azeotropdestillation – Wasserabscheider Azeotrop (Dampf) Lösungsmittel Azeotrop (Dampf) Lösungsmittel Wasser Wasser Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 3 Technische Universität München Aufgabe 7.5-75 Carbodiimid cHex O N O cHex N C N OH O (CH2Cl2) BocHN BocHN N H cHex vgl. Anhydrid - aktivierte Säure O O N O NH2 BocHN O O NH2 cHex N H O cHex BocHN O O BocHN O NH N cHex N H cHex O tetraedrisches Intermediat O N H H O O O N H N H Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 4 Technische Universität München Aufgabe 7.5-75 R H N O H O BOC-geschütztes Amin (tert-Butoxycarbonyl) R H N O R H N OH O OH Carbaminsäure (instabil Decarboxylierung) - CO2 R NH2 -H freies Amin Festphasensynthese Vorteile: - Produkt kann sehr leicht von allen Nebenprodukten abgetrennt werden - Automatisierbar O O R2 OH NHBoc DCC (Überschuss) CF3COOH (CH (CH 2Cl 2Cl 2)2) Dann "Waschen" Dann "Waschen" R2 O R3 OH OH NHBoc NHBoc 2 2 OO O RR DCCDCC HH (Überschuss) CF3COOH NN NH2 (Überschuss) OO O NH NHBoc 2 Cl2)2Cl2) (CH2(CH Cl2)2(CH RR11R1OO "Waschen" Dann "Waschen" DannDann "Waschen" 2 O R2 R2 RO H H H NHBoc N N N N NH2 O O O NHBoc H 1 R3 O R1 R1ORO O O und, und, und… Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 5 Technische Universität München Säurechlorid reaktiver als Aldehyd TRICK: tertraedrisches Intermediat stabil Aufgabe 7.5-77 Weinreb-Amid TEMPO-Oxidation NaOCl O O O LiAlH4 (Et2O) H2 [Pd/C, BaSO4] O Cl O (CH2Cl2) R H DMSO R OH (COCl)2 NEt3 (CH2Cl2) O LiAlH4 R (THF) OH 1 Äquiv. DIBAL-H O Lindlar-Katalysator 2 Äquiv. DIBAL-H O R N R N H NEt3 (CH2Cl2) R NaHCO3 [TEMPO] (CH2Cl2/H2O) MeOH [H2SO4] O (PhMe), -78 °C O R MeOH NEt3 (THF) LiHAl(OtBu)3 O OH R O O O -78 °C R Cl Swern-Oxidation tetraedrisches Intermediat unter den Bedingungen nicht stabil Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 6 Technische Universität München Aufgabe 7.8-91 O O O O O O -H O +H O O O O Michael-Addition O O O -H O O O O O O OH Aldol-Reaktion O O NH - H2O O O +H O O ODER O O + H2O N N O O NH O OH z.B. Prolin katalysiert O O O +H O OH - H2O N H O OH Enantioselektive Katalyse (Organokatalyse) E1-Eliminierung Die gesamte Sequenz wird als Robinson-Annelierung bezeichnet Dr. Andreas Bauer – Lehrstuhl für Organische Chemie I – Übung zur Vorlesung Organische Chemie II (Reaktivität) 7