folien1
Werbung

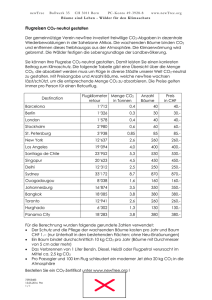
Physikalische Chemie I Vorlesung: Criegee-HS Teil A: Thermodynamik Teil B: Kinetik Übungen: HS I & II Übungsleiter Teil A: Mi. & Fr. 9.45 - 11.15 Uhr PD Dr. Patrick Weis Prof. Dr. Marcus Elstner Di. 17.30 - 19:00 Uhr Dipl. Chem. Rebecca Kelting Dr. Katerina Mattheis Tutorien: Seminarraum 411, Geb. 30.44 (PC-Turm, 4.OG) Di. 11:30 -12:30 Uhr Mi. 8:30 - 9:30 Uhr Mi. 11:30 -12:30 Uhr Do. 9:45 -10:45 Uhr Do. 14:00 -15:00 Uhr Fr. 8:30 - 9:30 Uhr Martin Grüßer Michael Lorenz Rainhard Machatschek Christian Schöttle Constantin Kohl Lorenz Schmidt In der Vorlesung gezeigte Folien, Übungsblätter Studierendenportal https://studium.kit.edu [email protected] In der Vorlesung gezeigte Folien, Übungsblätter Studierendenportal https://studium.kit.edu In der Vorlesung gezeigte Folien, Übungsblätter Studierendenportal https://studium.kit.edu Passwort: Molekel Klausur: Fr. 18.02.11, 14:30 - 16:30 Uhr HS Neue Chemie (Geb. 30.41) Nachklausur: Fr. 8.04.11, 9:30 - 11:30 Uhr HS Neue Chemie (Geb. 30.41) 10 Aufgaben (im Stil der Übungsaufgaben) 100 Punkte (gesamt), 55 Punkte (zum Bestehen) Hilfsmittel: Taschenrechner (nicht programmierbar, nicht grafikfähig), Formelsammlung (2 Blätter, DIN A4, keine Lehrbücher) Unterscheide: (1) für Physiker 8 Leistungspunkte (Klausur) [+ 6 (Praktikum)] Klausur benotet (Modulnote setzt sich aus Klausur + Praktikum zusammen) (2) Für Chemiker Klausur nicht benotet (nach dem Praktikum mündl. Modulabschlußprüfung) Bestehen der Klausur relevant für Zugang zum PC-Praktikum bis zu 20 Bonuspunkte (4 Kurztests während der Übungen, je 5 Punkten). Bonuspunkte werden nur für die Klausur, am 18.02.11., nicht für die Nachklausur angerechnet Lehrbücher: (für PC1 und PC2) P. W. Atkins, Julio de Paula, "Physikalische Chemie", Wiley-VCH, Weinheim 4., vollständig überarbeitete Auflage - September 2006 82,90 Euro ISBN-10: 3-527-31546-2 ISBN-13: 978-3-527-31546-8 P.W. Atkins,Charles A. Trapp, Marshall P. Cady, Carmen Giunta, "Arbeitsbuch Physikalische Chemie" Wiley-VCH, Weinheim Lösungen zu den Aufgaben 49,90 Euro April 2007 ISBN-10: 3-527-31828-3 ISBN-13: 978-3-527-31828-5 G. Wedler, "Lehrbuch der Physikalischen Chemie", (5. Auflage, 2004) Wiley-VCH, Weinheim 5., vollst. überarb. u. aktualis. Auflage - August 2004 89,90 Euro 2004. XXX, 1072 Seiten, Hardcover ISBN-10: 3-527-31066-5 ISBN-13: 978-3-527-31066-1 - Wiley-VCH, Weinheim Donald A. McQuarrie, John D. Simon, "Physical Chemistry – A Molecular Approach", University Science Books 1999 ISBN 0-935702-99-7 1. EINFÜHRUNG: PHYSIKALISCHE CHEMIE „makroskopische Welt“, mehr als 1020 Moleküle wägbare Mengen – mg, g, kg, t Thermodynamik Kinetik Festkörpertheorie Festkörperspektroskopie Systemgröße „top down“ „Nanowelt“, (abzählbar) viele Moleküle „bottom up“ statistische Thermodynamik Kinetik Quantenmechanik (Theorie der chem. Bindung in Molekülen) „mikroskopische Welt“, einzelnes Molekül Molekülspektroskopie 1. EINFÜHRUNG: PHYSIKALISCHE CHEMIE Kurzer Exkurs: Mikroskopische vs. Makroskopische Welt Röntgenbeugung Fotoplatte Röntgenbeugung Wellenlänge (λ) vergleichbar mit Atomabständen je nach Winkel θ konstruktive (hell) oder destruktive (dunkel) Interferenzen Abbilden von Oberflächen mit atomarer Auflösung Direkte Abbildung, „Sehen“ , mit sichtbarem Licht unmöglich Ausweg: Ertasten mit sehr feiner Spitze Rastersondenmikroskopie Rasterkraftmikroskopie (AFM) atomic force microscopy Rastertunnelmikroskopie (STM) scanning tunneling microscopy Die Idee: 1) man bewegt die Spitze knapp über eine Oberfläche 2) man misst die Kraft (Strom) zwischen Spitze und Oberfläche 3) man erhält so Punkt für Punkt den Abstand zwischen Spitze und Oberfläche (Höhenlinien) 4) Bildgebung – analog Höhenlinien auf topographischen Karten Spitze Oberfläche Wie sieht so ein Gerät aus? Rastertunnelmikroskop Scanning Tunnelling Microscope (STM) Rasterkraftmikroskop Atomic Force Microscope (AFM) Erfinder: Binnig und Rohrer, IBM Quelle: Digital Instruments Rasterkraft-Bild einer Glimmeroberfläche. Man erkennt die einzelnen Oberflächenatome. 5 nm = 0.000005 mm Quelle: Digital Instruments Rastertunnel-Bild von SauerstoffAtomen, die auf einer Rhodiumoberfläche adsorbiert (chemisorbiert) sind. 1 Monolage 4 nm = 0.000004 mm Rastertunnelbild von Iod-Atomen, die auf einer Platinoberfläche adsorbiert sind. 2.5 nm = 0.0000025 mm ... ein Iod-Atom fehlt Quelle: Don Eigler, IBM Man kann Atome nicht nur "ertasten", sondern auch bewegen: Ein Ring aus 48 Eisenatomen entsteht. Quelle: Don Eigler, IBM … oder ein Männchen aus einzelnen CO-Molekülen ! Thermodynamik 2.1. Grundbegriffe der Thermodynamik Systeme: offenes Becherglas mit Wasser Wasserkreislauf einer Wohnungsheizung Heizkessel Wasser in Thermoskanne (mit Deckel) Heizkörper Offen: Geschlossen: Isoliert (abgeschlossen) Stoffaustausch mit Umgebung kein Stoffaustausch mit Umgebung kein Stoffaustausch Wärmeaustausch mit Umgebung Wärmeaustausch mit Umgebung kein Wärmeaustausch ein „leeres“ Glas (mit Luft gefüllt) Phase 1 (N2,O2,Ar,CO2) ein Glas Wasser Phase 1 (N2,O2,H2O,Ar,CO2) Phasengrenzfläche Phase 2 (H2O) ein Glas Wasser mit einem Eiswürfel Phase 1 (N2,O2,H2O,Ar,CO2) Phase 3 (H2O) Phasengrenzflächen Phase 2 (H2O) Whiskey on the rocks Phase 1 (N2,O2,H2O,Ar,CO2) Phase 3 (H2O) Phasengrenzflächen Phase 2 (H2O, C2H5OH) ein Glas Wasser mit Öl Phase 1 (N2,O2,H2O,Ar,CO2) Phase 2 (Öl) Phase 3 (H2O) Phasengrenzflächen ein Glas Milch Phase 1 (N2,O2,H2O,Ar,CO2) Phase 2 (Öl) Phase 3 (H2O) Extensive / Intensive Variablen System 1 Beispiel: 2 Behälter mit Gas System 3 System 2 p, V, p, 2 x V, p, V, T,m T, 2xm T,m Thermodynamik 2.1. Grundbegriffe der Thermodynamik 2.2. Temperatur und Nullter Hauptsatz Gasthermometer P p Kolben mit Gas 1 bar T Wasserbad 0 bar -273.15 0 100 1. Fixpunkt 2. Fixpunkt Gefrierpunkt von Wasser Siedepunkt von Wasser T(°C) Kelvin-Skala P p Kolben mit Gas T Wasserbad 0 273.15 373.15 T(K) Thermodynamik 2.1. Grundbegriffe der Thermodynamik 2.2. Temperatur und Nullter Hauptsatz 2.3. Eigenschaften des idealen Gases Gesetz von Boyle-Mariotte p ~ 1/V F mg Masse m F p A Kolben, 2m Fläche A V A h 3m ideales Gas h h/2 Temperatur konstant ! h/3 Gesetz von Gay-Lussac (1) p~T Masse 2m 3m m Kolben, Fläche A ideales Gas h h h 2 * T1 3 * T1 Volumen konstant Temperatur variabel T1 Gesetz von Gay-Lussac (2) V~T T1 3 * T1 2 * T1 m m m 3h 2h Druck konstant Temperatur variabel h Isothermen Isobaren Vm(p,T) V2 T T2 T1 V1 p2 p1 p p2,V2,T2 Vm(p,T) p1,V1,T1 V2 T T2 T1 V1 p2 p1 p p2,V2,T2 p2,V*,T1 Vm(p,T) ΔV Δp T p1,V1,T1 V2 T T2 T1 V1 p2 Δp p1 p Molvolumen (liter) Quelle: http://webbook.nist.gov/chemistry/ 30 Molvolumen von Stickstoff als Funktion des Drucks 25 Temperatur: 300K (27°C) 20 15 10 5 0 0 20 40 60 Druck (bar) 80 100 Molvolumen (liter) 30 Molvolumen von Stickstoff als Funktion des Drucks 25 Temperatur: 300K (27°C) 20 15 10 5 ideales Gas 0 0 20 40 60 Druck (bar) 80 100 Molvolumen von Stickstoff als Funktion des Drucks 0.3 Molvolumen (Liter) Temperatur: 300K (27°C) 0.2 0.1 ideales Gas 0 0 200 400 600 Druck (bar) 800 1000 Quelle: http://webbook.nist.gov/chemistry/ 3 Molvolumen von Kohlendioxid als Funktion des Drucks Molvolumen (liter) 2.5 Temperatur: 300K (27°C) 2 1.5 1 ideales Gas Meßwerte 0.5 0 0 20 40 60 Druck (bar) 80 100 Wechselwirkungspotential einiger Moleküle CO2 Energie (kJ/mol) 5 2.5 0 -2.5 -5 0 0.2 0.4 0.6 Molekülabstand (nm) 0.8 1 Wechselwirkungspotential einiger Moleküle N2 Energie (kJ/mol) 5 CO2 2.5 0 -2.5 -5 0 0.2 0.4 0.6 Molekülabstand (nm) 0.8 1 Wechselwirkungspotential einiger Moleküle He Energie (kJ/mol) 5 N2 CO2 2.5 0 -2.5 -5 0 0.2 0.4 0.6 Molekülabstand (nm) 0.8 1 Realgasfaktor von Stickstoff als Funktion des Drucks 1.1 Temperatur: 300K (27°C) 1.08 Realgasfaktor z 1.06 1.04 1.02 1 0.98 0 50 100 150 Druck (bar) 200 250 300 1.1 Realgasfaktor z 1 0.9 Realgasfaktor von Kohlendioxid als Funktion des Drucks 0.8 Temperatur: 300K (27°C) 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0 200 400 600 Druck (bar) 800 1000 Quelle:NIST 1.3 1.2 1000K 1.1 Realgasfaktor z 1 500K 0.9 Realgasfaktor von Kohlendioxid als Funktion des Drucks und der Temperatur 0.8 400K 0.7 0.6 0.5 0.4 300K 0.3 0.2 0.1 0 200 400 600 Druck (bar) 800 1000 Quelle:NIST 1.3 1.2 1000K 1.1 715K Realgasfaktor z 1 500K 0.9 Realgasfaktor von Kohlendioxid als Funktion des Drucks und der Temperatur 0.8 400K 0.7 0.6 Boyle-Temperatur: 0.5 dz lim 0 p 0 dp 0.4 300K 0.3 0.2 0.1 0 200 400 600 Druck (bar) 800 1000 Quelle:NIST 500 K – Isotherme von CO2 200 175 Druck (bar) 150 125 100 75 ● exp. Werte 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 500 K – Isotherme von CO2 200 175 Druck (bar) 150 125 100 van der Waals Gleichung 75 ● exp. Werte 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 500 K – Isotherme von CO2 200 ideales 175 Gasgesetz Druck (bar) 150 125 100 van der Waals Gleichung 75 ● exp. Werte 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 400 K – Isotherme von CO2 200 ideales 175 Gasgesetz Druck (bar) 150 125 100 75 van der Waals Gleichung ● exp. Werte 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 320 K – Isotherme von CO2 200 175 Druck (bar) 150 125 100 75 ● exp. Werte 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 320 K – Isotherme von CO2 200 175 Druck (bar) 150 125 100 75 ● exp. Werte van der Waals Gleichung 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 320 K – Isotherme von CO2 200 ideales 175 Gasgesetz Druck (bar) 150 125 100 75 ● exp. Werte van der Waals Gleichung 50 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 310 K – Isotherme von CO2 200 175 Druck (bar) 150 125 Wendepunkte 100 75 50 ● exp. Werte 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 310 K – Isotherme von CO2 200 175 Druck (bar) 150 125 100 75 50 ● exp. Werte van der Waals Gleichung 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 310 K – Isotherme von CO2 200 ideales 175 Gasgesetz Druck (bar) 150 125 100 75 50 ● exp. Werte van der Waals Gleichung 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 304.2 K – Isotherme von CO2 kritischer Punkt 200 175 Druck (bar) 150 125 Sattelpunkt p 0 V m T und 2p 0 V 2 m T 100 75 50 ● exp. Werte 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 304.2 K – Isotherme von CO2 kritischer Punkt 200 175 Druck (bar) 150 125 van der Waals Gleichung 100 75 50 ● exp. Werte 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 304.2 K – Isotherme von CO2 kritischer Punkt 200 ideales 175 Gasgesetz Druck (bar) 150 125 van der Waals Gleichung 100 75 50 ● exp. Werte 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 273 K – Isotherme von CO2 Flüssigkeit 200 175 Druck (bar) 150 125 100 75 50 ● exp. Werte 25 2 Phasen: g+l Gas 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 273 K – Isotherme von CO2 van der Waals Gleichung 200 ideales Druck (bar) 175 "van der Waals- Schleifen" Gasgesetz 150 vdW-Gleichung in diesem Bereich qualitativ falsch: 125 Druck sinkt, wenn Volumen verkleinert wird! 100 das ist unphysikalisch 75 50 ● exp. Werte 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 273 K – Isotherme von CO2 van der Waals Gleichung 200 ideales 175 "van der Waals- Schleifen" Gasgesetz Korrektur durch sog. Maxwell-Konstruktion: Druck (bar) 150 Horizontale Linie, gleiche Flächen 125 100 75 50 ● exp. Werte 25 0 0 0.2 0.4 0.6 Molvolumen (l/mol) 0.8 1 250 K – Isotherme von CO2 Flüssigkeit 200 175 Druck (bar) 150 125 100 75 50 2 Phasen: g+l Gas 25 ● exp. Werte 0 0 0.5 1 Molvolumen (l/mol) 1.5 2 250 K – Isotherme von CO2 van der Waals Gleichung 200 ideales 175 Gasgesetz Druck (bar) 150 125 100 75 50 ● exp. Werte 25 0 0 0.5 negativer Druck ! 1 Molvolumen (l/mol) 1.5 2 Zusammenfassung: verschiedene Isothermen von CO2 Flüssigkeit Oberhalb des kritischen Punktes verschwindet der Unterschied zwischen Flüssigkeit und Gas! "Überkritischer Bereich" Gas 2 Phasen, flüssig + gas Quelle: Engel/Reid