1-Novotny
Werbung

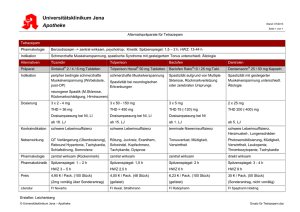
Warum 153Sm-EDTMP? Clemens Novotny Zentralröntgeninstitut, Kaiserin-Elisabeth-Spital, Wien Radionuklidtherapie Patienten mit disseminierten ossären Metastasen Keine lokale externe Bestrahlung möglich therapierefraktäre Schmerzen Nachgewiesene osteoblastische Aktivität Skelettszintigraphie (nicht älter als 4 Wochen ) Prostata-Ca, Mamma-Ca, Bronchus-Ca prinzipiell jede szintigraphisch positive Metastasierung Radionuklidtherapie β-Strahlung-emittierende osteotrope Radiopharmaka Radionuklide in elementarer Form Phosphor (32P), Stromtium (89Sr), Yttrium (90Y) knochenaffinen Trägersubstanz gebundene Radionuklide Samarium (153Sm), Rhenium (186Re), Lutetium (177Lu),... Radionuklidtherapie Ansprechrate 50-90% Schmerzfreiheit 25-75% Vorübergehende Schmerzzunahme <5%-30% (Flare Phänomen - besseres Ansprechen?) Dosislimitation: Knochenmarkdepression (insb. Thrombozyten) Einzeldosis vs. wiederholte Dosis (Protokoll) schlechteres Ansprechen bei fortgeschrittenen Fällen ? 32Phosphor 1930, Chiewitz und Hevesy osteotropes Verhalten von 32P 1950, Friedell und Storaasli erste Anwendung von 32P am Menschen als Natriumphosphat direkter Knochenmarkuptake - ernsthafte Knochemarkdepression KM-Dosis 240 cGy bei 370 MBq Ansprechrate von etwa 75-80% mittlere Wirkungsdauer ca. 5 Monate heute aufgrund der Strahlenbelastung obsolet 89Strontium-Chlorid Pecher 1942: erste 89Sr Therapie bei Skelettmetastasen eines Prostatakarzinoms 89Sr– Kalziumanalogon – Einbau in Knochenumbauzone physikalische HWZ 50,5d biologische HWZ in Knochenmetastasen > 50 d in Knochengewebe ca. 14 d nach 3 Mo 12-90% der appl. Aktivität in Metastasen (ohne Zerfallskorrektur) ca. 60% der applizierten Aktivität in der ersten Woche ausgeschieden bei Knochenmetastasierung deutlich weniger 89Sr applizierte Aktivität 35-150 MBq Ansprechrate ca. 50-85% KM-Dosis 0,3-33 cGy/MBq geringe Dosisraten später Eintritt der Therapiewirkung (1-2 Monate) längeres Anhalten der Therapiewirkung (3-6 Monate) - NW KM-Depression nach 5-6 Wochen (WHO Grad I) prinzipiell wiederholbar frühestens nach 12 Wochen (Toxozität kummulativ) Keine Bildgebung 90Yttrium-Citrat 90Y– Kalziumanalogon kürzere HWZ (2,7 d), höhere ß-Energie, längere Reichweite als 89Sr 40-150 MBq höhere Tumordosisraten als bei 89Sr mittlere Wirkungsdauer kürzer als bei 89Sr Bremsstrahlungsbilder - lediglich eine grobe Darstellung Nuklid Halbwertszeit (d) ß-Energien (MeV) (100%) Mittlere ß-Energie (MeV) max. Reichweite in Gewebe (mm) mittlere Reichweite (mm) 32P 14,3 1,71 0,69 7,5 2,5 89Sr 50,5 1,49 0,58 6,0 2,0 90Y 2,7 2,28 0,94 11,0 3,6 Lanthanoide Nuklid HWZ Haupt-β-Energie (MeV) mittlere ßEnergie (MeV) Max. Reichweite (Weichteil) Mittlere Reichweite 153Sm 1,95 d 0,81 (21%) 0,71 (43%) 0,64 (35%) 0,23 2,6 mm 0,5 mm 186Re 3,8 d 1,07 (74%) 0,93 (21%) 0,35 3,6 mm 1,0 mm 177Lu 6,7 d 0,48 (78%) 1,7 mm 0,3 mm 188Re 0,7 d 2,12 (71%) 1,96 (25%) 8,5 mm 2,7 mm 0,75 in elementarer Form keine osteotrope Eigenschaften Bindung an Trägersubstanzen - Chelat + Tetra-/Diphosphonat Anlagerung an der Knochenmatrix an der Hydroxiylapatitoberfäche Lanthanoide γ-Komponente für Bildgebung / Dosimetrie Nuklid Energie (keV, %) γ-Emission für Bildgebung 153Sm-EDTMP 103 (29%) Ja 186Re-HEDP 137 (10%) Ja 177Lu-EDTMP 113 (6.4%) 208 (11%) Ja 188Re-HEDP 155 (15%) Ja [99mTc-MDP 140 (88%) Ja] 90Y - Nein 32P - Nein 89Sr - Nein 186Re-HEDP Hydroxyethylidendiphosphonat (186Re-HEDP; auch 186Re-Etidronat) 1,3 GBq „Standarddosis“ Anreicherung in den Metastasen : Knochenmark 15-20:1 bei 186Re-HEDP gegenüber ca. 10:1 bei 89Sr KM-Dosis ca. 1 mGy/MBq ca. 27% im Knochen gespeichert 70% mit dem Harn ausgeschieden (davon 70% nach 24 h) Harnelimination: > 40% der applizierten Aktivität nach 6 h Ansprechrate 70-80% 188Re-HEDP Generatorprodukt 188W/188Re Generator Verfügbarkeit über einen längeren Zeitraum relativ lange HWZ des Mutternuklids 188W (ca. 70 d) günstigen physikalischen Eigenschaften Kurze HWZ (0,7 d) fast doppelt so hohe maximale Energie wie 186Re (2,12 MeV) über den schmerzpalliativen Effekt hinausgehenden Erfolg ? 177Lu-EDTMP Kurze Reichweite (max 1,7 mm Weichteile, Mittel 0,3 mm) Niedrige Energie 0,48 MeV (78%) HWZ länger 6,7 d - Transport, Logistik 153Sm-EDTMP Ethylen-diamin-tetra-methylen-Phosphat (EDTMP) [135Sm(III)(CH2N(CH2PO3)2)2] -5-5Na+ 153Sm-EDTMP Biodistribution günstige Biokinetik: 90% Blutclearace innerhalb von 30 min >50% des applizierten Aktivität nach 24 h im Knochen (186Re ca. 27%) Skelettuptake 65,5% +/- 15,5% Weichteilretention 12,7% +/-4,7% Urinexkretion 39,5%+/-13,8% [Brenner et al., 2000] Urinexkretion nach 6h nahezu abgeschlossen Rest innerhalb von 24 h mit dem Harn ausgeschieden Keine Metabolisierung 153Sm Nuklid Knochen / Durchschn. β-Max KM RW (mm) (MeV) Dosisratio 89Sr Cl2 1,6 186Re-HEDP 2,3 153Sm-EDTMP 5,5 2,4 1,05 0,55 1,46 1,08 0,81 Krishnamuti et al, JNM 1997 hohe Dosisraten bei 153Sm-EDTMP β-Durschn. (MeV) HWZ (d) 0,58 0,33 0,22 55,5 3,7 1,9 153Sm-EDTMP posttherapeutische Szintigraphie (γ-Anteil 28%, 103 keV) Uptake Ratio nach 2h: Läsion : Knochen 5:1 Läsion : Weichteile 6 : 1 Knochen : Weichteile 2,5:1 Biodistribution vergleichbar zu 99mTc-MDP Dokumentation der Speicherherde Dosimetrie 153Sm-EDTMP 1,3-2,6 GBq (18,5-37 MBq/kg bis zu 111 MBq/kg) Hohe (variable) Ansprechraten Bei Standarddosis 2,6 GBq/70 kg KM-Dosis 0,27-3,38 Gy (1,2-2 mGy/MBq) Herddosis im Metastasen bis 86.5 Gy Schmerzlinderung nach wenigen Tagen signifikante Besserung nach 1-3 Wochen zu erwarten Wirkdauer 8-16 Wochen (Einzelfälle länger) Bei Bedarf Therapie wiederholbar Voraussetzung Blutbilderholung (ca. 8 Wochen) Warum 153Sm-EDTMP ? max. Reichweite im Knochen 3mm 0,55 mm rasche Elimination – hoher Uptake in Knochen (>50%) = günstiges Knochen/KM Dosisverhätnis HWZ < 2d - hohe Dosisraten rascher Wirkungseintritt nach wenigen Tagen kurzzeitige Myelosuppression 103 keV γ Komponente (Biodistribution, Dosimetrie)