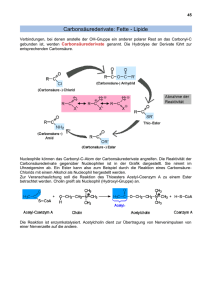
ppt - ChidS
Werbung

Ester Experimentalvortrag von Alexander Achenbach WS 07/08 am 16.01.2008 1 Gliederung 1. Einleitung 2. Carbonsäureester 2.1 2.2 2.3 2.4 2.5 2.6 2.7 3. 4. Vorkommen Struktur und Nomenklatur Physikalische Eigenschaften Darstellung Verseifung CH-acide Ester Verwendung Ester anorganischer Säuren Schulrelevanz 2 1. Einleitung 1. Einleitung Stoffgruppe organischer Verbindungen Entstehung durch Reaktion von Sauerstoffsäuren mit Alkoholen Es gibt Ester organischer und anorganischer Säuren Ester sind Derivate dieser Säuren 3 1. Einleitung 1. Einleitung Organische Ester sind Carbonsäure-Derivate Ersatz der Hydroxylgruppe (-OH) durch eine Alkoxygruppe (-OR) Ester anorganischer Säuren leiten sich analog her 4 2. Carbonsäureester 2.1 Vorkommen Vorkommen in der Natur: Fette und Öle: Ester höherer aliphatischer, gesättigter oder ungesättigter Monocarbonsäuren Glycerin ist dreiwertige Alkoholkomponente Glycerin = 1,2,3-Propantriol 5 2. Carbonsäureester 2.1 Vorkommen Wachse: Ester höherer einwertiger Alkohole und höherer einwertiger Carbonsäuren Palmitinsäuremyrizylester C15H31-CO-OC30H61 zu 72 % in Bienenwachs 6 2. Carbonsäureester 2.1 Vorkommen Riechstoffe: Ester in vielen ätherischen Ölen enthalten Verantwortlich für zahlreiche Düfte von Früchten und Blüten Meist Ester niederer Alkohole und Carbonsäuren flüchtig Pyrola uniflora (Einblütiges Wintergrün) enthält Salicylsäuremethylester 7 8 2. Carbonsäureester 2.2 Struktur und Nomenklatur Struktur: Moleküle enthalten Carbonsäure-Teil und Alkohol-Teil Carbonsäureester besitzen die funktionelle Gruppe -COOR (Als Substituent: Alkoxycarbonyl) 9 2. Carbonsäureester 2.2 Struktur und Nomenklatur Namen der Carbonsäureester hängen von den beteiligten Kohlenstoffgerüsten der eingesetzten Säuren und Alkohole ab: Mehrere Möglichkeiten: Systematisch (IUPAC) Alternativ (gebräuchlich) Trivialnamen 10 2. Carbonsäureester 2.2 Struktur und Nomenklatur Systematische Nomenklatur nach IUPAC: Beispiel: Ester sind nach IUPAC also Alkanoate 11 2. Carbonsäureester 2.2 Struktur und Nomenklatur Alternative Nomenklatur (gebräuchlich): Beispiel: 12 2. Carbonsäureester 2.2 Struktur und Nomenklatur Ein cyclischer Ester wird Lacton genannt: Entstehung durch intermolekulare Veresterung Systematisch: Oxa-2-cyclo alkanon: 13 2. Carbonsäureester 2.3 Physikalische Eigenschaften Niedermolekulare Ester: Höher molekulare Ester: Flüssig und farblos Brennbar Niedrig siedend Fest / wachsartig Siedepunkte: 14 2. Carbonsäureester 2.3 Physikalische Eigenschaften Polarität: Die funktionelle Gruppe der Ester enthält eine Carbonylgruppe: Carbonylsauerstoff ist größtenteils für Polarität verantwortlich Polarität = schwach 15 16 2. Carbonsäureester D2 Löslichkeit von Styropor Styropor (Polystyrol) löst sich gut in Essigsäureetylester: Prinzip: Gleiche Polarität „Similia similibus solvuntur“ (Gleiches löst sich in Gleichem) 17 18 2. Carbonsäureester V1 Wasserlöslichkeit von Essigsäureethylester Geringe Wasserlöslichkeit von Essigsäureethylester Wechselwirkung des Carbonylsauerstoffs mit dem Wasserstoff im Wasser Mit wachsendem Alkylrest sinkt Wasserlöslichkeit 19 2. Carbonsäureester V1 Wasserlöslichkeit von Essigsäureethylester Aussalzen: Ionen des Salzes werden solvatisiert Solvatation benötigt Wassermoleküle Diese stehen dann zur Solvatation anderer Moleküle nicht mehr zur Verfügung 20 2. Carbonsäureester 2.4 Darstellung Carbonsäuren und Alkohole reagieren langsam miteinander Mineralsäure als Katalysator Erhitzen Hermann Emil Fischer 21 2. Carbonsäureester 2.4 Darstellung Frage: Woher stammt der Sauerstoff ? Isotopenmarkierung: O O + 18 H O 18 OH Benzoesäure + CH3 Methanol O H2O CH3 Methylbenzoat 22 23 2. Carbonsäureester V2 Darstellung von Essigsäureethylester 24 2. Carbonsäureester 2.5 Verseifung Unter „Verseifung“ versteht man zunächst die basische Hydrolyse eines Esters Der Begriff „Verseifung“ kommt aus der Nutzung dieses Reaktionstyps zur Herstellung von Seife aus Fett Andere Variante: Erhitzen von Estern mit Überschuss von Wasser in Gegenwart von Mineralsäuren 25 26 2. Carbonsäureester V3 Alkalische Verseifung Esterhydrolyse durch Umsetzung mit starker Base: Über tetraedrische Zwischenstufe Letzter Schritt ist irreversibel 27 28 2. Carbonsäureester V4 Quantitative Hydrolyse von Oxalsäurediethylester Es handelt sich um einen Gleichgewichtsprozess: Wasserüberschuss zwingt System zu neuer Gleichgewichtseinstellung Carbonsäure kann durch Neutralisation aus Gleichgewicht entfernt werden 29 2. Carbonsäureester V4 Quantitative Hydrolyse von Oxalsäurediethylester Neutralisation: Mittels vollständiger Neutralisation kann über den Verbrauch an Natronlauge die Stoffmenge n des eingesetzten Esters berechnet werden 30 2. Carbonsäureester 2.6 CH-acide Ester Ester verfügen über eine schwache Acidität des a –Wasserstoffatoms Besonders CH-acide Ester verdanken ihre Eigenschaft der Mesomeriestabilisierung des gebildeten Anions durch elektronenziehende CO-Gruppen in b-Stellung. 31 32 2. Carbonsäureester V5 Keto-Enol-Tautomerie Definition: Tautomerie „Das Vorhandensein zweier im Gleichgewicht stehender Molekülformen, die sich nur durch die Stellung eines Protons (mit der entsprechenden Verschiebung der Bindungen) unterscheiden, wird als Tautomerie bezeichnet.“ 33 2. Carbonsäureester V5 Keto-Enol-Tautomerie Das mesomeriestabilisierte Enolat-Anion steht im Gleichgewicht mit der tautomeren Enol-Form Acetessigsäureethylester ist ein b-Keto-Carbonsäureester 34 2. Carbonsäureester V5 Keto-Enol-Tautomerie Orange-rote Färbung durch Zugabe von Eisen(III)-chlorid Chelat-Komplex Oktaedrisch koordiniert Eisentrienolat 35 2. Carbonsäureester V5 Keto-Enol-Tautomerie Trans-Addition von Brom an C-C-Doppelbindung: 36 2. Carbonsäureester 2.7 Verwendung Aromastoffe: - Nahrungsmittel - Parfüme Lösungsmittel: - Lacke - Klebstoffe Emulgatoren/ - Haushaltsreiniger Konservierungstoffe: - Fischkonserven (PHB-Ester) PHB-Ester = para-Hydroxybenzoesäureester 37 2. Carbonsäureester 2.7 Verwendung Medizin: Acetylsalicylsäure 1899 wurde Aspirin zum Patent angemeldet Hemmt Prostaglandinsynthese im Körper 38 2. Carbonsäureester 2.7 Verwendung Kunststoffe: - PET Polyethylenterephtalat (Verpackungen) - Phtalsäureester - Fettsäureester - Citronensäureester (Weichmacher für PVC) 39 40 2. Carbonsäureester V6 Darstellung eines Polyesters Vorgehensweise: 41 2. Carbonsäureester V6 Darstellung eines Polyesters Citronensäure Ricinusöl 3 Carboxylgruppen 1 Hydroxylgruppe Enthält zu ca. 85 % Ricinolsäure HO 9 O 12 18 OH 42 2. Carbonsäureester V6 Darstellung eines Polyesters Es findet eine Polykondensation statt: R1-CO-OH R2-OH R1-CO-OR2 H2O Dreidimensional vernetztes Harz (Wassereinschlüsse)! 43 3. Ester anorganischer Säuren 3. Ester anorganischer Säuren Entstehung durch formale oder tatsächliche Kondensationsreaktion zwischen Säure und Alkohol Im Folgenden: Bekannte Beispiele für: Phosphorsäureester Schwefelsäureester Salpetersäureester Borsäureester 44 3. Ester anorganischer Säuren Phosphorsäureester Ester der ortho-Phosphorsäure: Natürlich vorkommend: Als Phosphorsäurediester sind in der DNA die Nucleotide miteinander verbunden 45 3. Ester anorganischer Säuren Schwefelsäureester Ester der Schwefelsäure: Natürlich vorkommend: Carrageen (E 407) aus Rotalgen (Geliermittel: z.B. in Babynahrung) 46 3. Ester anorganischer Säuren Salpetersäureester Ester der Salpetersäure: Salpetersäureester von Polyalkoholen sind Explosivstoffe Nitroglycerin: (Propan-1,2,3-trioltrinitrat) Darstellung durch Veresterung der drei OH-Gruppen des Glycerols mit Nitriersäure 47 48 3. Ester anorganischer Säuren V7 Flammenfärbung mit Borsäuretrimethylester Trimethylborat entsteht durch Veresterung von ortho-Borsäure mit Methanol: Schwefelsäure katalysiert die Reaktion und entfernt Wasser aus dem Gleichgewicht 49 3. Ester anorganischer Säuren V7 Flammenfärbung mit Borsäuretrimethylester Trimethylborat verbrennt als borhaltige Verbindung mit grüner Flamme: +3 -2 0 2 BO3(CH3)3 (g) + 9 O2 (g) +3 -2 +4 -2 +1 -2 B2O3 (g) + 6 CO2 (g) + 9 H2O Keine C-C-Bindungen Kein Ruß, welcher glüht Keine Überdeckung der Flammenfärbung 50 5. Schulrelevanz 4. Schulrelevanz Gymnasialer Bildungsgang (G8) Hessen: 11G.1: Alkansäuren und ihre Derivate 11G.2: Naturstoffe: Fette (Eigenschaften und Reaktionen) Synthese von Makromolekülen (Polykondensation) 12G.1: Umkehrbare Reaktionen Chemisches Gleichgewicht (MWG) Prinzip vom Zwang: Beeinflussung der Lage des Gleichgewichts 51 Ende Vielen Dank für Ihre Aufmerksamkeit 52