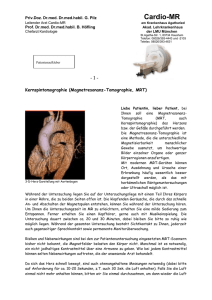
Veränderungen der Pulmonalarterien nach multimodaler Therapie
Werbung

Aus dem Institut für Pathologie der Berufsgenossenschaftlichen Kliniken Bergmannsheil - Universitätsklinik der Ruhr- Universität Bochum Direktor: Prof. Dr. K.- M. Müller VERÄNDERUNGEN DER PULMONALARTERIEN NACH MULTIMODALER THERAPIE BEI NICHT - KLEINZELLIGEN LUNGENTUMOREN Inaugural – Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr- Universität Bochum vorgelegt von Andrea Schnyder aus Papenburg 2002 Dekan: Prof. Dr. G. Muhr Referent: PD Dr. K. Junker Koreferent: Prof. Dr. Eckhard, Prof. Dr. Böhm Tag der mündlichen Prüfung: 6. Mai 2003 1. EINLEITUNG 1 1.1. EINLEITUNG 1 1.2. ANATOMISCHE VERHÄLTNISSE 3 1.2.1. Aufbau der Lunge 3 1.2.2. Aufbau des Gefäßsystems 4 1.3. HISTOLOGIE 1.3.1. Gefäßaufbau der Pulmonalarterien 1.4. PATHOLOGIE 1.4.1. Tumoren der Lunge 5 5 7 7 1.4.1.1. Ätiologie 7 1.4.1.2. Epidemiologie 7 1.4.1.3. Einteilung der Lungentumoren 8 1.4.1.4. Metastasierung der Lungentumoren 10 1.4.1.5. Klassifikation der Lungentumoren 11 1.4.1.6. Vaskularisation der Lungentumoren 12 1.4.2. Gefäßveränderungen 14 1.4.2.1. Altersbedingte Pulmonalarterienveränderungen 14 1.4.2.2. Krankheitsbedingte Pulmonalarterienveränderungen 14 1.4.2.3. Tumorbedingte Pulmonalarterienveränderungen 16 1.5. THERAPIE 1.5.1. 18 Modalitäten 18 1.5.1.1. Operation 18 1.5.1.2. Bestrahlung 19 1.5.1.3. Chemotherapie 20 1.5.1.4. Multimodale Behandlungskonzepte 21 1.5.2. Behandlung der Lungentumoren 22 1.5.2.1. Kleinzellige Lungentumoren 22 1.5.2.2. Nicht- kleinzellige Lungentumoren 24 1.5.3. Therapiebedingte Gewebsveränderungen 27 1.5.3.1. Veränderungen der Lunge 27 1.5.3.2. Veränderungen der Gefäße 29 2. FRAGESTELLUNG 32 3. MATERIAL UND METHODEN 34 4. ERGEBNISSE 38 4.1. GEFÄßVERÄNDERUNGEN ALLER UNTERSUCHTEN PULMONALARTERIEN 38 4.1.1. Entzündliche Infiltration 38 4.1.2. Tumoröse Infiltration 39 4.1.3. Intimaproliferation 40 4.1.4. Stenosierung 41 4.1.5. Obliteration 43 4.1.6. Kompression 45 4.1.7. Aufsplitterung der Membrana elastica interna 46 4.1.8. Elastose 46 4.1.9. Destruktion 47 4.1.10. Restlumen 48 4.2. GEFÄßVERÄNDERUNGEN IN ABHÄNGIGKEIT VOM HISTOLOGISCHEN TUMORTYP 4.2.1. 50 Adeno- und Plattenepithelkarzinome im Vergleich 50 4.3. GEFÄßVERÄNDERUNGEN IN ABHÄNGIGKEIT VON DER GEFÄßGRÖßE 4.3.1. 52 Kleine und große Gefäße von Adeno- und Plattenepithelkarzinomen im Vergleich 52 4.4. GEFÄßVERÄNDERUNGEN IN ABHÄNGIGKEIT VOM REGRESSIONSGRAD 4.4.1. 55 Adeno- und Plattenepithelkarzinome sowie kleine und große Gefäße im Vergleich 55 4.5. GEFÄßVERÄNDERUNGEN IN ABHÄNGIGKEIT VOM RESTLUMEN 4.5.1. 64 Adeno- und Plattenepithelkarzinome sowie kleine und große Gefäße im Vergleich 64 71 4.6. ERGEBNISÜBERBLICK 4.6.1. 5. Wichtigste Gefäßveränderungen 71 DISKUSSION 73 5.1. LASSEN SICH GEFÄßVERÄNDERUNGEN BEHANDELTER TUMOREN MIT DENEN VERGLEICHEN, DIE KEINER PRÄOPERATIVEN THERAPIE UNTERZOGEN WAREN ? 73 5.1.1. Vergleich der Gefäßveränderungen insgesamt 73 5.1.2. Vergleich der Gefäßveränderungen getrennt nach Tumortyp und Gefäßgröße 76 5.2. STELLEN DIE GEFÄßVERÄNDERUNGEN RESULTATE DER THERAPIE DAR ? 79 5.2.1. Gefäßveränderungen therapieunabhängiger Genese 79 5.2.2. Typische Gefäßveränderungen nach Strahlen- und Chemotherapie 81 5.2.3. Gefäßveränderungen abhängig vom Ausmaß der therapieinduzierten Tumorregression 82 5.3. IN WIEWEIT BEEINFLUSSEN SICH GEFÄßVERÄNDERUNGEN UND RESTLUMEN GEGENSEITIG ? 91 5.3.1. Gefäßveränderungen verantwortlich für verbleibende Restlumina 91 5.3.2. Gefäßveränderungen in Korrelation zum verbliebenem Restlumen 91 5.4. WELCHE FOLGEN ERGEBEN SICH AUS DEN GEFÄßVERÄNDERUNGEN? 94 5.4.1. Tumorversorgung 94 5.4.2. Pulmonale Situation 95 6. ZUSAMMENFASSUNG 98 7. LITERATURVERZEICHNISS 101 8. ANHANG 138 9. LEBENSLAUF 160 1. EINLEITUNG 1.1. Einleitung Nach wie vor stellt der Lungentumor mit einer Inzidenz von jährlich ungefähr 45.000 Neuerkrankungen die häufigste maligne Tumorerkrankung in der Bundesrepublik Deutschland dar. Während bei Männern nach zwanzig Jahren mit nahezu konstanter Inzidenz erstmals eine rückläufige Tendenz zu beobachten ist, ist der prozentuale Anteil der Zuwachsrate jedoch zugunsten der Frauen verschoben (Drings 1986, Krebsatlas 1997). Für die Prognose und die Therapie ist die histologische Differentialdiagnose zwischen kleinzelligem bzw. nicht- kleinzelligem Lungentumor, dazu gehören Plattenepithel-, großzellige und Adenokarzinome, ebenso von entscheidender Bedeutung wie die Topographie, Größe und das Metastasierungsverhalten des Tumors (Müller 1986, Braun 1986). Im Gegensatz zum kleinzelligen Lungentumor besteht bei dem nicht- kleinzelligen Lungentumor eine eindeutige Beziehung zwischen dem Tumorstadium entsprechend der TNM- Klassifikation und der Prognose der Erkrankung (Braun 1986). Bislang sind die Therapieresultate nicht zufriedenstellend, die 5- Jahres- Überlebensrate liegt insgesamt unter 10 %. Die mediane Lebenserwartung liegt laut Preiß bei 8 bis 12 Monaten (Preiß 1990). Verantwortlich dafür dürften das schon oft bei Diagnosestellung lokal fortgeschrittene Tumorstadium sein, die bereits erfolgte Metastasierung, die hohe Rezidivrate und die relativ hohe Anzahl der als nicht- operabel geltenden Patienten, sei es aufgrund der Tumorausbreitung oder aus internistischen Gründen. Erst seit jüngerer Zeit gibt es Therapiekonzepte, die Fortschritte bei der Behandlung von Lungentumoren bringen könnten. Neben verbesserten diagnostischen Möglichkeiten, Operations- und Bestrahlungstechniken ist es vor allem die Kombination der einzelnen Modalitäten in unterschiedlicher Reihenfolge, die derzeit Gegenstand zahlreicher Studien ist. Zum einen kann z.B. präoperativ eine Verkleinerung der Tumormasse erreicht werden, die dem Patienten unter Umständen eine Operation erst ermöglichen kann, zum anderen kann eine postoperative Therapie den verbliebenen Resttumor vernichten. Der Chemotherapie kommt hier eine besondere Bedeutung zu, da durch sie zusätzlich das Auftreten von Fernmetastasen beeinflußbar zu sein scheint. 1 Für den Erfolg dieser Therapie ist ein intaktes Gefäßsystem des funktionellen Kreislaufs notwendig. Daß dies aber bei bösartigen Lungentumoren nicht der Fall ist, konnte sowohl durch postmortale angiographische Darstellungen der Pulmonalarterien gezeigt werden, als auch durch histologisch- morphometrische Untersuchungen (Delarue et al. 1954; Delarue et al. 1955; Milne 1967; Reitemeyer et al. 1984; Fisseler- Eckhoff et al. 1987). Unterschiedliche Stadien tumorbedingter Gefäßkompressionen, Infiltrationen, entzündlicher Veränderungen bis hin zur völligen Zerstörung der Gefäße wurden beschrieben (Ballantyne et al. 1957; Steinberg u. Findby 1959; Mosely u. Dickson 1960; Krüger u. Ruckes 1966; Bariety et al. 1967; Kolin u. Koutoulakis 1987; Fisseler- Eckhoff u. Müller 1994). Es stellt sich nun im weiteren die Frage nach Gefäßveränderungen in nicht- kleinzelligen Lungentumoren, welche zuvor einer präoperativen multimodalen Therapie unterzogen wurden. Dies zu untersuchen, ist Inhalt der vorliegenden Arbeit. 2 1.2. Anatomische Verhältnisse 1.2.1. Aufbau der Lunge Durch die Anordnung der verschiedenen Abschnitte des Bronchialbaums, der Gefäße und auch durch Bindegewebssepten läßt sich die Lunge sowohl nach topographischen als auch nach funktionellen Gesichtspunkten gliedern. Zunächst findet eine Aufteilung in Lungenlappen, Lobi pulmonales, statt, die durch die Fissurae interlobulares getrennt werden. In der linken Lunge finden sich ein Lobus inferior und ein Lobus superior, auf der rechten Seite zusätzlich ein dritter Lappen, der Lobus medius. Bedeckt wird die Oberfläche durch Pleura visceralis. Ein zentral gelegener Bronchus sowie ein Ast der Arteria pulmonalis unterteilen einen Lappen, äußerlich nicht erkennbar, in Segmenta bronchopulmonalia. Insgesamt entstehen auf diese Weise zehn bronchoarterielle Segmente in der rechten Lunge, in der Regel jedoch nur neun in der linken. Venen verlaufen im Bindegewebe, durch das diese Lungeneinheiten, wenn auch nur unvollständig, getrennt werden. Ebenfalls durch Bindegewebe, hier als Septa interlobularia bezeichnet, wird die Unterteilung in Lobuli pulmonales vorgenommen. Die Lungenläppchen hinterlassen eine polygonale Felderung auf der Oberfläche, die allerdings nur in der Mantelzone als Felder mit einem Durchmesser von 1- 4 cm zu erkennen sind. Der Bronchialbaum als luftleitender Abschnitt und die alveolären, für den Gasaustausch zuständigen Abschnitte machen den funktionellen Bau der Lunge aus. Nach der Aufteilung in einen rechten und linken Hauptbronchus, Bronchus principalis dexter et sinister, entspricht die weitere Gliederung des Bronchialbaumes der Einteilung der Lunge in Lappen und Läppchen. So folgen auf den Hauptbronchus Bronchi lobares, rechts drei, links zwei. Nun folgen Segmentbronchi, aus denen durch dichotome Teilung Bronchioli hervorgehen, die unterhalb eines Durchmessers von einem Millimeter als Bronchioli terminales bezeichnet werden. Bis zur Teilung in Bronchioli werden in den vorhergehenden Abschnitten dem Aufbau der Tachea entsprechend Knorpelanteile in der Wand der Bronchi gefunden, distal der Bronchioli sind diese mit kontinuierlichem Bronchialepithel ausgekleidet. Die sich anschließenden Bronchioli respiratorii gehen nach weiteren Aufteilungen in Ductus alveolares über. Für die beiden letztgenannten Abschnitte sind Alveolen charakteristisch, die mit dem Septum interalveolare eine gemeinsame Wand besitzen und die für den Gasaustausch 3 die entscheidenden Bereiche sind. Alle Alveolen, die einem Bronchiolus terminalis zugeordnet werden können, werden als Azinus zusammengefaßt (v. Hayek 1970). 1.2.2. Aufbau des Gefäßsystems Es wird bei dem Blutversorgungssystem der Lunge zwischen einem funktionellen und einem nutritiven Kreislauf unterschieden. Gefäße des funktionellen Kreislaufs werden als Vasa publica bezeichnet und dienen dem Gasaustausch, indem deren Arteriae pulmonales das aus dem Körper herantransportierte Kohlendioxid in der Lunge abgeben und anschließend oxygeniertes Blut über die Venae pulmonales zum Herzen zurückführen. Die Aa. und Vv. pulmonales stellen mit den Kapillaren den Lungenkreislauf dar, in dem im Gegensatz zum großen Keislauf ein Niederdrucksystem herrscht. Die Pulmonalarterien entspringen dem gemeinsamen Stamm des Truncus pulmonalis, treten jeweils am Hilus pulmonalis in die Lunge ein und folgen mit wenigen Abweichungen dem Bronchialbaum und seinen Aufzweigungen (Eliott u. Reid 1965). Durch peribronchiales Bindegewebe sind die Gefäße mit den Bronchien und Bronchiolen verbunden. Angiographisch konnten die Aufteilungen der Aa. pulmonales verfolgt und somit auch deren Durchmesser bestimmt werden. 7,5 mm beträgt der durchschnittliche Durchmesser einer Segmentarterie, Dotter u. Steinberg legten 1949 den Durchmesser für Subsegmentarterien mit ungefähr 6 mm fest. Prälobulararterien werden mit 1,5 mm von Lobulararterien mit einem mittleren Durchmesser von 0,6 mm unterschieden. Junghanns fand für Terminalarterien einen Durchmesser von 200 bis 300 µm (Junghanns 1958). Im histologischen Präparat konnte für Lungenarteriolen eine maximale Dicke von 100 µm aufgezeigt werden (Harris u. Heath 1977; Murray 1978). Das mit Sauerstoff angereicherte Blut sammelt sich nach Durchfluß des Kapillarnetzwerkes zunächst in Venolen, die sich zu Venen zusammenfinden, im interlobulären und intersegmentalen Bindegewebe verlaufen und durch Orientierung am Bronchialbaum als Vv. pulmonales den Lungenhilus erreichen. Lungenvenen haben keine Klapppen wie sie in Venen des Körperkreislaufs gefunden werden. 4 Die Vasa privata des nutritiven Gefäßsystems versorgen den überwiegenden Teil des Lungengewebes, den Bronchialbaum, die Gefäßwände der Pulmonalarterien- und venen und liegen bis zu den Bronchioli respiratorii in enger Nachbarschaft zu den Bronchien und Bronchioli (v. Hayek 1970; Müller u. Bordt 1974). Dort anastomosieren sie mit den Aa. pulmonales, venöses Blut gelangt in arterialisiertes Blut und Blut beider Systeme fließt über die postkapillären Venen über den linken Vorhof in den großen Kreislauf. Auch über die Vv. azygos, hemiazygos und interkostale Venen fließt, wenn auch nur ein geringer Teil des Bronchialarterienblutes ab und somit in den rechten Vorhof (Murray 1978). 1.3. Histologie 1.3.1. Gefäßaufbau der Pulmonalarterien Verglichen mit gleich großen Arterien des Körperkreislaufs fällt die geringere Wanddicke der Pulmonalarterien auf (Töndury u. Weibel 1958). Außerdem enthalten sie einen höheren Anteil an elastischen Fasern, wodurch sie den Druckschwankungen von 20 mm Hg in der Systole und 8 mm Hg in der Diastole besser standhalten können (Witzleb 1985). Der insgesamt niedrigere Druck im Lungenkreislauf erklärt auch die geringere Wandstärke. Die Arterienwand läßt sich in drei Schichten gliedern, in eine Intima, Media und Adventitia. Grundsätzlich muß bei den Pulmonalarterien zwischen einem elastischen und einem muskulären Typ unterschieden werden, da Ausprägung und Zusammensetzung der einzelnen Schichten und ihrer Grenzmembranen für jeden Typ charakteristische Merkmale aufweisen. Elastische Pulmonalarterien, deren durchschnittlicher äußerer Durchmesser von mehreren Autoren auf mehr als 1000 µm festgelegt werden konnte, besitzen eine Intima, die aus einem einfachen Endothelrohr besteht, aber auch eine Schicht enthalten kann, die sich aus Bindegewebe und zahlreichen elastische Fasern zusammensetzt (Brenner 1935; Merkel 1949; Dunnhill 1960; Harris u. Heath 1977; Murray 1978; Töndury u. Weibel 1958). Die zwischen Intima und Media liegende Membrana elastica interna zeigt sich aufgrund ihrer längs verlaufenden, dicken Fasern im orthograd getroffenen Gefäß als gewellte, ringförmige 5 Linie. Sie ist weniger deutlich ausgeprägt als bei Arterien des Körperkreislaufs. Die Media besteht hauptsächlich aus elastischen Lamellen, zwischen denen glatte Muskelzellen, Kollagen und Bindegewebe anzutreffen sind (Harris u. Heath 1977). Die konzentrisch angeordneten elastischen Lamellen nehmen mit der Größe des Gefäßes in ihrer Anzahl zu, nach außen hin verdicken sich die kräftiger werdenden Lamellen, von denen die 2- 3 äußersten wie eine Membrana elastica externa imponieren. Die elastischen Fasern können laut Merkel sowie Töndury u. Weibel zum Lumen hin auch direkt bis unter das Endothel reichen. An das lockere Bindegewebe des Peribronchium findet die Adventitia mit ihren ausgeprägten kollagenen, dagegen nur spärlichen elastischen Bindegewebsfasern Anschluß (Töndury u. Weibel 1958). Pulmonalarterien vom muskulären Typ sind in der Regel mit einem äußeren Durchmesser von 100 bis 1000 µm kleiner als elastische Gefäße und kommen ab dem Übergang von Bronchien in Bronchioli vor. Deutlich erkennbar sind nun zwei elastische Membranen. Unterschiedlich ist dagegen deren Zusammensetzung: Die Lamina elastica interna ist aus dicht gelagerten, dicken Längsfasern aufgebaut, während die Fasern der Lamina elastica externa eher zirkulär verlaufen (Töndury u. Weibel 1958). Zwischen ihnen liegt die aus 4- 5 Schichten glatter Ringmuskelzellen bestehende Media mit nur ganz geringen Anteilen elastischer Fasern. Auch wenn bei diesen Gefäßen von einem muskulären Aufbau gesprochen wird, so beträgt der Anteil der muskulären Masse unter physiologischen Bedingungen nicht mehr als 5 % der Gesamtwandmasse (Murray 1978). Als Übergang zum Peribronchium folgt die Adventitia, die durch ein Geflecht aus kollagenen Fasern mit schräg und längs verlaufenden elastischen Fasern gekennzeichnet ist. 6 1.4. Pathologie 1.4.1. Tumoren der Lunge 1.4.1.1. Ätiologie Die Ätiologie des Lungentumores gilt heute als geklärt. An erster Stelle kann als wichtigster Risikofaktor das Zigarettenrauchen als Ursache für die Entstehung des Lungenkrebses verantwortlich gemacht werden (Graham 1951; Wynder 1972; Müller 1983; Zeller u. Schmähl 1985; Drings 1986; Schmähl 1987; Krebsatlas 1997). Zu 85 % ist der Tabakrauch, in dem zahlreiche krebserzeugende polyzyklische Kohlenwasserstoffe und Kokarzinogene enthalten sind, Ursache des Lungenkrebses. Es konnten direkte Zusammenhänge zwischen Rauchgewohnheiten und Karzinomgefährdung aufgezeigt werden (Müller 1976; Zeller u. Schmähl 1985). Auch gilt die Exposition von Nichtrauchern gegenüber Tabakrauch als Risikoerhöhung mittlerweile als bestätigt (Krebsatlas 1997). Zahlreiche berufsbedingte Noxen spielen ebenfalls eine wichtige Rolle. Hier sind vor allem ionisierende Strahlung, Asbest, Arsen, Chrom und Nickel zu nennen. Neben endogenen Faktoren wie Ernährung und genetische Disposition steht auch ein sogenannter Urbanisationsfaktor zur Diskussion, durch den der ubiquitären Schadstoffbelastung in der Luft Rechnung getragen werden soll (Müller 1983; Zeller u. Schmähl 1985; Schmähl 1987). In der Zwischenzeit konnte einzig für Lungentumoren ein Zusammenhang zwischen der Schadstoffbelastung der Luft und der Erhöhung des Lungenkrebsrisikos gezeigt werden (Krebsatlas 1997). 1.4.1.2. Epidemiologie Kein anderer Tumor hat in den vergangenen Jahrzehnten weltweit so sehr an Häufigkeit zugenommen wie der Lungentumor (Silverberg 1980). Verglichen mit den Zahlen aus den 30er Jahren ist eine Zunahme um ein Vielfaches zu verzeichnen (Müller 1983). Damit stehen in der Todesursachenstatistik die bösartigen 7 Neubildungen der Atmungsorgane beim Mann mit fast 30 % an der Spitze aller bösartigen Tumorerkrankungen (Müller 1976; Krebsatlas 1997). Verändert hat sich die Geschlechterverteilung. Während bei Männern nach einer starken Zunahme der Sterblichkeit bis zum Ende der siebziger Jahre eine Stagnation bis zum Ende der achtziger Jahre eintrat, die daran anschließend in einen Rückgang überging, konnte für Frauen eine eher gegenläufige Entwicklung verzeichnet werden. Hier verläuft die Tendenz der Sterblichkeit anhaltend nach oben (Krebsatlas 1997). Von mehreren Autoren konnte die stärker steigende Inzidenz bei Frauen bei leicht fallender Inzidenz bei Männern bestätigt werden (Deaner 1970; Schneiderman u. Levin 1972; Wynder 1973; Beamis 1975; Vincent 1977; Drings 1986). So wird vorausgesagt, daß auch bei Frauen dieser Tumor die erste Stelle der bösartigen Neubildungen erreichen wird (Drings 1986). Veränderte Rauchgewohnheiten sollen hierfür hauptsächlich die Ursache sein (Wynder 1973). Der Altersgipfel dieser Erkrankung liegt im siebten Lebensjahrzehnt (Müller 1976; Drings 1986). 1.4.1.3. Einteilung der Lungentumoren Topographisch lassen sich die Lungentumoren in zentrale und intermediäre, periphere und diffus infiltrierende, pneumonisch wachsende Tumoren untergliedern (Müller 1983). Für Therapie und Prognose ist jedoch die histologische Differentialdiagnose von entscheidender Bedeutung (Müller 1985; Müller 1986). Nach Grundmann sind bösartige Tumoren nicht aus einer einzelnen Zelle hervorgegangen, sondern stellen die Endstufe einer Reihe von Zell- und Gewebsveränderungen dar (Grundmann 1980). Zu den Präneoplasien der Bronchialschleimhaut zählen Epithelhyperplasien, Metaplasien und Mikropapillomatose, Dysplasien in drei verschiedenen Graden und das Carcinoma in situ (Müller 1979; Müller u. Eckhoff 1991). Die vier histologischen Haupttypen umfassen Plattenepithel-, Adeno-, klein- und großzellige Karzinome, die vor allem in ihrer Häufigkeit und Herkunft einige Charakteristika aufweisen. Plattenepithelkarzinome bilden mit ungefähr 40 % die größte Gruppe der Lungentumoren. Meist im Bereich der Segment- und Subsegmentbronchien entstehend zeigen sich häufig enge 8 Beziehungen zu präneoplastischen Veränderungen, die für Minna einen Beweis des primären Ursprungs der Tumorentwicklung darstellen (Minna et al.1989). Durch ihre Neigung, Nekrosen zu bilden, entstehen z. T. ausgedehnte Tumorkavernen (Müller 1983). In ihrer Häufigkeit folgen die kleinzelligen Karzinome mit einem Anteil von ungefähr 20 %. Diese Tumoren, deren Zellen durchschnittlich nur 9 µm groß sind, zeichnen sich durch eine frühzeitige Metastasierung aus. Nicht selten führen metastasenbedingte Beschwerden zur Entdeckung des dann schon weit fortgeschrittenen Tumorleidens (Müller 1985). Der Nachweis von neurosekretorischen Granula scheint mit den paraneoplastischen Symptomen der ektopen Hormonproduktion in enger Verbindung zu stehen (Mc Dowell 1976; Müller 1986). Adenokarzinome, deren Inzidenz stark zugenommen hat und die unter Frauen, Nichtrauchern und Patienten unter vierzig Jahren die häufigste Tumorart darstellen, sind mit ungefähr 15 25 % die drittgrößte Tumorgruppe (Neuman et al. 1956; Wynder u. Berg 1967; Valaitis 1981). Als Ursprungszellen kommen sowohl Zylinderepithelzellen, Clara- Zellen als auch Pneumozyten Typ II in Frage (Fasske 1984). Diffus infiltrierend wachsen sie intraalveolär als sogenannte Alveolarzellkarzinome in peripheren Abschnitten der Lunge. Der Nachweis von Schleim ist zwar kein beweisendes Kriterium, jedoch ein häufiges Phänomen (Müller 1985). So fanden Walter u. Pryce in allen von ihnen untersuchten Adenokarzinomen Schleim (Walter u. Pryce 1955). Bis zu 40 µm große Zellen sind ebenso charakteristisch für großzellige Lungentumoren wie atypische epitheliale Zellen mit hyperchromatischen, oft gelappten Zellkernen und reichlich Zytoplasma (Müller 1983). Plattenepitheliale, drüsige oder kleinzellige Anteile sind nicht nachweisbar. Hervorzuheben ist auch hier die Tendenz zu lokaler Infiltration und Metastasierung, sowie zur Entstehung von Nekrosezonen (Müller 1983; Minna et al. 1989). Bei jeder beschriebenen Tumorart wurden in der WHO- Klassifikation Subtypen festgelegt, die jedoch für die Therapie und Prognose nicht von Relevanz sind (WHO 1981). Deswegen wird an dieser Stelle auf eine weitergehende Darstellung verzichtet. Problematisch bei der exakten Klassifizierung ist die Heterogenität der Lungentumoren. Ein einheitliches histologisches Bild zeigen lediglich 40- 50 % der Lungentumoren (Schubert 1975; Müller u. Eckhoff 1989). 9 Unter der Bezeichnung Narbenkarzinom werden Tumoren zusammengefaßt, die im Bereich alter Lungennarben entstanden sind. Eine Tuberkuloseerkrankung kann in einer Vielzahl der Fälle als Erklärung für die Entstehung solcher Narben dienen, wenn auch die eindeutige Ätiologie oft nicht nachzuvollziehen ist. In Betracht gezogen werden muß auch die Möglichkeit, daß es in zentralen Tumorbereichen aufgrund einer Minderversorgung mit Sauerstoff zu einem Untergang von Gewebe mit anschließender Narbenentwicklung gekommen ist (Haupt u. Kühn 1968; Reitemeyer et al. 1987; Kolin u. Koutoulakis 1988; Fisseler- Eckhoff et al. 1988). 1.4.1.4. Metastasierung der Lungentumoren Bereits zum Zeitpunkt der Diagnosestellung liegen in über 50 % der Lungentumoren Lymphknotenmetastasen vor. Bei einigen Tumortypen sind Abhängigkeiten der hämatogenen Metastasierung von der histologischen Differenzierung zu sehen (Junker u. Müller 1989). Grundsätzlich kann festgehalten werden, daß eine höhere Metastasierungsrate bei Tumoren mit niedrigem Differenzierunggrad zu erwarten ist ( Müller 1983). Die lymphogenen Metastasierungswege dagegen scheinen von der Lokalisation des Primärtumors abhängig zu sein (Junker et al. 1987). Über intrapulmonale Lymphdrainage erreichen Tumorzellen zunächst regionale bronchopulmonale Lymphknoten, von dort zu Hilus-, tracheobronchiale, mediastinale und retroperitoneale Lymphknotenstationen. Am häufigsten, nämlich mit 85 %, erfolgt die lymphogene Metastasierung bei kleinzelligen Karzinomen, während Plattenepithel- und Adenokarzinome zu 57 % bzw. zu 51 % lymphogen metastasieren. Ausmaß und Lokalisation der hämatogen gestreuten Fernmetastasen variieren beträchtlich zwischen den Tumortypen. So fällt vor allem das kleinzellige Karzinom durch eine frühzeitige Metastasierung auf, dessen Metastasen in zahlreichen Organen zu finden sind: Leber, Gehirn, Knochen, Nebennieren, Pankreas, Schilddrüse, Hypophyse und Hoden (Matthews 1976; Müller 1978; Braun 1986; Menne u. Müller 1984). Insgesamt liegt die Metastasierungsrate bei 85 %. 10 Mit 77 % liegen Adenokarzinome an zweiter Stelle der Metastasierungshäufigkeit, wobei besonders bei diesen Tumoren gilt, daß sie bei höherer Differenzierung weniger metastasieren (Müller 1983). Bevorzugt finden sich sehr früh Tochtergeschwulste im Zentralnervensystem. Aufgrund ihres langsamen Wachstums bleiben Plattenepithelkarzinome lange Zeit lokal begrenzt, was sich auch in der Metastasierungsrate von 55 % niederschlägt (Müller 1983). 1.4.1.5. Klassifikation der Lungentumoren Nach Vorschlägen zahlreicher Experten entstand mit der TNM- Klassifikation der UICC 1979 ein international einheitliches System zur Einteilung der Lungentumoren. Basierend auf klinischen, röntgenologischen und endoskopischen Befunden werden Tumoren entsprechend ihres klinischen Stadiums eingruppiert. Die Ausdehnung des Primärtumors findet sich in dem Kürzel T für Tumor wieder, N ( = Nodulus) beschreibt das Ausmaß des Lymphknotenbefalls und das Ausmaß der Fernmetastasierung wird durch den Buchstaben M beschrieben. Zusätzlich legte man eine Einteilung der TNM- Klassifizierung in vier Stadien fest (Staging). Dem Stadium I entsprechen: T1 N0 M0 T2 N0 M0 T1 N1 M0 T2 N1 M0 T3 N0 M0 T3 N1 M0 T1-3 N2 M0 T1-4 N3 M0 Stadium II: Stadium III a: Stadium III b: T4 Stadium IV: N0-3 M0 T0-4 N0-3 M1 Diese Einteilung, bei der erstmals eine Untergliederung des Stadium III erfolgte, wurde von Mountain festgelegt (Mountain 1986). In der Zwischenzeit liegt eine neue Stadieneinteilung vor, welche jedoch bei dem dieser Arbeit zugrundeliegendem Studienprotokoll nicht mehr zur Anwendung gekommen ist (Mountain 1997). Bei einer weiteren Form der Klassifikation, dem Grading, finden histopathologische Malignitätsgrade Berücksichtigung. Vier Grade wurden festgelegt: 11 G1 für gut, G2 für mäßig, G3 für schlecht differenzierte und G4 für undifferenzierte Tumoren (UICC 1987). Ein Grad Gx umfaßt Tumoren, deren Differenzierung nicht möglich ist. Gerade für Lungentumoren gestaltet sich das Grading aufgrund der Heterogenität oft problematisch (Müller u. Reichel 1990). Kleinzellige Lungentumoren nehmen eine Sonderstellung ein, so daß sich eine Einteilung in “limited disease“ , bei dem sich das Tumorgeschehen noch auf die ipsilaterale, ursprüngliche Thoraxhälfte beschränkt, und “extensive disease“ im klinischen Alltag bewährt hat (Sauer u. Wilmanns 1991; Havemann u. Wolf 1991). Die Tumoren der Stadien I und II gelten, bislang zumindest, als operabel. Solange keine Fernmetastasen (M0) vorliegen und der Tumor mit T1-2 als nichtinvasiv gilt, entscheidet der Nachweis bzw. das Fehlen eines mediastinalen Lymphknotenbefalls über die Operabilität des Patienten (Braun 1986). Die operative Behandlung höher- gradiger Tumoren bleibt derzeit kontrollierten Studien vorbehalten. Vorhandene Lymphknotenmetastasen versucht man mit Hilfe der Chemotherapie oder Bestrahlung zu bekämpfen. 1.4.1.6. Vaskularisation der Lungentumoren Die Blutversorgung der Lungentumoren wird hauptsächlich von neugebildeten Gefäßen der Bronchialarterien übernommen (Wood u. Miller 1938; Wright 1938; Cudkovicz u. Armstrong 1953; Delarue et al. 1965; Neyazaki 1970; Müller 1983). Eher peripher gelegene Tumoren zeigen eine zunehmende Beteiligung der Pulmonalarterien (Milne 1967). Mit Hilfe von klinischen und postmortalen, selektiven angiographischen Darstellungen konnten je nach Tumorgröße unterschiedliche Vaskularisationsmuster nachgewiesen werden. Die Veränderungen reichen von einer Proliferation korrekt ausgerichteter Gefäße über wollknäuelartige Gefäßkonvolute bis hin zu Kontrastmittelextravasaten in nekrotischen Tumorarealen (Meyer- Schwickerath 1977). Im Zuge der Hypervaskularisierung sind vermehrt Anastomosen zwischen Pulmonal- und Bronchialarterien entstanden (Cudkovicz u. Armstrong 1953; Harris u. Heath 1977; Müller u. Meyer- Schwickerath 1978). Einige Autoren sehen Abhängigkeiten von der histologischen Differenzierung des Tumors, jedoch lassen sich zuverlässige Rückschlüsse nur bedingt ziehen (Milne 1967; Ikeda et al. 1968; Neyazaki et al. 1970). Ein geordneteres, weniger dichtes Gefäßmuster zeichnet mehr differenzierte Tumoren wie Plattenepithel12 und Adenokarzinome aus, während schnellwachsende klein- und großzellige Tumoren durch stark verzweigte Gefäßkonvolute mit vielen neugebildeten Kapillaren auffallen (Müller 1983). Als schwierig kann sich die Abgrenzung zu vorbestehenden oder begleitenden Lungenveränderungen gestalten. Entzündungen, Vernarbungen, alte tuberkulotische Herde, Atelektasen, Abszesse und Tumorkavernen sind in der Lage, ähnliche angiographische Befunde hervorzurufen. Ikeda gelang es dennoch 1968 in einer Studie, Charakteristika zur Unterscheidung einiger wichtiger Lungenprozesse herauszuarbeiten (Ikeda et al. 1968). 13 1.4.2. Gefäßveränderungen 1.4.2.1. Altersbedingte Pulmonalarterienveränderungen Die auffälligsten Befunde stellen Veränderungen der Intima dar. Schon 1935 wurden von Brenner Intimaproliferationen als typisch altersbedingte Gefäßwandveränderung erkannt. Unregelmäßige Verdickungen, die in kleineren muskulären Arterien am häufigsten vorkommen, während sie bei elastischen Arterien eher die Ausnahme sind, sind in ihrer Ausprägung charakteristisch (Wagenvoort u. Wagenvoort 1965). Im Gegensatz zur Intima verändert die Media mit zunehmendem Alter kaum ihre durchschnittliche Dicke (Wagenvoort u. Wagenvoort 1977). Lediglich im Querschnitt zeigen sich Unregelmäßigkeiten in der Dicke und die angrenzenden elastischen Membranen schaffen keine deutliche Abgrenzung mehr (Wagenvoort u. Wagenvoort 1965). Auerbach beschreibt eine generelle Dickenzunahme der Pulmonalarterienwand, ohne näher auf Verdickungen der einzelnen Schichten einzugehen. Jedoch sind Gefäße von Rauchern in einem stärkeren Maße betroffen als die Gefäße von Nichtrauchern (Auerbach et al. 1963). Mit dem Alter scheinen Wandbestandteile Veränderungen in der Zusammensetzung zu erfahren (Farrar et al. 1965). Elastische Komponenten nehmen ab, hyaline und kollagene dagegen nehmen zu (Simons u. Reid 1969; Harris u. Heath 1977). Daraus resultiert eine Abnahme der Lungenelastizität (Hartung 1957). 1.4.2.2. Krankheitsbedingte Pulmonalarterienveränderungen Der pulmonale Bluthochdruck Gefäßwandveränderungen aus. zeichnet Die sich durch Ursachen des besonders stark Bluthochdrucks ausgeprägte können ganz unterschiedlicher Natur sein. Sowohl Veränderungen des Lungengewebes und der Lungenstrombahn selbst, als auch kardial bedingte Ursachen, hier vor allem angeborene Septumdefekte und Herzklappenfehler, kommen in Frage. Besteht keine dieser Möglichkeiten, ist von einer primären, auch idiopathisch genannten, Hypertonie auszugehen. Intimafibrosen und Mediahypertrophien kennzeichnen beide Formen der Hypertonie, primäre wie sekundäre, jedoch entscheidet die Grunderkrankung über das Ausmaß und die Art der Veränderungen (Heath u. Whitaker 1955; O`Neal et al. 1955; Edwards 1957; Heath u. Best 14 1958; Heath u. Edwards 1958; Wagenvoort 1959; Dunnill 1960; Wagenvoort et al. 1967; Wagenvoort u. Wagenvoort 1970; Dingemans u. Wagenvoort 1978; Wagenvoort 1986; Wagenvoort 1988). Plexiforme Läsionen stellen den höchsten Grad der Pulmonalgefäßveränderungen dar, von denen bevorzugt Gefäße des muskulären Typs betroffen sind (Naeye u. Vennart 1960). Atriale und ventrikuläre Septumdefekte mit Links- Rechts- Shunt, persistierender Ductus arteriosus, Mitralstenosen, primäre pulmonale Hypertension, chronische Hypoxie führen über einen erhöhten Gefäßwiderstand und Vasokonstriktion zu Veränderungen, die unter der Bezeichnung der plexogenen Arteriopathie zusammengefaßt werden (Wagenvoort 1988). Am Anfang stehen Intimaproliferation und Mediahypertrophie. In der Intima findet zunächst eine zelluläre Proliferation statt, durch Ablagerung von Kollagen und elastischen Lamellen entwickelt sich dann eine konzentrisch laminäre Intimafibrose, die zu einer starken Lumenverengung führt. Außerdem lassen sich glatte Längsmuskulaturzellen nachweisen, von denen man eine Migration aus der Media annimmt (Poole et al. 1971). Der Mediahypertrophie liegen eine Größenzunahme und eine Vermehrung glatter Muskelzellen zugrunde (Heath u. Best 1958). Eine ausgeprägte Dilatation der Gefäße folgt den ersten Veränderungen. Sogenannte dilatative Läsionen umfassen venenähnliche Äste hypertrophierter muskulärer Arterien, kavernöse und angiomatöse Läsionen (Wagenvoort 1988). Über fibrinoide Nekrosen und entzündliche Infiltrationen nehmen die Veränderungen ihren Lauf, die in plexiformen Läsionen mit Zerstörung der Arterienwand enden (Naeye u. Vennart 1960; Wagenvoort et al. 1984). Short wies auf das Problem hin, daß ein erhöhtes Wand- Lumen- Verhältnis die Entscheidung, ob eine Hypertrophie oder eine Konstriktion des Gefäßes vorliegt, wesentlich erschweren kann (Short 1962). Exzentrische Intimafibrosen entstehen bei chronisch venöser Hypertonie, Thrombembolien und chronischen Thrombosen, die nach Rekanalisation durch intraarterielle fibröse Septen auffallen (Wagenvoort u. Wagenvoort 1970). Experimentelle Verletzungen arterieller Gefäße zeigten anfangs thrombotische und hämostatische Reaktionen. Später resultierte eine verdickte Intima, die sich aus einer bedeckenden Endothelschicht mit zahlreichen glatten Muskelzellen zusammensetzt und in der 15 elektronenmikroskopisch Kollagen, Elastin und Mikrofibrillen gefunden werden konnten (Poole 1971). Thrombose, exzentrische Intimafibrose, plexiforme Läsionen und Aneurysma- ähnlich dilatierte, gewundene Gefäße wurden nach intravenösem Drogenabusus beobachtet (Tomashefski u. Hirsch 1980). In seltenen Fällen entwickelten auch Patienten mit Leberzirrhose pulmonalen Hochdruck und wiesen ebenfalls die oben genannten Gefäßveränderungen auf (Harris u. Heath 1977). 1.4.2.3. Tumorbedingte Pulmonalarterienveränderungen Das Spektrum der Veränderungen der A. pulmonalis bei bösartigen Lungentumoren reicht angiographischen Befunden zufolge von Kaliberabnahmen bis hin zu einem völligen Abbruch des Gefäßverlaufes (Steinberg u. Findby 1959; Fisseler- Eckhoff et al. 1987). Abhängigkeiten von der Lokalisation des Primärtumors konnten nachgewiesen werden. So sind es Arterien zentraler, hilusnaher Tumoren, die frühzeitig Stenosierungen und Deviationen unterliegen. Als Resultat stellen sich Minderversorgungen oder sogar völlige Unterbrechungen Subsegmentarterien der der Versorgung des intermediären Lungenparenchyms Lungentumoren werden ein. Segment- dagegen in und ihren Teilungswinkeln aufgeweitet und im Tumorrandbereich parallelisiert und gebündelt. Gefäßabbrüche und baumwollartige Gefäßmuster kennzeichnen Prälobulararterien in peripheren Lungentumoren (Bergmann 1980; Fisseler- Eckhoff et al.1987). Aufgrund ihrer Wandzusammensetzung und des relativ hohen intraluminalen Druckes wird der Pulmonalarterie ein besonderer Widerstand gegen Invasion von Tumorzellen zugesprochen (Shivas u. Finlayson 1965). Dennoch gelingt es Tumorzellen, dieses Hindernis zu überwinden. Angaben zur Häufigkeit schwanken jedoch. Zwischen 58 % und 87 % liegt die Invasionsrate, die von Kolin und Koutoulakis beschrieben wurde (Kolin u. Koutoulakis 1987). Sie sehen keine Verbindung zur histologischen Differenzierung des Tumors. Krüger und Ruckes fanden Invasionen durch Tumorzellen in 76 % der von ihnen untersuchten Fällen, Langston hingegen 88 % (Langston et al. 1958; Krüger und Ruckes 1966). 16 Schwierigkeiten bei der Differenzierung zwischen arteriellen und venösen Gefäßen führten bei Ballantyne et al. zu einer Gesamtinvasionsrate von 88 %, sicher arteriell waren nur 17 % der Gefäße (Ballantyne et al. 1957). Auffallend geringere Invasionsraten für Pulmonalarterien zeigten sich bei Pryce und Walter, die bei nur 43 % liegt. Venöse und arterielle Invasionen zusammengefaßt ergaben bei zentralen, peripheren bzw. nicht mehr eindeutig zuweisbaren Lungentumoren Invasionsraten von 40 %, 61 % bzw. 81 % (Pryce u. Walter 1960). Sie stellten heraus, daß die elastischen Membranen der Arterienwand keine effektive Barriere für Tumorzellen darstellen. Ähnliche Werte arterieller Invasion erbrachten Untersuchungen von Mosely und Dickson (Mosely u. Dickson 1960). Daß eine Gefäßinvasion durch Tumorzellen nicht ohne Folgen für die Gefäßwand bleibt, beschrieben sowohl Ballantyne et al. wie auch Kolin u. Koutoulakis. Die Veränderungen umfassen Intimaproliferationen, Thrombosierungen mit verschiedenen Stadien der Rekanalisation und Organisation sowie Vernarbungen (Ballantyne et al. 1957; Wagenvoort u. Wagenvoort 1965; Kolin u. Koutoulakis 1987). Konsequenz der Invasion ist eine insgesamt schlechtere Prognose, die einerseits durch die hohe Anzahl der Fernmetastasen bedingt ist, andererseits sinken die Chancen einer vollständigen operativen Resektion beträchtlich, wenn sie nicht sogar ganz unmöglich ist (Ballantyne et al. 1957; Langston et al. 1958; Collier et al. 1958; Steinberg u. Finby 1959; Mosely u. Dickson 1960). Pulmonalarterienveränderungen, wie sie in Lungentumoren gefunden werden, treten allerdings auch bei anderen Erkrankungen der Lunge auf. Es handelt sich um Intima- und Mediaproliferationen, beschrieben von Wagenvoort und Ballantyne, Thrombosierungen, entzündliche Infiltrationen, ödematöse Auflockerungen und Erhöhung der Permeabilität der Gefäßwände (Delarue et al. 1954; Ballantyne et al. 1957; Wagenvoort u. Wagenvoort 1965; Krüger u. Ruckes 1966; Bariety et al. 1967; Papadimitriou u. Woods 1975). Krüger u. Ruckes beobachteten ebenfalls eine Aufsplitterung und Zerstörung der elastischen Lamellen. Broncho- pulmonale Anastomosen konnten in erhöhtem Maße nachgewiesen werden (Delarue et al. 1965; Wagenvoort u. Wagenvoort 1965; Müller u. Meyer- Schwickerath 1978; Müller u. Bordt 1980). In einer neueren Studie wurde bei nicht- kleinzelligen Lungentumoren der Einfluß von Tumorart und Tumorzone auf das Ausmaß der Pulmonalarterienveränderungen untersucht. 17 Hier konnten klare Abhängigkeiten aufgezeigt werden. Entzündungen, Aufsplitterungen der Membrana elastica interna, Obliterationen und Destruktionen nehmen demnach zum Tumorzentrum hin an Häufigkeit zu (Fisseler- Eckhoff u. Müller 1994). 1.5. Therapie 1.5.1. Modalitäten 1.5.1.1. Operation Es ist unbestritten, daß eine Heilung des Lungenkrebses im allgemeinen nur durch eine Operation möglich ist. Dennoch sind einer operativen Therapie lediglich 30 % der Patienten zugänglich. Da die Tumorentwicklung bereits zum Zeitpunkt der Diagnosestellung weit fortgeschritten ist, werden die Kriterien der Operabilität häufig nicht erreicht. Als operabel gilt ein Patient, abgesehen vom Tumorstadium nach der TNM- Klassifikation, wenn aus klinischer Sicht eine Operation durchgeführt werden kann, die auch zur vollständigen Resektion des Tumors führt (Ehler et al 1954). Risiken entstehen bei einem hohen Alter des Patienten, das nicht selten Multimorbidität birgt. So sind der Allgemeinzustand und das Vorhandensein kardialer, respiratorischer, renaler und zerebraler Erkrankungen genauestens zu prüfen (Whrigt 1984). Mit dem Karnofski- Index wurden einheitliche Maßstäbe zur Beurteilung des Allgemeinzustandes festgelegt. Fernmetastasen schließen einen Patienten ebenfalls von chirurgischen Maßnahmen aus. Einerseits würde die Operation womöglich nicht überlebt werden, andererseits kann durch eine Operation keine wesentliche Verbesserung des Tumorleidens erfolgen, die sich in einer höheren Überlebenszeit äußern würde. Die operativen Möglichkeiten erstrecken sich von atypischen Segmentresektionen über Lobektomien bis hin zu Pneumektomien, wobei sich trotz vorherigem sorgfältigen Staging erst intraoperativ das gesamte Ausmaß des Tumors darstellen kann. Hier muß dann ein geplanter Eingriff erweitert oder abgebrochen werden, falls sich eine Inoperabilität herausstellt (Vogt- Moykopf et al. 1991). 18 Daraus erklären sich die im Vergleich zu Operabilitätsraten unterschiedlichen Resektionsraten. 43 % : 33 % zum Beispiel wurden von Minna beschrieben (Minna et al. 1989). Kleinere Eingriffe als die Pneumektomie stellen mit 70- 80 % den Hauptanteil der Resektionen (Vogt- Moykopf et al. 1991). Zur Beurteilung des Erfolges der chirurgischen Intervention dient die R- Klassifikation. Beim Stadium R0 liegt kein Residualtumor vor, mikroskopisch nachweisbarer Residualtumor verlangt eine Einteilung nach R1, makroskopischer Tumorrest dagegen ist bei R2 einzugruppieren. Vorgesehen ist auch eine Rx Bezeichnung für Fälle, in denen keine Beurteilung möglich ist (UICC 1987). Ist kein kurativer Ansatz zur Behandlung möglich, kann dennoch in manchen Fällen eine Operation mit palliativer Intention zur Verminderung tumorbedingter Symptome und Schmerzen sinnvoll sein. 1.5.1.2. Bestrahlung Grundsätzlich kommen die Patienten für eine Bestrahlung in Frage, die keiner chirurgischen Therapie zugänglich sind, sei es aus internistischen Gründen oder aufgrund eines fortgeschrittenen Tumorstadiums. Auch diese Patienten können potentiell geheilt werden (Heilmann 1976). Variationen der Strahlenreaktion beruhen auf der Erkenntnis, daß die Strahlensensitivität vom Zellteilungzyklus abhängig ist (Hellman 1989). Die Mitosephase hat sich als strahlensensibelste Phase herausgestellt, gefolgt von der G2Phase. Im Laufe der G1- Phase entwickelt sich eine zunehmende Resistenz, die ihr Maximum in der späten S- Phase erreicht. Eine Fraktionierung der Therapie, d. h. eine Aufteilung der Gesamtdosis in mehrere einzelne, scheint eine sinnvolle Konsequenz zu sein, da so eher die Abtötung einer größeren Anzahl von Tumorzellen gewährleistet ist, befindet sich doch eine Zellpopulation in ganz unterschiedlichen Phasen des Zellzyklusses (Scherer u. Sack 1989; Hellman 1989). Ferner ist eine Synchronisation der Tumorzellen versucht worden, um dann in einer strahlenempfindlichen Zyklusphase die Bestrahlung vorzunehmen. Jedoch sind die Resultate der Synchronisierung nur mäßig. Schwierig gestaltet es sich auch, den richtigen Zeitpunkt für die zweite Strahlendosis zu finden (Scherer u. Sack 1989; Hellman 1989). 19 Änderungen der Strahlenempfindlichkeit konnten auch nach Applikation einer Strahlendosis beobachtet werden. Es überleben strahlenresistente Zellen, die sich weiter vermehren und den Tumor selbst und ein mögliches späteres Lokalrezidiv resistenter werden lassen (Scherer u. Sack 1989). Intrazelluläre Reparationsvorgänge, Einschleusung überlebender Zellen in den Zellzyklus sowie Änderungen der Sauerstoffkonzentration verursachen ebenfalls eine veränderte Strahlensensibilität (Fowler et al. 1971). Unter dem Phänomen der Reoxygenierung erfahren hypoxische Zellen unmittelbar nach Strahleneinwirkung eine verbesserte Versorgung mit Sauerstoff (Thomlinson 1968). Gewöhnlich sind Zellen unter hypoxischen Bedingungen resistenter gegen Bestrahlung als solche die einer besseren Durchblutung unterliegen. Durch die Reoxygenierung erhöht sich die Chance, bei fraktionierter Therapie eine größere Anzahl von Tumorzellen vernichten zu können. Effektiver ist die Schädigung der Tumorperipherie als die des Zentrums, da in der Peripherie die größte Mitosetätigkeit vorliegt und sie Abgangsstelle von Tumorembolien ist (Zuppinger 1971). Gegenstand der Forschung zur Wirkungssteigerung der Strahlentherapie sind vor allem Untersuchungen mit hyperbarem Sauerstoff, schnellen Neutronen, Hyperthermie und Substanzen, die spezifisch hypoxische Zellen sensibilisieren können (Scherer u. Sack 1989). Nitroimidazolderivate sind in der Lage, den Sauerstoffeffekt im Tumorgewebe nachzuahmen (Hellman 1989). Untersucht werden auch verschiedene Rhythmen der Fraktionierung (Wannenmacher 1987; Hazuka u. Bunn 1992). Keine der Methoden hat sich jedoch bislang als die Methode der Wahl herauskristallisiert. Bei Komplikationen durch fortgeschrittenes Tumorwachstum und zur Behandlung von Skelett- und ZNS- Metastasen findet die Strahlentherapie palliative Anwendung wie auch zur prophylaktischen Bestrahlung des ZNS zur Vermeidung von zerebralen Mikrometastasen (Kimmig et al. 1991). 1.5.1.3. Chemotherapie Der Nutzen der Chemotherapie bei der Behandlung der Lungentumoren wird kontrovers diskutiert. Während sie sich bei kleinzelligen Lungentumoren als die Therapie der Wahl bewährt hat, übt sie bei fortgeschrittenen nicht- kleinzelligen Tumoren in der Regel nur 20 palliativen Charakter aus. Eine neue Rolle kommt ihr in neueren multimodalen Therapieansätzen zu. Mit Hilfe der Chemotherapie gilt es, Fernmetastasierungen zu verhindern, da sie systemisch angreifen kann und so bereits disseminierte Tumorzellen bekämpft werden können. Die Verwendung mehrerer Chemotherapeutika hat sich gegenüber der Monotherapie allgemeinhin durchgesetzt (Drings 1990). Das Auftreten von Resistenzen gegenüber den Chemotherapeutika bringt erhebliche Probleme bei der Behandlung von Rezidiven mit sich (Osieka u. Makoski 1976; De Vita 1989). Die Wirkungsmechanismen der Zytostatika weisen ein großes Spektrum auf. Sie greifen in die Synthese der DNA (alkylierende Substanzen, Antibiotika), der RNA (Antimetabolite) und in den Mitosespindelapparat (Vincaalkaloide) ein und beeinflußen den Zellzyklus demnach in ganz unterschiedlichen Phasen (Chabner u. Myers 1989). Die genannten Chemotherapeutika entfalten ihre Wirkung nur bei proliferierenden Zellen. Unabhängig von bestimmten Zyklusphasen und Proliferation reagieren z. B. Asparaginase und Stickstofflost (Müller 1975). Durch die Southwest Oncology Group (SWOG) wurden einheitliche Kriterien zur Beurteilung des klinischen Stadiums der Remission festgelegt. Demnach handelt es sich um eine komplette Remission (CR), wenn alle meßbaren Tumorparameter über mindestens vier Wochen verschwinden. Eine partielle Remission (PR) bedeutet eine Reduktion aller meßbaren Tumorparameter oder mehr über mindestens vier Wochen. Wenn eine weniger als 50 %ige Reduktion oder eine weniger als 25 %ige Vergrößerung der meßbaren Tumorparameter vorliegt, so ist von einer stabilen Erkrankung auszugehen (NC), von einer progressiven Erkrankung dagegen bei Vergrößerung der meßbaren Tumorparameter um mindestens 25 % (Green et al. 1992). Erhebliche Nebenwirkungen, wie Myelo- und Nephrotoxizität, Übelkeit und Erbrechen erschweren die Durchführbarkeit einer Chemotherapie. 1.5.1.4. Multimodale Behandlungskonzepte Die niedrigen Langzeitüberlebensraten nach alleiniger chirurgischer und strahlentherapeutischer Behandlung rechtfertigen die Entwicklung von kombinierten Therapieformen. 21 Man unterscheidet zwischen präoperativer, auch neoadjuvant genannter und postoperativer, adjuvanter Therapie. Folgende Überlegungen befürworten die Tumorbehandlung vor einem chirurgischen Eingriff: Durch Bestrahlung kann einerseits eine Verkleinerung des Tumorvolumens erreicht werden, zum anderen ist eine Verbesserung der Operabilität möglich. Außerdem soll die intraoperative Ausschwemmung vitaler Tumorzellen vermieden werden (Kimmig et al. 1991). Die gleichen Ziele werden mit der Chemotherapie verbunden. Zusätzlich ist sie in der Lage, das Auftreten von Metastasen zu verhindern, zumindest aber zu reduzieren, was für die Gesamtprognose von entscheidender Bedeutung ist. Einige Zytostatika wie Vindesin und Cisplatin zeichnen sich durch ihre strahlensensibilisierende Wirkung aus (Scherer u. Sack 1989). Postoperative Bestrahlung erfolgt beim prä- oder intraoperativen Nachweis mediastinaler Lymphknotenmetastasen oder nach unvollständiger Resektion (R1; R2) (Kimmig et al. 1991). Die Möglichkeit zur Zerstörung des Resttumors und eine bessere lokale Kontrolle begründen diese Therapiemaßnahme. Während der Operation ausgeschwemmte Tumorzellen hofft man mit Hilfe adjuvanter Chemotherapie angehen zu können. Nachteile präoperativer Strahlentherapie stellen erschwerte Operationsbedingungen dar, die durch Strahlenreaktionen des Gewebes bedingt sind. Nicht bei jedem Patienten kann eine Anwendung aller drei Modalitäten in Betracht gezogen werden. Unterschiedliche Kombinationen sollen dem einzelnen Patienten die beste Chance auf Heilung seines Tumorleidens gewährleisten. 1.5.2. Behandlung der Lungentumoren 1.5.2.1. Kleinzellige Lungentumoren Ein besonders aggressives Wachstum, das in einer kurzen Tumorverdopplungzeit und frühzeitiger hämatogener Metastasierung zum Ausdruck kommt, kennzeichnet diesen Tumortyp (Vogt- Moykopf et al. 1991). 22 Aufgrund der häufig bereits erfolgten Metastasierung wird in erster Linie eine chemoterapeutische Behandlung in Erwägung gezogen. Kleinzellige Lungentumoren sind sensibler für Chemo- und Strahlentherapie als andere Lungentumoren. Entscheidend ist bei der systemischen Therapie die Verwendung von potentiell wirksamen Zytostatika. Hohe Ansprechraten, die sich im Rahmen von 20- 50 % bewegen, versprechen z.B. Ifosfamid, Vincristin, Etoposid, Cyclophosphamid, Methotrexat, Adriamycin und Cisplatin (Niederle 1985). In Kombination gegeben bringen sie bessere Ergebnisse als nach einzelner Gabe. Remissionen sind bei 70- 80 % der Patienten zu verzeichnen, wobei der Anteil der kompletten Remissionen zwischen 30 und 50 % liegt (Osieka u. Makoski 1976; Drings 1990). Je nach Autor werden nach alleiniger Chemotherapie Lokalrezidive in einer Größenordnung von 40- 80 % beobachtet, die durch Kombination mit einer Strahlentherapie vermindert werden können (Choi u. Carey 1976; Alberti 1985; Minna et al. 1989; Kimmig et al. 1991). Da eine Dosis- Wirkungsabhängigkeit besteht, nach der höhere Strahlendosen niedrigere Lokalrezidivraten hervorbringen, wird eine Strahlendosis von mindestens 40 Gy appliziert (Heilmann 1976; Alberti 1985). Eine strahlenbedingte Tumorregression ist dann bei über 80 % der Patienten möglich (Choi u. Carey 1976). Mit weniger als 30 % ist die lokale Rezidivrate deutlich gesunken (Drings 1990). Erhöhte Remissions- und niedrigere Rezidivraten wirken sich auf die Überlebenszeit aus (Lichter u. Ihde 1988). Im limited disease beträgt die mediane Überlebenszeit durchschnittlich 12- 15 Monate (Aisner 1988; Drings 1990). Im Kontrast dazu stehen Überlebenszeiten zwischen 24- 46 Monaten, von denen bei Minna die Rede ist (Minna et al. 1989). Etwas unterschiedlich werden die Raten angegeben, nach denen die Patienten zwei Jahre krankheitsfrei überleben. Bei Aisner sind es 20- 25 %, bei Lichter und Ihde 10- 15 % und bei Drings lediglich 5- 10 % (Aisner 1988; Lichter u. Ihde 1988; Drings 1990). 7 % bestätigten 1991 auch Havemann und Wolf. Bei Vorliegen eines Lungentumores im extensive disease wird ebenfalls eine Chemotherapie durchgeführt. Es gelingt, ungefähr 20 % der Patienten in Vollremission zu bringen (Alberti 1985; Lichter u. Ihde 1988). Daran schließt sich eine Bestrahlung des Primärtumors an. Doch treten im weiteren Verlauf lokale Rezidive und Fernmetastasen auf, so daß insgesamt keine signifikante Verlängerung der Überlebenszeit zu verzeichnen ist. Konnte keine Vollremission erreicht werden, erfolgt eine individuelle Therapie nur noch mit palliativer Intention und 23 weniger aggressiv (Alberti 1985; Richter u. Ihde 1988; Sauer u. Wilmanns 1991). Sechs bis neun Monate mittlere Überlebenszeit und eine 2- Jahres- Überlebenszeit von 1- 5 % unterstreichen die noch schlechtere Prognose dieses Patientenkollektivs (Aisner 1988; Havemann u. Wolf 1991; Drings 1991). Eine Schädelbestrahlung kann einerseits zur Prophylaxe, andererseits zur Behandlung zerebraler Metastasen indiziert sein. Da die meisten Zytostatika nicht liquorgängig sind, entgehen dort zirkulierende Tumorzellen oder bereits bestehende Mikrometastasen der systemischen Chemotherapie. Die Metastasierungsfrequenz in das ZNS konnte auf diese Weise von 25- 30 % auf 5- 8 % gesenkt werden (Scherer u. Sack 1989). Als Parameter zur Verlaufskontrolle dienen auch verschiedene Tumormarker, die zum Teil von den Tumoren selbst produziert werden. Trotz aller therapeutischen Versuche ist es bislang nicht gelungen, die Gesamtüberlebenszeit zu verlängern. Immer noch leben weniger als 10 % aller Patienten mit der Diagnose eines kleinzelligen Karzinoms nach 5 Jahren (Drings 1990). 1.5.2.2. Nicht- kleinzellige Lungentumoren Die heterogene Gruppe der nicht- kleinzelligen Lungentumoren, die mit 75 % den Hauptanteil der Lungentumoren darstellen, erfordert eine andere Therapiestrategie verglichen mit der der kleinzelligen. Im Vordergrund steht im Stadium I und II die operative Resektion des Primärtumors. Zwischen 17 und 46 % der Patienten können dadurch fünf Jahre und länger überleben (Sauer u. Wilmanns 1991; Drings 1991). Über die Hälfte der operierten Patienten sterben innerhalb eines Zeitraumes von zwei Jahren an der progredienten Erkrankung, sei es durch Metastasierung oder durch Rezidivierung. Die häufigen lokalen Rezidive haben zu der Überlegung geführt, daß mit Hilfe der Bestrahlung das Problem der lokalen Kontrolle beherrschbar werden könnte. Ein Überlebensvorteil dieser Patientengruppe scheint sich abzuzeichnen (Fitzgerald u. Greenberger 1988). Indiziert ist eine postoperative Bestrahlung auf jeden Fall beim Nachweis eines Lymphknotenbefalls (Scherer u. Sack 1989). 21 % beträgt die 5- Jahres- Überlebensrate der wegen inkompletter Resektion Lymphknotenmetastasen bestrahlten Patienten im Stadium I oder II (Kimmig et al. 1991). 24 oder Auf das Gesamtkollektiv bezogen liegt diese Rate bei den chirurgisch/ strahlentherapeutisch behandelten Patienten bei ungefähr 10 % (Joss u. Brunner 1985). Aber nur für lediglich 25 % der Patienten kommt überhaupt eine Operation in Betracht. Der überwiegende Teil der Patienten ist aufgrund lokaler Tumorausdehnung oder aus internistischen Gründen nicht operabel. Mit der Strahlentherapie wird auch bei diesem Patientenkollektiv eine kurative Intention verfolgt. Auch wenn insgesamt bei der Patientengruppe mit primärer Strahlentherapie die 5Jahres- Überlebenrate bei nur 6 % liegt, lassen sich doch für bestimmte Patientenkollektive bessere Resultate erzielen (Minna et al. 1989, Kimmig et al. 1991). Außerdem berichtet Warram, daß es gelungen ist, 36 % der primär inoperablen Patienten durch Tumorverkleinerung in einen resektionsfähigen Zustand zu bringen (Warram 1975). Sherman berichtet sogar von 72 % (Sherman et al. 1978). Dieser hohe Prozentsatz konnte von Martini bestätigt werden (Martini et al. 1988). Lokale Tumorkontrolle und Überlebensrate sind wie auch bei den kleinzelligen Lungentumoren dosisabhängig (Würschmidt et al. 1994). Selbige Autoren fordern eine Gesamtdosis von 70 Gy, wenn mit der Bestrahlung eine kurative Absicht verbunden sein soll. Dies stimmt mit den Angaben anderer Autoren in etwa überein (Perez et al.1982; Heilmann 1985; Scherer u. Sack 1989). Die generell geringere Wirksamkeit der Zytostatika bei nicht- kleinzelligen Lungentumoren äußerte sich bislang in einer eher zurückhaltenden Anwendung der Chemotherapie bei diesen Tumoren, auch wenn bei ungefähr 65- 75 % der Patienten im Laufe der Erkrankung Fernmetastasen auftreten. Als die wirksamsten Medikamente in der Monotherapie haben sich Etoposid, Adriamycin, Cisplatin, Mitomycin C, Vindesin und Ifosfamid erwiesen, deren Remissionsraten zwischen 9 und 26 % variieren (Drings 1991). Sehr selten werden komplette Remissionen erreicht und auch die partiellen Remissionen sind mit 2- 4 Monaten nur von kurzer Dauer (Joss u. Brunner 1985). Deshalb ist die Kombination mehrerer Zytostatika vorzuziehen, die 25- 45 % Remissionen hervorrufen können mit einem Anteil von 5- 10 % Vollremissionen (Elliott 1986; Drings 1991, Marino et al. 1995). Für derart behandelte Patienten ist ein lebensverlängernder Effekt erkennbar, jedoch auch umstritten, da ebenso Variationen der prognostischen Faktoren in dem Patientenkollektiv zugrunde liegen könnten als daß wirklich ein Therapieeffekt ursächlich ist (Greco 1986). 25 Die Erfolgsaussichten von Chemo- und Strahlentherapie unterscheiden sich innerhalb der Gruppe der nicht- kleinzelligen Lungentumoren. Laut Muggia verschlechtern sie sich in der Reihenfolge Adeno-, großzelliges und Plattenepithelkarzinom (Muggia 1974). Heilmann hingegen betrachtet das Adenokarzinom aufgrund seiner mäßigen Strahlenempfindlichkeit und der frühen hämatogenen Metastasierung am ungünstigsten für eine Bestrahlung. Bei manchen Plattenepithelkarzinomen muß sogar eine Dosissteigerung auf 80 Gy in Erwägung gezogen werden (Heilmann 1976). Differierende Angaben zu Ansprechraten auf Chemotherapie, 70 % für Adeno-, 88 % für Plattenepithelkarzinome, und zur Operabilität, 35,3 % bei Adeno- und 40,1 % bei Plattenepithelkarzinomen, liegen ebenfalls vor (Folman u. Rosman 1988; Ehler et al. 1954). Neuere Studien, die den Stellenwert der Chemotherapie, gegebenenfalls kombiniert mit einer Strahlentherapie, in adjuvanten und neoadjuvanten Ansätzen prüfen sollen, haben zu einer kontroversen Diskussion geführt. Während einige Autoren einen eindeutigen Vorteil sehen, äußern sich andere eher zurückhaltend (Cormier et al. 1982; Folman u. Rosman 1988; Gralla 1990; Murren et al. 1991; Le Chevalier et al. 1992; Hazuka et al. 1992; Eberhardt et al. 1994). Keinen chemotherapeutisch bedingten Effekt konnten Souhami, Feld sowie Holmes verzeichnen (Souhami 1985; Feld et al. 1993; Holmes 1993). Von nahezu allen soeben genannten Autoren wird resumiert, daß weitere Therapieoptimierungen der bereits bekannten Modalitäten notwendig sind, neue wirksame Medikamente erforscht werden müssen und vor allen Dingen daß die Ergebnisse in randomisierten Studien verifiziert werden müssen. Mittlerweile liegen Ergebnisse einiger Phase- II- Studien zur multimodalen Therapie lokal fortgeschrittener Tumoren der Stadien III A und B vor, bei denen sich eine höhere mediane Überlebenszeit abzeichnet (Martini et al. 1988; Faber et al. 1989; Dillman et al. 1990; Le Chevalier et al. 1991; Murren et al. 1991; Nasr et al. 1992; Schaake- Koning et al. 1992; Rusch et al. 1993; Albain 1993; Shepherd 1993; Rosell et al. 1994; Roth et al. 1994; Elias et al. 1994). Vor allem Patienten mit Tumoren des Stadiums III B scheinen der Ansicht einiger der genannten Autoren nach von der präoperativen Therapie besonders zu profitieren, da höhere Resektionsraten evaluiert werden konnten und auch eine erhöhte Rate histologisch gesicherter kompletter Remissionen im Resektat (Rusch et al. 1993). 26 Allerdings ließ sich nicht in allen Studien ein Überlebensbenefit nachweisen (NiitamoKorhonen et al. 1989, Weiden et al. 1991). Einige Autoren betonten, daß das multimodale Therapieschema von den Patienten gut vertragen wurde (Yashar et al. 1992; Rusch et al. 1993; Bonomi et al. 1994). Murren betont weiterhin, daß ein direkter Vergleich der Studien aus verschiedenen Gründen schwierig sei. Dazu führen heterogene, hoch selektierte Patientengruppen sowie die umstrittene Rolle der Mediastinoskopie beim Staging und Probleme im Studiendesign (Murren et al. 1991). 1.5.3. Therapiebedingte Gewebsveränderungen 1.5.3.1. Veränderungen der Lunge Strahlenbedingte Reaktionen des normalen Lungengewebes bleiben bei den hohen Dosen, die zur Tumorvernichtung notwendig sind, nicht aus. Schon ab einer Dosis von 20- 25 Gy beginnen die ersten Veränderungen. Häufigkeit und Ausmaß zeigen eine Abhängigkeit von der Gesamtdosis, dem Fraktionierungsschema und von dem Volumen, das bestrahlt wird. Muß eine gesamte Lungenhälfte bestrahlt werden, liegt die Toleranzschwelle bei ungefähr 15 Gy (Kimmig et al. 1991). Bereits wenige Stunden nach Strahleneinwirkung schwindet das lymphatische Gewebe und ist damit Kennzeichen des Frühstadiums nach einer Einteilung von Engelstad (Engelstad 1934). Später setzt eine kapilläre Hyperämie ein und durch Schädigung des Alveolarepithels und Kapillarendothels, nach Warren und Spencer die am frühesten auftretenden Veränderungen, wird eine Permeabilitätsstörung hervorgerufen (Warren u. Gates 1940; Warren u. Spencer 1940; Holsten 1963). Mit dem sich daraus entwickelnden Ödem im Interstitium und in den Alveolarräumen ist das Hauptstadium erreicht (Henzi 1956; Jennig u. Arden 1961). Bis zu diesem Stadium dauert es je nach Strahlendosis wenige Tage bis Wochen. Das ödematöse Gewebe, in das auch Erythrozyten eingewandert sind, verursacht einen erhöhten Gewebedruck und die zusätzliche Verquellung des Endothels verschlechtert die Blutversorgung weiterhin in diesem Gebiet. Lymphozyten, Leukozyten und Plasmazellen sind in der Alveolarwand aufzufinden, an die sich dünne Fibrinmembranen anlagern (Warren u. 27 Gates 1940; Jenning u. Arden 1961; Holsten 1963). Außerdem können Alveolarzelldesquamationen, kleine Atelektasen und emphysematöse Bezirke beobachtet werden (Warren u. Gates 1940). Im Gegensatz zu Cottier, der die Pathogenese der Atelektasen auf eine Gewebsverquellung und Kompression durch Exsudat und benachbartes Gewebe zurückführt, hält Awwad einen Surfactantmangel für ursächlich. Dieser beruhe darauf, daß vor allem Pneumozyten des Typ II, die für die Surfactantproduktion verantwortlich sind, neben den Kapillarendothelzellen Zielzellen der strahlenbedingten Schäden seien (Cottier 1956; Awwad 1990). Nach Schwellung und Hypertrophie des Alveolarepithels werden im folgenden hyaline Membranen beschrieben (Warren u. Gates 1940; Warren u. Spencer 1940; Henzi 1956; Cottier 1956; Stone et al. 1956). Peribronchial und perivaskulär erweitern sich die Lymphgefäße (Cottier 1956). Konsequenz dieser Veränderungen ist die Reduktion des alveolären Luftraumes (Phillips u. Margolis 1972). Hypoxische und damit strahlenresistentere Areale sind die Folge. Dies kann aber durch die allgemein höhere Strahlenabsorption in dichterem Gewebe wieder ausgeglichen sein. Auffallend mehr Schleim produzieren die Becherzellen des Bronchialepithels, das Epithelatypien aufweist und auch Zilien verliert (Voegt 1938; Warren u. Gates 1940; Stone et al. 1956; Arndt 1973). Es resultiert das Vollbild der strahlenbedingten Pneumonitis. Nur nach Applikation mittlerer Strahlendosen ist eine Regeneration der Gewebeschäden möglich (Engelstad 1934). Ansonsten nehmen die Veränderungen ihren Lauf bis hin zum Stadium der Lungenfibrose. Während Hyperämie und Alveolarreaktion nach ungefähr 20 Wochen allmählich abklingen, nimmt die Bindegewebsproliferation, in deren Zusammenhang vermehrt Kollagen abgelagert wird, im Interstitium zu. Warren und Spencer konnten Fibroblasten identifizieren (Warren u. Spencer 1940). Eine Vermehrung und Aufsplitterung der elastischen Fasern konnte von mehreren Autoren bestätigt werden (Karlin u. Mogilnitzki 1932; Voegt 1938; Warren u. Gates 1940; Cottier 1956; Deeley 1960). 28 Auch in der Pleura finden Veränderungen statt, die sich zum einen in einer Verdickung, zum anderen in einer Exsudatbildung äußern (Karlin u. Mogilnitzki 1932; Stone et al. 1956; Deeley 1960). Bis zur Entwicklung des fibrotischen Endstadiums vergehen in der Regel acht Monate (Kimmig et al. 1991). Jedoch werden nicht nur nach Strahleneinwirkung charakteristische Veränderungen beschrieben, auch die Behandlung mit zytostatischen Substanzen stellt für das Gewebe eine schädigende Noxe dar. So wurden erstmals bereits 1961 Schäden des Lungengewebes nach Verabreichung von Busulfan beschrieben (Oliner et al. 1961). Weitere Beobachtungen folgten für andere Chemotherapeutika wie Cyclophophamid, Methotrexat und Bleomycin (Andre et al. 1967, Acute Leukamia Group B 1969, Ichikawa et al. 1969). Zunächst gingen sie unter den Bezeichnungen “Busulfan“- bzw. “Bleomycin“- Lunge in die Literatur ein (Burkhardt et al. 1977, Koch u. Lesch 1976). Da es sich um identische Schädigungsmuster handelt, wurde später die allgemeinere Bezeichnung “Zytostatika- Pneumopathie“ gewählt (Flubacher et al. 1977 ). Unter diesem Begriff werden folgende Veränderungen zusammengefaßt: zum einen liegt eine schwere Schädigung des Alveolarepithels mit Zellatypien und begleitendem intraalveolärem Ödem mit Fibrinexsudation und hyalinen Membranen vor, zum anderen kann eine interstitielle Fibrose nachgewiesen werden (Flubacher et al. 1977). Durch elektronenmikroskopische Untersuchungen ist es gelungen, den Ablauf des Schädigungsprozesses besser nachvollzihen zu können. Im Vordergrund steht zunächst die Schädigung der membranösen Pneumozyten (Typ I) und die Hyperplasie der granulierten Pneumozyten (Typ II). Es resultiert eine gestörte Surfactant- Bildung und ein intraalveoläres Ödem (Pariente et al. 1972; Aso et al. 1975, Daskal et al. 1976; Burkhardt et al. 1977). Kayser konnte eine Schädigungsrate zwischen 5- und 40 % belegen und fand am häufigsten interstitielle Fibrosen und chronische interstitielle Pneumonitiden (Kayser et al. 1994 ). 1.5.3.2. Veränderungen der Gefäße Das Gefäßsystem hat sich als sehr strahlensensibel erwiesen (Reinhold 1972). Alle Wandanteile sind involviert und zeigen Veränderungen, die zum Teil auch bei anderen 29 Erkrankungen beobachtet werden oder altersbedingte Veränderungen darstellen. Im Zusammenhang mit der Entstehung der strahlenbedingten Pneumonitis spielen Gefäßveränderungen eine bedeutende Rolle. Die Wirkung der ionisierenden Strahlen äußert sich zunächst in einer Schädigung des Kapillarendothels. Kleinere und größere Gefäße fallen durch eine Verquellung der gesamten Wand auf (Warren u. Gates 1940; Cottier 1956). Sowohl Zellkerne und Zytoplasma als auch glatte Muskelzellen sind betroffen, es kommt zu einer Vakuolisierung (White 1972; Arndt 1974). Das Endothel beginnt zu wuchern, im späteren Verlauf ist außerdem eine Hyalinisierung zu beobachten (Warren u. Spencer 1940; Henzi 1956; Stone et al. 1956; Sweany et al. 1959). Die verdickten Laminae elasticae erfahren zusätzlich eine Aufsplitterung ihrer elastischen Fasern (Karlin u. Mogilnitzki 1932; Engelstad 1934; Voegt 1938; Warren u. Gates 1940; Cottier 1956; Deeley 1960; Holsten 1963). Bei Einwirkung hoher Strahlendosen können sich fibrinoide Nekrosen entwickeln (White 1972). Folge der genannten Veränderungen ist die Zerstörung der Blut- Gewebsschranke. Damit verbunden ist eine Permeabilitätsstörung (Reinhold 1972). Mit übertretendem Blut und Plasma gelangen auch Entzündungszellen in die Gefäßumgebung, ein perivaskuläres Ödem entsteht und übt externen Druck auf die Gefäße aus. Die Kapazität des Stromas ist nun entscheidend bei der Absorption der Flüssigkeiten und Zellen. Durch die Kompression der Gefäße von außen und durch eine Verengung der Gefäße aufgrund einer ausgeprägten Intimaschwellung resultiert eine lokale Ischämie des Gewebes (Warren 1942 und 1943; Rubin u. Casarett 1942 und 1943; White 1972). Die Permeabilitätsstörung und die Hyperämie im Anfangsstadium der Lungenveränderungen korrelieren gut mit der Beobachtung einer erhöhten Blutungsneigung (Engelstad 1934; Warren u. Gates 1940; Jenning u. Arden 1961). Nach fraktionierter Bestrahlung nehmen die Gefäßschäden ein geringeres Ausmaß an als nach einer Einzeldosis- Bestrahlung (Mattson u. Peterson 1978). Arteriosklerose und höheres Lebensalter scheinen einen begünstigenden Einfluß auf die Entstehung der strahlenbedingten Lungenschäden zu haben (McIntosh 1934; Borgström u. Gynning 1957). 30 Gefäßveränderungen werden ebenfalls nach Gabe von Zytostatika beschrieben. Aufgrund der Dosisabhängigkeit ist von einer direkten Toxizität einiger Chemotherapeutika auszugehen, was sich als akute oder chronische Pneumonitis zeigt. Als Korrelat hierzu zeigt sich eine Störung der vaskulären Strombahn mit hyalinen Thromben (Kayser 1992). Auch Angiitiden kommen bis zu einem Prozentsatz von 43 % vor (Kayser et al. 1994). Im Rahmen der Entstehung der “Zytostatika- Pneumopathie“ ist die Beteiligung von Gefäßveränderungen ein weiterer wichtiger Faktor. Neben intraalveolären Schäden entsteht ein Endothelschaden, der einerseits zur Mikrothrombosierung und andererseits zu einem interstitiellem Ödem führt (Flubacher et al 1977). 31 2. FRAGESTELLUNG Intakte Gefäße stellen wie erwähnt nicht nur eine notwendige Voraussetzung für die regelrechten Abläufe der Lungenfunktion dar, sondern auch für die Versorgung von Lungentumoren. Daß bereits in unbehandelten Lungentumoren gravierende pathologische Gefäßveränderungen zutage treten, wurde eingangs dargelegt. Bislang fehlen allerdings in der Literatur Angaben über Häufigkeit und Ausmaß von Pulmonalarterienveränderungen, welche in Lungentumoren nach Durchführung einer neoadjuvanten Therapie zu finden sind. Zunächst gilt es deshalb herauszufinden, ob sich überhaupt nach erfolgter präoperativer Therapie Gefäßveränderungen bei nicht- kleinzelligen Lungentumoren nachweisen lassen. Da bereits aufgrund der Gefäßbeschreibungen nicht- behandelter Tumoren kein regelrechtes Gefäßsystem zu erwarten ist, bleibt zu untersuchen, in welchem Ausmaß ihr Auftreten vorliegt. Auch ergibt sich die Frage, ob sich Unterschiede zwischen den verschiedenen Typen nichtkleinzelliger Lungentumoren beziehungsweise zwischen unterschiedlich großen Gefäßen aufzeigen lassen. Ein weiterer Schwerpunkt bei der Untersuchung der Gefäßstrukturanomalien stellt eine Beziehung zwischen Therapieeinwirkung und Gefäßveränderungen her. Aus diesem Grund werden die Gefäßveränderungen in Abhängigkeit vom Regressionsgrad analysiert, da nur eine Aufschlüsselung nach Regressionskriterien, die keine Gefäßveränderungen, sondern Tumorund Lungengewebsveränderungen beinhalten, auch eine Beurteilung nach therapieinduzierter Wirkung bei Gefäßen zuläßt. Ob sich lediglich die Ursachen, die zu den entsprechenden Lumeneinengungen bzw. Lumenverschlüssen geführt haben, eruieren lassen, oder ob vor allem bei Pulmonalarterien mit verbleibendem Restlumen weitere Beobachtungen abhängig von dem unterschiedlich großen Restlumen gemacht werden können, soll bei der Gefäßveränderungen nach verbleibendem Restlumen deutlich werden. 32 Aufschlüsselung der Besonderes Interesse gilt der Fragestellung, in welcher Häufigkeit die Gefäßveränderungen bei Pulmonalarterien präoperativ behandelter Lungentumoren im Vergleich mit den Ergebnissen von Pulmonalarterien unbehandelter Lungentumoren auftreten. In diesem Zusammenhang ist es von grundlegender Bedeutung, ob sich von den bislang beschriebenen Gefäßveränderungen abweichende Reaktionsmuster finden lassen, welche spezifisch der präoperativen Therapie zuzuordnen sind, oder ob gleichartige Gefäßveränderungen vorliegen, die sich möglicherweise bezüglich ihrer Häufigkeit und ihrer Ausprägung von den bisherigen Untersuchungsergebnissen unterscheiden. Stellung genommen wird abschließend auch zu der Frage, ob derart veränderte Gefäße überhaupt ihrer eigentlichen Funktion gerecht werden können und welche Auswirkungen sich aufgrund der Pulmonalarterienveränderungen sowohl für die Lunge generell als auch für den Lungentumor selbst ergeben. 33 3. MATERIAL UND METHODEN Im Rahmen einer Phase II- Studie wurden insgesamt 54 Patienten mit der Diagnose eines nicht- kleinzelligen Lungentumores einer multimodalen Behandlung zugeführt. Voraussetzungen zur Teilnahme an der Studie waren folgende Kriterien: • histologisch gesicherter nicht- kleinzelliger Lungentumor im • Stadium III A oder III B • funktionelle Operabilität • guter Allgemeinzustand (nach Karnofsky mindestens 70 %) • Alter des Patienten maximal 65 Jahre • ausreichende Leber- und Nierenfunktion • ausreichende Knochenmarksreserve • vorliegende Patienteneinwilligung Ausgeschlossen wurden Patienten mit vorheriger Strahlen- oder Chemotherapie bzw. Resektion des Primärtumors, ebenso bei gleichzeitig bestehender maligner Zweiterkrankung oder manifester Infektion vor Therapiebeginn. Das Therapieschema sah zunächst zwei Blöcke einer Kombinationschemotherapie mit den Substanzen Ifosfamid, Carboplatin und Etoposid (ICE- Schema) vor. Daran anschließend erfolgte die Radiotherapie in Form einer hyperfraktionierten, akzelerierten Bestrahlung. Insgesamt wurden 45 Gy appliziert und zwar an 5 Tagen in der Woche täglich zweimal 1,5 Gy. An den Tagen 1, 8 und 15 wurde zusätzlich der 3. Block der Chemotherapie bestehend aus der Kombination Carboplatin und Vindesin verabreicht. 7 Wochen nach Abschluß der simultanen Radio-/ Chemotherapie wurde bei operablen Patienten die radikale Operation durchgeführt. Bei nicht operablen Patienten erfolgte eine Aufsättigung der Gesamtstrahlendosis auf 68,4 Gy. 54 Patienten wurden insgesamt in die Studie aufgenommen, deren Durchschnittsalter beträgt 56,9 Jahre. Bei 25 Patienten liegt ein Stadium III A, bei 29 Patienten ein Stadium III B vor. 37 Mal konnte die histologisch gesicherte Diagnose eines Plattenepithelkarzinoms gestellt werden, 17 Mal die eines Adenokarzinoms. Im Anschluß an die kombinierte Radio- und 34 Chemotherapie erfolgte bei 40 Patienten die Operation. Die Operabilitätsrate liegt damit bei 74,1 %. In 34 Fällen, das sind 85 %, war eine komplette Resektion ( R0) möglich, eine R1- Resektion bei 4 Patienten und in zwei Fällen war makroskopisch noch Residualtumor zu erkennen ( = R2). Das Operationsmaterial gelangte zur Referenzbegutachtung in das Institut für Pathologie an den Berufsgenossenschaftlichen Krankenanstalten "Bergmannsheil" Bochum. Das Material war in Formalin fixiert und Anteile mit Tumorgewebe oder regressiv verändertem Gewebe wurden nach makroskopischer Begutachtung in Paraffin eingebettet und stufenweise aufgearbeitet. Durch den Pathologen fand zunächst an 5µm dicken Schnitten in der Hämatoxylin- Eosin- Färbung (H.E.) und der Elastica- van- Gieson- Färbung (EVG) eine Begutachtung hinsichtlich des Ausmaßes der therapieinduzierten Tumorregression ( = Regressionsgrading) statt. Folgende Einteilung kam hierbei zur Anwendung: Regressionsgrad I: keine oder nur geringe Tumorregression, Regressionsgrad II: morphologische Zeichen einer therapieinduzierten Tumorregression mit II a: mindestens 10 % vitalem Tumorgewebe und II b: weniger als 10 % vitalem Tumorgewebe und Regressionsgrad III: komplette Tumorregression ohne vitales Tumorgewebe (Junker et al. 1997). Bei drei Patienten lag ein Regressionsgrad I vor, bei 10 Patienten ein Stadium II a, bei 20 Patienten ein Regressionsgrad II b und bei sieben Patienten ein Regressionsgrad III. Da Gefäßveränderungen in Lungentumoren beurteilt werden sollen, wurden Patienten mit einem Regressionsgrad III (kein vitales Tumorgewebe) von der Untersuchung ausgeschlossen. Bei insgesamt 33 Fällen wurde schließlich die Beurteilung der Gefäßveränderungen vorgenommen. Die Verteilung der einzelnen Tumortypen sieht folgendermaßen aus: 25 Plattenepithelkarzinome: 2 Fälle im Regressionsgrad I 8 Adenokarzinome: ( 8,0 %) 6 Fälle im Regressionsgrad II a ( 24,0 %) 17 Fälle im Regressionsgrad II b ( 68,0 %) 1 Fall im Regressionsgrad I ( 12,5 %) 4 Fälle im Regressionsgrad II a ( 50,0 %) 35 3 Fälle im Regressionsgrad II b ( 37,5 %) Beim Staging zu Beginn der Studie wurden 17 Fälle, davon 15 Plattenepithelkarzinome und 2 Adenokarzinome, bei einem Tumorstadium III A eingruppiert, 16 hingegen wurden als III BTumoren eingestuft. 10 von ihnen waren Plattenepithelkarzinome und 6 Adenokarzinome. In die Auswertung gingen Gefäße ab einem inneren Durchmesser von 90 µm ein, gemessen am äußeren Rand der Membrana elastica interna. Nur orthograd getroffene Gefäße fanden Berücksichtigung. Um sicher zu gehen, daß es sich bei den untersuchten Gefäßen um Pulmonalarterien handelt und nicht um Pulmonalvenen oder neu gebildete Gefäße des Tumors, wurden zwei Kriterien festgelegt, die eine Verwechslung ausschließen sollen. Als erstes muß die unmittelbare Lage in der Nachbarschaft eines Bronchus oder Bronchiolus gewährleistet sein, zum zweiten sollen beide elastische Membranen deutlich ausgeprägt sein. Folgende Gefäßveränderungen kamen zur Auswertung: • Infiltration der Gefäßwand durch Entzündungszellen • Infiltration der Gefäßwand durch Tumorzellen • Intimaproliferation • Kompression der Gefäßwand • Aufsplitterung der Membrana elastica interna • Elastose • Stenosierung des Gefäßlumens • Obliteration des Gefäßlumens • Destruktion der Gefäßwand Mehrere Veränderungen können gleichzeitig zu einer Verengung des Lumens beitragen. Da das ursprüngliche Gefäßlumen oftmals nicht zu bestimmen war, erfolgte eine semiquantitative Abschätzung des Restlumens in vier Graden: ein Restlumen von 0 %, ein Restlumen weniger als 30 % bzw. zwischen 31 und 60 %, sowie Gefäße, deren Restlumen 61 % und darüber betrug. Insgesamt wurden 666 Gefäße ausgewertet, das sind durchschnittlich 20 Gefäße pro Tumor. Zur Beurteilung der Frage, ob sich in Abhängigkeit von der Gefäßgröße Unterschiede in der Häufigkeit der Gefäßveränderungen nachweisen lassen, wurden die Gefäße zunächst in zwei 36 Größengruppen einander gegenüber gestellt. In der einen Gruppe befinden sich Pulmonalarterien mit einem Durchmesser zwischen 90 und 300 µm, in der anderen Gefäße mit einem Durchmesser, der größer ist als 301 µm. Die Größeneinteilung fand auch Berücksichtigung bei der Untersuchung von Abhängigkeiten in bezug auf Regressionsgrad und Restlumen. Hierbei wurde jeweils auf Veränderungen zwischen Adeno- und Plattenepithelkarzinomen und zusätzlich zwischen kleinen und großen Gefäßen geachtet. Die im Ergebnisteil verwendeten Abbildungen sind mit folgenden Angaben in den Legenden versehen: prägnante Beschreibung der Gefäßveränderungen im Wortlaut, wobei zu beachten ist, daß es sich bei allen Abbildungen um Ausschnitte behandelter Lungentumoren handelt. In Klammern werden weiterhin aufgeführt: • Identifikationsnummer des Instituts für Pathologie der Berufgenossenschaftlichen Kliniken “Bergmannsheil“ Bochum • primärer histologischer Tumortyp (PEC für Plattenepithelkarzinom bzw. ADC für Adenokarzinom) • Regressionsgrad (RG I, II a bzw. II b) • Geschlecht (m. / w.) • Alter • Färbung (EvG = Elastica- van- Gieson- Färbung) • Vergrößerung 37 4. ERGEBNISSE Bei der histologischen Untersuchung war bei allen Gefäßen eine unterschiedliche Kombination mehrerer Veränderungen festzustellen. Die Häufigkeit, mit der entzündliche und tumoröse Infiltrationen, Intimaproliferation, Aufsplitterung der Membrana elastica interna, Elastose, stenosierende und obliterierende Prozesse sowie Destruktionen auftraten, wird jedoch von Tumorart, Gefäßgröße und Regressionsgrad bestimmt. Nach der Untersuchung der Gefäßveränderungen in der Gesamtheit aller Pulmonalarterien erfolgt die Aufschlüsselung nach histologischen Tumortypen. Desweiteren werden die Veränderungen in Abhängigkeit von Gefäßgröße und Regressionsgrading einzeln dargestellt, da sich hier deutliche Unterschiede in ihrer Ausprägung aufzeigen lassen. Anschließend wird analysiert, in wieweit die Gefäßveränderungen für die verschiedenen Restlumina verantwortlich sind und ob sich bei den Begleitreaktionen wie Entzündung, Aufsplitterung der elastischen Membran und Elastose Gesetzmäßigkeiten bezüglich des Vorkommens in den jeweiligen Kategorien des Restlumens nachweisen lassen. 4.1. Gefäßveränderungen aller untersuchten Pulmonalarterien 4.1.1. Entzündliche Infiltration Als entzündlich infiltriert galt ein Gefäß, sobald sich entweder in der Intima, in der Media oder in der Adventitia Lymphozyten, Granulozyten oder Plasmazellen nachweisen liessen. Hauptsächlich handelte es sich um Lymphozyten, die das entzündliche Infiltrat ausmachten. Selten waren ausschließlich Lymphozyten zu beobachten, in der Regel fand sich eine Kombination mit Plasmazellen oder Granulozyten. Vereinzelte im Lumen zu findende Entzündungszellen wurden nicht in der Auswertung berücksichtigt, da sie normalerweise auch mit dem Blutstrom transportiert werden. Standen die Zellen hingegen in Verbindung mit der Gefäßwand oder waren neben mehreren 38 Entzündungszellen im Lumen auch welche in der Gefäßwand darstellbar, so zählten die betroffenen Gefäße zu denen mit entzündlicher Infiltration. Insgesamt zeigten 407 der 666 Gefäße Zeichen einer entzündlichen Infiltration. Das entspricht 61,1 % (s. Abbildung 19, S. 49). 4.1.2. Tumoröse Infiltration In Analogie zur entzündlichen Infiltration wurde das Vorhandensein mindestens einer Tumorzelle in der Gefäßwand als tumoröse Infiltration bezeichnet. Dies war lediglich bei 18 % aller untersuchten Gefäße bzw. bei 120 Gefäßen der Fall (s. Tab. 1, S.140). Zu beachten ist, daß allein in dreizehn Fällen keine Tumorzellen in der Gefäßwand nachzuweisen waren. Alle entsprachen dem Regressionsstadium II b, zwölf von ihnen waren Plattenepithelkarzinome, eins war ein Adenokarzinom. Abbildung 1 Arterielle Gefäßwand Abbildung 2 mit Tumorzell- Destruiertes, obliteriertes Gefäß mit infiltration in proliferierter Intima, Auf- Infiltration von Tumor- und Ent- splitterung der M. elastica interna und zündungszellen bei einem Pl. Vermehrung der elastischen Fasern. (Wi 1463/94 PEC,RG II b, m.,57 J., (Wi 4084/95 PEC, RG II a, m.,60 J., EvG-Färbung, 67-fach) EvG-Färbung, 126-fach) 39 4.1.3. Intimaproliferation Da therapiebedingte Pulmonalarterienveränderungen beurteilt werden sollen, gelangten konzentrische Intimaproliferationen, - sie gelten als typische Folge strahlenbedingter Gefäßveränderungen, - wie auch exzentrische zur Auswertung. Exzentrisch gelegene Intimaverbreiterungen stellen häufig das Resultat einer Thrombosierung dar, welche auch Tumor- oder Therapiefolge sein kann. Deswegen wurden auch sie berücksichtigt. Der Definition entsprechend fanden sich Intimaproliferationen in 34,5 % der Gefäße (s. Abb. 19), von den 666 untersuchten Pulmonalarterienästen waren dies 230 Gefäße (s. Tab. 1). Abbildung 3 Durch Intimaproliferation stenosiertes arterielles Gefäß mit einem Restlumen zwischen 31- 60 %. (Wi 1984/94 PEC, RG I, m., 43 J., EvG-Färbung, 58-fach) Abbildung 4 Exzentrische Intimaprolifer- ation eines arteriellen Gefäßes mit begleitender entzündlicher Infiltration. (Wi 1983/94 PEC, RG II b, m.,65 J., EvG-Färbung, 60-fach) 40 4.1.4. Stenosierung Stenosierende Gefäßveränderungen waren in 53,9 % der Karzinome (= 359 Gefäße) offensichtlich (s. Abbildung 19). Diese resultieren teils aus einer Vermehrung lockeren, kapillarreichen, teils aus einer Vermehrung straffen, kollagenfaserreichen Bindegewebes. Abbildung 5 Stenosiertes und komprimiertes arterielles Gefäß mit zündlicher Infiltration, entRest- lumen < 30 %. (Wi 1984/94 PEC, RG I, m., 43 J.,EvG-Färbung, 57-fach) Abbildung 6 Gefäßausschnitt eines arteriellen Gefäßes stenosiert durch Intimaproliferation mit Infiltration durch Entzündungszellen. (Wi 2685/95 PEC, RG II b, m.,57 J.,EvG-Färbung, 59-fach) 41 Abbildung 7 Nahezu vollständig durch lockeres Bindegewebe stenosiertes arterielles Gefäß mit Begleitentzündung. (Wi 4084/95 PEC,RG II a, m., 60 J.,EvG-Färbung, 105-fach) Abbildung 8 Nahezu teration vollständige eines Obli- arteriellen Gefäßes mit Infiltration durch Ent-zündungszellen. (Wi 1986/94 PEC,RG II b, m., 45 J.,EvG-Färbung, 105-fach) Abbildung 9 Hochgradige Stenosierung zweier entzündlich veränderter arterieller Gefäße in unmittelbarer Nähe von Bronchialästen. (Wi 3302/94 PEC, RG II b, m.,63 J.,EvG-Färbung, 53-fach 42 4.1.5. Obliteration Als Konsequenz weitreichender Stenosierung des Gefäßlumens zeigte sich ein völliger Verschluß von Gefäßen, was unter der Bezeichnung Obliteration Berücksichtigung fand. Eine entsprechende Obliteration war in 13,2 % der untersuchten Pulmonalarterien nachzuweisen (= 88 Gefäße). 94,3 % dieser Gefäße waren narbig obliteriert, während bei den übrigen 5,7 % abgesehen von bindegewebigen Anteilen zusätzlich zum Beispiel proliferierte Intima oder Tumorzellnester für einen vollständigen Verschluß sorgte (s. Tab. 1). Abbildung 10 Obliteriertes Gefäß mit entzündlicher Infiltration und Tumorzellnest im ehemaligen Lumen, Aufsplitterung der M. elastica interna. (Wi 2519/94 PEC, RG II a, m.,59 J.,EvG-Färbung, 100-fach) 43 Abbildung 11 Obliteration eines arteriellen Gefäßes durch Narbengewebe. (Wi 3300/94 PEC, RG II b, m.,59 J.,EvG-Färbung, 53-fach) Abbildung 12 Vollständig durch zum Teil narbig umgewandeltes Bindegewebe verschlossenes arterielles Gefäß mit Infiltration durch Entzündungszellen. (Wi 1463/94 PEC, RG II b, m.,57 J.,EvG-Färbung, 85-fach) 44 4.1.6. Kompression Bindegewebe, Vernarbungen und Tumorgewebe sind in der Lage, Gefäßkompressionen hervorzurufen. Das Ausmaß der durch Kompression hervorgerufenen Lumeneinengung kann bis zu einer vollständigen Verlegung des Gefäßes reichen. In nahezu der Hälfte aller Fälle (43,7 %, = 291 Gefäße) zeigten sich Auswirkungen durch Veränderungen der Gefäßumgebung wie zum Beispiel Tumorzellverbände und Narbengewebe, die die Gefäßwand zu komprimieren vermögen (s. Abbildung 19). Der Anteil der davon tumorös bedingten Kompressionen beträgt 18,9 %. Insgesamt stellen diese Gefäße einen Anteil von 8,3 % (= 55 Gefäße, s. Tab. 1). Die relativ geringe Zahl tumorös infiltrierter Gefäße korreliert gut zu diesem Befund. Abbildung 13 Abbildung 14 Destruiertes, durch Tumorzellverbände Durch Tumorzellverbände komprimierte komprimiertes arterielle arterielles Gefäß, Gefäße mit entzündlicher ebenso Tumor-zellen im ehemaligen Infiltration, Restlumen 31- 60 %. Lumen, (Wi 3210/94 PEC, RG II a, m.,49 J.,EvG- Vermehrung elastischer Fasern. Färbung, 57-fach) (Wi 833/94 PEC, RG I, m.,70 J.,EvGFärbung 114 fach) 45 4.1.7. Aufsplitterung der Membrana elastica interna Eine Aufsplitterung der elastischen Membran war ein häufig zu eruierendes Phänomen. 428 der insgesamt 666 ausgewerteten Pulmonalarterien wiesen diese Veränderung auf. Mit 64,3 % liegt diese Strukturanomalie an der Spitze der zu beobachtenden Veränderungen (s. Abb. 19). Ein ähnlich hoher Wert (61,1 %) konnte nur bei den entzündlich infiltrierten Gefäßen ermittelt werden. Schwierig, wenn nicht manchmal sogar ganz unmöglich, gestaltete sich die Abgrenzung einer Aufsplitterung der Membrana elastica interna zu einer ausgeprägten Elastose oder aber bei destruierten Gefäßen, bei denen die Membran selbst gar nicht mehr auszumachen war. 4.1.8. Elastose Wenn sich bei den Gefäßen eine Verdichtung elatischer Fasern einstellte, wurde dies als Elastose bezeichnet. Häufig war die Media betroffen, jedoch fand auch eine Ausbreitung über die gesamte Gefäßwand statt. Mit zunehmender Ausprägung verlieren die Gefäße ihren eigentlichen Wandaufbau. Eine Elastose kennzeichnete 46,4 % aller untersuchten Pulmonalarterien, dies sind 309 aller analysierten Arterien (s. Tab. 1). Abbildung 15 Destruiertes arterielles Gefäß mit Aufsplitterung der M. elastica interna und Vermeherung der elastischen Fasern, sowie Tumorzellen im ehemaligen Lumen und der Gefäßumgebung. (Wi 1463/94 PEC, RG II b, m., 57 J.,EvG-Färbung, 150-fach) 46 4.1.9. Destruktion War ein Gefäß derart verändert, daß sich die einzelnen Wandschichten in ihrem typischen Aufbau nicht mehr erkennen ließen, galt es als destruiert. Als Ursachen dafür kamen vor allem tumorös infiltrative Prozesse in Frage, aber auch eine Aufsplitterung der elastischen Membran und Elastose. Die destruierten Gefäße machten für Adeno- und Plattenepithelkarzinome zusammen einen Anteil von 9,5 % aus, das entspricht 63 von 666 Gefäßen (s. Abbildung 19). Abbildung 16 Zerstörte Gefäße mit Auf- splitterungen der M. elasticae internae und Vermehrung der elastischen Fasern. (Wi 682/94 PEC, RG II b, m., 67 J.,EvG-Färbung, 60-fach) Abbildung 17 Destruiertes arterielles Gefäß mit Aufsplitterung der M. elastica interna, Vermehrung der elastischen Fasern und Infiltration durch zündungszellen, Ent- Restlumen < 30%. (Wi 679/94 PEC, RG II b, m.,60 J.,EvG-Färbung, 112-fach) 47 4.1.10. Restlumen Nahezu alle der aufgeführten Gefäßveränderungen können in unterschiedlichem Ausmaß eine Verengung des Lumens herbeiführen. Das Gesamtresultat der Veränderungen spiegelt sich darin wieder, wie ausgeprägt die Einengung des Lumens ist. Die Restlumina wurden in vier Kategorien eingestuft: 0 %, weniger als 30 %, 31 % bis 60 % und 61 % bis 100 %. Durchschnittlich ergaben sich für alle Gefäße folgende Ergebnisse (s. Abbildung 18, S. 48): 15,6 % der Fälle (= 104 Gefäße) hatten kein Restlumen (0 %), 27,8 % (= 185 Gefäße) wiesen ein restliches Lumen von weniger als 30 % auf, mit 37,4 % (= 249) stellten Gefäße mit einem Restlumen von 31 % bis 60 % den größten Anteil und schließlich entfielen auf ein Restlumen von 61 % bis 100 % 19,2 % aller Pulmonalarterienäste, was 128 Gefäße ausmachte (s. Tab. 1). 40.0 37.4 35.0 30.0 27.8 25.0 20.0 19.2 15.0 15.6 10.0 5.0 0.0 0% < 30 % 31 % - 60 % 61 % - 100 % Restlumen: Abbildung 18 Verteilung der Restlumina für Adeno- und Plattenepithelkarzinome 48 Zusammenfassende Darstellung der einzelnen Gefäßveränderungen für Adeno- und Plattenepithelkarzinome insgesamt: 70.0 60.0 64.3 50.0 61.1 53.9 40.0 46.4 43.7 30.0 34.5 20.0 18.0 13.2 10.0 12.5 9.5 8.3 Destruktion Elastose Aufsplitterung der M. elastica interna - durch Tumorgewebe Kompression - narbig Obliteration Stenosierung Intimaproliferation Infiltration durch Tumorzellen Infiltration durch Entzündungszellen 0.0 gesamt % Abbildung 19 Darstellung der Gefäßveränderungen insgesamt Auffallend war insgesamt, daß außer bei der Infiltration durch Tumorzellen in allen untersuchten Tumoren jeweils jede der analysierten Gefäßveränderung vorkam. Lediglich in der Häufigkeit und Ausprägung waren Unterschiede zu verzeichnen. 49 4.2. Gefäßveränderungen in Abhängigkeit vom histologischen Tumortyp 4.2.1. Adeno- und Plattenepithelkarzinome im Vergleich Während sich Adeno- und Plattenepithelkarzinome nur geringfügig in der entzündlichen Infiltration unterschieden, Adenokarzinome waren zu 65,2 %, Plattenepithelkarzinome zu 59,6 % entzündlich infiltriert, zeigte sich bei der tumorösen Infiltration ein deutlicher Unterschied zwischen beiden Tumorarten. Gefäße von Adenokarzinomen waren mit 32,0 % mehr als doppelt so häufig von Tumorzellen infiltriert als Gefäße von Plattenepithelkarzinomen, die zu 12,9 % Tumorzellen in ihrer Gefäßwand aufwiesen (s. Abbildung 20, S. 51). Stenosierte Gefäße ließen sich hingegen mehr bei Plattenepithelkarzinomen nachweisen. Hier standen 57,0 % den 45,5 % der betroffenen Gefäße von Adenokarzinomen gegenüber. Ebenso fanden sich bei obliterierenden Prozessen, wenn auch nur leicht höhere Werte bei Plattenepithelkarzinomen (14,1 % : 10,7 %). Mit 95,7 % lag auch der Anteil narbiger Obliterationen etwas höher als der der Adenokarzinome. Hier betrug der Anteil 89,5 %. Ähnlich geringe Unterschiede ergaben die untersuchten Kriterien wie Intimaproliferation (35,5 % : 32,0 %), Aufsplitterung der Membrana elastica interna (65,6 % : 60,7 %) und bei destruierten Gefäßen (10,7 % : 6,2 %). Die angegebenen Prozentzahlen entsprechen jeweils dem Vergleich Plattenepithelkarzinom : Adenokarzinom (vgl. Abbildung 20). Komprimierte Gefäße wurden dagegen eher bei Pulmonalarterienästen von Adenokarzinomen gefunden (49,4 %), analog dem Befund der zahlreicheren tumorösen Infiltration erfolgte auch häufiger eine tumorbedingte Kompression der Gefäßwand (12,9 %). Demgegenüber fanden sich bei Plattenepithelkarzinomen 41,6 % komprimierte Gefäße, sowie 6,6 % tumorös bedingte Kompressionen. Nahe beieinander liegende Werte ergaben sich für Gefäße mit einer Aufsplitterung der Membrana elastica interna. Für Adenokarzinome betrugen sie 60,7 %, für Plattenepithelkarzinome 65,6 %. Ebenfalls kaum differierende Ergebnisse konnten für das Merkmal Elastose aufgezeigt werden. Den 47,8 % bei Gefäßen aus Adenokarzinomen standen 45,9 % denen der Plattenepithelkarzinome gegenüber (s. Abbildung 20). 50 Adenocarcinome % 51 Destruktion Elastose Aufsplitterung der M. elastica interna - durch Tumorgewebe Kompression 10.0 6.2 6.6 13.5 10.7 12.9 9.6 14.1 10.7 20.0 - narbig Obliteration 40.0 35.5 32.0 32.0 47.8 49.4 45.9 41.6 45.5 50.0 Stenosierung Intimaproliferation 12.9 60.0 65.6 65.2 60.7 57.0 59.6 70.0 Infiltration durch Tumorzellen Infiltration durch Entzündungszellen [%] Destruierte Gefäße machten bei den Adenokarzinomen einen Anteil von 6,2 % aus, bei Plattenepithelkarzinomen 10,7 %. 30.0 0.0 Plattenepithelcarcinome % Abbildung 20 Vergleich der Gefäßveränderungen von Adeno- und Plattenepithelkarzinomen 4.3. Gefäßveränderungen in Abhängigkeit von der Gefäßgröße 4.3.1. Kleine und große Gefäße von Adeno- und Plattenepithelkarzinomen im Vergleich Im Vergleich zwischen kleinen und großen Gefäßen fiel auf, daß sowohl bei den Adenokarzinomen als auch bei den Plattenepithelkarzinomen große Gefäße wesentlich häufiger entzündliche Infiltrationen zeigten. 71,2 % der großen Gefäße waren betroffen, kleine hingegen zu 52,3 % (s. Tab. 2 und 3). Definitionsgemäß galt ein Gefäß mit einem Durchmesser zwischen 90 und 300 µm als ein kleines, ein Gefäß hingegen mit einem Durchmesser größer als 300 µm als ein großes Gefäß. Tumorzellen fanden sich häufiger in den Wänden kleiner und großer Pulmonalarterien der Adenokarzinome. Gefäße von Plattenepithelkarzinomen sind zu 11,4 % (kleine) und 14,7 % (große) befallen (s. Abbildung 22, S. 54), 28,9 % (kleine) und 34,7 % (große) der Adenokarzinome (s. Abbildung 21, S. 53). Außerdem ließ sich eine Verschiebung hin zu den großen Gefäßen erkennen, sie wiesen eine etwas höhere tumoröse Infiltration auf. Eine Intimaproliferation war bei größeren Gefäßen sowohl für Adeno- als auch für Plattenepithelkarzinome, häufiger zu beobachten. Die niedrigsten Werte ergaben sich für die kleinen Gefäße von Adenokarzinomen (s. Tab. 4). Stenosierende Prozesse waren bei kleinen und großen Gefäßen aus Plattenepithelkarzinomen häufiger vorhanden als bei Adenokarzinomen. Besonders deutlich zeigte sich der Unterschied bei den großen Pulmonalarterienästen. Waren bei Plattenepithelkarzinomen Stenosierungen in 60,4 % der Fälle offensichtlich, so waren es 44,2 % der großen Gefäße der Adenokarzinome (s. Tab. 5). Im Gegensatz dazu konnten Obliterationen vermehrt bei kleinen Gefäßen nachgewiesen werden, 16,9 % gegenüber 9,0 % bei größeren Gefäßen. Ähnlich verhielt es sich bei narbig obliterierten Arterien (s. Tab. 4). Insgesamt fanden sich bei Adenokarzinomen mehr kleine und große komprimierte Pulmonalarterienästen als bei den anderen Tumoren. Am deutlichsten zeigte sich die Diskrepanz zwischen den großen Gefäßen, 52,6 % der großen Gefäße von Adenokarzinomen verglichen mit 41,0 % komprimierter großer Gefäße von Plattenepithelkarzinomen. Auch der prozentuale Anteil tumorbedingter Kompressionen war um ungefähr das doppelte deutlich höher als der bei kleinen Gefäßen (s. Tab. 4). 52 Keine wesentlichen Unterschiede erbrachte der Vergleich zwischen kleinen und großen Gefäßen hinsichtlich der Aufsplitterung der Membrana elastica interna und einer Elastose (s. Abb. 21 und 22). Leicht vermehrt waren von der Aufsplitterung Plattenepithelkarzinome betroffen, von der Elastose eher kleine Gefäße der Adenokarzinome, jedoch blieb vor allem letzteres Ergebnis ohne wesentliche Auswirkung auf das Gesamtresultat. Den geringsten Anteil an destruierten Gefäßen wiesen mit 4,2 % die großen Pulmonalarterienäste der Adenokarzinome auf, den größten machten mit 11,1 % die kleinen Gefäße der Plattenepithelkarzinome aus (s. Tab. 4). Insgesamt, d. h. kleine und große Gefäße zusammen, fand sich bei Plattenepithelkarzinomen eine höhere Anzahl von destruierten 75.8 Gefäßen. 80.0 45.8 8.4 4.2 10.0 6.3 7.4 13.3 14.5 20.0 12.0 13.7 24.1 30.0 50.6 45.3 52.6 38.9 34.7 28.9 40.0 Adenoca. kleine G. Adenoca. große G. Abbildung 21 Gegenüberstellung kleiner und großer arterieller Gefäße von Adenokarzinomen 53 Destruktion Elastose Aufsplitterung der M. elastica interna - durch Tumorgewebe Kompression - narbig Obliteration Stenosierung Intimaproliferation Infiltration durch Tumorzellen 0.0 Infiltration durch Entzündungszellen [%] 50.0 47.0 44.2 60.0 53.0 60.2 61.1 70.0 Plattenepithelca. kleine G. Plattenepithelkarzinomen 54 Plattenepithelca. große G. Abbildung 22 Gegenüberstellung kleiner und großer arterieller Gefäße von Destruktion 6.0 11.1 10.1 7.0 9.2 17.0 17.7 42.1 46.5 45.4 41.0 50.0 Elastose Aufsplitterung der M. elastica interna - durch Tumorgewebe Kompression - narbig 10.0 9.7 38.2 40.0 Obliteration 33.2 54.2 60.0 Stenosierung Intimaproliferation 20.0 14.7 11.4 52.0 66.8 64.6 60.4 69.1 70.0 Infiltration durch Tumorzellen Infiltration durch Entzündungszellen [%] 80.0 30.0 0.0 4.4. Gefäßveränderungen in Abhängigkeit vom Regressionsgrad 4.4.1. Adeno- und Plattenepithelkarzinome sowie kleine und große Gefäße im Vergleich Bei der Gegenüberstellung von Adeno- und Plattenepithelkarzinomen ließen sich mitunter sehr deutliche Abhängigkeiten von den Regressionsgraden I, II a und II b darstellen. Infiltration durch Entzündungszellen Adenokarzinome zeigten eine kontinuierliche Zunahme einer entzündlichen Infiltration der Gefäße mit steigendem Regressionsgrad. Waren im Regressionsgrad I noch 46,2 % der Gefäße in ein entzündliches Geschehen involviert, waren im Regressionsgrad II a bereits 63,2 % betroffen und im Regressionsgrad II b sogar 75,4 % der Gefäße. Bei den Plattenepithelkarzinomen war ebenfalls eine Zunahme entzündlicher Infiltration zu verzeichnen, wenn auch nicht so deutlich und nicht kontinuierlich ansteigend (RG I 53,4 % : RG II a 60,6 % : RG II b 60,1 %). Überwog zunächst noch die Infiltration von Gefäßen der Plattenepithelkarzinome (53,4 % : 46,2 % im Regressionsgrad I), näherten sich die Werte im Regressionsgrad II a einander an (60,6 % : 63,2 %), während im Regressionsgrad II b die Gefäße der Adenokarzinome deutlich häufiger befallen waren (75,4 % : 60,1 %) (s. Abbildungen 23 und 24, S. 63). Betrachtete man jeweils kleine und große Pulmonalarterien von Adeno- und Plattenepithelkarzinomen getrennt (s. Tab. 13), wurde eine Diskrepanz zwischen beiden Gefäßgruppen offensichtlich. Kleine Gefäße waren in allen Regressionsgraden deutlich weniger häufig mit Entzündungszellen durchsetzt als große. Am eindrucksvollsten zeigte sich der Unterschied bei Gefäßen der Adenokarzinome des Regressionsgrades I. Während die Wände der kleinen Gefäße lediglich zu 20,0 % betroffen waren, waren es 81,8 % der großen Gefäße. Mehr als zwanzig Prozent Differenz betrug der Unterschied zwischen kleinen und großen Gefäßen in Plattenepithelkarzinomen in diesem Regressionsgrad und auch bei beiden histologischen Tumortypen im Regressionsgrad II a. Im Regressionsgrad II b war der Unterschied nicht mehr in der Deutlichkeit nachweisbar. Zwar hielt sich bei den Plattenepithelkarzinomen der Unterschied zwischen kleinen und großen Gefäßen bei 53,9 % : 55 67,7 %, bei Adenokarzinomen fanden sich 73,3 % kleine betroffene Gefäße im Vergleich zu 77,1 % großer entzündlich infiltrierter Gefäße. Infiltration durch Tumorzellen Neben der bereits erwähnten häufigeren tumorösen Gefäßinfiltration bei Adenokarzinomen, insgesamt waren es 32,0 % gegenüber 12,9 % bei Plattenepithelkarzinomen (s. Abb. 20), war eine deutliche Abnahme der Tumorzellinfiltration mit zunehmendem Regressionsgrad zu beobachten (s. Abb. 23 und 24, S. 63). Bei den Plattenepithelkarzinomen nahm die tumoröse Infiltration von 37,2 % im Regressionsgrad I über 26,6 % im Regressionsgrad II a kontinuierlich bis hin zu 6,3 % im Regressionsgrad II b ab. Im Gegensatz dazu war bei den Adenokarzinomen eine Zunahme zum Regressionsgrad II a zu verzeichnen (38,5 % im RG I: 50,6 % im RG II a), erst danach sank die Infiltrationsrate auf 4,6 % im Regressionsgrad II b. Dies führte zu einer Diskrepanz bei der Gegenüberstellung beider Tumorarten in den jeweiligen Regressionsgraden. Während der Unterschied in den Regressionsgraden I und II b nur geringfügig war, lag im Regressionsgrad II a bei Adenokarzinomen eine nahezu doppelt so häufige Infiltration durch Tumorzellen vor als dies bei Plattenepithelkarzinomen der Fall war (50,6 % für Adenokarzinome : 26,6 % für Plattenepithelkarzinome). Wichtig bleibt jedoch festzuhalten, daß es sich bei den ermittelten Prozentwerten nicht um zeitliche Abläufe zwischen den einzelnen Regressionsgraden handelt, sondern jeweils um das Ausmaß der erreichten Tumorregression. Kleinere Gefäße fielen im Regressionsgrad I durch eine geringere Infiltration durch Tumorzellen auf als große, was sowohl für Adenokarzinome (26,7 % : 54,7 %) als auch für die Plattenepithelkarzinome (32,0 % : 44,4 %) zutraf (s. Tab. 13). Der geringere Befall kleiner Gefäße setzte sich im Regressionsgrad II a fort, wenn auch nicht mehr in dieser Ausprägung. Im nachfolgenden Regressionsgrad konnte keine eindeutige Aussage mehr getroffen werden, ob größere oder kleinere Gefäße einer Tumorart einem häufigerem Befall von Tumorzellen unterlagen. Jedoch wurden in allen untersuchten Gefäßkategorien des Regressionsgrades II b weniger als zehn Prozent tumorös infiltrierte Gefäße gefunden. Auffallend war, daß sowohl die höchste Infiltrationsrate (54,5 % im Regressionsgrad I) von den großen Gefäßen der Adenokarzinome gestellt wurde als auch die niedrigste (2,9 % im Regressionsgrad II b). 56 Intimaproliferation Ein Vergleich der Ergebnisse der Intimaproliferation in Gefäßen von Adeno- und Plattenepithelkarzinomen ließ keine einheitliche Tendenz der Veränderungen in bezug auf die verschiedenen Regressionsgrade erkennen (s. Tab. 7- 9). Auffallend war jedoch die relativ geringe Schwankungsbreite zwischen den einzelnen Regressiongraden. Abgesehen von den Gefäßen der Plattenepithelkarzinome im Regressionsgrad II a waren sonst immer die großen Gefäße vermehrt von der Proliferation der Intima betroffen. Die deutlichsten Unterschiede konnten für Plattenepithelkarzinome im Regressionsgrad I belegt werden: 32,0 % kleine Gefäße gegenüber 50,0 % betroffene große Gefäße, sowie für Pulmonalarterien von Adenokarzinome im Regressionsgrad II b: 23,3 % kleine : 45,7 % große Gefäße (s. Tab. 13). Stenosierung Durch Stenosierung hervorgerufene Lumeneinengungen konnten in abnehmendem Maße für Gefäße der Adenokarzinome beobachtet werden, wenn auch nicht kontinuierlich von Regressionsgrad zu Regressionsgrad. Die meisten stenosierten Gefäßen entstammten dem Regressionsgrad I (65,4 %). Während im Regressionsgrad II a 37,9 % Stenosierungen zu verzeichnen waren, waren es im Regressionsgrad II b wiederum ungefähr zehn Prozent mehr, nämlich 47,7 % (s. Abb. 23). Verantwortlich schienen dafür die großen Gefäße zu sein, während stenosierte kleine Gefäße mit zunehmendem Regressionsgrad kontinuierlich abnahmen (s. Tab. 13). Bei den Pulmonalarterien der Plattenepithelkarzinome dagegen zeigte sich ebenfalls eine leichte Abnahme von stenosierten Gefäßen vom Regressionsgrad I zum Regressionsgrad II a (58,1 % : 52,1 %), jedoch erreichten die Stenosierungen im Regressionsgrad II b wiederum einen Anteil von 58,1 % (s. Abb. 24). Während im Regressionsgrad I noch Gefäße von Adenokarzinomen mit den höchsten überhaupt ermittelten Stenosierungraten überwogen (60,0 % für kleine Gefäße, 72,7 % für große), drehte sich das Verhältnis in den beiden anderen Regressionsgraden um (s. Tab. 13). Insgesamt resultierte daraus, daß Gefäße von Plattenepithelkarzinomen häufiger stenosiert waren (57,0 % : 45,5 %, s. Tab. 10). Abgesehen vom Regressionsgrad II a überwogen bei beiden Tumorarten die größeren Gefäße mit stenosiertem Lumen. Stenosierte kleine Gefäße von Adenokarzinomen wurden mit steigendem Regressionsgrad zunehmend seltener. Bei allen anderen untersuchten Gefäßkategorien prägten unterschiedliche Schwankungen 57 zwischen den einzelnen Regressionsgraden das Bild, so daß eine Aussage zur Abhängigkeit vom Regressionsgrad nicht möglich war. Obliteration Obliterationen kamen mit höherem Regressionsgrad in zunehmendem Maße vor. Gefäße von Plattenepithelkarzinomen zeigten einen kontinuierlichen Anstieg an komprimierten Gefäßen (4,6 % RG I: 14,9 % RG II a: 15,1 % RG II b, s. Abb. 24), bei Adenokarzinomen sah die Zunahme folgendermaßen aus: 7,7 % : 11,5 % : 10,8 % (s. Abb. 23). Narbig bedingte Obliterationen konnten allerdings für beide Tumorarten als kontinuierlich steigend nachgewiesen werden. Im Vergleich nahmen vom Regressionsgrad I zu Regressionsgrad II a die obliterierten Gefäße deutlicher bei den Plattenepithelkarzinomen, nämlich um mehr als das doppelte von 4,6 % auf 14,9 %, zu, als dies bei Adenokarzinomen zu beobachten war (7,7 % > 11,5 %; vgl. Tab. 9). In den einzelnen Regressionsgraden traten folgende Besonderheiten zutage: Im Grad I fanden sich vermehrt Gefäße, hier vor allem größere, von Adenokarzinomen obliteriert (s. Tab. 13). Im Regressionsgrad II a hingegen waren Pulmonalarterienäste von Adenokarzinomen etwas weniger häufig als Gefäße von Plattenepithelkarzinomen von obliterierenden Prozessen betroffen, was sich im Regressionsgrad II b fortsetzte. Hier zeigte sich deutlich ein Überwiegen kleiner verschlossener Gefäße bei beiden histologischen Tumortypen: für Adenokarzinome 16,7 % kleine Gefäße gegenüber 5,7 % große Gefäße, sowie für Gefäße in Plattenepithelkarzinomen jeweils 20,7 % gegenüber 8,2 %. Sowohl bei Adeno- als auch bei Plattenepithelkarzinomen nahmen von Regressionsgrad I zu II b Obliterationen bei kleinen Gefäßen kontinuierlich zu: 6,7 % : 15,8 % : 16,7 % bzw. 4,0 % : 13,2 % : 20,7 %. Große Gefäße von Plattenepithelkarzinomen unterlagen in Abhängigkeit von den Regressionsgraden Schwankungen: 5,6 % (RG I): 19,5 % (RG II a): 8,2 % (RG II b). Bei großen Gefäßen von Adenokarzinomen war eine kontinuierliche Abnahme festzustellen: 9,1 % : 8,2 % : 5,7 %. Der prozentuale Anteil narbiger Obliterationen an der Gesamtzahl der Obliterationen war insgesamt bei kleinen Gefäßen höher als bei großen (91,7 % bei Adenokarzinomen und 95,8 % bei Plattenepithelkerzinomen für kleine Gefäße gegenüber 71,4 % und 86,4 % für große Gefäße). Auffallend war, daß alle obliterierten kleinen Gefäße der Adenokarzinome außer im Regressionsgrad I narbig verschlossen waren. 58 Nicht- narbige Obliterationen können durch Intimaproliferationen, Nester von Tumorzellen oder auch durch eine Vermehrung elastischer Faserkomponenten verursacht werden bzw. können diese genannten Ursachen als Teilkomponente zu einer Obliteration beitragen. Kompression Bei komprimierten Gefäßen bestand eine eindeutige Beziehung zwischen der Häufigkeit des Vorkommens und dem Regressionsgrad. Mit steigendem Regressionsgrad nahm die Anzahl der Kompressionen bei beiden Tumortypen ab. Plattenepithelkarzinome zeigten eine deutlichere Tendenz zur Abnahme als Adenokarzinome: 58,1 % (RG I) : 52,1 % (RG II a) : 36,8 % (II b) für Plattenepithelkarzinome und 53,8 % : 49,4 % : 47,6 % für Adenokarzinome (s. Abbildungen 23 und 24). Ähnlich verhielt es sich mit den tumorbedingten Kompressionen. Besonders deutlich fielen hier die Pulmonalarterien der Plattenepithelkarzinome auf. Im Regressionsgrad I waren noch 34,9 % der Kompressionen durch Tumoren verursacht, im folgendem ungefähr ein Drittel weniger (12,8 % RG II a) und im Regressionsgrad II b lediglich noch 1,4 %. Bei Adenokarzinomen sah die Tumorbeteiligung an den Kompressionen etwas anders aus. Analog zur tumorösen Infiltration ließen sich tumorbedingte Kompressionen vom Regressionsgrad I zum Regressionsgrad II a häufiger ausmachen, jedoch zeigte sich auch hier im Regressionsgrad II b dann eine deutliche Abnahme: 11,5 % : 18,4 % : 6,2 % (s. Tab. 9). Im Vergleich beider Tumortypen innerhalb der einzelnen Regressionsgrade trat ein mehr als doppelt so hoher Anteil tumorbedingter Gefäßkompressionen der Plattenepithelkarzinome in Grad I (11,5 % : 34,9 %., s. Tab. 10) zutage, allerdings veränderte sich mit höherem Regressionsgrad das Verhältnis zugunsten der betroffenen Gefäße von Adenokarzinomen. Insgesamt resultierte ein Überwiegen von Gefäßen dieser Tumoren. Im Regressionsgrad I war das Verhältnis komprimierter kleiner und großer Pulmonalarterien unausgewogen, mit 81,8 % wiesen große Pulmonalarterien der Adenokarzinome die höchste ermittelte Rate an durch Kompression hervorgerufenen Veränderungen auf, im Gegensatz dazu nur 33,3 % komprimierte kleine Gefäße (s. Tab. 13). Die großen Gefäße dieser Gruppe nahmen wie betroffene große Gefäße von Plattenepithelkarzinomen kontinuierlich von Regressionsgrad zu Regressionsgrad ab: 81,8 % (RG I ): 51,0 % (RG II a ): 45,7 % (RG II b) für Adenokarzinome sowie 66,7 % : 46,3 % : 33,5 % für Plattenepithelkarzinome. 59 Die Befunde tumorbedingter Gefäßkompressionen korrelierten gut zu diesen Ergebnissen. Ließ sich auch noch bei den kleinen Gefäßen von Plattenepithelkarzinomen eine Abnahme der Häufigkeit verzeichnen (56,0 % : 56,6 % : 36,3 %), waren kleine Pulmonalarterien von Adenokarzinomen im Gegensatz dazu mit zunehmendem Regressionsgrad häufiger durch Kompression in ihrer Struktur verändert, wie durch folgende Werte bestätigt werden konnte: 33,3 % (RG I): 47,4 % (RG II a): 50,0 % (RG II b). In den Regressionsgraden I und II a zeigten noch vermehrt kleine Gefäße der Plattenepithelkarzinome komprimierte Wände, während sie im Stadium II b weniger davon betroffen waren. Aufsplitterung der M. elastica interna Auch für Aufsplitterungen der Membrana elastica interna konnte sowohl für Adeno- als auch für Plattenepithelkarzinome eine deutliche Abhängigkeit vom Regressionsgrad nachgewiesen werden. Je höher der Regressionsgrad war, desto mehr nahmen die Veränderungen an Häufigkeit zu (s. Abb. 23 und 24). Pulmonalarterien von Adenokarzinomen zeigten im Regressionsgrad I in 30,8 % der Fälle eine aufgesplitterte Membran, im folgenden Regressionsgrad handelte es sich bereits um 62,1 %. Eine nochmalige Zunahme auf 70,8 % war zum Regressionsgrad II b hin zu beobachten. Ein vergleichbarer Anstieg ließ sich für die Gefäße von Plattenepithelkarzinomen belegen: 34,9 % : 67,0 % : 68,9 %. Auffallend war, daß bei beiden Tumortypen der Anstieg von Grad I zu Grad II a am ausgeprägtesten war. Er betrug jeweils etwas mehr als dreizig Prozent (s. Tab. 9). Gegenübergestellt konnten innerhalb der einzelnen Regressionsgrade keine wesentlichen Unterschiede zwischen Adeno- und Plattenepithelkarzinomen dargelegt werden (s. Tab. 10). Betrachtet man die Verteilung kleiner und großer Gefäße (s. Tab. 13), war zu erkennen, daß kleine Pulmonalarterien im Regressionsgrad I seltener von einer Aufsplitterung der elastischen Membran betroffen waren, was sich aber in den folgenden Regressionsgraden nicht fortsetzen konnte. 20,0 % der kleinen standen 45,5 % der großen Gefäße von Adenokarzinomen gegenüber. Kleinere Gefäße waren für den Sprung der Gesamthäufigkeit zwischen den ersten beiden Regressionsgraden die Ursache. Die Häufigkeit, mit der die Integrität der Gefäßwände durch Aufsplitterung der Membrana elastica interna gestört wurde, nahm von 20,0 % um über vierzig Prozent auf 63,2 % zu. In den übrigen Gefäßkategorien reichte die prozentuale Zuwachsrate von 15,7 % bis zu 34,2 %, während der Anstieg zum 60 nächst höheren Regressionsgrad II b lediglich zwischen 4,5 % und 13,5 % variierte. Abgesehen von den großen Gefäßen plattenepithelial differenzierter Tumoren stellte sich die Zunahme bei allen anderen Pulmonalarterien als kontinuierlich dar. Als Besonderheit erwies sich folgende Beobachtung: Obwohl die kleinen Gefäße von Adenokarzinomen den niedrigsten ermittelten Wert (20,0 % im Regressionsgrad I) stellten, schienen sie im Stadium II b am anfälligsten für eine Aufsplitterung der elastischen Membran zu sein, denn auch der insgesamt höchste Wert konnte den betreffenden Gefäßen zugesprochen werden (76,7 %). Im Gegensatz zum Regressionsgrad I, in dem noch bei beiden Tumortypen deutlich weniger kleine Gefäße eine aufgesplitterte Membrana elastica interna zeigten, überwogen im Regressionsgrad II b kleine Gefäße mit dieser Strukturveränderung. Elastose Bei der Untersuchung der Gefäße, deren Wandveränderungen durch Elastose hervorgerufen wurden, mußte zunächst aufgrund verschiedener Entwicklungen in Abhängigkeit von den Regressionsgraden eine getrennte Beurteilung der beiden Tumortypen erfolgen. Bei den Adenokarzinomen konnte eindeutig eine kontinuierliche Zunahme konstatiert werden. Im Regressionsgrad I wiesen 26,9 % der Gefäße eine Elastose auf, im Regressionsgrad II a bereits 44,8 % und im weiteren (RG II b) erhöhte sich die Anzahl der betroffenen Gefäße auf 60,0 %. Die Zuwachsraten betrugen jeweils mehr als fünfzehn Prozent (s. Abb. 23). Ebenfalls um gut fünfzehn Prozent nahmen Elastosen bei Plattenepithelkarzinomen vom Regressionsgrad I zum Regressionsgrad II a zu (32,6 % : 48,9 %, s. Abb. 24). Anders als bei den Adenokarzinomen war dann eine geringfügige Abnahme um 2,2 % (RG II b) zu verzeichnen. Schwankungen der großen Pulmonalarterienäste von Plattenepithelkarzinomen konnten hierfür verantwortlich gemacht werden wie folgende Zahlen belegen: 22,2 % (RG I): 56,1 % (RG II a): 46,8 % (RG II b) (vgl. Tab. 13). Der gleichen Schwankungstendenz unterlagen kleine Gefäße der Adenokarzinome, bei denen nach einer Zunahme um fast fünfzig Prozent von 26,7 % auf 73,7 % im Regressionsgrad II a ein Rückgang auf 63,3 % im Regressionsgrad II b nachgewiesen werden konnte. Stetige Zunahme erfuhren sowohl Elastosen bei kleinen Gefäßen von Plattenepithelkarzinomen in geringer Ausprägung (40,0 % 61 RG I: 43,4 % RG II a: 46,6 % RG II b) als auch bei großen Gefäßen von Adenokarzinomen, bei denen die Zunahme deutlicher ausfiel: 27,3 % : 40,8 % : 57,1 %. Nachweisbar war auch, daß insgesamt kleine Gefäße häufiger durch Elastose ihren typischen Wandaufbau eingebüßt hatten als dies bei großen Pulmonalarterien der Fall war. Bei einem direkten Vergleich beider Tumorarten überwogen in den Regressionsgraden I und II a Gefäße von Plattenepithelkarzinomen (26,9 % : 32,6 % im Regressionsgrad I sowie 44,8 % : 48,9 % im Regressionsgrad II a), im Regressionsgrad II b hingegen hatte sich das Verhältnis zugunsten der Gefäße von Adenokarzinomen umgekehrt: 60,0 % für Adenokarzinome waren gegenüber 46,7 % für Plattenepithelkarzinome betroffen (s. Tab 10). Da sich das aber um so ausgeprägter herausstellte, resultierte insgesamt ein höherer Anteil von betroffenen Gefäßen, die in Adenokarzinomen zu finden waren und zusammenfassend konnten deren kleine Gefäße mit 61,4 % als die am häufigsten durch Elastose gekennzeichneten Gefäße identifiziert werden. Destruktion Pulmonalarterienäste, die durch eine völlige Zerstörung ihrer Wandstruktur auffielen, ließen auf eine enge Beziehung der Veränderungen zu den Regressionsgraden schließen. Mit höherem Regressionsgrad nahm auch der Anteil an Destruktionen der Gefäße zu. Sowohl für Adenokarzinome (3,8 % : 4,6 % : 9,2 %) als auch für Plattenepithelkarzinome (4,6 % : 10,6 % : 11,4 %) konnte ein kontinuierlicher Anstieg beobachtet werden (s. Abb. 23 und 24). Mit Hilfe der Aufschlüsselung der einzelnen Regressionsgrade waren jeweils Besonderheiten darzustellen. Keine großen Gefäße im Regressionsgrad I veränderten sich so stark, daß die Wandschichten nicht mehr deutlich voneinander abzugrenzen waren (s. Tab. 13). Destruktionen konnten im Regressionsgrad II a (10,6 % : 4,6 %) und II b (11,4 % : 9,2 %) vermehrt für Gefäße von Plattenepithelkarzinomen nachgewiesen werden (s. Tab. 10). Vor allem deren große Gefäße zeigten sich doppelt so häufig wie die kleinen betroffen, 14,6 % standen 7,5 % gegenüber. Auffallend geringe Werte erbrachte die Analyse der großen Gefäße von Adenokarzinomen: 0 % : 4,8 % und im Regressionsgrad II b 5,7 %, was sich im Gesamtresultat widerspiegelte. Destruktionen kamen bei Adenokarzinomen seltener vor. 62 80.0 70.0 60.0 [%] 50.0 40.0 30.0 20.0 10.0 0.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen Intimaproliferation Stenosierung Obliteration - narbig Kompression - durch Tumorgewebe Aufsplitterung der M. elastica interna Elastose Adenoca. I 46.2 38.5 34.6 65.4 7.7 3.8 53.8 11.5 30.8 26.9 3.8 Adenoca. II a 63.2 50.6 28.7 37.9 11.5 10.3 49.4 18.4 62.1 44.8 4.6 Adenoca. II b 75.4 4.6 35.4 47.7 10.8 10.8 47.7 6.2 70.8 60.0 9.2 Destruktion Abbildung 23 Abhängigkeit der Gefäßveränderungen vom Regressionsgrad für Adenokarzinome 80.0 70.0 60.0 [%] 50.0 40.0 30.0 20.0 10.0 0.0 Infiltration durch Infiltration durch Intimaproliferation Entzündungszellen Tumorzellen Stenosierung Obliteration - narbig Kompression - durch Tumorgewebe Aufsplitterung der M. elastica interna Elastose Plattenepithelca. I 53.5 37.2 39.5 58.1 4.7 4.7 58.1 34.9 34.9 32.6 4.7 Plattenepithelca. II a 60.6 26.6 33.0 52.1 14.9 12.8 52.1 12.8 67.0 48.9 10.6 Plattenepithelca. II b 60.1 6.3 35.6 58.1 15.1 14.8 36.8 1.4 68.9 46.7 11.4 Destruktion Abbildung 24 Abhängigkeit der Gefäßveränderungen vom Regressionsgrad für Plattenepithelkarzinome 63 4.5. Gefäßveränderungen in Abhängigkeit vom Restlumen 4.5.1. Adeno- und Plattenepithelkarzinome sowie kleine und große Gefäße im Vergleich Für eine Reihe von Gefäßveränderungen ließen sich eindeutige Zusammenhänge zwischen dem Restlumen und den untersuchten Veränderungen aufzeigen. Infiltration durch Entzündungszellen Entzündliche Infiltrationen konnten um so häufiger nachgewiesen werden je größer das Restlumen war. Bei verschlossenen Gefäßen zeigten sich 45,2 % entzündlich infiltriert, bei Gefäßen mit einem Restlumen von weniger als dreißig Prozent stieg der Anteil auf 58,9 % und erhöhte sich weiterhin: 62,7 % betrug er bei Gefäßen, deren Restlumen zwischen 31 und 60 Prozent lag und 65,6 % bei Gefäßen mit 61 bis 100 Prozent Restlumen. Die genannten Zahlen beinhalten die Ergebnisse von Adeno- und Plattenepithelkarzinomen (s. Abb. 25, S. 70). Getrennt betrachtet wiesen Gefäße von Plattenepithelkarzinomen ohne Restlumen deutlich weniger Entzündungszellen in der Wand auf als dies bei Adenokarzinomen der Fall war (65,4 %: 38,5 %, s. Tab. 16). Bei den übrigen Kategorien der Restlumina überwogen insgesamt entzündliche Infiltrationen von Adenokarzinomen, deren große Gefäße in allen Restlumenkategorien deutlich häufiger betroffen waren (s. Tab. 19). Übereinstimmend waren die Beobachtungen bei den großen Gefäßen von Plattenepithelkarzinomen. Lediglich kleine Gefäße dieser Karzinome nahmen kontinuierlich an Infiltration durch Lymphozyten, Granulozyten und Plasmazellen zu, Gefäße aller anderen Kategorien unterlagen Schwankungen, so daß keine Hinweise für eine Abhängigkeit vom Restlumen ergaben. Infiltration durch Tumorzellen Tumorzellinfiltrationen kamen zwar bei Gefäßen mit einem Restlumen von mehr als 61 Prozent ungefähr dreimal so häufig vor wie bei vollkommen verschlossenen Gefäßen (25,0 % : 8,7 %), jedoch lag bei Gefäßen, deren Lumen auf unter 30 Prozent des ursprünglichen Lumens eingeengt war, eine leicht höhere 64 tumoröse Infiltration vor als bei Pulmonalarterienästen mit einem Restlumen zwischen 31 und 60 Prozent (17,8 % : 16,1 %) (s. Abbildung 25). Analog dazu konnten die Veränderungen bei der Aufschlüsselung nach Adeno- und Plattenepithelkarzinomen nachgewiesen werden, bei ersteren waren sie jedoch ausgeprägter zu finden (vgl. Tab. 16). Auffallend war, daß der höchste ermittelte Wert für tumoröse Infiltration bei Gefäßen von Plattenepithelkarzinomen mit 17,8 % bei größtem Restlumen noch unter dem niedrigsten Wert, der für Pulmonalarteriengefäße aus Adenokarzinomen gemessen werden konnte, lag. 19,2 % der Gefäße ohne nachweisbares Restlumen zeigten eine tumoröse Infiltration der Gefäßwände und nahm über 33,3 % (RL <30 %) bzw. 27,3 % (RL 31- 60 %) auf 42,1 % zu. Damit waren fast die Hälfte der Gefäße mit einem Restlumen über 60 Prozent mit Tumorzellen befallen. Kontinuierlich mit höhergradiger verbliebenem Restlumen stiegen die prozentualen Ergebnisse der großen Gefäße von Plattenepithelkarzinomen an (7,7 % : 11,9 % : 14,3 % : 14,9 %, vgl. Tab. 19). Deren kleine Pulmonalarterienäste und die großen Gefäße von Adenokarzinomen unterlagen den bereits oben beschriebenen Schwankungen innerhalb der festgelegten Restlumenkategorien. Kleine Gefäße dieser Tumoren waren durch eine kontinuierliche Zunahme der Tumorzellinfiltration gekennzeichnet, die sich jedoch nicht bei Gefäßen mit einem Restlumen von mehr als 60 Prozent fortsetzen konnte. Allerdings handelte es sich nur um eine Abnahme um 2,1 %. Intimaproliferation Im Gegensatz zu den übrigen analysierten Parametern war bei den Intimaproliferationen in der Aufschlüsselung nach den Restlumina eine deutlich steigende Tendenz der Veränderungen zu beobachten. Eine proliferierende Intima verengte das Lumen häufiger bei Gefäßen mit größerem Restlumen. Die entsprechenden Werte sahen folgendermaßen aus: 1,0 % : 29,2 % : 45,4 % : 46,1 % (s. Abb. 25). Lediglich bei kleinen Gefäßen von Adenokarzinomen konnte eine Intimaproliferation bei einem Restlumen von 0 Prozent nachgewiesen werden. Aufgrund kontinuierlicher Zunahme der großen betroffenen Gefäße beider Tumorarten (0 % : 28,6 % : 44,7 % : 50,0 % für Adenokarzinome sowie 0 % : 34,3 % : 42,9 % : 51,1 % für 65 Plattenepithelkarzinome) wurde die prozentuale Zunahme der Veränderungen mit steigendem Restlumen insgesamt verursacht (s. Tab. 19). Nach einem Anstieg der veränderten Gefäße ohne Restlumen zu der Gruppe, die ein Restlumen von weniger als 30 % hatte, um fast fünfundzwanzig Prozent (5,6 % : 29,6 %) verhielt sich die untersuchten Strukturanomalien der kleinen Pulmonalarterienäste von Adenokarzinomen nicht abhängig von der Einteilung in die verschiedenen Restlumina. Wie die kleinen Gefäße der Plattenepithelkarzinome schwankten sie in der Häufigkeit der Intimaproliferationen von Kategorie zu Kategorie, wobei insgesamt die Zunahmen jedoch ausgeprägter herausstellten. Stenosierung Die Analyse der Ergebnisse stenosierter Gefäße erforderte eine getrennte Darstellung von Adeno- und Plattenepithelkarzinomen (s. Tab. 16). Nachdem lediglich 7,7 % Stenosierungen zu einem völligen Verschluß der Gefäße von Adenokarzinomen beigetragen hatten, waren schon 66,7 % an den Veränderungen beteiligt, die die Gefäße bis auf ein Restlumen von 30 Prozent und weniger einengten. Für ein verbleibendes höheres Restlumen schien ein geringer werdendes Auftreten von stenosierenden Prozessen verantwortlich zu sein. Zu 43,9 % waren Gefäße mit einem Restlumen zwischen 31 und 60 Prozent betroffen und zu 39,5 % Gefäße, deren Lumina am geringsten stenosiert waren. Überwiegend handelte es sich um kleine Gefäße, während das Verhältnis von kleinen und großen stenosierten Gefäßen bei den Plattenepithelkarzinomen insgesamt eher ausgeglichen war (vgl. Tab. 19). Auch bei diesen Tumoren zeigte sich, daß zur Stenosierung führende Gefäßveränderungen nur noch zu einem geringen Anteil bei einem Restlumen von 0 Prozent abgegrenzt werden konnten, welcher bei 3,8 % lag. Zu dem weitaus überwiegenden Teil sind für ein Restlumen von 0 Prozent vor allem Destruktionen oder auch Kompressionen verantwortlich, die das Lumen zu 100 % stenosieren vermögen, was damit einer Obliteration gleichkommt. Auch muß beachtet werden, daß es in der Regel bei einem zu untersuchenden Gefäß zu einer Überlappung mehrerer Gefäßveränderungen gekommen ist, weshalb die Differenzierung einzelner Merkmale erschwert sein kann. 66 Obliteration Zu 82,7 % waren allein Obliterationen an einem Restlumen von 0 % beteiligt, die in der Regel narbig bedingt waren (s. Tab. 15). 83 der 86 betroffenen Gefäße (96,5 %) waren durch Narbengewebe verschlossen. Die Obliteration der verbleibenden Anzahl von Gefäßen kann durch Tumorgewebe, elastische Fasern bei destruierten Gefäßen oder aber durch zusätzliche Kompression von außen verursacht werden. Diskrepanzen ergaben sich bei der Gegenüberstellung von Adeno- und Plattenepithelkarzinomen insofern, als das letztere zu 87,2 % im Vergleich zu 69,2 % der Gefäße von Adenokarzinomen Obliterationen unterlagen (s. Tab. 16). Außerdem unterschieden sich die beiden Tumortypen dadurch, daß einerseits bei den Plattenepithelkarzinomen vermehrt kleine Pulmonalarterien obliteriert waren, andererseits bei den Adenokarzinome vermehrt große Gefäße (s. Tab. 19). Kompression Kompressionen der Gefäßwände nahmen von Pulmonalarterienästen mit Restlumina von 0 % bis 60 % zu und waren bei Gefäßen mit größerem Restlumen wieder etwas seltener ausgeprägt (s. Abb. 25, Tab. 15). Bei beiden Tumortypen konnte diese Beobachtung bestätigt werden (s. Tab. 16). Folgende Ergebnisse fanden sich je höher das verbliebene Restlumen war: 38,5 % : 52,1 % : 53,0 % : 36,8 % komprimierte Gefäße bei Adenokarzinomen und 21,8 % : 37,2 % : 44,8 % : 42,2 % bei Plattenepithelkarzinomen. Auffallend waren die deutlichere Zunahme von Kompressionen bei Gefäßen ohne Restlumen zu solchen, deren Lumen auf weniger als 30 Prozent des Ausgangslumens verengt war und der stärkere Rückgang bei Adenokarzinomen bei höheren Restlumina. Unabhängig von der Differenzierung der Tumoren zeigten sich kleine Gefäße insgesamt anfälliger für Kompressionen (s. Tab. 19). Aufgetretene Ausnahmen ließen aber nicht das Ausmaß erkennen, mit der die großen Gefäße sonst von den kleinen übertroffen wurden. Während tumorbedingte Kompressionen bei Adenokarzinomen kontinuierlich mit höherem Restlumen zunahmen (3,8 % : 12,5 % : 15,2 % : 18,4 %, s. Tab. 16), war bei den Plattenepithelkarzinomen zwar ebenfalls ein Anstieg zu verzeichnen, in deren Verlauf sich 67 eine geringe Schwankung nach unten bei den Gefäßen mit einem Restlumen zwischen 31 und 60 Prozent bemerkbar machte (1,3 % : 7,3 % : 5,5 % : 8,9 %), die sich geringfügig auch im Gesamtresultat der tumorbedingten Kompressionen niederschlug (1,9 % : 8,6 % : 8,0 % : 11,7 %, s. Abbildung 25). Aufsplitterung der M. elastica interna Aufsplitterungen der Membrana elastica interna zeigten eine kontinuierlich abnehmende Tendenz mit größer verbliebenem Restlumen. Genau ¾ der Gefäße ohne nachweisbares Restlumen waren durch eine aufgesplitterte Membran gekennzeichnet und 70,3 % der Gefäße mit weniger als 30 % Restlumen. 61,4 % der Gefäße mit einem Restlumen zwischen 31 und 60 Prozent sowie 46,9 % der Gefäße mit einem Restlumen darüber ließen eine Aufsplitterung der elastischen Membran erkennen (s. Abbildung 25). Eine kontinuierliche Abnahme bestätigte die Aufschlüsselung nach Tumorarten für die Plattenepithelkarzinome (75,6 % : 75,2 % : 63,9 % : 43,3 %). Anders verhielten sich die Ergebnisse für die Gefäße von Adenokarzinomen wie folgende Prozentzahlen aufgelistet nach höhergradig gebliebenem Restlumen belegen: 73,1 % : 56,3 % : 54,5 % : 55,3 % (vgl. Tab. 16). In bezug auf das Verhalten von kleinen und großen Gefäßen innerhalb und im Vergleich der einzelnen Gefäßkategorien ließ sich lediglich der Schluß ziehen, daß kleine Pulmonalarterien mit höhergradiger verbliebenem Restlumen weniger von Aufsplitterungen der elastischen Membran betroffen waren (s. Tab. 19). Elastose Insgesamt vergleichbare Ergebnisse brachten die durch Elastose veränderten Gefäße hervor, so daß sich auch hier eine eindeutige Beziehung der Veränderungen zu dem Restlumen erkennen läßt (s. Abb. 25). Bei geringerem Restlumen hatten zahlreichere Gefäße ihren typischen Wandaufbau durch Elastose verloren. Für alle Gefäße zusammen bedeutete das folgendes: von 59,6 % für Pulmonalarterien ohne Restlumen über 57,3 % (Restlumen < 30 %) und 43,4 % (Restlumen 31- 60 %) wurden schließlich 21,1 % Elastosen für Gefäße mit einem verbleibenden Restlumen von über 60 Prozent ermittelt. 68 Entsprechend dazu stellten sich die Ergebnisse nur für die Plattenepithelkarzinome dar: 62,8 %: 59,1 %: 40,4 % und 18,9 % je höher das verbliebene Restlumen war (s. Tab. 16). Nicht ganz so einheitlich entwickelten sich die Veränderungen bei Adenokarzinomen: 50,0 %: 52,1 %: 51,5 % sowie 26,3 % durch Elastose veränderte Gefäße. Diese Tumoren zeigten ein Überwiegen von betroffenen kleinen Gefäßen ohne Restlumen (55,6 % verglichen mit 37,5 % großer Gefäße) und mehr als 60 % Restlumen (40,0 % : 21,4 %) um nahezu zwanzig Prozent und ein fast ausgeglichenes Verhältnis kleiner und großer Gefäße in den beiden übrigen eingeteilten Gruppen nach verbleibendem Restlumen (51,9 % (klein): 52,4 % (groß) bei einem Restlumen kleiner als 30 % bzw. 50,2 % (klein) : 52,6 % (groß) bei einem Restlumen zwischen 30 und 60 %; s. Tab. 19). Bei Plattenepithelkarzinomen fanden sich annähernd die gleichen Werte für kleine und große Pulmonalarterien, die ein Restlumen aufweisen konnten. Analog zu den Adenokarzinomen machten die kleinen Pulmonalarterien die Mehrheit der verschlossenen Gefäße aus (55,6 % (klein): 37,5 % (groß) für Adenokarzinome und für Plattenepithelkarzinome 65,4 % (klein): 57,7 % (groß)) und übereinstimmend mit den Aufsplitterungen der Membrana elastica interna kennzeichnete diese Gefäße eine kontinuierliche Abnahme der Veränderungen mit höhergradig verbliebenem Restlumen (kleine Gefäße von Adenokarzinomen 55,6 % : 51,9 % : 50,0 % : 40,0 %; kleine Gefäße von Plattenepithelkarzinomen 65,4 % : 57,1 % : 39,6 % : 18,6 %; vgl. Tab. 19). Destruktion Bei Gefäßen ohne Restlumen lagen die meisten destruierten Gefäße vor. 56,7 % der Gefäße waren derart verändert, daß der typische Wandaufbau nicht mehr zu erkennen war (s. Abb. 23). Deutlich mehr Destruktionen konnten in allen Restlumina- Gruppen bei Plattenepithelkarzinomen nachgewiesen werden. Ungefähr doppelt so hoch erwies sich im Vergleich zu den Adenokarzinomen die Anzahl destruierter Gefäße von Plattenepithelkarzinomen (s. Tab. 16). Den 65,4 % der Gefäße ohne Restlumen standen 30,8 % destruierte Gefäße von Adenokarzinomen gegenüber. Kleine Gefäße, die jeweils zu 88,5 % bzw. zu 37,5 % betroffen waren, schienen für das hohe Ausmaß der Veränderungen verantwortlich zu sein (s. Tab. 19). 69 11,7 % der Gefäße von Plattenepithelkarzinomen und 6,3 % von Adenokarzinomen trugen dazu bei, das Lumen von insgesamt 185 Gefäßen auf weniger als 30 % einzuengen. Beteiligt waren bei den erstgenannten Tumoren im Gegensatz zu den anderen wiederum vermehrt die kleinen Gefäße. In ihrem Wandaufbau gestörte Pulmonalarterienäste, die dennoch über ein Restlumen von 30- 60 % verfügten, wurden nur bei Plattenepithelkarzinomen mit einer Häufigkeit von 2,2 % gefunden (s. Tab. 16). Destruierte Gefäße mit einem höherem Restlumen gab es nicht. Zusammenfassend resultierten 56,7 %, 10,3 % und 1,6 % Zerstörungen der Gefäßwände in Abhängigkeit von den verbliebenen Restlumina 0 %, < 0 % bzw. 31- 60 % (s. Abbildung 25). 43.4 46.9 56.7 59.6 57.3 61.4 46.5 47.0 40.6 45.4 46.1 [%] 45.2 60.0 53.9 58.9 62.7 65.6 70.0 50.0 62.2 65.9 80.0 75.0 70.3 79.8 82.7 90.0 0% 31- 60 % 21.1 10.3 Destruktion Elastose Aufsplitterung der M. elastica interna 1.6 0.0 1.9 - durch Tumorgewebe - narbig < 30 % Kompression 0.0 0.0 0.0 0.5 0.8 0.0 Stenosierung Intimaproliferation Infiltration durch Tumorzellen Infiltration durch Entzündungszellen 0.0 Obliteration 1.0 10.0 4.8 8.7 20.0 8.6 8.0 11.7 17.8 16.1 30.0 26.0 25.0 29.2 40.0 61- 100 % Abbildung 25 Abhängigkeit der Gefäßveränderungen vom Restlumen für Adeno- und Plattenepithelkarzinome zusammen 70 4.6. Ergebnisüberblick 4.6.1. Wichtigste Gefäßveränderungen Insgesamt konnten Aufsplitterungen der Membrana elastica interna, entzündliche Infiltrationen gefolgt von Stenosierungen, Elastose und Kompressionen sowie Intimaproliferationen als die häufigsten vorkommenden Gefäßveränderungen identifiziert werden. Im Vergleich dazu traten tumorbedingte Infiltrationen und Kompressionen, Obliterationen und Destruktionen in den Hintergrund. Auffallend bei der Gegenüberstellung beider histologischen Tumortypen zeigten sich vermehrt Tumorzellinfiltrationen und Kompressionen bei Adenokarzinomen, Stenosierungen und Destruktionen dagegen mehr bei Plattenepithelkarzinomen. Deutliche Unterschiede erbrachten die Untersuchungen getrennt nach kleinen und großen Gefäßen für zwei Kriterien. Der Nachweis von Entzündungszellen in der Gefäßwand gelang häufiger bei großen Pulmonalarterienästen, Obliterationen überwogen bei kleinen Gefäßästen. Besonders deutliche Ergebnisse ließen sich in Abhängigkeit von den Regressionsgraden darstellen. Kontinuierliche, mit steigendem Regressionsgrad zunehmende Werte konnten für Gefäßveränderungen wie entzündliche Infiltrationen und Elastosen bei Adenokarzinomen, Obliterationen bei Plattenepithelkarzinomen und außerdem narbig bedingte Obliterationen, Destruktionen sowie Aufsplitterungen der Membrana elastica interna bei beiden Tumorarten ermittelt werden. Nicht kontinuierlich, aber dennnoch mit eindeutiger Tendenz, daß die Veränderungen von zunehmendem Charakter in Abhängigkeit von höheren Regressionsgraden stehen, zeichneten sich bei entzündlichen Infiltrationen und Elastosen von Plattenepithelkarzinomen und bei Obliterationen von Adenokarzinomen ab. Ein kontinuierlichen Rückgang der Veränderungen konnte für Tumorzellinfiltration und tumorbedingte Kompressionen bei Plattenepithelkarzinomen und für Kompressionen generell belegt werden. Übereinstimmend wurde sowohl für eine Infiltration und als auch für eine Kompression durch Tumorzellen bei Adenokarzinomen im Regressionsgrad II a ein höherer Wert als im Regressionsgrad I beobachtet, jedoch ließen sich im Regressionsgrad II b deutlich geringere tumorbedingte Veränderungen finden, so daß die Gesamttendenz als abnehmend zu bezeichnen ist. 71 Stenosierungen bei Adenokarzinomen hingegen wurden, allerdings ebenfalls nicht kontinuierlich, weniger. Intimaproliferationen bei beiden Tumortypen waren zwar Schwankungen unterworfen, aber ihr Anteil blieb im Verlauf zunehmender regressiver Tumorveränderungen in etwa konstant. Außer den beschriebenen Zusammenhängen von Gefäßveränderungen und Tumorart, Gefäßgröße, Regressionsgrad stellten sich bei der Auflistung nach verbleibendem Restlumen einige Charakteristika ein. Obliterationen und Destruktionen kamen, was per definitionem zu erwarten war, bei den Gefäßen ohne Restlumen mit deutlichem Abstand am häufigsten vor. Aufsplitterungen der elastischen Membran und Elastose waren in dieser Kategorie ebenfalls am stärksten ausgeprägt, nahmen weiterhin kontinuierlich mit zunehmendem Restlumen ab. Deutlich zunehmende Infiltrationen durch Entzündungs- und Tumorzellen gelang es vermehrt bei Gefäßen mit höherem Restlumen nachzuweisen. Auch Intimaproliferationen stiegen in Abhängigkeit von größerem Restlumen kontinuierlich an. Auffallend war außerdem, daß sowohl Stenosierungen als auch Kompressionen bei Gefäßen ohne nachweisbarem Restlumen in geringerem Ausmaß gefunden wurden. Gefäße mit verbleibendem Restlumen dagegen wiesen unabhängig von der Größe des Restlumens einen deutlich höheren Anteil stenosierter und komprimierter Gefäße auf, der jedoch nicht mit höherem Restlumen in Beziehung stand. Die ermittelten Werte unterlagen nur geringen Schwankungen. 72 5. DISKUSSION 5.1. Lassen sich Gefäßveränderungen behandelter Tumoren mit denen vergleichen, die keiner präoperativen Therapie unterzogen waren ? 5.1.1. Vergleich der Gefäßveränderungen insgesamt Einige der hier untersuchten Gefäßveränderungen wie entzündliche Veränderungen, tumoröse Infiltration, Stenosierung, Obliteration, Aufsplitterung der Membrana elastica interna, Elastose sowie Destruktion konnten bereits bei Pulmonalarterienästen in unbehandelten Lungentumoren beschrieben werden. In Abhängigkeit von verschiedenen Tumorzonen ließen sich Aussagen treffen über ein unterschiedlich häufiges Vorkommen von Gefäßveränderungen im Tumorzentrum bis hin zur Tumorperipherie (Fisseler- Eckhoff u. Müller 1994). Erwartungsgemäß lag der prozentuale Anteil tumorös infiltrierter Gefäße bei nicht behandelten Lungentumoren wesentlich höher als bei denen mit Status nach Therapie. Nahezu alle Gefäßwände (96 %) waren bei ersteren mit Tumorzellen durchsetzt, während nach erfolgter Therapie lediglich 18,0 % der Gefäße noch durch Tumorzellbefall auffielen (vgl. Tab. 1). Insgesamt fanden sich 54 % entzündlich veränderte Gefäße in unbehandelten Lungentumoren. Ein etwas höherer Wert (61, 1 %) konnte bei Tumoren nach Therapie ermittelt werden. Obliterierte Gefäße wurden nur halb so häufig in behandelten Tumoren gefunden, nämlich zu 13,2 %, hingegen zu 32 % bei Tumoren ohne präoperative Therapie. Dieser Befund ist in sofern nicht überraschend, da die Mehrheit der Obliterationen bei nicht behandelten Tumoren durch Tumorzellen hervorgerufen wurde, die, wie oben beschrieben, nach Therapie deutlich weniger in den Gefäßwänden beobachtet werden konnten. Im Gegensatz dazu waren bei vorbehandelten Tumoren über 90 % der obliterierten Gefäße (=12,5 % aller Gefäße) narbig verschlossen. Vergleichbare Werte ergaben sich für komprimierte Gefäße: 46 % bei Pulmonalarterienäste ohne therapeutische Vorbehandlung standen 43,7 % nach Therapie gegenüber. 73 Nicht ganz so viele Gefäße, für deren Membrana elastica interna eine Aufsplitterung aufgezeigt werden konnte, wie bei unbehandelten Lungentumoren (80 %) waren in Lungentumoren vorhanden (64,3 %), die zuvor einer Chemo- /Radiotherapie ausgesetzt waren. Eine Elastose kam bezogen auf die Tumorzonen unbehandelter Lungentumoren in unterschiedlichem Ausmaß vor. Zwischen 65 % der Pulmonalarterienäste im Tumorzentrum und 32 % in der Tumorperipherie wiesen dieses Strukturveränderung auf, während bei der Analyse von posttherapeutischen Gefäßschäden Elastosen zu einem Prozentsatz von 46,4 % nachgewiesen werden konnten. Eine deutliche Diskrepanz ergab der Vergleich destruierter Gefäße. Waren 60 % der Gefäße aus unbehandelten Tumoren derart verändert, daß sich kein regelrechter Wandaufbau mehr erkennen ließ, kam dies lediglich bei 9,5 % der Gefäße behandelter Tumoren vor. Hier bietet sich an, die Gefäßveränderungen unbehandelter Tumoren mit denen des Regressionsgrades I zu vergleichen. Dabei gehen die Regressionsphänomene nicht über die einer spontanen Tumorregression hinaus. Fraglich ist demnach, ob die ermittelten Gefäßveränderungen dieses Regressionsgrades überhaupt therapieinduzierte Veränderungen darstellen, wenn sich schon für den Tumor kaum Auswirkungen der Therapie ergeben haben. Einzig für entzündlich veränderte Pulmonalarterienäste konnten bei diesem Vergleich annähernd gleiche Werte verzeichnet werden. 50,7 % der Gefäße im Regressionsgrad I (s. Tab. 6) wiesen Entzündungszellen auf und bei Gefäßen aus unbehandelten Tumoren waren es 54 %. Auch Kompressionen ließen sich mit nur zehn Prozent Differenz bei Gefäßen aus unbehandelten Tumoren (46 %) und aus dem Regressionsgrad I (56,6 %) nachweisen. Bei allen übrigen untersuchten Gefäßwandveränderungen fanden sich sehr unterschiedliche Ergebnisse: Infiltrationen durch Tumorzellen waren zwar im Regressionsgrad I häufiger (37,7 %) als in der Gesamtheit der präoperativ behandelten Tumoren (18,0 %) zu beobachten (vgl. Tab. 6), jedoch ist die tumoröse Infiltration bei 96 % der untersuchten unbehandelten Lungentumoren fast dreimal so hoch. Gravierende Unterschiede ergaben sich auch für Obliterationen (32 % bei unbehandelten Tumoren versus 5,8 % im Regressionsgrad I), Aufsplitterungen der Membrana elastica 74 interna (80 % bei unbehandelten Tumoren versus 33,3 % im Regressionsgrad I) und Destruktionen (60 % bei unbehandelte Tumoren versus 4,3 % im Regressionsgrad I). Die Werte weisen so erhebliche Differenzen auf, daß sie einen Vergleich der Wandveränderungen von nicht behandelten und Gefäßen aus dem Regressionsgrad I therapierter Lungentumoren nicht rechtfertigen. Aufgrund der Unterschiede ist davon auszugehen, daß die Gefäßveränderungen im Regressionsgrad I doch im Zusammenhang mit der erfolgten präoperativen Therapie stehen, da sich sonst bei dem Vergleich ähnlichere Werte hätten ergeben müssen. Abgesehen davon ist es nicht möglich, anhand der Veränderungen, wie sie sich histologisch darstellen, auf die Pathogenese, sei es therapieinduziert oder therapieunabhängig, schließen zu wollen. Zusammenfassend läßt sich festhalten, daß der Vergleich zwischen Veränderungen von Gefäßen aus dem Stroma unbehandelter Lungentumoren und denen, die einer präoperativen Therapie unterzogen waren, z. T. deutliche Unterschiede einiger Gefäßveränderungen hervorbringt. Wichtig bleibt jedoch die Feststellung, daß bei der Untersuchung von therapieinduzierten Gefäßschäden keine Veränderungen zu beobachten waren, die nicht auch schon bei Tumoren ohne präoperativ durchgeführter Therapie beschrieben worden waren. Es handelt sich also nicht um spezifische Gefäßreaktionen auf die erfolgte Therapie, dem gefäßführenden Stroma ist es demnach nicht möglich, qualitativ anders auf Noxen zu reagieren. 75 5.1.2. Vergleich der Gefäßveränderungen getrennt nach Tumortyp und Gefäßgröße Hier stellt sich die Frage, ob sich für Adeno- und Plattenepithelkarzinome unterschiedliche Ergebnisse eruieren lassen. Infiltration durch Entzündungszellen Innerhalb der jeweiligen Gruppen von Tumoren (behandelte vs. nicht behandelte) waren für Adeno- und Plattenepithelkarzinome annähernd gleich hohe Werte für entzündliche Infiltrationen auswertbar. Bei Tumoren nach Therapie waren dies für Adenokarzinome 65,2 % und für Plattenepithelkarzinome 59,6 % (s. Tab. 1), hingegen wurden entsprechend bei unbehandelten Tumoren 81 % bzw. 87 % entzündlich veränderte Gefäße in der Tumorperipherie gefunden. Zu beachten ist, daß entzündliche Infiltrationen vom Tumorzentrum hin zur Peripherie von zunehmender Häufigkeit waren, was eine immunologische Reaktion zwischen Tumorgewebe und noch nicht infiltriertem Gewebe vermuten läßt, zumal die Rolle der Entzündung im Rahmen der Tumorexpansion bislang nicht geklärt werden konnte (Ioachim et al. 1976). Womöglich läßt sich die Differenz von ca. 20 % zwischen beiden Tumorgruppen durch verschiedene pathogenetische Mechanismen erklären. Auf der einen Seite stehen die immunologischen Abwehrmechanismen des Lungengewebes, auf der anderen Seite stellen entzündliche Veränderungen ein typisches Korrelat nach erfolgter Radio-/ Chemotherapie dar. Während bei nicht behandelten Lungentumoren keine Beziehung zur Gefäßgröße hergestellt werden konnte, ließen sich bei behandelten Tumoren sowohl für Adeno- als auch für Plattenepithelkarzinome vermehrt große Gefäße mit Infiltrationen durch Entzündungszellen nachweisen (s. Tab. 4). Infiltration durch Tumorzellen Analog zu den Befunden unbehandelter Tumoren zeigte sich auch bei den Tumoren nach Therapie eine höhere Anzahl von Gefäßen, hier auch wieder mehr die größeren Gefäße, aus Adenokarzinomen tumorös infiltriert (s. Tab. 1 und 4). Dies könnte darauf zurückzuführen sein, daß Adenokarzinome eine invasivere Potenz besitzen als Plattenepithelkarzinome. 76 Stenosierung Stenosierende Prozesse kamen bei 28 % der Gefäße in der Tumorperipherie jeweils für unbehandelte Adeno- und Plattenepithelkarzinome vor, für Gefäße in behandelten Tumoren konnte dagegen ein wesentlich höherer Anteil an Stenosierungen ausgemacht werden. So waren dies für Adenokarzinome 45,5 % und für Plattenepithelkarzinome 57,0 % (s. Tab. 1), hier vor allem wieder die großen Gefäße. Ursächlich kommt in erster Linie der hohen Anzahl von Intimaproliferationen eine Bedeutung zu. Obliterationen Bei Obliterationen konnte ebenfalls eine Diskrepanz zwischen behandelten und unbehandelten Tumoren nachgewiesen werden. Lediglich 4 % der Pulmonalarterienäste in nicht- behandelten Adenokarzinomen waren in der Tumorperipherie obliteriert, gar keine obliterierten Gefäße waren bei Plattenepithelkarzinomen in dieser Region ausfindig zu machen. Bei Gefäßen präoperativ behandelter Tumoren ließ sich bei Adeno- bzw. Plattenepithelkarzinomen ein Anteil von 10,7 % bzw. 14,1 % obliterierter Gefäße belegen (s. Tab. 1). Die überwiegende Mehrheit dieser Gefäßverschlüsse kam durch narbiges Gewebe zustande (9,8 % in bezug auf 10,7 % bzw. 13,5 % in bezug auf 14,1 %), so daß in Zusammenhang mit dem beobachteten häufigen Vorkommen von ausgedehnten bindegewebigen Arealen in der Umgebung von Gefäßen mit zum Teil verbliebenen geringen Tumorresten durchaus von therapieinduzierten Veränderungen ausgegangen werden kann. Aufsplitterungen der M. elastica interna Aufsplitterungen der Membrana elastica interna waren sowohl bei behandelten wie auch bei nicht behandelten Lungentumoren ein sehr häufig zu beobachtendes Kennzeichen der veränderten Gefäßwände, wenn auch bei letztgenannten Tumoren in geringerer Häufigkeit: 60,7 % bzw. 65,6 % jeweils für Adeno- und Plattenepithelkarzinome (s. Tab. 1) sowie 83 % für Gefäße beider Tumortypen unbehandelter Lungentumoren. Elastose Eine Vermehrung und Verdichtung elastischer Fasern konnte dagegen vermehrt bei präoperativ behandelten Tumoren nachgewiesen werden. Waren 33 % der Gefäße aus 77 Adenokarzinomen und 32 % aus Plattenepithelkarzinomen unbehandelter Tumoren von einer Elastose betroffen, so zeigten 47,8 % bzw. 45,9 % aller Gefäße dieses Merkmal bei behandelten Lungentumoren (s. Tab. 1). Berücksichtigt werden muß allerdings auch, daß es in Abhängigkeit vom Untersucher differierende Angaben über das Vorliegen einer Gefäßanomalie geben kann. Destruktion Destruierte Gefäße fanden sich jedoch häufiger bei nicht behandelten Tumoren, bei denen die Destruktion mehrheitlich durch infiltrative, tumoröse Prozesse hervorgerufen wurde. Hingegen waren bei Tumoren nach Radio-/ Chemotherapie in erster Linie narbige Prozesse und Veränderungen der elastischen Fasern als Ursache für die Destruktion auszumachen. Es bleibt festzuhalten, daß sich destruierte Gefäße in nicht behandelten Lungentumoren gar nicht (Plattenepithelkarzinome) bzw. nur zu 4% (Adenokarzinome) in der Tumorperipherie fanden und von dem ermittelten Gesamtwert an Destruktionen allein über ¾ von Gefäßen aus dem Tumorzentrum gestellt wurde. Für Adenokarzinome ergab sich ein Anteil von 6,2 % destruierter Gefäße nach erfolgter Therapie, für Plattenepithelkarzinome 10,7 % (s. Tab.1). Restlumen Mehrere Veränderungen sind in der Lage, das Lumen des Gefäßes zu verkleinern. Da außerdem in der Regel eine unterschiedliche Kombination von Veränderungen bei einem Gefäß auftrat, summierten sich die Effekte. In Abhängigkeit von den einzelnen Tumorzonen konnten stark differierende Ergebnisse für das Ausmaß der Verengung des Gefäßlumens gefunden werden. So war bei ungefähr 60 % aller Gefäße aus unbehandelten Tumoren, die im Tumor selbst gelegen waren, ein verbleibendes Restlumen von weniger als 20 % zu verzeichnen, in der Tumorperipherie hingegen stellten Gefäße mit einem verbleibendem Restlumen über 70 % einen Anteil von 55 % für Adenokarzinome und 76 % für Plattenepithelkarzinome. Bei Gefäßen aus behandelten Lungentumoren betrug der Anteil der Gefäße mit weniger als 60 % Restlumen sogar 80,2 %. Dies hat allerdings für die verschiedenen Tumoren eine unterschiedliche Bedeutung. Sind durch Verkleinerung des Gefäßlumens bei den einen Tumoren z.B. Chemotherapeutika nicht in der Lage den Tumor zu erreichen, kann eine reduzierte Versorgung des Tumors 78 gewünschte Folge der Therapie sein, so daß es zu Tumornekrosen und damit zu einer Verkleinerung des Tumors kommt. Zusammenfassend ist festzuhalten, daß es bei einigen Gefäßveränderungen Unterschiede in der Häufigkeit des Vorkommens gibt, jedoch muß auch berücksichtigt werden, daß unterschiedliche Ursachen, die in Zusammenhang mit der durchgeführten Therapie stehen, für die Veränderungen verantwortlich sein können. Abhängigkeiten von der Gefäßgröße ließen sich bei unbehandelten Tumoren nicht nachweisen (Nowakowski 1992). Im Gegensatz dazu waren bei Gefäßen, die präoperativ behandelten Tumoren entstammten, außer bei Aufsplitterungen der Membrana elastica interna, Elastose und Destruktionen Beziehungen zur Gefäßgröße herzustellen. 5.2. Stellen die Gefäßveränderungen Resultate der Therapie dar ? 5.2.1. Gefäßveränderungen therapieunabhängiger Genese Grundsätzlich kann zwischen Veränderungen unterschieden werden, die mit zunehmendem Alter auftreten, und denen, die in Zusammenhang mit Erkrankungen zu beobachten sind. Hierbei handelt es sich in erster Linie um Erkrankungen des Herz- Kreislaufsystems, die Rückwirkungen auf das pulmonale Gefäßsystem nehmen können. Im Vordergrund stehen unabhängig von der Ursache Veränderungen der Intima. Als die auffälligsten Befunde altersbedingter Veränderungen wurden Intimaproliferationen schon frühzeitig beschrieben (Brenner 1935). Doch auch im Rahmen verschiedener Erkrankungen sind Intimaveränderungen charakteristisch. So stehen Proliferationen der innersten Gefäßschicht wie auch die Mediahypertrophie am Anfang von komplexen Veränderungen, die unter der Bezeichnung der plexogenen Arteriopathie zusammengefaßt werden. Intimafibrosierung mit Einlagerung glatter Muskelzellen, Dilatation der Gefäße, kavernöse und angiomatöse Läsionen sowie fibrinoide Nekrosen und entzündliche Infiltrationen kennzeichnen den Endzustand, der die Zerstörung der Arterienwand bedeutet (Naeye u. Vennart 1960; Wagenvoort 1988). 79 Zu finden sind diese ausgeprägten Gefäßveränderungen vor allem bei Septumdefekten, Mitralstenosen, chronischer Hypoxie und primärer pulmonaler Hypertension (Wagenvoort 1988). Intimafibrosen und Mediahypertrophie lassen sich jedoch auch bei pulmonaler Hypertension anderer Genese nachweisen. Im Gegensatz dazu unterliegt die Media mit höherem Lebensalter kaum einer Dickenzunahme, wenn auch Unregelmäßigkeiten im Querschnitt zu beobachten sind (Wagenvoort u. Wagenvoort 1965). Die Autoren stellen in dieser Arbeit ebenfalls heraus, daß eine Abgrenzung der einzelnen Gefäßschichten durch die elastischen Membranen nicht mehr gewährleistet ist. Untersuchungen von Simons u. Reid sowie Harris u. Heath haben ergeben, daß elastische Anteile der Gefäßwand mit zunehmendem Alter weniger werden, wohingegen hyaline und kollagene Komponenten zunehmen (Simons u. Reid 1969, Harris u. Heath 1977). Beschreibungen krankheitsbedingter Pulmonalarterienveränderungen gehen nicht auf Veränderungen elastischer Membranen oder einzelner Bestandteile der Gefäßwand ein. Im Zusammenhang mit thrombembolischen Ereignissen resultieren exzentrische Intimafibrosen (Wagenvoort u. Wagenvoort 1970). Auch ist im Rahmen der Intra- und Extravasation von Tumorzellen die Entstehung von Thromben ein häufig zu beobachtendes Phänomen (Warren 1976; Engel et. al. 1988; Gabbert 1989). Die meisten der genannten Gefäßveränderungen werden von den Autoren als typisch altersbedingt beschrieben oder aber bestimmten Erkrankungen zugeordnet. Sie lassen sich allerdings zum einen ebenfalls in unbehandelten Lungentumoren wie auch bei Tumoren, die einer präoperativen Radio-/ Chemotherapie unterzogen waren, wiederfinden. Daher ist bei den ermittelten Gefäßveränderungen sicherlich davon auszugehen, daß zumindest zum Teil eine Überlagerung von therapieinduzierten und altersbedingten oder auch krankheitsbedingten Veränderungen vorliegt. Das durchschnittliche Alter der in die Studie aufgenommenen Patienten liegt bei 56,9 Jahren, während zu den möglichen Begleiterkrankungen, abgesehen von den allgemeinen Einschlußkriterien, keine Angaben vorliegen. Auch durch die Tatsache, daß sowohl bei den als altersbedingt beschriebenen Veränderungen als auch bei den Veränderungen im Rahmen von tumorunabhängigen Erkrankungen Angaben zu deren Häufigkeit und Ausprägung fehlen, läßt sich im einzelnen nicht näher differenzieren, welcher Genese die Gefäßveränderungen sind und vor allem zu welchem Anteil alters- und 80 krankheitsbedingte Veränderungen die Ergebnisse therapiebedingter Gefäßveränderungen beeinflussen. 5.2.2. Typische Gefäßveränderungen nach Strahlen- und Chemotherapie Die meisten der in dieser Arbeit untersuchten Gefäßveränderungen lassen sich in Beschreibungen zur Reaktion des Gewebes auf eine Strahlentherapie und auch nach Anwendung von Chemotherapeutika wiederfinden. Die Gefäßveränderungen betreffen in erster Linie Schäden des Gefäßendothels. Es kommt zur Verquellung, Wucherung von Endothelzellen mit nachfolgender Hyalinisierung (Warren u. Gates 1940; Stone et al. 1956; Sweany et al. 1959). Die Intimaproliferation führt nicht nur zu verminderter Blutversorgung des nachgeschalteten Gewebes, sondern auch in Zusammenspiel mit weiteren Veränderungen der Gefäßwand zu einer Permeabilitätsstörung (Reinhold 1972). Entzündungszellen gelangen im Rahmen der Blutungen aus der intravasalen Strombahn und sind in der Gefäßwand und perivaskulär in ödematösem Gewebe zu finden (Warren u. Gates 1940; Jenning u. Arden 1961; White 1972). In Zusammenhang mit der Entstehung der Zytostatika- Pneumopathie werden neben der Schädigung des Alveolarepithels und der Pneumozyten ebenfalls die Endothelveränderungen hervorgehoben. Begünstigt wird dadurch die Entstehung von Mikrothromben. Resultat der vermehrten Thrombosierung stellen exzentrische Intimaproliferationen dar, die bei der Auswertung ebenfalls Berücksichtigung fanden (Flubacher et al. 1977). In bezug auf elastische Komponenten der Gefäßwand kann in Übereinstimmung mit mehreren Autoren festgehalten werden, daß eine präoperative Strahlentherapie zu einer generellen Überproduktion elastischer Fasern führt und diese außerdem eine Aufsplitterung erfahren (Engelstad 1934; Cottier 1956; Holsten 1963). Daß die beiden genannten Veränderungen zu einem hohen Prozentsatz in Lungentumoren nach erfolgter Bestrahlung nachgewiesen werden konnten, kann als Argument dafür dienen, daß es sich bei diesen Wandveränderungen durchaus um therapieinduzierte Veränderungen handelt. Wie auch bei alters- und krankheitsbedingten Gefäßveränderungen liegen bei therapieinduzierten Veränderungen bislang in der Literatur keine Angaben zu Häufigkeit und Ausmaß der morphologischen Veränderungen vor, so daß anhand der ermittelten Ergebnisse 81 keine Beurteilung zur Frage, inwieweit sich zum Beispiel Strahlenreaktion und Wirkung der verwendeten Chemotherapeutika beeinflussen, möglich ist. Allerdings wird seit Anwendung multimodaler Behandlungskonzepte mehrfach davon berichtet, daß unter anderem ausgeprägtere Lungen- und Gefäßschäden auftreten, sei es durch additive oder sensitivierende Wirkung, wenn die Bestrahlung in Kombination mit einer Chemotherapie erfolgte (Phillips u. Fu 1976). 5.2.3. Gefäßveränderungen abhängig vom Ausmaß der therapieinduzierten Tumorregression Charakteristische morphologische Veränderungen nach neoadjuvanter Therapie nichtkleinzelliger Lungentumoren stellen unterschiedlich große kokardenförmige Herde mit zentraler Nekrose, meist umgeben von einem schmalen Schaumzellsaum und gefäßreichem Granulationsgewebe dar. Außerdem kommt es zu ausgeprägter narbiger Fibrosierung im Bereich des Primärtumors. Nachweisbar sind zum Teil auch Ausfällungen von Cholesterinkristallen mit angelagerten mehrkernigen Riesenzellen im Randbereich von Tumornekrosen oder Schaumzellnestern (Junker et al. 1997). Neben dem Vorhandensein und Ausmaß von vitalem Tumorgewebe tragen die genannten Veränderungen zur Festlegung des Regressionsgradings bei (Junker et al. 1995 a). Je ausgeprägter die Veränderungen und damit auch die therapieinduzierte Tumorregression ist, desto höher ist der Regressionsgrad. Vom genannten Autor konnte bereits in früheren Untersuchungen gezeigt werden, daß die beschriebenen morphologischen Veränderungen im Primärtumorbereich auch bei kleinzelligen Lungentumoren als Therapiefolge angesehen werden können (Junker et al. 1995 b). Als Zeichen spontaner Tumorregression zeigten sich in nicht- behandelten Lungentumoren durchaus fokale Nekrosezonen, die jedoch im Gegensatz zu den zentralen Nekrosen präoperativ behandelter Tumoren unmittelbar von einem vitalen Tumorsaum umgeben waren und zu 65 % im Randbereich eine granulozytäre Reaktion aufwiesen. Nur gelegentlich ließen sich kleine Schaumzellansammlungen nachweisen (Junker 1998). 82 Sicherlich ist davon auszugehen, daß sich bei präoperativ behandelten Tumoren zu einem unbekannten Anteil spontane und therapieinduzierte Regressionsphänomene überlagern, während bei unbehandelten Tumoren lediglich spontane Tumorregression vorkommen kann. Da in Abhängigkeit vom Regressionsgrad die therapieinduzierten Veränderungen des Tumors zunehmen, kann auch davon ausgegangen werden, daß sich analog dem Gewebe im Bereich des Primärtumors auch die Gefäße zunehmend regressiv verändern. Somit ist es durchaus gerechtfertigt, das Regressionsgrading zur Beurteilung der Frage, ob und in welchem Ausmaß Gefäßveränderungen als therapiebedingt angesehen werden können, heranzuziehen. Die Ergebnisse dieser Arbeit weisen darauf hin, daß zumindest für einige der untersuchten pathologischen Gefäßveränderungen eine Abhängigkeit vom Regressionsgrad besteht. Infiltration durch Entzündungszellen Zutreffend ist dies für entzündliche Veränderungen im Bereich der Gefäßwand, insbesondere für Gefäße, die dem Stroma von Adenokarzinomen entstammen. Sowohl im Rahmen der strahleninduzierten Vaskulitis als auch nach Anwendung chemotherapeutischer Medikamente sind angiitische Prozesse für den weiteren Verlauf der Gefäßschäden von zentraler Bedeutung. Allerdings konnten in unbehandelten Tumoren in bestimmten Tumorzonen ebenfalls zu einem vergleichbar hohen Prozentsatz entzündliche Veränderungen der Pulmonalarterien nachgewiesen werden, was dagegen sprechen würde, daß entzündliche Prozesse eine spezifische Reaktion des Gefäßgewebes auf therapeutische Maßnahmen darstellen (FisselerEckhoff u. Müller 1994). Analog zu den Befunden, daß entzündliche Gefäßveränderungen vermehrt in der Tumorperipherie zu finden sind (Nowakowski 1992), fiel vor allem im Randbereich von Nekrosezonen präoperativ behandelter Tumoren ein entzündliches Geschehen auf. Einerseits kann dies unmittelbar im Zusammenhang mit den Vorgängen, die zur Nekrose des Gewebes führen, stehen oder es handelt sich hierbei um eine Auseinandersetzung regressiv veränderten Gewebes im Sinne einer Abwehrfunktion mit der nicht- involvierten Umgebung. 83 Infiltration durch Tumorzellen Entsprechend der Definition des Regressiongradings war auch bei den Gefäßen eine deutliche Abnahme der Infiltration durch Tumorzellen mit zunehmendem Regressionsgrad zu verzeichnen. Besonders auffallend war, daß hierzu gut folgendes Ergebnis korreliert: im Regressionsgrad II b war bei keiner der untersuchten Einflußgrößen wie Tumortyp und Gefäßgröße ein höherer Prozentsatz als zehn Prozent Tumorinfiltrationen zu finden (vgl. Tab. 6, Tab. 8, Tab. 12). Definitionsgemäß muß der Anteil von vitalem Tumorgewebe weniger als zehn Prozent betragen, damit eine Einteilung in das Regressionsgrad II b vorgenommen werden darf (Junker et al. 1995 a). Daß hingegen bei den Pulmonalarterien aus Adenokarzinomen im Regressionsgrad II a eine vermehrte Tumorzellinfiltration im Vergleich zum Regressionsgrad I zu beobachten war, muß als zufällig angesehen werden. Im Hinblick auf die Rolle der sogenannten “dormant cells“, denen im Rahmen der Tumorangiogenese und damit der Expansion des Tumors eine besondere Bedeutung zukommt, ergaben sich anhand einiger morphologischer Besonderheiten sehr interessante Aspekte. Das Konzept der schlafenden Zellen umfaßt nach Folkman folgende Beobachtungen, die zum Teil auf experimenteller Basis beruhen (Folkman 1974; Folkman u. Cotran 1976): Tumoren sind in der Lage, bis zu einer bestimmten Größe, die auf wenige Millimeter, etwa 1- 2 mm im Durchmesser, beschränkt ist, in einem avaskulären Stadium zu wachsen. In diesem Stadium kann das Tumorwachstum für unbestimmte Zeit zum Stillstand kommen. Es macht den Eindruck, daß der Tumor schläft. Allerdings ruht der Tumor nicht völlig, es liegt vielmehr eine Tumorzellproliferation in der Peripherie vor, während im Tumorzentrum Zellen apoptotisch werden, so daß der Gesamtdurchmesser über eine bestimmte Größe nicht hinauskommt. Als limitierend hat sich die Oberflächengröße herausgestellt, da über sie die Tumorversorgung mittels Absorption von Nährstoffen und ebenso die Eliminierung von Kataboliten des Tumorstoffwechsels erfolgt. 84 Der Veränderung zytologischer und zytochemischer Strukturen von der Tumorperipherie in Richtung Tumorzentrum legten auch Caspersson und Santesson einen Gradienten in der Tumorversorgung durch Diffusion zugrunde (Thomlinson u. Gray 1955). Während der avaskulären Phase verlieren die Zellen nicht ihre Überlebensfähigkeit. Im Gegenteil, sie können unter anderem Substanzen produzieren, die beim Wirt die Bildung neuer Kapillaren bewirkt, die schließlich den Tumor erreichen. Daß es solche Substanzen geben muß, wurde schon 1907 von Goldmann vermutet, jedoch gelang es erst wesentlich später den sogenannten “Tumor- Angiogenese- Faktor“ zu isolieren (Folkman 1970). Die Möglichkeit, daß die Angiogenese in Tumoren womöglich über Mediatoren wie Entzündungszellen induziert werden könnte, konnte ausgeschlossen werden (D´Amore 1986), zumal auch von anderen Autoren lediglich eine milde entzündliche Reaktion im Rahmen der Tumor- Angiogenese beobachtet werden konnte (Cavallo et al. 1973). Mit Erreichen des vaskulären Stadiums wird es dem Tumor ermöglicht, weiter zu proliferieren. Zu betonen ist, daß der Prozeß der Metastasierung solange nicht fortschreitet, wie sich Tumorzellen intravasal im Rahmen der Adhäsion an die Gefäßwand und nachfolgender Extravasation in dem Stadium der schlafenden Zellen befinden (Warren 1976). Einige Beobachtungen, die bei der Auswertung des präoperativ behandelten Untersuchungsmaterials besonders auffielen, unterstützen die Vorstellungen über das beschriebene Konzept der “dormant cells“. Als vital zu bezeichnende Tumorzellen fanden sich völlig abgekoppelt vom anatomisch regelrechtem gefäßführenden Bindegewebe. Sie liegen zum Teil am Rande von Nekrosezonen, in großen Narbenfeldern oder auch in fibrösen Leisten von Blutgefäßen. Nur selten waren die Tumorzellkomplexe von Entzündungszellen umgeben. Eindrucksvoll stellte sich auch der Befund von vitalen Tumorzellen in unmittelbarer Nachbarschaft eines hochgradig destruierten Blutgefäßes dar. Hier stellt sich die Frage über die verbleibende Ernährung dieser atypischen Zellen. Dadurch daß die Tumorzellen ganz offensichtlich keinen direkten Anschluß an das Gefäßsystem haben, liegt die Vermutung nahe, daß die Ernährung per diffusionem erfolgen muß. Auch intravasal konnte restliches Tumorgewebe mit umgebender Fibrose beobachtet werden. Intimaproliferation 85 Morphologische Veränderungen der Intima gelten als typische Reaktion sowohl nach durchgeführter Bestrahlung als auch nach Chemotherapie. Allerdings lassen sich keine Abhängigkeiten bezüglich des Regressionsgrades aufweisen. Der Prozentsatz bleibt bei Adenokarzinomen wie bei Plattenepithelkarzinomen mit nur geringen Abweichungen zwischen 30 und 35 %. Auch wenn Intimaschäden in Zusammenhang mit stattgehabter Therapie als deren Folge dargestellt werden, muß angesichts der ermittelten relativen Konstanz von Intimaproliferationen diskutiert werden, ob der Grund dafür nicht am ehesten in einer Überlagerung mit Intimaveränderungen anderer Genese zu suchen ist. Beschreibungen altersund krankheitsbedingter Gefäßveränderungen beziehen sich zu einem Großteil ebenfalls auf die Veränderungen der Intima, obschon im einzelnen nicht zu differenzieren ist, welche Ursache der veränderten Morphologie zugrunde liegt. Gezeigt hatte sich eine Abhängigkeit vom Regressionsgrad für die Infiltration durch Entzündungszellen, so daß man analog dazu auch hier vermehrt Intimaproliferationen mit höherem Regressionsgrad hätte erwarten können, da sie durchaus als reaktiv- entzündliche Veränderung gilt und damit in engem Zusammenhang mit den Ergebnissen der entzündlichen Prozesse stehen müßte. Grundsätzlich gilt es aber auch zu berücksichtigen, daß alle Patienten im Rahmen der Studie die gleiche Therapie erhalten haben, wodurch sich gleiche, vom Regressionsgrad unabhängige Reaktionsmuster durchaus erklären lassen. Da auch bei Gefäßen, die Lungentumoren mit niedrigem Regressionsgrad ( I) entstammten, ein mit den übrigen Regressionsgraden (II a und II b) vergleichbarer Prozentsatz an Intimaproliferationen nachgewiesen werden konnte, liegt es nahe, daß es sich wie hier bei Intimaproliferationen um eine Gefäßveränderung handelt, die unabhängig vom Ausmaß der Therapieinduktion entsteht. Stenosierung Ebenfalls unabhängig vom Regressionsgrad erwiesen sich stenosierte Gefäße, wobei verschiedene Veränderungen wie Intimaproliferation, straffes kollagenes und lockeres Bindegewebe und Tumorzellverbände zur Stenosierung beitragen können. Aufgrund dieser Vielfalt ist es nicht verwunderlich, daß Stenosen insgesamt zu einem recht hohen Prozentsatz nachweisbar sind. So ist davon auszugehen, daß sich die Gesamtheit der Stenosen aus mehreren Veränderungen zusammensetzt. 86 Deutlich wird dies anhand der Ergebnisse, bei denen Stenosierungen insgesamt mit einer Häufigkeit von 53,9 % zu verzeichnen waren. Gefäßwandveränderungen, die zu einer Stenosierung beitragen, waren jedoch nicht in der gleichen Häufigkeit zu belegen: so erreichen zum Beispiel durch Intimaproliferation veränderte Pulmonalarterienäste einen Anteil von 34,5 % aller untersuchten Gefäße (s. Tab 1). Aus der Diskrepanz der beiden letztgenannten Zahlen wird deutlich, daß neben Intimaproliferationen weitere Gefäßveränderungen zur Stenosierung eines Gefäßes beitragen müssen. Innerhalb der einzelnen Regressionsgrade sind die Veränderungen aber zu einem unterschiedlich hohen Anteil an der Stenosierung beteiligt (s. Tab. 8). So kommt ein stenosiertes Lumen im Regressionsgrad I eher durch Tumorgewebe zustande, während im Regressionsgrad II b häufiger narbiges Bindegewebe dafür verantwortlich ist. Auch die Relation verändert sich von Regressionsgrad zu Regressionsgrad. So findet sich im Regressionsgrad I ein Anteil von Intimaproliferationen von der Hälfte an der Gesamtzahl der stenosierten Gefäße (34,6 % : 64,4 %), im Regressionsgrad II b sich hingegen ein Verhältnis von 28,7 % : 37,9 %. Obliteration Obliterationen waren für Adeno- und Plattenepithelkarzinome mit zunehmendem Regressionsgrad häufiger zu beobachten. Fast ausschließlich lag ein Lichtungsverschluß durch Narbengewebe vor. Zwar kommt es auch bei unbehandelten Tumoren zu obliterierenden Pulmonalarterienveränderungen, vielfach unter Einbeziehung von Tumorzellen, jedoch wird vor allem in Zusammenhang mit der Strahlentherapie ein vermehrtes Vorkommen von narbigem Bindegewebe betont (Warren u. Spencer 1940), so daß aufgrund der Abhängigkeit vom Regressionsgrad der sehr hohe Anteil bindegewebiger Obliterationen durchaus der durchgeführten Therapie zugesprochen werden kann. Kompression Das Auftreten von Kompressionen war abhängig vom Regressionsgrad. Als einzige Gefäßveränderung konnten Kompressionen mit zunehmendem Regressionsgrad weniger häufig nachgewiesen werden. Dies galt übereinstimmend für beide Tumortypen, wenn auch für Plattenepithelkarzinome in eindrucksvollerer Ausprägung. 87 Der Anteil tumorbedingter Kompressionen nimmt für Plattenepithelkarzinome deutlich, für Adenokarzinome analog der Infiltration durch Tumorzellen ab (s. Tab. 8). Dadurch daß der Gesamtanteil an Kompressionen aber nicht in dem gleichen Maße abnimmt, muß der Anteil der Kompressionen durch narbiges Bindegewebe ansteigen. Auch dies läßt sich auf die durchgeführte präoperative Therapie zurückführen. Unbehandelte Tumoren entsprechen dem Regressionsgrad I insofern, als bei beiden die Tumorregression nicht über Spontanveränderungen hinausgeht und Kompressionen primär durch Tumorgewebe erfolgen. Dagegen kommt es bei Tumoren nach Therapie mit höherem Regressionsgrad in erster Linie zu Gefäßkompressionen durch kollagenes Bindegewebe. Die Fibrosierung stellt eine markante Therapiefolge dar. Die Überproduktion elastischer Fasern stellt ebenfalls ein typisches Resultat nach Strahlentherapie dar (Engelstaad 1934, Cottier 1956; Holsten 1963). Dies korreliert wiederum gut mit den Ergebnissen für Gefäße, die eine Elastose der Gefäßwand aufwiesen. Diese war für Pulmonalarterienäste in Adenokarzinomen vom Regressionsgrad abhängig, während Arterien aus Plattenepithelkarzinomen mit zunehmendem Regressionsgrad häufiger eine Elastose aufwiesen. Aufsplitterung der M. elastica interna Auch für Aufsplitterungen der Membrana elastica interna ließ sich für beide histologischen Tumortyen eine Abhängigkeit vom Regressionsgrad ermitteln. Deutlicher ausgeprägt stellte sich die Abhängigkeit für Gefäße aus Adenokarzinomen dar. Es fanden sich neben sektorförmigen Verlusten elastischer Faserkomplexe auch Kondensationszonen. Aufsplitterungen der elastischen Membran gelten wie die Elastose als typische strahlentherapeutische Nebenwirkung (Karlin u. Mogilnitzki 1932, Voegt 1938; Warren u. Gates 1940, Cottier 1956, Deeley 1960), so daß bei den ermittelten Ergebnissen für beide Gefäßveränderungen durchaus ein Zusammenhang zur durchgeführten Therapie herzustellen ist. Warum allerdings aufgesplitterte elastische Membranen zu einem Prozentsatz, der noch höher liegt als die hier ermittelten, in Tumoren nachweisbar waren, die keinerlei präoperativer Therapie unterzogen waren, bleibt unbeantwortet (Fisseler- Eckhoff u. Müller 1994). In betracht gezogen werden müssen jedoch wiederum auch hier die Unterschiede, welche bei Analyse durch verschiedene Untersucher anzunehmen sind. 88 Einen Erklärungsansatz für die morphologischen Veränderungen von Gefäßen in nichtbehandelten Lungentumoren bietet die von mehreren Autoren gemachte Beobachtung, daß Tumorzellen möglicherweise selbst aktiv am Gefäßaufbau beteiligt sind (Goodall et al. 1965; Warren et al. 1978; Hammersen 1983). Bassermann sieht darin einen wichtigen Unterschied gegenüber der Angiogenese in nichttumorösen Wachstumsprozessen, der die strukturellen Besonderheiten von Tumorgefäßen erklären könnte (Bassermann 1984). Elastose Einige frühere Beobachtungen aus unbehandelten Tumoren konnten durch diese Arbeit bestätigt werden. Aufsplitterungen der Membrana elastica interna zeigten sich weitaus häufiger als eine Elastose, was für beide Tumortypen gleichermaßen zutraf, unabhängig davon, ob sie präoperativ behandelt waren oder nicht. Schon bei nicht therapierten Lungentumoren waren Aufsplitterungen der elastischen Membran ein früh zu beobachtendes Kennzeichen pathologisch veränderter Gefäße (Nowakowski 1992). Auffallend war insgesamt die deutliche Abhängigkeit vom Regressionsgrad für Infiltrationen durch Entzündungszellen, Aufsplitterungen der Membrana elastica interna und Elastose bei Pulmonalarterienäste in präoperativ behandelten Adenokarzinomen. Auch war für Adenokarzinome, behandelte wie unbehandelte, eine höhere Gefäßinfiltration durch Tumorzellen belegt worden. Anhand dieser Befunde läßt sich ableiten, daß Adenokarzinome womöglich aggressiver wachsen, so daß eine höhere Anzahl von infiltrierten Gefäßen resultiert. Destruktion Auswirkungen der durchgeführten Therapie scheinen sich auch in dem Anteil an destruierten Gefäßen widerzuspiegeln, da hier ebenfalls mit zunehmendem Regressionsgrad eine Zunahme von Destruktionen zu verzeichnen war. Zum Teil ließen sich Gefäßresiduen aus elastischen Fasern nur unter Zuhilfenahme von perivaskulären Kohlenstaubablagerungen identifizieren. 89 Zusammengefaßt machen stenosierte, obliterierte und destruierte Gefäße einen Gesamtanteil von über zwei Dritteln aller ausgewerteter Pulmonalarterienäste aus (s. Tab. 1), die, wenn überhaupt nur noch über ein deutlich reduziertes Lumen verfügen (s. Tab 14). Daraus ergibt sich die Frage, inwieweit Tumornekrosen als direkte Schädigung aufgrund der durchgeführten präoperativen Therapie aufzufassen sind oder ob sie infarkt- ähnlich durch verminderte Sauerstoffversorgung zustande gekommen sind. Sicherlich ist von einer Kombination beider Ursachen auszugehen, wenn auch nicht genau zu klären ist, welchen Ausmaßes sie jeweils sind. Da jedoch durch die Abhängigkeit vom Regressionsgrad aufgezeigt werden konnte, daß auch therapiebedingte Veränderungen für Stenosen, Obliterationen und Destruktionen verantwortlich zu machen sind, handelt es sich bei den dadurch entstandenen Tumornekrosen um indirekte Folgen der therapieinduzierten Schäden. Nicht zu vernachlässigen Endothelproliferation und sind auch die Ergebnisse Vaskularisation langsamer mehrerer Autoren, stattfinden als daß die Tumorzellproliferation (Gunduz 1981; Denekamp u. Hobson 1982; Gabbert u. Wagner 1983). Daraus ergibt sich eine geringere Gefäßdichte als im eigentlichen Muttergewebe (Bassermann 1984), worin ebenfalls ein wichtiger Grund für das Auftreten von Nekrosen zu sehen ist. Gunduz und Denekamp betonen die Ineffizienz des neu entstandenen Gefäßsystems als maßgebliche Ursache für die Entstehung von Tumornekrosen (Gunduz 1981, Denekamp u. Hobson 1982). Um auf die Beobachtung zurückzukommen, daß nahezu alle Gefäßveränderungen,- lediglich bei einer bestimmten Anzahl von Fällen (=13) gelang der Nachweis von Tumorzellen in der Gefäßwand nicht- , in unterschiedlicher Zusammensetzung in jedem Tumor zu finden waren, soll folgendes verdeutlicht werden: Jeder Tumor unterstand präoperativ einer identischen Therapie. Anhand der gemachten Beobachtung wird jedoch erkennbar, daß jeder Tumor mit dazugehörigem Lungengewebe und gefäßführendem Stroma auf die Bestrahlung und Chemotherapie reagiert und zwar mit zunächst qualitativ identischen histologischen Korrelaten. Das grundsätzliche Reaktionsmuster ist demnach gleich. Aber jeder Tumor vermag individuell, d.h. mit unterschiedlicher quantitativer Ausprägung einzelner 90 Gefäßveränderungen auf die Therapieschäden zu antworten, weshalb sich dem Untersucher jeweils ein dem Tumor eigenes Bild präsentiert. 5.3. In wieweit beeinflussen sich Gefäßveränderungen und Restlumen gegenseitig ? 5.3.1. Gefäßveränderungen verantwortlich für verbleibende Restlumina Die Aufschlüsselung nach Restlumina erbrachte in bezug auf die Fragestellung, wodurch die Gefäße eine Reduzierung ihres Lumens erfahren, erwartete Befunde. Obliterationen, die nahezu alle durch Narbengewebe hervorgerufen wurden, fanden sich bei Gefäßen ohne Restlumen. Ebenso waren Destruktionen in der Regel mit einem Restlumen von 0 Prozent verbunden. Nur zu einem geringen Prozentsatz kamen Destruktionen bei Gefäßen mit verbleibendem Restlumen vor. Auswirkungen auf das Lumen haben zu unterschiedlichen Anteilen außerdem Stenosierungen hervorgerufen durch Intimaproliferationen, Tumorzellverbände und Kompressionen. Auch die häufig nachgewiesene deutliche Vermehrung elastischer Fasern innerhalb der Gefäßwand beeinträchtigt das Lumen zusätzlich. 5.3.2. Gefäßveränderungen in Korrelation zum verbliebenem Restlumen Entzündliche Infiltrationen der Gefäßwand und vor allem auch Intimaproliferationen kamen um so häufiger vor, je größer das Restlumen war. Wobei der erhaltene Blutfluß in unmittelbarem Zusammenhang mit den entzündlichen Gefäßveränderungen steht, da nur bei erhaltener Perfusion eine Entzündung ablaufen kann. Durch die Tatsache, daß übereinstimmend kontinuierliche Zunahmen verzeichnet werden konnten, läßt sich doch auf einen Zusammenhang von Intimaproliferationen als reaktiv- entzündliche Veränderung 91 schließen. Anhand der Aufschlüsselung nach dem Regressionsgrad hatte sich eine direkte Beziehung zwischen beiden Merkmalen nicht nachweisen lassen. Der niedrige Wert von 1,0 % für Intimaproliferationen bei Pulmonalarterienästen ohne Restlumen hängt damit zusammen, daß sich diese Gefäßkategorie zum weitaus größten Teil aus obliterierten und destruierten Gefäßen zusammensetzt. Allerdings kann die Obliteration durch Narbengewebe auch das Endstadium einer abgelaufenen Entzündung darstellen. Auch könnte die Anzahl der in entzündliche Prozesse involvierten Gefäße, die deutlich unter der der obliterierten und destruierten liegt, darauf hindeuten, daß es im Rahmen der Destruktion und der Entwicklung narbiger Obliterationen nicht unbedingt zu Entzündungen kommen muß. Mehr noch unterstützt dieser Befund aber die oben genannte Aussage, daß Narbengewebe das Resultat abgelaufener entzündlicher Prozesse sein kann: der geringe Nachweis entzündlicher Prozesse läßt dann darauf schließen, daß die Entzündung nicht mehr aktiv ist. Wichtig ist es zu beachten, daß immer verschiedene Stadien entzündlicher Gefäßveränderungen nebeneinander zu beobachten sind. Während manche Gefäße durch Entzündungsinfiltrate auffallen, kann bei anderen Gefäßen in fortgeschritterem Stadium der Arteriitis bereits eine Intimafibrose und Intimaproliferation mit Granulationsgewebe vorliegen oder es findet sich gar das endgültige Korrelat der Vernarbung, die das Gefäß auch vollständig obliterieren kann. Auch kommt es im Rahmen entzündlicher Prozesse zu einem Verlust elastischer Fasern. In Betracht gezogen werden muß ebenfalls eine mögliche Überlagerung mehrerer Gefäßveränderungen, die es erschweren, bei zum Beispiel als destruiert zu bezeichnenden Gefäßen noch eine proliferierte Intima abzugrenzen. Bei Gefäßen mit erhaltenem Restlumen fanden sich zu einem hohen Prozentsatz Stenosierungen, die allerdings anders als Intimaproliferationen und entzündliche Infiltrationen keine Abhängigkeit vom Restlumen zeigten. Zugrunde liegen den Stenosen in erster Linie Intimaproliferationen und auch narbige Veränderungen. Tumorzellen tragen ebenfalls zur Beeinträchtigung des Blutflusses durch Stenosierung der Gefäße bei. Infiltrationen durch Tumorzellen nehmen mit höherem Restlumen zu, obwohl vielleicht zu erwarten gewesen wäre, daß Tumorzellinfiltrationen maßgeblich an der Destruktion oder Obliteration eines Gefäßes beteiligt sind, also bei Gefäßen ohne nachweisbarem Restlumen. 92 Ungefähr ein Viertel der Gefäße ohne Restlumen erfahren eine Kompression der Gefäßwände, während Pulmonalarterienäste unabhängig von der Größe des verbleibenden Lumens immerhin fast zur Hälfte von Kompressionen betroffen sind, die das Lumen zusätzlich zu den Veränderungen, die sich innerhalb des Gefäßes und der Gefäßwand abspielen, verkleinern. Abgesehen von Tumorzellen sind Narbengewebe und weit über die Norm vermehrte elastische Faserkomponenten für die Kompressionen von außen verantwortlich. Aufsplitterungen der Membrana elastica interna und Elastose nehmen als einzige Veränderungen kontinuierlich ab je größer das Restlumen ist, wobei in Gefäßen ohne beziehungsweise mit nur geringem Restlumen aufgesplitterte Membranen die am häufigsten zu beobachtenden Veränderungen darstellen. Daraus wird ersichtlich, daß die Veränderungen der elastischen Membran einerseits wesentlich zur Zerstörung der Gefäßwand beitragen, andererseits muß es sich dabei um frühzeitige Schäden handeln, da sie sonst nicht in der nachgewiesenen Häufigkeit zu erwarten wären. Auch Nowakowski konnte die genannten Veränderungen als frühzeitige Gefäßschäden identifizieren (Nowakowski 1992). Da Elastosen ebenfalls kontinuierlich seltener bei höherem Restlumen nachzuweisen waren, wobei die Abnahme zwischen den einzelnen Restlumenkategorien noch deutlicher ausfiel als bei den Aufsplitterungen der elastischen Membranen, kann festgehalten werden, daß es bei höherem Restlumen zu selteneren Schäden durch die beiden genannten Veränderungen kommt. Unterstützt wird dies durch die bei der Untersuchung der Intimaproliferationen gewonnenen Ergebnisse. Auf den ersten Blick ist zwar ein häufigeres Vorkommen mit höherem Restlumen zu belegen, jedoch kann das Ausmaß der Proliferation bei Gefäßen mit größerem verbleibendem Lumen nicht so ausgeprägt sein, da sonst eine deutlichere Einengung des Lumen hätte resultieren müssen. Ähnlich verhält es sich mit den Tumorzellinfiltrationen. Auch sie sind häufiger bei größerem Restlumen nachweisbar, allerdings sind sie dann nicht in Destruktionen und Obliterationen involviert, sondern eher bei Stenosierungen und Kompressionen. Während also alle anderen Gefäßveränderungen mit höherem Restlumen entweder seltener werden oder in ihrer Ausprägung geringer werden, nehmen Infiltrationen durch Entzündungszellen zu. Beachtenswert ist dieser Befund auch im Hinblick auf die Beobachtung bei nicht präoperativ behandelten Lungentumoren, daß alle untersuchten 93 Gefäßveränderungen von der Tumorperipherie bis zum Tumorzentrum hin zunahmen, nur entzündliche Infiltrationen und auch Kompressionen sich entgegengesetzt verhielten (Nowakowski 1992). 5.4. Welche Folgen ergeben sich aus den Gefäßveränderungen? 5.4.1. Tumorversorgung Für die Versorgung des Tumors mit Nährstoffen und Sauerstoff ist ein durchgängiges Gefäßsystem unabdingbar, da es sonst zum Untergang von Tumorgewebe kommt. Ziel der Therapie stellt jedoch die Tumorvernichtung dar. Wenn dies nicht vollständig erreicht werden kann, gilt es zumindest eine Reduzierung des Tumorvolumens zu bewirken. Die Begründung einer präoperativen Therapie beruht auf dieser Zielvorstellung. Somit spielt es keine wesentliche Rolle, ob es sich bei Tumornekrosen um direkte Folgen der durchgeführten Therapie oder aber um indirekte, durch Gefäßveränderungen induzierte handelt. Durch die hohe Anzahl der von Stenosierungen, Obliterationen und Destruktionen betroffenen Gefäße konnte aufgezeigt werden, daß zu einem nicht unerheblichen Teil Gefäßveränderungen für Tumornekrosen verantwortlich werden können. Auch sprechen einige Befunde dafür, daß die Veränderungen durchaus als therapieinduziert anzusehen sind. Hier sind vor allem die hohe Anzahl narbiger Umbauvorgänge und die morphologischen Besonderheiten in bezug auf die elastischen Faserkomponenten sowohl im Lungen- und Tumorgewebe als auch bei den Gefäßen selbst zu nennen. Dennoch stehen dem die Beobachtungen unbehandelter Tumoren entgegen, denn auch hier konnte ein recht hoher Anteil der genannten Gefäßveränderungen nachgewiesen werden. Jedoch war hier vielfach ein Zusammenhang mit dem Vorhandensein von ausgedehntem Tumorbefall, welcher die Gefäßveränderungen verursachte oder zumindest beeinflußte, herzustellen. 94 5.4.2. Pulmonale Situation Dadurch daß Gefäßveränderungen im Rahmen der Reaktion auf Bestrahlung und Chemotherapie von zentraler Bedeutung sind, kommt es zu Auswirkungen auf die Lunge insgesamt und damit schließlich auch zu funktionellen Beeinträchtigungen. Abgesehen von der insuffizienten Versorgung des Tumors, die durch den Sauerstoffmangel als limitierenden Faktor zu regressiven Nekrosen führt, sind einige weitere wichtige Aspekte der Therapiefolgen zu nennen. Hypoxische Tumorareale, die eine in bezug auf die Ernährung per diffusionem kritische Distanz zu versorgenden Gefäßen erreicht haben, sind zum Beispiel resistenter gegen Bestrahlung als solche mit ausreichender Sauerstoffversorgung (Holthusen 1936; Thomlinson u. Gray 1955). Dies hat zur Folge, daß resistentere Zellen weitaus bessere Überlebenschancen haben, weil empfindlichere Zellen der Tumorperipherie absterben, lokale Rezidive dadurch aber ebenfalls aus resistenteren Zellen bestehen mit den sich daraus ergebenden reduzierten Therapiemöglichkeiten (Scherer 1988). Nekrotische Zonen des Tumors fallen in der Versorgung durch Blutgefäße aus, so daß ein vermehrter Blutfluß durch die vormals hypoxischen Areale strömt und als Reoxygenierung bezeichnet wird (Thomlinson u. Gray 1955; Scherer 1988). Ferner kann generell eine gesteigerte Mikrozirkulation nach Bestrahlung verzeichnet werden (Reinhold 1971), was gut zu der von anderen Autoren beobachteten erhöhten Blutungsneigung paßt (Engelstad 1934; Holsten 1963). Festzuhalten ist ebenfalls, daß in hypoxischem Gewebe Reparaturmechanismen langsamer erfolgen als es in regelrecht oxygeniertem Gewebe der Fall ist (Wannenmacher 1987). Während Schäden in normal oxygeniertem Gewebe bereits behoben sind, trifft die nächste Bestrahlung auf noch nicht repariertes Gewebe, wodurch eine Potenzierung der Schäden in den hypoxischen Tumorarealen bewirkt wird. In der Tat war das Ausmaß der Gefäßschäden größer in den Fällen, bei denen die präoperative Radio- und Chemotherapie größere Wirkung gezeigt hat. Die direkt an der Gefäßwand nachgewiesenen Veränderungen bleiben auch für das umgebende normale Lungengewebe nicht ohne gravierende Folgen. Abgesehen von der reduzierten Versorgung durch Lumenverengung und Zerstörung wird die Diffusion durch die Gefäßwand in benachbartes Gewebe durch Verquellung und Intimaproliferationen zusätzlich erschwert. 95 Andererseits haben einige der Gefäßveränderungen, die zur Permeabilitätsstörung führen, eine Schlüsselposition inne im Hinblick auf den weiteren Verlauf der Therapieschäden, wobei der Pathomechanismus übereinstimmend jeweils auch nach alleiniger Strahlentherapie oder Chemotherapie beschrieben wurde. Am Anfang steht die Endothelläsion, durch die es wegen der resultierenden Durchlässigkeit zur Exsudation von Flüssigkeit und Plasmaproteinen inklusive Fibrinogen in die interstitiellen Räume kommt. In der Gefäßwand und im perivaskulären Ödem reichern sich Erythrozyten und Entzündungszellen an, was anhand der Ergebnisse ebenfalls belegt werden konnte. Ist die fibrinolytische Aktivität nicht ausreichend, wandern Fibroblasten ein und es erfolgt die Expression von Kollagen (White 1972; Awwad 1990). Auch hierfür sprechen die Untersuchungsergebnisse dieser Arbeit, die sowohl innerhalb der Gefäßwand als auch im umgebenden Gewebe eine deutliche Vermehrung kollagener Fasern ergaben. Die bereits lokal bestehende Ischämie wird durch die ausgeprägten Faserkomponenten weiter verstärkt, da sie für die Diffusion ein zusätzliches Hindernis darstellen. Negativ wirkt sich darüber hinaus der von extern auf die Gefäße ausgeübte Druck durch Ödem, Narbengewebe und kollagenen Fasern aus. Alles in allem führen die Veränderungen zur Progression des Nährstoff- und Sauerstoffmangels. Die zunehmende Fibrosierung des Gewebes mündet schließlich in einer Abnahme der Elastizität und damit über einen Funktionsverlust zur zunehmenden respiratorischen Insuffizienz, deren klinischer Aspekt von einer Anstrengungsdyspnoe über Ruhedyspnoe bis hin, wenn auch selten, zum letalen Ausgang durch progrediente Ateminsuffizienz reicht (Stone et al. 1956). Hiervon wird vor allem berichtet, nachdem eine Kombination von Bestrahlung und Chemotherapie durchgeführt worden war (Flubacher et al. 1977; Frey et al. 1977). Hinzugefügt werden muß dem allerdings der nicht unerhebliche Schaden des Alveolarepithels, der Pneumozyten mit nachfolgendem Surfactant- Mangel und den sich daraus ergebenden Folgen und der Schaden der Becherzellen, die mit einer vermehrten Schleimproduktion reagieren (Flubacher et al. 1977; Frey et al. 1977; Awwad 1990). Insgesamt sind damit alle drei Hauptfunktionen der Lunge beeinträchtigt: die Ventilation durch restriktive Ventilationsstörung, die Diffusion durch Störungen des Gasaustausches im Bereich des Gefäßbettes und der respiratorischen Membran und die Perfusion durch 96 stenosierende Gefäßveränderungen. Klinische Tests wie zum Beispiel die Lungenfunktionsprüfung sind in der Lage, schon relativ frühzeitig Einschränkungen der pulmonalen Leistungsfähigkeit aufzudecken, so daß ein rechtzeitiges Eingreifen in therapeutischer Hinsicht möglich ist. In Zusammenhang mit den Endothelläsionen ist hervorzuheben, daß sie eine wichtige Voraussetzung für die Adhäsion von Thromben darstellen (White 1972; Warren 1976). Als Resultat der erfolgten Thrombosierung gelten exzentrische Intimaproliferationen, die häufig bei der Auswertung zu finden waren. Verständlich ist auch, daß die geschilderten Gefäß- und Gewebsveränderungen, in erster Linie sind entzündliche Reaktionen, Hyperämie und Vernarbungen zu nennen, zu erschwerten Operationsbedingungen führen (Zuppinger 1971). 97 6. ZUSAMMENFASSUNG Gefäßveränderungen von Pulmonalarterienästen werden bei nicht- kleinzelligen Lungentumoren in nicht unerheblichen Maße beschrieben und sind von zentraler Bedeutung im Hinblick auf die Tumorversorgung bzw. auf die Erreichbarkeit durch zytostatische Substanzen. Zur Frage, ob sich im Unterschied hierzu Veränderungen nach erfolgter präoperativer Bestrahlung und Chemotherapie nachweisen lassen, wurden insgesamt 666 Gefäße aus Resektaten von 25 Plattenepithelkarzinomen und 8 Adenokarzinomen analysiert. In Abhängigkeit von histologischem Tumortyp, Gefäßgröße, Regressionsgrad sowie vom Restlumen fanden sich folgende Ergebnisse: 1.: histologischer Tumortyp: • Infiltrationen durch Tumorzellen und Kompressionen waren häufiger bei Adenokarzinomen • Stenosierungen waren häufiger bei Plattenepithelkarzinomen 2.: Gefäßgröße: • Infiltration durch Entzündungszellen waren häufiger bei großen Pulmonalarterienästen • Obliterationen geringfügig häufiger bei kleinen Gefäßen 3.: Regressionsgrad: kontinuierliche Zunahmen mit höherem Regressionsgrad für: • Aufsplitterungen der Membrana elastica interna, narbig bedingte Obliterationen und Destruktionen bei beiden histologischen Tumortypen • Infiltration durch Entzündungszellen und Elastosen bei Adenokarzinomen; deutliche Zunahme jeweils bei Plattenepithelkarzinomen • Obliterationen bei Plattenepithelkarzinomen; Adenokarzinomen 98 Zunahme insgesamt bei kontinuierlicher Rückgang mit höherem Regressionsgrad für: • Kompressionen für beide histologischen Tumortypen • Infiltration durch Tumorzellen und tumorbedingte Kompressionen bei Plattenepithelkarzinomen; deutlicher Rückgang insgesamt für Adenokarzinome 4.: Restlumen: - mit höhergradig verbliebenem Restlumen • deutlich weniger Destruktionen • Infiltration durch Entzündungszellen und Intimaproliferationen wurden häufiger • Aufsplitterungen der M. elastica interna und Elastosen wurden seltener 5.: Vergleich von Gefäßen mit bzw. ohne präoperative Therapie • Infiltration durch Tumorzellen, Obliterationen durch Tumorgewebe, Destruktionen, Aufsplitterung der M. elastica interna häufiger ohne vorangegangene Therapie • Infiltration durch Entzündungszellen, Obliterationen durch Narbengewebe häufiger nach erfolgter Therapie • Kompressionen vergleichbar häufig Zusammenfassend läßt sich festhalten: I. Gefäßveränderungen bei nicht- kleinzelligen Lungentumoren zeigen nach präoperativer Chemo- und Radiotherapie hinsichtlich der Häufigkeit ihres Auftretens je nach Gefäßveränderung z. T. deutliche Unterschiede gegenüber entsprechenden Veränderungen bei nicht vorbehandelten Lungentumoren. II. Qualitativ liegen jedoch bei behandelten wie bei unbehandelten Lungentumoren gleichartige Gefäßveränderungen vor, d. h. es gibt keine Gefäßveränderungen nach neoadjuvanter Therapie, die spezifisch auf die Therapieeinwirkung zurückzuführen sind. III. Die Abhängigkeit der Pulmonalarterienveränderungen vom Regressionsgrad verdeutlicht, daß es sich bei den untersuchten Gefäßveränderungen durchaus um therapieinduzierte Veränderungen handelt, auch wenn zumindest zum Teil von einer Überlagerung mit therapieunabhängigen Gefäßveränderungen ausgegangen werden muß. 99 IV. Das je nach Regressionsgrad unterschiedliche Spektrum von Pulmonalarterienveränderungen verdeutlicht auch, daß bei für alle Patienten gleicher präoperativer Therapie nicht nur die epithelialen Tumorzellen, sondern auch das gefäßführende Stroma ein individuell unterschiedliches Reaktionsmuster aufweisen. 100 7. LITERATURVERZEICHNISS 1. Acute Leukaemia Group B. Acute lymphocytic leukaemia in children. Maintenance therapy with methotrexate administered intermittently. JAMA 20: 923- 928 (1969) 2. Aisner, J. Chemotherapy for small cell carcinomas of the lung. in: Bitran, J. S., Golomb, H. M., Little, A. G., Weichselbaum, R. R.(eds) Lung Cancer. Grune & Stratton, Inc. Florida 1988, pp 307- 321 3. Albain, K. S. Induction therapy followed by definitive local control for stage III non- small cell lung cancer. Chest 102: 43s- 50s (1993) 4. Alberti, W. Die Rolle der Strahlentherapie in der Behandlung des kleinzelligen Bronchialkarzinoms. in: Seeber, S., Niederle, N. Interdisziplinäre Therapie des Bronchialkarzinoms. Springer Verlag Berlin Heidelberg New York Tokyo 1985 S. 37- 43 5. André, R., Rochant, H., Dreyfus, B., Duhamel, G., Péchere, J.- C. Fibrose interstitielle diffuse du poumon au cours d’une maladie de Hodgkin traitrée par des doses élevées d’Endoxan. Bull. Soc. Méd. Hôp. Paris 118: 1133-1141 (1967) 101 6. Aso, Y., Yoneda, K., Kikkawa, Y. Bleomycin induced pulmonary fibrosis. Amer. Rev. Resp. Dis 111: 904 (1975) 7. Auerbach O., Stout, A. P., Hammond, E. C., Garfinkel, L. Smoking habits and age in relation to pulmonary changes. New Engl J Med 269 1045- 1054 (1963) 8. Awwad, H. K. Late reacting tissues: radiation- induced lung damage. in: Awwad, H. K. Radiation oncology: radiobiological and physiological perspectives Kluwer Academic Publishers Dordrecht Netherlands 1990, S. 357- 396 9. Ballantyne, A.J., Clagett, O. T., McDonald, R. Vascular invasion in bronchogenic carcinoma. Thorax 12: 294- 299 (1957) 10. Bariety, M., Delarue, J., Paillas, J., Rulliere, R. Les carcinomes bronchiques primitifs. Hrg.: Masson, Cie, Paris 1967 S. 185- 189 11. Bassermann, R. Angiogenese und Vaskularisation in Metastasen. Verh. Dtsch. Ges. Path. 68: 124- 139 (1984) 12. Beamis, J. F., Stein, A., Andrews, J. L. Changing epidemiology of the lung cancer. Increasing incidence in women. Med. Clin. North Am. 99: 315- 325 (1975) 102 13. Becker, N., Wahrendorf, J. Krebsatlas der Bundesrepublik Deutschland. Springer Verlag Berlin Heidelberg New York 3. Auflage, S.307-336 (1998) 14. Bergmann, M. Pulmonalarterien bei Bronchialkarzinomen. Inaugural- Dissertation Medizinische Fakultät Münster 1980 15. Bonomi, P. Brief overview of combination chemotherapy in NSCLC. Semin Oncol 13: 89- 91 (1986) 16. Borgström, K. E., Gynning, J. Roentgenographic changes in the lungs and vertebrae following intense rotation roentgen therapy of esophageal cancer. Acta radiol. 47: 281 (1957) 17. Braun, G. Tumorstadien des nicht-kleinzeligen Bronchialkarzinoms. Therapiewoche 36: 674 (1986) 18. Brenner, M. Pathology of the vessels of the pulmonary circulation. Arch. Int. Med. 56: 211- 237 (1935) 19. Burkhardt, A., Gebbers, J.- O., Höltje, W.- J. Die Bleomycin- Lunge. Dtsch. Med. Wschr. 102: 281- 289 (1977) 103 20. Cavallo, T., Sade, R., Folkman, J., Cotran, R. S. Tumor angiogenesis: Rapid induction of endothelial mitoses demonstrated by autoradiography. J. Cell Biol. 54: 408- 420 (1973) 21. Chabner, B. A., Myers, C. E. Clinical pharmacology of cancer chemotherapy. in: DeVito, V. T., Hellman, S., Rosenberg, S. A. Cancer. Principles and Practice Oncology. Lippincott Philadelphia 1989, S. 156- 197 22. Choi, C. H., Carey, R. W. Small cell anaplastic carcinoma of the lung. Reappraisal of current management. Cancer 37: 2651- 2657 (1976) 23. Collier, F. C., Enterline, H. T., Kyle, R. H., Tristan, T. T., Greening, R. Prognostic implications of vascular invasion in primary carcinomas of the lung. A. M. A. Arch. Path. 66: 594- 603 (1958) 24. Cormier, Y., Bergeron, D., La Forge, J., Lavandier, M., Fournier, M., Chenard, J., Desmeulles, M. Benefits of polychemotherapy in advanced NSCLC. Cancer 50 :845- 849 (1982) 25. Cormier, Y. D. Benefits of polychemotherapy in advanced NSCLC. Cancer 50: 845- 849 (1982) 104 26. Cottier, H. Über die unterschiedliche Schädigung des Lungengewebes durch therapeutische Röntgenbestrahlung. Strahlentherapie 100: 385- 389 (1956) 27. Cudkowicz, L., Armstrong, J. B. Blood supply of malignant pulmonary neoplasms. Thorax 8: 152- 156 (1953) 28. Cudkowicz, L., Armstrong, J. B. Die pathologische Anatomie der Pulmonalarterien. Erg. Ges. Tuberk.- Forsch. 14: 191- 206 (1958) 29. Cullen, M. H., Joshi, R., Chetiyawardana, A. D., Woodroffe, C. M. Mitomycine, ifosfamid, cisplatin in NSCLC: Treatment good enough to compare. Br. J. Cancer 58: 359- 361 (1988) 30. D`Amore, P. A. Growth factors, angiogenesis and metastasis. in: Alan R. Liss Cancer Metastasis: Experimental and Clinical Strategies, pp 269- 283 (1986) 31. Daskal, Y., Gyorkey, F., Gyorkey, P., Busch, H. Ultrastructural study of pulmonary bleomycin toxicity. Cancer Res. 36: 1267- 1272 (1976) 32. Deaner, M., Trummer, M. J. Carcinoma of the lung in women. J. Thorac Cardiovasc Surg 59: 551- 554 (1970) 105 33. Deeley, T. I. The effects of radiation on the lungs in the treatment of carcinoma of the bronchus. Clin. Radiol. 11: 33- 39 (1960) 34. Delarue, J., Abelanet, R., Chomette, G. La vascularisation des tumeurs malignes. Presse Med. 73: 1517- 1522 (1965) 35. Delarue, J., Mignot, J., Paillas, J., Sors, C. Etude sur la vascularisation des cancers bronchiques. J. Fr. Med. 5.: 545- 554 (1954) 36. Delarue, J., Sors, C., Mignot, J., Paillas, J. Lésions bronchopulmonaires et modifications circulatoires. Presse Med. 63: 173- 177 (1955) 37. Denekamp, J. u. Hobson, B. Endothelial- cell proliferation in experimental tumours. Br. J. Cancer 46: 711- 720 (1982) 38. DeVita, V. T. Principles of chemotherapy. in: DeVita, V. T., Hellman, S., Rosenberg, S. A. Cancer. Principles and Practice Oncology. Lippincott Philadelphia 1989, S. 132- 1 39. Dillman, R. O., Seagran, S. L., Propert, K. J., Guerra, J., Eaton, W. L., Perry, M. C., Carey, R. W., Frei, E. F., Green, M.R. A randomized trial of induction chemotherapy plus high- dose radiation versus radiation alone in stage III non- small cell lung cancer. N Engl J Med 323: 940- 945 (1990) 106 40. Dingemans, K. P., Wagenvoort, C. A. Pulmonary arteries and veins in experimential hypoxia. Am J Path 93: 353- 368 (1978) 41. Drings, P. Bronchialkarzinom: Neue Erkenntnisse zu Epidemiologie und Klinik. Therapiewoche 36: 1628- 1634 (1986) 42. Drings, P. Aktuelle medikamentöse Therapie des Bronchialkarzinoms. Verh. Dt. Ges. f. Innere Medizin 96: 220- 228 (1990) 43. Drings, P. Die Chemotherapie des Bronchialkarzinoms. in: Drings, P.: Thoraxtumoren. Urban & Schwarzenberg München 1991, S. 219- 230 44. Dunnill, M.S. Fibrinoid necrosis in the branches of the pulmonary artery in chronic non- specific lung disease. Brit. J. Dis. Chest 54: 355- 358 (1960) 45. Eberhardt, W., Wilke, H., Stamatis, G., Budach, W., Krause, B., Stuschke, M., Stahl, M., Müller, M. R., Schlenger, L., Trenn, G., Nowrousian, M. R., Greschuchna, D., Konietzko, N., Seeber, S. Ergebnisse einer intensiven präoperativen Chemotherapie gefolgt von einer Radio-/ Chemotherapie unter Einschluß hyperfraktionierter akzelerierter Radiotherapie bei lokal weit fortgeschrittenen NSCLC. Pneumologie 48 Suppl. 2: 553 (1994) 107 46. Edwards, J. E. Functional pathology of the pulmonary vascular tree in congenital cardiac disease. Circulation 15: 164- 197 (1957) 47. Ehler, A., Stranahan, A., Olson, K. B. Bronchogenic carcinoma. New Engl J Med 251: 207- 213 (1954) 48. Elias, A. D., Skarin, A. T., Gonin, R., Oliynyk, P., Stomper, P. C., O´Hara, C., Socinski, M. A., Sheldon, T., Maggs, P., Frei, E. Neoadjuvant treatment of stage IIIA non- small cell lung cancer. Am J Clin Oncol 17: 26- 36 (1994) 49. Elliot, F. M., Reid, L. Some new facts about the pulmonary artery and ist branching pattern. Clin. Radiol. 16: 193- 198 (1965) 50. Elliot, J. A. Is there a standard chemotherapy for NSCLC? Eur. J. Cancer Clin Oncol 22: 369- 371 (1986) 51. Engel, U., Zerbino, D. D., Panasjuk, E. N. et al. Ultrastructural aspects of intra- and extravascular coagulation in lung cancer. Zentralbl. Allg. Pathol. pathol. Anat 134: 531- 538 (1988) 52. Engelstad, R. B. Über die Wirkung der Röntgenstrahlen auf die Lungen. Acta radiol. Suppl. XIX 1- 19 (1934) 108 53. Faber, L. P., Kittle, C. F., Warren, W. H., Bonomi, P. D., Taylor, S. G., Reddy, S., Lee, M.- S. Preoperative chemotherapy and irridiation for stage III non- small cell lung cancer. Ann Thorac Surg 47: 669- 677 (1989) 54. Farrar, J. F., Blomfield, J., Reye, R. D. K. The structure and composition of the maturing pulmonary circulation. J. Path. Bact. 90: 83- 96 (1965) 55. Fasske, E. Das bronchopulmonale Adenokarzinom: gewebliche Differenzierung und zelluläre Herkunft. Pathologe 5: 3- 12 (1984) 56. Feld, R., Rubinstein, L., Thomas, P.A. The Lung Cancer Study Group: Adjuvant chemotherapy with cyclophosphamide, doxorubicin and cisplatin in patients with completely resected stage I non- small lung cancer. J Natl Cancer Inst 85: 299- 306 (1993) 57. Fisseler- Eckhoff, A., Müller, K.- M. Pathologie der Pulmonalarterien bei Lungentumoren. Dtsch. Med. Wschr. 119: 1415- 1420 (1994) 58. Fisseler- Eckhoff, A., Reitemeyer, E., Müller, K.- M. Pulmonalgefäßveränderungen bei Bronchialkarzinomen. Prax. Klin. Pneumol. 41: 693- 694 (1987) 109 59. Fitzgerald, T. J., Greenberger, J. S. Adjuvant radiotherapy and ist role in the treatment of stage II lung cancer. in: Bitran, J. D., Golomb, H. M., Little, A. G., Weichselbaum, R. R. (eds ) Lung Cancer. Grune & Stratton, Inc. Florida 1988, pp 165-171 60. Flubacher, P., Meier, V., Obrecht, J. P., Hartmann, D. Zytostatika- Pneumopathie nach Polychemotherapie wegen metastasierenden Mammakarzinoms. Schweiz. Med. Wschr. 107: 1412- 1417 (1977) 61. Folkman, J. Tumor angiogenesis factor. Cancer Research 34: 2109- 2113 (1974) 62. Folkman, J., Cotran, R. Relation of vascular proliferation to tumor growth. in: Richter, G. W., Epstein, N. A. (eds ) International Review of Experimental Pathology New York, Academic Press, pp 207- 248 (1976) 63. Folkman, J. Merler, E., Abernathy, C., Williams, G. Isolation of a tumor factor responsible for angiogenesis. J Exptl Med 133: 275- 288 (1971) 64. Folman, R. S., Rosman, M. The role of chemotherapy in NSCLC: community perspective. Semin Oncol 15 Suppl. 4: 16- 21 (1988) 110 65. Fowler, J. F., Denekamp, J., Hegazy, M. A. H. Fraktionierung in der Strahlentherapie. in: Hug, O. Präoperative Tumorbestrahlung. Urban & Schwarzenberg München Berlin Wien 1971 S. 22- 35 66. Frey, F., Marone, C., Zimmermann, A. Interstitielle Pneumopathie nach niedrig dosierter Bleomycintherapie. Schweiz. Med. Wschr. 107: 1418- 1422 (1977) 67. Gabbert, H. Basismechanismen der Metastasierung. in: Metastasenchirurgie. Rothmund, M. (Hrg.) Georg Thieme Verlag Stuttgart New York Tokyo 1989, S. 1- 16 68. Gabbert, H. u. Wagner, R. Tumorzellproliferation und Tumorvaskularisation experimentell erzeugter Dickdarmkarzinome während früherer Wachstumsphasen. in: Vaupel, P. Hammersen, F. (Hrg. ) Mikrozirkulation in malignen Tumoren. Karger Basel 1983 69. Goodall, C. M., Feldmann, R., Sanders, A. G., Shubik, P. Vascular patterns of four transplantable tumours in the hamster. Physiology 16: 622- 630 (1965) 111 70. Graham, E. A. Primary cancer of the lung with special considerations of ist etiology. Bull. N. Y. Acad. Med. 27: 261- 276 (1951) 71. Gralla, R. J. New directions in NSCLC. Semin. Oncol. 17 Suppl. 7: 14- 19 (1990) 72. Gralla, R. J., Casper, E. S., Kelsen, D. P., Braun, D. W., Dukeman, M. E., Martini, N., Young, C. W., Golbey, R. B. Cisplatin and vindesine combination chemotherapy for advanced carcinoma of the lung: a randomized trial. Ann. Intern. Med. 95: 414- 420 (1981) 73. Greco, A. Rationale for chemotherapy for patients with advanced NSCLC. Semin Oncol 13: 92- 96 (1986) 74. Greschuchna, D., Maassen, W. Bronchialkarzinom – Neue Erkenntnisse. Therapiewoche 36; 1613- 1621 (1986) 75. Grundmann, E. Precancerous lesions and their clinical consequences. Arch Geschwulstforsch 50: 539- 548 (1980) 76. Gunduz, N. Cytokinetics of tumor and endothelial cells and vascularisation of lung metastases. Cell Tissue Kinet. 14: 343- 350 (1981) 112 77. Hammersen, F., Osterkamp- Baust, U., Endrich, D. Ein Beitrag zum Feinbau terminaler Strohmbahnen und ihrer Entstehung in bösartigen Tumoren. in: Vaupel, P., Hammersen, F. Mikrozirkulation in malignen Tumoren. Karger Basel 1983 78. Harris, P., Heath, D. The human pulmonary circulation. 2nd ed. Edinburgh Churchill- Livingstone 1977 79. Hartung, W. Die Altersveränderungen der Lungenelastizität nach Messungen an isolierten Leichenlungen. Beitr. Path. Anat. 118: 368- 389 (1957) 80. Haupt, R., Kühn, H. Narben und Vernarbungen in Bronchialkarzinomen. Z. Krebsforschung 71. 301- 307 (1968) 81. Havemann, K., Wolf, M. Prognostische Faktoren beim kleinzelligen Bronchialkarzinom. in: Drings, P. Thoraxtumoren. Urban & Schwarzenberg München 1991, S. 30- 37 82. Hazuka, M. B., Bunn, P. A. Controversies in the nonsurgical treatment of stage III non- small cell lung cancer. Am. Rev. Respir. Dis. 145: 967- 977 (1992) 113 83. Heath, D., Best, P. V. The tunica media of the arteries of the lung in pulmonary hypertension. J. Path. Bact. 76: 165- 174 (1958) 84. Heath, D.; Edwards, J. E. The pathology of hypertensive pulmonary vascular disease. Six grades of structural changes. Circulation 18: 533- 548 (1958) 85. Heath, D., Whitaker, W. The pulmonary vessels in mitral stenosis. J. Path. Bact. 70. 291- 298 (1955) 86. Heilmann, H.- P. Bronchialkarzinom- radiologische Therapie. Verh. Dt. Krebsges. 1: 401- 404 (1976) 87. Heilmann, H.- P. Die Strahlentherapie des nicht- kleinzelligen Bronchuskarzinoms. in: Seeber, S., Niederle, N. Interdisziplinäre Therapie des Bronchialkarzinoms Springer Verlag Berlin Heidelberg New York Tokyo 1985 S. 95- 98 88. Hellman, S. Principles of radiation therapy. in: DeVita, V. T., Hellman, S., Rosenberg, S. A. Cancer. Principles and Practice of Oncology. Lippincott Philadelphia 1992, pp 103- 193 114 89. Henzi, H. Zur pathologischen Anatomie der Lungenveränderungen nach hohen Dosen von Röntgenstrahlen. Strahlentherapie 100: 275- 289 (1956) 90. Holmes, E. C. Postoperative chemotherapy for non- small cell lung cancer. Chest 103: 30s- 34s (1993) 91. Holsten, D. R. Lunge. in: Scherer, E., Stender, H.- S. (Hrg.) Strahlenpathologie der Zelle. Thieme Verlag Stuttgart 1963, S. 265- 276 92. Holthusen, H. Erfahrungen über die Verträglichkeitsgrenze für Röntgenstrahlen und deren Nutzanwendung zur Verhütung von Schäden. Strahlentherapie 57: 254- 269 (1936) 93. Ichikawa, T., Nakano, I., Hirokawa, I. Bleomycin treatment of the tumors of penis and scrotum. J. Urol.: 102: 699- 704 (1969) 94. Ikeda, M., Neyazaki, T., Chiba, S., Yoneti, M., Susuki. C. Bronchial vascular pattern of various pulmonary diseases, with particular emphasis on ist diagnostic value in pulmonary cancer. J. thorac. Cardiovasc. Surg. 55: 642- 654 (1968) 115 95. Ioachim, H. L., Dorsett, B. H., Paluch, E. The immune response at the tumor site in lung carcinoma. Cancer 38: 2296- 2309 (1976) 96. Jennings, F. L., Arden, A. Development of experimential radiation pneumonitis. Arch. Path. 71: 437- 443 (1961) 97. Joss, R. A., Brunner, K. W. Die Chemotherapie der nicht- kleinzelligen Bronchuskarzinome. in: Seeber, S., Niederle, N. Interdisziplinäre Therapie des Bronchialkarzinoms. Springer Verlag Berlin Heidelberg New York Tokyo 1985 S. 75- 93 98. Junghanns, W. Die Endstrombahn der Lunge im postmortalen Angiogramm. Virch. Arch. Path. Anat. 331: 263- 275 (1958) 99. Junker, K. Tumoregression bösartiger Lungentumoren. Habilitationsschrift Medizinische Fakultät Bochum 1998 100. Junker, K., Bosse, U., Klinke, F., Thomas, M. Therapieinduzierte Tumorregression bei lokal fortgeschrittenen nicht- kleinzelligen Bronchialkarzinomen. Verh. Dtsch. Ges. Path. 79: 380 (1995 a) 101. Junker, K., Krapp, D., Müller, K.- M. Kleinzelliges Bronchialkarzinom nach Chemotherapie – Morphologische Befunde. Pathologe 16: 217- 222 (1995 b) 116 102. Junker, K., Müller, K.- M. Metastasierungsmuster beim Bronchialkarzinom. Z. Herz- Thorax- Gefäßchir. 3: 189- 194 (1989) 103. Junker, K., Thomas, M., Schulmann, K., Klinke, F., Bosse, U., Müller, K.- M. Tumoregression in non- small cell lung cancer following neoadjuvant therapy. Histological assessment. J Cancer Res Clin Oncol 123: 469- 477 (1997 a) 104. Karlin, M. I., Mogilnitzky, B. N. Zur Frage nach der Wirkung der Röntgenstrahlen auf die Lungen und das Herz der Tiere. Frankfurt Z. Path. 43, 434- 439 (1932) 105. Kayser, K. Analytical lung pathology. Springer Verlag Heidelberg New York 1992 106. Kayser, K., Carl, S., Gabius, H.- J., Bauer, H. G., Schneider, P. Wie verändert adjuvante zytostatische Chemotherapie intrapulmonale Metastasen und tumorfreies Lungenparenchym? Z. Herz-, Thorax-, Gefäßchir. 8: 79- 84 (1994) 107. Kimmig, B., Vogel, D., Flentje, M., Wannenmacher, M. Radiotherapie des Bronchialkarzinoms. in: Drings, P. Thoraxtumoren. Urban & Schwarzenberg München 1991, S. 199- 211 117 108. Klatersky, J., Sculier, J. P. Chemotherapy of NSCLC. Semin Oncol 12 : 38- 48 (1985) 109. Koch, H., Lesch, R. Busulfanlunge. Med. Welt 27: 308- 311 (1976) 110. Kolin, A., Koutlakis, T. Invasion of pulmonary arteries by bronchial carcinomas. Hum. Pathol. 18 (11): 1165- 1171 (1987) 111. Kolin, A., Koutlakis, T. Role of arterial occlusion in pulmonary scar cancers. Hum. Pathol. 19 (10): 1161- 1170 (1988) 112. Krüger, G., Ruckes, J. Zur Morphologie des Tumorbefalles der A pulmonalis beim Bronchialkarzinom. Frankfurter Zeitschrift f. Pathol. 76: 81- 86 (1966) 113. Langston, H. T., Laws, J., Mc Grew, T. A., Heidenreich, C., Slominski, M. D. Incidence of blood vessel invasion in bronchogenic carcinoma. Surg. Gynec. Obstret. 107: 704- 708 (1958) 114. Le Chevalier, T., Arriagada, R., Quoix, E. et al. Radiotherapy alone versus combined chemotherapy and radiotherapy in nonresectable non- small cell lung cancer: first ananlysis of a randomized trial. J Natl Cancer Inst 83: 417- 423 (1991) 118 115. Le Chevalier, T., Arriagada, R., Tarayre, M., Lacombe- Terrier, M.- J., Laplanche, A., Quoix, E., Ruffie, P., Martin, M., Douillard, J.- Y. Significant effect of adjuvant chemotherapy on survival in locally advanced nonsmall cell lung carcinoma. J Natl Cancer Inst 84: 58 (1992) 116. Loddenkemper, R., Gabler, A., Göbel, D. Criteria of functional operability in patients with bronchial carcinoma. Thorac. Cardiovasc. Surg. 31.: 334- 337 (1983) 117. Maaßen, W., Greschuchna, D. Gegenwärtiger Stand der Chirurgie des nichtkleinzelligen und kleinzelligen Bronchuskarzinoms. in: Seeber, S., Niederle, N. Interdisziplinäre Therapie des Bronchialkarzinoms. Springer Verlag Berlin Heidelberg New York Tokyo 1985 S. 47- 52 118. Marino, P., Preatoni, A., Cantoni, A., Buccheri, G. Single- agent chemotherapy versus combination chemotherapy in advanced nonsmall cell lund cancer: a quality and meta- analysis study. Lung Cancer 13: 1- 12 (1985) 119. Martini, N., Kris, M. G., Flehinger, B. J. Preoperative chemotherapy for stage IIIA lung cancer. Ann. Thorac. Surg. 89: 1365- 1374 (1993) 120. Martini, N., Kris, M. G., Gralla, R. J. Effects of preoperative chemotherapy on the resectability of NSCLC. Ann Thorac Surg 45: 370- 379 (1988) 119 121. Matthews, M. J. Problems of morphology and behavior of bronchopulmonary malignant disease. in: Israel, L., Chahinian, A. P. (eds ) Lung cancer. Natural history, prognosis and therapy. Academic Press, New York San Francisco London 1976 S. 23- 63 122. Mattsson, J., Peterson, H.- I. Irradiation and tumor blood flow. in: Peterson, H.- I.: Tumor Blood Circulation. CRC Press USA 1979, pp 137- 168 123. Mc Dowell, E. M., Barett, L. A., Trump, B. F. Observations on small granule cells in adult human bronchial epithelium and in carcinoid and oat cell tumors. Lab. Invest. 34: 202- 206 (1976) 124. McIntosh, H. C. Changes in the lungs and the pleura following roentgen treatment of cancer of the breast by prolongated fractional method. Radiology 23: 558 (1934) 125. Menne, R., Junker, K., Müller, K.- M. Metastasen bösartiger Lungentumoren. Verh. Dtsch. Ges. Path. 68: 242- 245 (1984) 126. Merkel, H. Zur Histologie der Lungengefäße. Beiträge path. Anat. 105: 176- 202 (1949) 120 127. Meyer- Schwickerath, M. Bronchialarterien in wachsenden und regressiv veränderten Bronchialkarzinomen. Inaugural- Dissertation Medizinische Fakultät Münster 1977 128. Milne, E. N. C. Circulation of primary and metastatic pulmonary neoplasms. Study. Amer. J. Roentgenol. 100: (3) 603- 619 (1967) 129. Minna, J. D., Higgins, G. A., Glatstein, E. J. Cancer of the lung. in: DeVito, V. T., Hellman, S., Rosenberg, S. A. Cancer. Principles and practice of oncology. Lippincott Philadelphia 1989, S. 396- 474 130. Mosely, J. M., Dickson, D. R. Vascular invasion in lung cancer. Am. Rev. Respir. Dis. 82: 807- 809 (1960) 131. Mountain, C. F. A new international staging system for lung cancer. Chest 89: 225s- 233s (1986) 132. Mountain, C. F. Prognostic implications of the International Staging System for lung cancer. Semin Oncol 15: 236- 245 (1988) 133. Mountain, C. F. Revisions in the international system for staging lung cancer. Chest 111: 1710- 1717 (1997) 121 134. Muggia, F. M. Cell kinetic studies in patients with lung cancer. Oncology 30: 353- 361 (1974) 135. Müller, K.- M. Morphologie und Epidemiologie des Bronchialkarzinoms. Verh. Dtsch. Krebsges. 1: 353- 378 (1976) 136. Müller, K.- M. Krebsvorstadium der Bronchialschleimhaut. Verh. Dt. Ges. Path. 63: 112- 131 (1979) 137. Müller, K.- M. Lungentumoren. in: Doerr, W., Uehlinger, E.(Hrg.) Spezielle pathologische Anatomie, Band 16 II Springer Verlag Berlin Heidelberg New York Tokyo 1983 S. 1081- 1293 138. Müller, K.- M. Pathologie der Lungentumoren. in: Trendelenburg, F. Tumoren der Atmungsorgane und des Mediastinums A. Handbuch der Inneren Medizin Bd IV / 4A, Springer Verlag Berlin 1985, S. 87- 127 139. Müller, K.- M . Morphologie und Epidemiologie des Bronchialkarzinoms. Verh. Dtsch. Krebs. Ges. 1: 353- 378 (1986) 122 140. Müller, K.- M. Bronchialkarzinom. Therapiewoche 36: 1622- 1627 (1986) 141. Müller- K.- M., Bordt, J. Der Bronchialarterienkreislauf unter krankhaften Verhältnissen. Prax. Pneumol. 34: 324- 331 (1980) 142. Müller, K.- M., Fisseler- Eckhoff, A. What`s new in lung tumor heterogeneity? Path. Res. Pract. 184: 108- 115 (1989) 143. Müller, K.- M., Fisseler- Eckhoff, A. Pathologie der Lungentumoren in: Drings, P. Thoraxtumoren. Urban & Schwarzenberg München 1991, S. 5- 24 144. Müller, K.- M., Meyer- Schwickerath, M. Bronchial arteries in various stages of bronchogenic carcinoma. Path. Res. Pract. 163: 34- 41 (1978) 145. Müller, K.- M., Reichel, B. Heterogenität der Lungentumoren: Wie sinnvoll ist das Grading? Verhandlungen der deutschen Gesellschaft für Innere Medizin 96: 220- 228 (1990) 146. Murray, J. F. Die normale Lunge. F. K. Schattauer Verlag Stuttgart New York 1978 123 147. Murren, J. R., Buzaid, A. C., Hait, W. N. Critical analysis of neoadjuvant therapy for stage IIIA non- small cell lung cancer. Am Rev Respir Dis 143: 889- 894 (1991) 148. Naeye, R., Vennart, G. P. The structure and significance of pulmonary plexiform structures. Am J Path 36: 593- 605 (1960) 149. Nasr, E. B., Pellae- Cosset, B., Arriagada, R., LeChevalier, T., Baldeyrou, P., Ruffie, P., de Cremoux, H., Martin, M., Taraye, M. Combination of chemotherapy and thoracic radiotherapy in nonresectable non- small cell bronchial carcinoma. Bull. Cancer Paris 79: 681- 687 (1992) 150. Neuman, H. W., Ellis, F. H., McDonald, J. R. Bronchial carcinomas in persons under forty years of age. New Engl J Med 254: 502- 507 (1956) 151. Neyazaki, T., Ikeda, M., Mitsui, K., Kimura, S., Suzuki, M., Suzuki, C. Angioarchitecture of pulmonary malignancies in humans. Cancer 26: 1246- 1255 (1970) 152. Niederle, N. Ergebnisse und Möglichkeiten der Behandlung beim kleinzelligen Bronchialkarzinom. in: Seeber, S., Niederle, N. Interdisziplinäre Therapie des Bronchialkarzinoms. Springer Verlag Berlin Heidelberg New York Tokyo 1985 S. 1- 23 124 153. Niitamo- Korhonen, S. P., Holsti, P., Holsti, L. R., Pyrhonen, S., Mattson, K. A comparison of cisplatinum- vindesine and cisplatine- etoposide combined with radiotherapy for previously untreated localized inoperable non- small cell lung cancer. Europ. J. Cancer clin. Oncol. 25: 1039- 1043 (1989) 154. Nowakowski, A. Pulmonalarterienveränderungen in Bronchialkarzinomen. Inaugural- Dissertation Medizinische Fakultät Bochum 1992 155. Oliner, H., Schwartz, R., Rubio, F., Dameshek, W. Interstitial pulmonary fibrosis following busulfan therapy. Am. J. Med. 31: 134- 138 (1961) 156. O`Neal, R. M., Thomas, W. A., Hartroft, P. M. Media of small muscular pulmonary arteries in mitral stenosis. Arch. Path. 60: 267- 270 (1960) 157. Osieka, R., Makoski, H.- B. Integration von Chemotherapie und Strahlentherapie in der Behandlung des Bronchialkarzinoms. Verh. Dt. Krebsges. 1: 405- 410 (1976) 158. Pariente, R., André, J., Legrand, M., Brouet, G. Lésions élémentaires ultrastructurales du poumon. Nouv. Presse méd. 20: 1351- 1356 (1972) 159. Papadimitriou, J. M., Woods, A. E. Structural and functional characteristics of the microcirculation in neoplasms. J. Path. 116: 65- 72 (1975) 125 160. Perez, C. A., Stanley, K., Grundy, G., Hanson, W., Rubin, P., Kramer, S., Brady, L., Marks, J. E., Perez- Tamayo, R., Brown, G. S., Concannon, J. P., Rotman, M. Impact of irradiation technique and tumor extent in tumor control and survival of patients with unresectable non- oat cell carcinoma of the lung. Cancer 50: 1091- 1099 (1982) 161. Phillips, T. L., Fu, K. K. Quantification of combined radiation therapy and chemotherapy effects on critical normal tissues. Cancer 37: 1186- 1200 (1976) 162. Phillips, T. L., Margolis, L. Radiation pathology and the clinical response of lung and esophagus in: Frontiers of Radiation Therapy and Oncology: Radiation Effect and Tolerance, Normal Tissue. Karger Basel 1972, pp 254- 273 163. Poole, J. C. F., Cromwell, S. B., Benditt, E. P. Behavior of smooth muscle cells and formation of extracellular structures in the reaction of arterial walls to injury. Am J Path 62: 391- 404 (1971) 164. Preiß, J. Zytostatische Therapie solider Tumoren. in: Weihrauch, R. R. (Hrg. ) Internistische Therapie. Urban und Schwarzenberg München Berlin Baltimore 9: S. 696- 753 (1994) 126 165. Pryce, D. M., Walter, J. B. The frequency of gross vascular invasion in lung cancer with special reference to arterial invasion. J Path Bact 79: 141- 146 (1960) 166. Reinhold, H. S. Radiations and the microcirculation. in: Frontiers of Radiation Therapy and Oncology: Radiation Effect and Tolerance, Normal Tissue. Karcher Basel 1972, pp 44- 56 167. Reitemeyer, E., Bordt, J., Müller, K.- M. Angiographische Befunde bei Lungenmetastasen. Verh. Dtsch. Ges. Path. 68: 224- 229 (1984) 168. Reitemeyer, E., Eckhoff, A., Müller, K.-M. Sekundäre Tumorvernarbungen in Lungentumoren. Prax. Klin. Pneumol. 41: 689- 690 (1987) 169. Rosell, R., Gomez- Godina, J, Camps, C., Maestre, J., Padille, J., Canto, A., Mate, J. L., Li, S., Roic, J., Olazahal, A., Canela, M., Ariza, A., Skacel, Z., Morera- Prat, J., Abad, A.. A randomized trial comparing preoperative chemotherapy plus surgery with surgery alone in patients with non- small cell lung cancer. N Engl J Med 330: 153- 158 (1994) 170. Roth, J. A., Fossella, F., Komaki, R., Ryan, M. B., Putnam, J. B., Lee, J. S., Dhingra, H., De Caro, L., Chasen, M., McGavran, M., Atkinson, E. N., Hong, W. K. A randomized trial comparing perioperative chemotherapy and surgery with surgery alone in resectable stage IIIA non- small cell lung cancer. J Natl Cancer Inst 86: 673- 680 (1994) 127 171. Rubin, P., Casarett, G. W. Clinical radiation on normal tissues. Arch. Path. 34: 1070- 1084 (1942) 172. Rubin, P., Casarett, G. W. Clinical radiation on normal tissues. Arch. Path. 35: 341- 353 (1943) 173. Rusch, V. W., Albain, K. S., Crowley, J. J., Rice, T. W., Lonchyna, V., McKenna, R., Livingston, R. B., Griffin, B. R., Benfield, J. R. Surgical resection of stage IIIA and stage IIIB non- small cell lung cancer after concurrent induction chemoradiotherapy. J Thorac Cardiovasc Surg 105: 97- 106 (1993) 174. Schaake- Koning, C., van den Bogaert, W., Dalesio, O., Festen, J., Hoogenhout, J., van Houtte, P., Kirkpatrick, A., Koolen, M., Maat, B., Nijs, A., Renaud, A., Rodrigus, P., Schuster- Uitterhoeve, L., Sculier J.- P., van Zandwijk, N., Bartelink, H. Effects of concomitant cisplation and radiotherapy on inoperable non- small cell lung cancer. N Engl J Med 326: 524- 530 (1992) 175. Scherer, E., Sack, H. Biologische Grundlagen. in: Scherer, E., Sack, H.(Hrg.) Strahlentherapie. Thieme Verlag Stuttgart New York 1989, S. 96- 153 128 176. Schmähl, D. Ätiologie des Bronchialkarzinoms. in: Frommhold, W., Gerhardt, P. (Hrg.) Tumoren der Lunge. Thieme Verlag Stuttgart 1987, S. 25- 29 177. Schneiderman, M. A., Levin, D. L. Trends in lung cancer. Cancer 30: 1320- 1325 (1972) 178. Schubert, G.E. Pathologie des Bronchuskarzinoms. Klassifikation nach den WHO – Richtlinien Therapiewoche 37: 5080-5086 (1975) 179. Sculier, J. P., Klatersky, J. Progress in chemotherapy of NSCLC. Eur J Cancer Clin Oncol 20: 1329- 1333 (1984) 180. Shepherd, F. A. Induction therapy for locally advanced non- small cell lung cancer. Ann Thorac Surg 55: 1585- 1592 (1993) 181. Shermann, D.M., Neptune, W., Weichselbaum, R. R. An aggresive approach to marginally resectable lung cancer. Cancer 41: 2040- 2045 (1978) 182. Shivas, A. A., Finlayson, N. D. C. The resistance of arteries to tumor invasion. Br. J. cancer 19: 486- 489 (1965) 129 183. Short, D. S. The problem of medial hypertrophy in pulmonary hypertension. Med. Thorac. 19: 411- 417 (1962) 184. Silverberg, E. Cancer statistics. Cancer 30: 2338- 2345 (1980) 185. Simons, P., Reid, L. Muscularity of pulmonary artery branches in the upper and lower lobes of the normal young and aged lung. Br. J. Dis. Chest 63: 38- 44 (1969) 186. Souhami, R. Chemotherapy in NSCLC. Thorax 40: 641- 645 (1985) 187. Steinberg, I., Findby, N. Great vessel involvement in lung cancer: Angiographic report on 250 consecutive proved cases. Amer. J. Roentgen 81: 807- 818 (1959) 188. Stone, D. J., Schwarz, M. J., Green, R. A. Fatal pulmonary insufficiency due to radiation effect upon lung. Amer. J. Med. 21: 211- 219 (1956) 189. Sweany, S. K., Moos, W. T., Haddy, F. J. Effects of chest irradiation on pulmonary function. J. clin. Invest. 38: 587- 594 (1959) 130 190. Thomlinson, R. H. Changes in oxygenation in tumors in relation to irridiation in: Frontiers of Radiation. Therapy and Oncology, Vol. 3 Karger Basel 1968, pp 109- 114 191. Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br J Cancer 9: 539- 549 (1955) 192. Tomashefski, J. F., Hirsch, C. S. The pulmonary vascular lesions of intravenous drug abuse. Hum. Path. 11: 133- 145 (1980) 193. Töndury, G., Weibel, E. Anatomie der Lungengefäße. Erg. Ges. Tuberk.- Forschung 14: 59- 100 (1958) 194. UICC ( International Union against Cancer) TNM- Klassifikation maligner Tumoren. Hermanek, P., Scheibe, O., Spiessl, B., Wagner, G. (Hrg. ) Springer Verlag Berlin Heidelberg New York London Paris Tokyo 1987 195. v. Hayek, H. Die menschliche Lunge. Springer Verlag Berlin Heidelberg New York 1970 196. Valaitis, J., Warren, S., Gamble, D. Increasing incidence of adenocarcinoma of the lung. Cancer 47: 1042- 1046 (1981) 131 197. Vincent, R. G., Pickren, J. W., Lane, W. W., Bross, I., Takita, H., Houten, L., Gutierrez, A. C., Rzepka, T. Changing Histopathology of lung cancer. Cancer 39: 1647- 1655 (1977) 198. Voegt, H. Röntgenschädigung der Lungen beim Menschen. Virchows Arch. path. Anat. 302: 468- 474 (1938) 199. Vogt- Moykopf, I., Becker, H. D., Bülzebruck, H., Merkle, N. M., Meyer, G. Präoperative Diagnostik und operative Therapie des Bronchialkarzinoms. in: Drings, P., Schmähl, D., Vogt- Moykopf, I. Bronchialkarzinom. Zuckschwerdt München Bern Wien 1986, S. 287- 312 200. Vogt- Moykopf, I., Krysa, S., Probst, G., Bülzebruck, H., Schirren, J., Branscheid, D., Anyanwu, E., Bauer, E., Stoelben, E. Die chirurgische Therapie des Bronchialkarzinoms. in: Drings, P. Thoraxtumoren. Urban & Schwarzenberg München 1991 S. 170- 186 201. Wagenvoort, C. A. Medial defects of lung vessels. Hum. Path. 17: 722- 726 (1986) 132 202. Wagenvoort, C. A. Hypertension and low- flow states. In: Dail, D. H., Hammar, S. P. (eds) Pulmonary Pathology. Springer Verlag New York 1988, S. 691- 710 203. Wagenvoort, C. A., Keutel, J., Mooi, W. J., Wagenvoort, N. Longitudinal smooth muscle in pulmonary arteries. Virch Arch A 404: 265- 274 (1984) 204. Wagenvoort, C. A., Nauta, J., van der Schaar, P. J., Weeda, H. W. H., Wagenvoort, N. Effect of flow and pressure on pulmonary vessels. Circulation 35: 1028- 1037 (1967) 205. Wagenvoort, C. A., Wagenvoort, N. Age changes in muscular pulmonary arteries. Arch. Path. 79: 524- 528 (1965) 206. Wagenvoort, C. A., Wagenvoort, N. Pulmonary arteries in bronchial carcinoma. Arch. Path. 79: 529- 533 (1965) 207. Wagenvoort, C.A., Wagenvoort, N. Primary pulmonary hypertension. A pathologic study of lung vessels in 156 clinically diagnosed cases. Circulation 42 (2): 1163- 1184 (1970) 208. Walter, J. B., Pryce, D. M. The histology of lung cancer. Thorax 10: 107- 116 (1955) 133 209. Wannenmacher, M. Strahlentherapie mit unterschiedlichen Fraktionierungsrhythmen. in: K. z. Winkel (Hrg.) Wirkungssteigerung der Strahlentherapie maligner Tumoren. Springer Verlag Berlin Heidelberg New York 1987 S. 84- 92 210. Warram, J. R. Preoperative irradiation of cancer of the lung. Cancer 36: 914- 923 (1975) 211. Warren, B. A. Some aspects of blood borne tumour emboli associated with thrombosis. Z. Krebsforsch. 87: 1- 15 (1976) 212. Warren, B. A., Shubik, P., Wilson, R., Garcia, H., Feldman, R. The microcirculation in two transplantable melanomas of the hamster. Cancer Lett. 4: 117- 120 (1978) 213. Warren, S. Effects of irradiation on normal tissues. Arch. Path. 34: 1070- 1084 (1942) 214. Warren, S. Effects of irradiation on normal tissues. Arch. Path. 35: 341- 353 (1943) 215. Warren, S., Gates, O. Radiation pneumonitis. Experimential and pathologic observations. Arch. Path. 30: 440- 449 (1940) 134 216. Warren, S., Spencer, J. Radiation reaction in the lung. Amer. J. Roentgenol. 43: 682- 689 (1940) 217. Weiden, P. L., Piantadosi, S. Preoperative chemotherapy and radiation therapy in stage III non- small cell lung cancer. J Natl Cancer Inst 83: 266- 272 (1991) 218. White, D. C. Organized tissue alteration. in: Frontiers of Radiation Therapy and Oncology. Radiation Effect and Tolerance, Normal Tissue. Karcher Basel 1972, pp 79- 92 219. WHO Histological typing of lung tumors, second edition. World Health Organisation, Geneva 1981 220. Witzleb, E. Funktion des Gefäßsystems. in: Schmidt, R. F., Thews, G. (Hrg.) Physiologie des Menschen. Springer Verlag Berlin Heidelberg New York Tokyo 1985 S. 479- 501 221. Wood, D. A., Miller, M. The role of dual pulmonary circulation in various pathologic conditions of the lungs. J Thoracic Surg 7: 649- 670 (1938) 135 222. Wright, R. D. The blood supply of abnormal tissues in the lungs. J. Path. Bact. 47: 489- 499 (1938) 223. Würschmidt, F., Bünemann, H., Bünemann, C., Beck- Bornholdt, H.- P., Heilmann, H.- P. Strahlentherapie des inoperablen nichtkleinzelligen Bronchialkarzinoms. Strahlenther. Onkol. 170: 302- 304 (1994) 224. Wynder, E. L. Etiology of lung cancer. Cancer 30: 1332- 1339 (1972) 225. Wynder, E. L., Berg, J. W. Cancer of the lung among nonsmokers. Cancer 20: 1161- 1172 (1967) 226. Yashar, J., Weitberg, A. B., Glicksman, A. S., Posner, M. R., Feng, W., Wanebo, H. J. Preoperative chemotherapy and radiation therapy for stage IIIA carcinoma of the lung. Ann Thorac Surg 53: 445- 448 (1992) 227. Zeller, W. J., Schmähl, D. Ätiologie des Bronchialkarzinoms. in: Trendelenburg, F.: Tumoren der Atmungsorgane und des Mediastinums A. Handbuch der Inneren Medizin Bd IV / 4 A Springer Verlag Berlin 1985, S. 51- 86 136 228. Zuppinger, A. Die Vorbestrahlung. in: Hug, O. Präoperative Tumorbestrahlung. Urban & Schwarzenberg München Berlin Wien 1971 S. 49- 51 137 8. ANHANG Tabelle 1.: Gefäßveränderungen aller untersuchten Pulmonalarterienäste Tabelle 2.: Gefäßveränderungen kleiner Pulmonalarterienäste von Adeno- und Plattenepithelkarzinomen Tabelle 3.: Gefäßveränderungen großer Pulmonalarterienäste von Adeno- und Plattenepithelkarzinomen Tabelle 4.: Gegenüberstellung von kleinen und großen Gefäßen von Adeno- und Plattenepithelkarzinomen Tabelle 5.: Gegenüberstellung von kleinen und großen Gefäßen nach histologischem Tumortyp Tabelle 6.: Gefäßveränderungen in Abhängigkeit vom Regressionsgrading für Adeno- und Plattenepithelkarzinomen zusammen Tabelle 7.: Gefäßveränderungen in Abhängigkeit vom Regressionsgrading, Adenokarzinome Tabelle 8.: Gefäßveränderungen in Abhängigkeit vom Regressionsgrading, Plattenepithelkarzinomen Tabelle 9.: Gegenüberstellung der Gefäßveränderungen in Abhängigkeit vom Regressionsgrading nach histologischem Tumortyp Tabelle10.: Gegenüberstellung der Gefäßveränderungen von Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Regressionsgrading Tabelle11.: Gegenüberstellung der Gefäßveränderungen von Adeno- und Plattenepithelkarzinomen nach Regressionsgrading für kleine Gefäße Tabelle12.: Gegenüberstellung der Gefäßveränderungen von Adeno- und Plattenepithelkarzinomen nach Regressionsgrading für große Gefäße Tabelle13.: Gegenüberstellung der Gefäßveränderungen von kleinen und großen Gefäßen von Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Regressionsgrading Tabelle14.: Gegenüberstellung der Gefäßveränderungen von Adeno- und Plattenepithelkarzinomen für kleine und große Gefäße in Abhängigkeit vom Regressionsgrading Tabelle15.: Aufschlüsselung der Gefäßveränderungen nach Restlumina für Adeno- und Plattenepithelkarzinome 138 Tabelle16.: Gefäßveränderungen bei Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Restlumen Tabelle17.: Gegenüberstellung der Gefäßveränderungen kleiner und großer Gefäße in Abhängigkeit vom Restlumen, Adenokarzinome Tabelle18.: Gegenüberstellung der Gefäßveränderungen kleiner und großer Gefäße in Abhängigkeit vom Restlumen, Plattenepithelkarzinome Tabelle19.: Gegenüberstellung der Gefäßveränderungen kleiner und großer Gefäße von Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Restlumen 139 Tabelle 1.: Gefäßveränderungen aller untersuchten Pulmonalarterienäste Adenoca absolut Plattenepithelca gesamt % absolut % absolut % 116 65.2 291 59.6 407 61.1 57 32.0 63 12.9 120 18.0 Intimaproliferation 57 32.0 173 35.5 230 34.5 Stenosierung 81 45.5 278 57.0 359 53.9 Obliteration 19 10.7 69 14.1 88 13.2 - narbig 17 9.6 66 13.5 83 12.5 Kompression 88 49.4 203 41.6 291 43.7 23 12.9 32 6.6 55 8.3 108 60.7 320 65.6 428 64.3 Elastose 85 47.8 224 45.9 309 46.4 Destruktion 11 6.2 52 10.7 63 9.5 0% 26 14.6 78 16.0 104 15.6 < 30 % 48 27.0 137 28.1 185 27.8 31 % - 60 % 66 37.1 183 37.5 249 37.4 61 % - 100 % 38 21.3 90 18.4 128 19.2 178 100.0 488 100.0 666 100.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 140 Tabelle 2.: Gefäßveränderungen kleiner Pulmonalarterienäste von Adeno- und Plattenepithelkarzinomen Adenoca absolut Plattenepithelca gesamt % absolut % absolut % 44 53.0 141 52.0 185 52.3 24 28.9 31 11.4 55 15.5 Intimaproliferation 20 24.1 90 33.2 110 31.1 Stenosierung 39 47.0 147 54.2 186 52.5 Obliteration 12 14.5 48 17.7 60 16.9 - narbig 11 13.3 46 17.0 57 16.1 Kompression 38 45.8 114 42.1 152 42.9 10 12.0 19 7.0 29 8.2 50 60.2 175 64.6 225 63.6 Elastose 42 50.6 123 45.4 165 46.6 Destruktion 7 8.4 30 11.1 37 10.5 0% 18 21.7 52 19.2 70 19.8 < 30 % 27 32.5 70 25.8 97 27.4 31 % - 60 % 28 33.7 106 39.1 134 37.9 61 % - 100 % 10 12.0 43 15.9 53 15.0 83 100.0 271 100.0 354 100.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 141 Tabelle 3.: Gefäßveränderungen großer Pulmonalarterienäste von Adeno- und Plattenepithelkarzinomen Adenoca absolut Plattenepithelca gesamt % absolut % absolut % 72 75.8 150 69.1 222 71.2 33 34.7 32 14.7 65 20.8 Intimaproliferation 37 38.9 83 38.2 120 38.5 Stenosierung 42 44.2 131 60.4 173 55.4 Obliteration 7 7.4 21 9.7 28 9.0 - narbig 6 6.3 20 9.2 26 8.3 Kompression 50 52.6 89 41.0 139 44.6 13 13.7 13 6.0 26 8.3 58 61.1 145 66.8 203 65.1 Elastose 43 45.3 101 46.5 144 46.2 Destruktion 4 4.2 22 10.1 26 8.3 0% 8 8.4 26 12.0 34 10.9 < 30 % 21 22.1 67 30.9 88 28.2 31 % - 60 % 38 40.0 77 35.5 115 36.9 61 % - 100 % 28 29.5 47 21.7 75 24.0 95 100.0 217 100.0 312 100.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 142 Tabelle 4.: Gegenüberstellung von kleinen und großen Gefäßen von Adeno- und Plattenepithelkarzinomen kleine Gefäße große Gefäße gesamt Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca 53.0 52.0 75.8 69.1 65.2 59.6 28.9 11.4 34.7 14.7 32.0 12.9 Intimaproliferation 24.1 33.2 38.9 38.2 32.0 35.5 Stenosierung 47.0 54.2 44.2 60.4 45.5 57.0 Obliteration 14.5 17.7 7.4 9.7 10.7 14.1 - narbig 13.3 17.0 6.3 9.2 9.6 13.5 Kompression 45.8 42.1 52.6 41.0 49.4 41.6 12.0 7.0 13.7 6.0 12.9 6.6 60.2 64.6 61.1 66.8 60.7 65.6 Elastose 50.6 45.4 45.3 46.5 47.8 45.9 Destruktion 8.4 11.1 4.2 10.1 6.2 10.7 0% 21.7 19.2 8.4 12.0 14.6 16.0 < 30 % 32.5 25.8 22.1 30.9 27.0 28.1 31 % - 60 % 33.7 39.1 40.0 35.5 37.1 37.5 61 % - 100 % 12.0 15.9 29.5 21.7 21.3 18.4 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: Angaben in Prozent 143 Tabelle 5.: Gegenüberstellung von kleinen und großen Gefäßen nach histologischem Tumortyp Adenoca Plattenepithelca gesamt kleine G. große G. kleine G. große G. kleine G. große G. 53.0 75.8 52.0 69.1 52.3 71.2 28.9 34.7 11.4 14.7 15.5 20.8 Intimaproliferation 24.1 38.9 33.2 38.2 31.1 38.5 Stenosierung 47.0 44.2 54.2 60.4 52.5 55.4 Obliteration 14.5 7.4 17.7 9.7 16.9 9.0 - narbig 13.3 6.3 17.0 9.2 16.1 8.3 Kompression 45.8 52.6 42.1 41.0 42.9 44.6 12.0 13.7 7.0 6.0 8.2 8.3 60.2 61.1 64.6 66.8 63.6 65.1 Elastose 50.6 45.3 45.4 46.5 46.6 46.2 Destruktion 8.4 4.2 11.1 10.1 10.5 8.3 0% 21.7 8.4 19.2 12.0 19.8 10.9 < 30 % 32.5 22.1 25.8 30.9 27.4 28.2 31 % - 60 % 33.7 40.0 39.1 35.5 37.9 36.9 61 % - 100 % 12.0 29.5 15.9 21.7 15.0 24.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: Angaben in Prozent 144 Tabelle 6.: Gefäßveränderungen in Abhängigkeit vom Regressionsgrading für Adenound Plattenepithelkarzinome zusammen I II a II b gesamt absolut % absolut % absolut % absolut % 35 50.7 112 61.9 260 62.5 407 61.1 26 37.7 69 38.1 25 6.0 120 18.0 Intimaproliferation 26 37.7 56 30.9 148 35.6 230 34.5 Stenosierung 42 60.9 82 45.3 235 56.5 359 53.9 Obliteration 4 5.8 24 13.3 60 14.4 88 13.2 - narbig 3 4.3 21 11.6 59 14.2 83 12.5 Kompression 39 56.5 92 50.8 160 38.5 291 43.7 18 26.1 28 15.5 9 2.2 55 8.3 23 33.3 117 64.6 288 69.2 428 64.3 Elastose 21 30.4 85 47.0 203 48.8 309 46.4 Destruktion 3 4.3 14 7.7 46 11.1 63 9.5 0% 7 10.1 24 13.3 73 17.5 104 15.6 < 30 % 20 29.0 52 28.7 113 27.2 185 27.8 31 % - 60 % 27 39.1 63 34.8 159 38.2 249 37.4 61 % - 100 % 15 21.7 42 23.2 71 17.1 128 19.2 69 100.0 181 100.0 416 100.0 666 100.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 145 Tabelle 7.: Gefäßveränderungen in Abhängigkeit vom Regressionsgrading, Adenokarzinome I II a II b gesamt absolut % absolut % absolut % absolut % 12 46.2 55 63.2 49 75.4 116 65.2 10 38.5 44 50.6 3 4.6 57 32.0 Intimaproliferation 9 34.6 25 28.7 23 35.4 57 32.0 Stenosierung 17 65.4 33 37.9 31 47.7 81 45.5 Obliteration 2 7.7 10 11.5 7 10.8 19 10.7 - narbig 1 3.8 9 10.3 7 10.8 17 9.6 Kompression 14 53.8 43 49.4 31 47.7 88 49.4 3 11.5 16 18.4 4 6.2 23 12.9 8 30.8 54 62.1 46 70.8 108 60.7 Elastose 7 26.9 39 44.8 39 60.0 85 47.8 Destruktion 1 3.8 4 4.6 6 9.2 11 6.2 0% 4 15.4 11 12.6 11 16.9 26 14.6 < 30 % 12 46.2 21 24.1 15 23.1 48 27.0 31 % - 60 % 9 34.6 31 35.6 26 40.0 66 37.1 61 % - 100 % 1 3.8 24 27.6 13 20.0 38 21.3 26 100.0 87 100.0 65 100.0 178 100.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 146 Tabelle 8.: Gefäßveränderungen in Abhängigkeit vom Regressionsgrading, Plattenepithelkarzinome I II a II b absolut absolut % absolut % absolut % absolut % 23 53.5 57 60.6 211 60.1 291 59.6 16 37.2 25 26.6 22 6.3 63 12.9 Intimaproliferation 17 39.5 31 33.0 125 35.6 173 35.5 Stenosierung 25 58.1 49 52.1 204 58.1 278 57.0 Obliteration 2 4.7 14 14.9 53 15.1 69 14.1 - narbig 2 4.7 12 12.8 52 14.8 66 13.5 Kompression 25 58.1 49 52.1 129 36.8 203 41.6 15 34.9 12 12.8 5 1.4 32 6.6 15 34.9 63 67.0 242 68.9 320 65.6 Elastose 14 32.6 46 48.9 164 46.7 224 45.9 Destruktion 2 4.7 10 10.6 40 11.4 52 10.7 0% 3 7.0 13 13.8 62 17.7 78 16.0 < 30 % 8 18.6 31 33.0 98 27.9 137 28.1 31 % - 60 % 18 41.9 32 34.0 133 37.9 183 37.5 61 % - 100 % 14 32.6 18 19.1 58 16.5 90 18.4 43 100.0 94 100.0 351 100.0 488 100.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 147 Tabelle 9.: Gegenüberstellung der Gefäßveränderungen in Abhängigkeit vom Regressionsgrading nach histologischem Tumortyp Adenoca Plattenepithelca I II a II b gesamt I II a II b gesamt 46.2 63.2 75.4 65.2 53.5 60.6 60.1 59.6 38.5 50.6 4.6 32.0 37.2 26.6 6.3 12.9 Intimaproliferation 34.6 28.7 35.4 32.0 39.5 33.0 35.6 35.5 Stenosierung 65.4 37.9 47.7 45.5 58.1 52.1 58.1 57.0 Obliteration 7.7 11.5 10.8 10.7 4.7 14.9 15.1 14.1 - narbig 3.8 10.3 10.8 9.6 4.7 12.8 14.8 13.5 Kompression 53.8 49.4 47.7 49.4 58.1 52.1 36.8 41.6 11.5 18.4 6.2 12.9 34.9 12.8 1.4 6.6 30.8 62.1 70.8 60.7 34.9 67.0 68.9 65.6 Elastose 26.9 44.8 60.0 47.8 32.6 48.9 46.7 45.9 Destruktion 3.8 4.6 9.2 6.2 4.7 10.6 11.4 10.7 0% 15.4 12.6 16.9 14.6 7.0 13.8 17.7 16.0 < 30 % 46.2 24.1 23.1 27.0 18.6 33.0 27.9 28.1 31 % - 60 % 34.6 35.6 40.0 37.1 41.9 34.0 37.9 37.5 61 % - 100 % 3.8 27.6 20.0 21.3 32.6 19.1 16.5 18.4 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: Angaben in Prozent 148 Tabelle 10.: Gegenüberstellung der Gefäßveränderungen bei Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Regressionsgrading I II a II b gesamt Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca Infiltration durch Entzündungszellen Infiltration durch Tumorzellen 46.2 53.5 63.2 60.6 75.4 60.1 65.2 59.6 38.5 37.2 50.6 26.6 4.6 6.3 32.0 12.9 Intimaproliferation 34.6 39.5 28.7 33.0 35.4 35.6 32.0 35.5 Stenosierung 65.4 58.1 37.9 52.1 47.7 58.1 45.5 57.0 Obliteration 7.7 4.7 11.5 14.9 10.8 15.1 10.7 14.1 - narbig 3.8 4.7 10.3 12.8 10.8 14.8 9.6 13.5 Kompression 53.8 58.1 49.4 52.1 47.7 36.8 49.4 41.6 11.5 34.9 18.4 12.8 6.2 1.4 12.9 6.6 30.8 34.9 62.1 67.0 70.8 68.9 60.7 65.6 Elastose 26.9 32.6 44.8 48.9 60.0 46.7 47.8 45.9 Destruktion 3.8 4.7 4.6 10.6 9.2 11.4 6.2 10.7 0% 15.4 7.0 12.6 13.8 16.9 17.7 14.6 16.0 < 30 % 46.2 18.6 24.1 33.0 23.1 27.9 27.0 28.1 31 % - 60 % 34.6 41.9 35.6 34.0 40.0 37.9 37.1 37.5 61 % - 100 % 3.8 32.6 27.6 19.1 20.0 16.5 21.3 18.4 - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: Angaben in Prozent 149 Tabelle 11.: Gegenüberstellung von Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Regressionsgrading für kleine Gefäße I Adenca Plattenca Adenoca abs % abs % abs Infiltration durch Entzündungszellen Infiltration durch Tumorzellen II b II a Plattenca % abs Adenoca % abs % gesamt Plattenca Adenoca abs % abs % Plattenca abs % 3 20.0 11 44.0 19 50.0 26 49.1 22 73.3 104 53.9 44 53.0 141 52.0 4 26.7 8 32.0 18 47.4 13 24.5 2 6.7 10 5.2 24 28.9 31 11.4 Intimaproliferation 5 33.3 8 32.0 12 31.6 19 35.8 7 23.3 63 32.6 24 28.9 90 33.2 Stenosierung 9 60.0 14 56.0 17 44.7 30 56.6 13 43.3 103 53.4 39 47.0 147 54.2 Obliteration 1 6.7 1 4.0 6 15.8 7 13.2 5 16.7 40 20.7 12 14.5 48 17.7 - narbig 0 0.0 1 4.0 6 15.8 6 11.3 5 16.7 39 20.2 11 13.3 46 17.0 Kompression 5 33.3 14 56.0 18 47.4 30 56.6 15 50.0 70 36.3 38 45.8 114 42.1 3 20.0 8 32.0 5 13.2 8 15.1 2 6.7 3 1.6 10 12.0 3 20.0 8 32.0 24 63.2 33 62.3 23 76.7 134 69.4 50 60.2 175 64.6 Elastose 4 26.7 10 40.0 28 73.7 23 43.4 19 63.3 90 46.6 51 61.4 123 45.4 Destruktion 1 6.7 2 8.0 2 5.3 4 7.5 4 13.3 24 12.4 7 8.4 30 11.1 0% 3 20.0 2 8.0 8 21.1 6 11.3 7 23.3 44 22.8 18 21.7 52 19.2 < 30 % 7 46.7 4 16.0 10 26.3 19 35.8 10 33.3 47 24.4 27 32.5 70 25.8 31 % - 60 % 4 26.7 11 44.0 15 39.5 18 34.0 9 30.0 77 39.9 28 33.7 106 39.1 61 % - 100 % 1 6.7 8 32.0 5 13.2 10 18.9 4 13.3 25 13.0 10 12.0 43 15.9 15 100 25 100 38 100 53 100 30 100 193 100 83 100 271 100 - durch Tumorgewebe Aufsplitterung der M. elastica interna 19 7.0 Restlumen: 150 Tabelle 12.: Gegenüberstellung der Gefäßveränderungen von Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Regressionsgrading für große Gefäße I Adenoca II a Plattenca Adenoca abs % abs % abs Infiltration durch Entzündungszellen Infiltration durch Tumorzellen II b Plattenca % abs Adenoca % abs % gesamt Plattenca abs % Adenoca Plattenca abs % abs % 9 81.8 12 66.7 36 73.5 31 75.6 27 77.1 107 67.7 72 75.8 150 69.1 6 54.5 8 44.4 26 53.1 12 29.3 1 2.9 12 7.6 33 34.7 32 14.7 Intimaproliferation 4 36.4 9 50.0 17 34.7 12 29.3 16 45.7 62 39.2 37 38.9 83 38.2 Stenosierung 8 72.7 11 61.1 16 32.7 19 46.3 18 51.4 101 63.9 42 44.2 131 60.4 Obliteration 1 9.1 1 5.6 4 8.2 8 19.5 2 5.7 13 8.2 7 7.4 22 10.1 - narbig 1 9.1 1 5.6 3 6.1 6 14.6 1 2.9 12 7.6 5 5.3 19 8.8 Kompression 9 81.8 12 66.7 25 51.0 19 46.3 16 45.7 53 33.5 50 52.6 84 38.7 0 0.0 7 38.9 11 22.4 6 14.6 2 5.7 2 1.3 13 13.7 15 6.9 5 45.5 7 38.9 30 61.2 30 73.2 23 65.7 108 68.4 58 61.1 145 66.8 Elastose 3 27.3 4 22.2 20 40.8 23 56.1 20 57.1 74 46.8 43 45.3 101 46.5 Destruktion 0 0.0 0 0.0 2 4.1 6 14.6 2 5.7 16 10.1 4 4.2 22 10.1 0% 1 9.1 1 5.6 3 6.1 7 17.1 4 11.4 18 11.4 8 8.4 26 12.0 < 30 % 5 45.5 4 22.2 11 22.4 12 29.3 5 14.3 51 32.3 21 22.1 67 30.9 31 % - 60 % 5 45.5 7 38.9 16 32.7 14 34.1 17 48.6 56 35.4 38 40.0 77 35.5 61 % - 100 % 0 0.0 6 33.3 19 38.8 8 19.5 9 25.7 33 20.9 28 29.5 47 21.7 11 100 18 100 49 100 41 100 35 100 158 100 95 100 217 100 - durch Tumorgewebe Aufsplitterung der M. elastica interna Restlumen: 151 Tabelle 13.: Gegenüberstellung der Gefäßveränderungen von kleinen und großen Gefäßen von Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Regressionsgrading I II a II b gesamt Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca kl kl kl kl kl kl kl kl gr gr gr gr gr gr gr gr Infiltration durch 20.0 81.8 44.0 66.7 50.0 73.5 49.1 75.6 73.3 77.1 53.9 67.7 53.0 75.8 52.0 69.1 Entzündungszellen Infiltration durch 26.7 54.5 32.0 44.4 47.4 53.1 24.5 29.3 6.7 2.9 5.2 7.6 28.9 34.7 11.4 14.7 Tumorzellen Intimaproliferation 33.3 36.4 32.0 50.0 31.6 34.7 35.8 29.3 23.3 45.7 32.6 39.2 28.9 38.9 33.2 38.2 Stenosierung 60.0 72.7 56.0 61.1 44.7 32.7 56.6 46.3 43.3 51.4 53.4 63.9 47.0 44.2 54.2 60.4 Obliteration 6.7 9.1 4.0 5.6 15.8 8.2 13.2 19.5 16.7 5.7 20.7 8.2 14.5 7.4 17.7 10.1 - narbig 0.0 9.1 4.0 5.6 15.8 6.1 11.3 14.6 16.7 2.9 20.2 7.6 13.3 5.3 17.0 8.8 Kompression 33.3 81.8 56.0 66.7 47.4 51.0 56.6 46.3 50.0 45.7 36.3 33.5 45.8 52.6 42.1 38.7 - durch 20.0 0.0 32.0 38.9 13.2 22.4 15.1 14.6 6.7 5.7 1.6 1.3 12.0 13.7 7.0 6.9 Tumorgewebe Aufsplitterung der 20.0 45.5 32.0 38.9 63.2 61.2 62.3 73.2 76.7 65.7 69.4 68.4 60.2 61.1 64.6 66.8 M. elastica interna Elastose 26.7 27.3 40.0 22.2 73.7 40.8 43.4 56.1 63.3 57.1 46.6 46.8 61.4 45.3 45.4 46.5 Destruktion 6.7 0.0 8.0 0.0 5.3 4.1 7.5 14.6 13.3 5.7 12.4 10.1 8.4 4.2 11.1 10.1 0% 20.0 9.1 8.0 5.6 21.1 6.1 11.3 17.1 23.3 11.4 22.8 11.4 21.7 8.4 19.2 12.0 < 30 % 46.7 45.5 16.0 22.2 26.3 22.4 35.8 29.3 33.3 14.3 24.4 32.3 32.5 22.1 25.8 30.9 31 % - 60 % 26.7 45.5 44.0 38.9 39.5 32.7 34.0 34.1 30.0 48.6 39.9 35.4 33.7 40.0 39.1 35.5 61 % - 100 % 6.7 Restlumen: 0.0 32.0 33.3 13.2 38.8 18.9 19.5 13.3 25.7 13.0 20.9 12.0 29.5 15.9 21.7 Angaben in Prozent 152 Tabelle 14.: Gegenüberstellung der Gefäßveränderung von Adeno- und Plattenepithelkarzinomen für kleine und große Gefäße in Abhängigkeit vom Regressionsgrading I II b II a gesamt kleine G. große G. kleine G. große G. kleine G. große G. kleine G. große G. A P A P A P A P A P A P A P A P Infiltration durch 20.0 44.0 81.8 66.7 50.0 49.1 73.5 75.6 73.3 53.9 77.1 67.7 53.0 52.0 75.8 69.1 Entzündungszellen Infiltration durch 26.7 32.0 54.5 44.4 47.4 24.5 53.1 29.3 6.7 5.2 2.9 7.6 28.9 11.4 34.7 14.7 Tumorzellen Intimaproliferation 33.3 32.0 36.4 50.0 31.6 35.8 34.7 29.3 23.3 32.6 45.7 39.2 28.9 33.2 38.9 38.2 Stenosierung 60.0 56.0 72.7 61.1 44.7 56.6 32.7 46.3 43.3 53.4 51.4 63.9 47.0 54.2 44.2 60.4 Obliteration 6.7 4.0 9.1 5.6 15.8 13.2 8.2 19.5 16.7 20.7 5.7 8.2 14.5 17.7 7.4 10.1 - narbig 0.0 4.0 9.1 5.6 15.8 11.3 6.1 14.6 16.7 20.2 2.9 7.6 13.3 17.0 5.3 Kompression 33.3 56.0 81.8 66.7 47.4 56.6 51.0 46.3 50.0 36.3 45.7 33.5 45.8 42.1 52.6 38.7 8.8 - durch 20.0 32.0 0.0 38.9 13.2 15.1 22.4 14.6 6.7 1.6 5.7 1.3 12.0 7.0 13.7 6.9 Tumorgewebe Aufsplitterung der 20.0 32.0 45.5 38.9 63.2 62.3 61.2 73.2 76.7 69.4 65.7 68.4 60.2 64.6 61.1 66.8 M. elastica interna Elastose 26.7 40.0 27.3 22.2 73.7 43.4 40.8 56.1 63.3 46.6 57.1 46.8 61.4 45.4 45.3 46.5 Destruktion 6.7 8.0 0.0 0.0 5.3 7.5 4.1 14.6 13.3 12.4 5.7 10.1 8.4 11.1 4.2 10.1 0% 20.0 8.0 9.1 5.6 21.1 11.3 6.1 17.1 23.3 22.8 11.4 11.4 21.7 19.2 8.4 12.0 < 30 % 46.7 16.0 45.5 22.2 26.3 35.8 22.4 29.3 33.3 24.4 14.3 32.3 32.5 25.8 22.1 30.9 31 % - 60 % 26.7 44.0 45.5 38.9 39.5 34.0 32.7 34.1 30.0 39.9 48.6 35.4 33.7 39.1 40.0 35.5 61 % - 100 % 6.7 32.0 Restlumen: 0.0 33.3 13.2 18.9 38.8 19.5 13.3 13.0 25.7 20.9 12.0 15.9 29.5 21.7 Angaben in Prozent 153 Tabelle 15.: Aufschlüsselung der Gefäßveränderungen nach Restlumina für Adenound Plattenepithelkarzinome 0% < 30 % 31- 60 % 61- 100 % A plus P A plus P A plus P A plus P 45.2 58.9 62.7 65.6 8.7 17.8 16.1 25.0 Intimaproliferation 1.0 29.2 45.4 46.1 Stenosierung 4.8 62.2 65.9 53.9 Obliteration 82.7 0.5 0.8 0.0 - narbig 79.8 0.0 0.0 0.0 Kompression 26.0 46.5 47.0 40.6 1.9 8.6 8.0 11.7 75.0 70.3 61.4 46.9 Elastose 59.6 57.3 43.4 21.1 Destruktion 56.7 10.3 1.6 0.0 Infiltration durch Entzündungszellen Infiltration durch Tumorzellen - durch Tumorgewebe Aufsplitterung der M. elastica interna Angaben in Prozent 154 Tabelle 16.: Gefäßveränderungen bei Adeno- und Plattenepithelkarzinomen in Abhängigkeit vom Restlumen 0% < 30 % 31- 60 % 61- 100 % Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca Adenoca Plattenca Infiltration durch Entzündungszellen Infiltration durch Tumorzellen 65.4 38.5 56.3 59.9 66.7 61.2 73.7 62.2 19.2 5.1 33.3 12.4 27.3 12.0 42.1 17.8 Intimaproliferation 3.8 0.0 29.2 29.2 37.9 48.1 44.7 46.7 Stenosierung 7.7 3.8 66.7 60.6 43.9 73.8 39.5 60.0 Obliteration 69.2 87.2 0.0 0.7 1.5 0.5 0.0 0.0 - narbig 65.4 84.6 0.0 0.0 0.0 0.0 0.0 0.0 Kompression 38.5 21.8 52.1 37.2 53.0 44.8 36.8 42.2 3.8 1.3 12.5 7.3 15.2 5.5 18.4 8.9 73.1 75.6 56.3 75.2 54.5 63.3 55.3 43.3 Elastose 50.0 62.8 52.1 59.1 51.5 40.4 26.3 18.9 Destruktion 30.8 65.4 6.3 11.7 0.0 2.2 0.0 0.0 - durch Tumorgewebe Aufsplitterung der M. elastica interna Angaben in Prozent 155 Tabelle 17.: Gegenüberstellung der Gefäßveränderungen kleiner und großer Gefäße in Abhängigkeit vom Restlumen, Adenokarzinome 0% < 30 % 31- 60 % 61- 100 % große G. kleine G. große G. kleine G. große G. kleine G. große G. kleine G. abs % abs Infiltration durch Entzündungszellen Infiltration durch Tumorzellen % abs % abs % abs % abs % abs % abs % 8 100 9 50.0 14 66.7 13 48.1 29 76.3 15 53.6 23 82.1 5 50.0 2 25.0 3 16.7 8 38.1 8 29.6 9 23.7 9 32.1 13 46.4 3 30.0 Intimaproliferation 0 0.0 1 5.6 6 28.6 8 29.6 17 44.7 8 28.6 14 50.0 3 30.0 Stenosierung 0 0.0 2 11.1 13 61.9 19 70.4 18 47.4 11 39.3 9 32.1 6 60.0 Obliteration 6 75.0 12 66.7 0 0.0 0 0.0 1 2.6 0 0.0 0 0.0 0 0.0 - narbig 6 75.0 11 61.1 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 Kompression 1 12.5 9 50.0 13 61.9 12 44.4 20 52.6 15 53.6 9 32.1 5 50.0 0 0.0 1 5.6 5 23.8 1 3.7 5 13.2 5 17.9 4 14.3 3 30.0 7 87.5 12 66.7 11 52.4 16 59.3 21 55.3 15 53.6 16 57.1 5 50.0 Elastose 3 37.5 10 55.6 11 52.4 14 51.9 20 52.6 14 50.0 6 21.4 4 40.0 Destruktion 3 37.5 27.8 1 4.8 2 7.4 0 0.0 0 0.0 0 0.0 0 0.0 8 100 18 100 21 100 27 100 38 100 28 100 28 100 10 100 - durch Tumorgewebe Aufsplitterung der M. elastica interna 5 Angaben in Prozent 156 Tabelle 18.: Gegenüberstellung der Gefäßveränderung kleiner und großer Gefäße in Abhängigkeit vom Restlumen, Plattenepithelkarzinome 0% < 30 % 31- 60 % 61- 100 % große G. kleine G. große G. kleine G. große G. kleine G. große G. kleine G. abs. % abs % abs % abs % abs % abs % abs % abs % Infiltration durch Entzündungszellen Infiltration durch Tumorzellen 13 50.0 17 32.7 48 71.6 34 48.6 53 68.8 59 55.7 31 66.0 25 58.1 2 7.7 2 3.8 8 11.9 9 9 20.9 Intimaproliferation 0 0.0 0 0.0 23 34.3 17 24.3 33 42.9 55 51.9 24 51.1 18 41.9 Stenosierung 0 0.0 3 5.8 42 62.7 41 58.6 54 70.1 81 76.4 31 66.0 23 53.5 Obliteration 21 80.8 47 90.4 1 1.5 0 0.0 0 0.0 1 0.9 0 0.0 0 0.0 - narbig 20 76.9 46 88.5 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 0 0.0 Kompression 6 23.1 11 21.2 26 38.8 35 50.0 36 46.8 46 43.4 16 34.0 22 51.2 1 3.8 0 0.0 3 4.5 7 5 11.6 19 73.1 40 76.9 53 79.1 50 71.4 46 59.7 71 67.0 23 48.9 16 37.2 Elastose 15 57.7 34 65.4 41 61.2 40 57.1 32 41.6 42 39.6 9 19.1 8 18.6 Destruktion 23 88.5 28 53.8 10 14.9 6 8.6 1 1.3 2.8 0 0.0 0 0.0 26 100 100 67 100 70 100 77 100 106 100 47 100 43 100 - durch Tumorgewebe Aufsplitterung der M. elastica interna 52 Angaben in Prozent 157 12.9 11 14.3 11 10.4 10.0 4 5.2 6 3 5.7 7 3 14.9 6.4 Tabelle 19.: Gegenüberstellung der Gefäßveränderungen kleiner und großer Gefäße von Adenound Plattenepithelkarzinomen in Abhängigkeit vom Restlumen 0% Adenoca kl gr < 30 % Plattenca kl gr Adenoca kl gr 31- 60 % Plattenca kl gr Adenoca kl gr 61- 100 % Plattenca kl gr Adenoca kl gr Plattenca kl gr Infiltration durch 50.0 100 32.7 50.0 48.1 66.7 48.6 71.6 53.6 76.3 55.7 68.8 50.0 82.1 58.1 66.0 Entzündungszellen Infiltration durch 16.7 25.0 3.8 7.7 29.6 38.1 12.9 11.9 32.1 23.7 10.4 14.3 30.0 46.4 20.9 14.9 Tumorzellen Intimaproliferation 5.6 0.0 0.0 0.0 29.6 28.6 24.3 34.3 28.6 44.7 51.9 42.9 30.0 50.0 41.9 51.1 Stenosierung 11.1 0.0 5.8 0.0 70.4 61.9 58.6 62.7 39.3 47.4 76.4 70.1 60.0 32.1 53.5 66.0 Obliteration 66.7 75.0 90.4 80.8 0.0 0.0 0.0 1.5 0.0 2.6 0.9 0.0 0.0 0.0 0.0 0.0 - narbig 61.1 75.0 88.5 76.9 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 0.0 Kompression 50.0 12.5 21.2 23.1 44.4 61.9 50.0 38.8 53.6 52.6 43.4 46.8 50.0 32.1 51.2 34.0 - durch Tumorgewebe Aufsplitterung der M. elastica interna 5.6 0.0 0.0 3.8 3.7 23.8 10.0 4.5 17.9 13.2 5.7 5.2 30.0 14.3 11.6 6.4 66.7 87.5 76.9 73.1 59.3 52.4 71.4 79.1 53.6 55.3 67.0 59.7 50.0 57.1 37.2 48.9 Elastose 55.6 37.5 65.4 57.7 51.9 52.4 57.1 61.2 50.0 52.6 39.6 41.6 40.0 21.4 18.6 19.1 Destruktion 27.8 37.5 53.8 88.5 7.4 4.8 Angaben in Prozent 158 8.6 14.9 0.0 0.0 2.8 1.3 0.0 0.0 0.0 0.0 DANKSAGUNG Aufrichtig danke ich Herrn Professor Dr. med. K.- M. Müller für die Überlassung des Themas, des entsprechenden Untersuchungsmaterials und des Arbeitsplatzes. Herrn PD Dr. K. Junker danke ich vor allem für die Betreuung und hilfreiche Unterstützung auch über die lokale Entfernung hinweg. Beiden gilt ein ganz besonderer Dank für ihre außerordentliche Geduld und notwendige Strenge bis zur Fertigstellung meiner Arbeit. Ferner möchte ich allen Beteiligten meinen Dank aussprechen, ohne deren Hilfestellung die Fertigstellung der Arbeit nicht gelungen wäre. 159 9. LEBENSLAUF Persönliche Daten Name: Schnyder, geb. Haueisen Vorname: Andrea Geburtsdatum: 28.02.1972 Geburtsort: Papenburg Familienstand: verheiratet Staatsangehörigkeit: deutsch Anschrift: Kantonsstrasse 114, 6048 Horw LU, Schweiz Schulbildung 08.1978 - 07.1982 St. Martinus Grundschule Nottuln 08.1982 - 06.1991 Marienschule Münster, Bischöfliches Mädchengymnasium 07.06.1991 Abitur Berufsausbildung 11.1991 - 03.1992 MTA- Schule der Berufsgenossenschaftlichen Kliniken Bergmannsheil Bochum, Universitätsklinik 04.1992 - 03.1994 Vorklinischer Studienabschnitt Georg- August- Universität Göttingen 04.1994 - 09.1997 Klinischer Studienabschnitt Georg- August- Universität Göttingen 10.1997 - 09.1998 Praktisches Jahr mit dem Wahlfach Gynäkologie Universitätsklinik Göttingen 09.12.1998 3. Staatsexamen Beruf 02.1999 - 08.2000 AiP in der Frauenklinik, Städtisches Klinikum Pforzheim 02.2001 - 06.2002 Assistenzärztin in der Frauenklinik Männedorf ZH, Schweiz 07.2002 - Assistenzärztin in der Frauenklinik Zug, Schweiz 160