Verdünnen von konzentrierter Schwefelsäure
Werbung

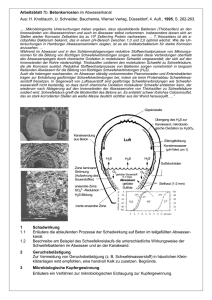
Verdünnen von konzentrierter Schwefelsäure Experimente, welche die Exothermizität der Reaktion von konzentrierter Schwefelsäure mit Wasser verdeutlichen sollen, sind in der Regel nicht sonderlich spektakulär, da man oft den Temperaturanstieg nur auf einem Thermometer beobachten kann. Hier werden zwei Experimente gezeigt, bei denen die starke Erwärmung, die mit der Reaktion einhergeht, auch ohne Thermometer eindeutig festzustellen ist. Die Idee zum ersten Versuch stammt von „chem-page.de“ (http://www.chem-page.de/ Æ Showexperimente Æ 50. Schwefelsäure und Wasser), die Idee und Anleitung zum zweiten Versuch von mir. • Sicherheitshinweise: Schwefelsäure ist ätzend (C). In beiden Experimenten beginnt das Wasser, beziehungsweise ein Wasser-Schwefelsäuregemisch aufgrund der großen Wärmefreisetzung zu kochen. Dabei reißt der Wasserdampf kleine Schwefelsäuretröpfchen mit. Ein Einatmen dieses Dampfes ist also zu vermeiden. Diese Sicherheitshinweise sind weder ausführlich noch vollständig. Experiment 1: Verdünnen von H2SO4 im Kaffeebecher • Versuchsdurchführung: In einen dünnwandigen Plastikbecher werden etwa 30ml Wasser gegeben (der Größe des Bechers anpassen). Der mit Wasser gefüllte Plastikbecher wird dann in ein großes Becherglas (1 oder 2 Liter) gestellt. Anschließend werden rasch 30ml Schwefelsäure hinzu gegossen. Aufgrund der hohen Temperaturen, die beim Mischen entstehen, beginnt das Schwefelsäure-Wasser Gemisch heftig zu kochen und der Plastikbecher kollabiert innerhalb weniger Sekunden und schmilzt dahin. Dampf steigt aus dem Becherglas auf. Um zu zeigen, dass es sich beim Kollabieren des Bechers um ein physikalisches Phänomen handelt, kann man etwas konzentrierte Schwefelsäure in einen anderen Plastikbecher geben, und man kann beobachten, dass der Becher von der Säure nicht angegriffen wird. Die Ausschnitte aus dem Film zeigen den Verlauf des Versuches Experiment 2: Niemals Wasser in die Säure, … • Versuchsdurchführung: Es wird folgende Versuchsanordnung aufgebaut: Zuerst wird der Boden eines großes 100ml Reagenzglases erwärmt, bis er glüht und dann gegen eine ebene Oberfläche gedrückt. Das wird so oft wiederholt, bis das Reagenzglas so verformt ist, dass es stehen bleibt. Dann wird einen Teil des Reagenzglases abgetrennt, so dass es bequem in das 2l Becherglas passt (siehe Foto). Der Rest der Versuchsanordnung wird aufgebaut und es wird überprüft, ob auch alles zusammenpasst. Das weiße und schwarze Papier dient nur der Kontrasterhöhung. Gleich vornweg: Wird Wasser in konzentrierte Schwefelsäure gegossen, sieht das meist recht harmlos aus, da oft nur ein paar kleine Spritzer entstehen. Dies ist zwar keineswegs harmlos und sollte auch nicht unterschätzt werden, für einen schönen Film ist dies jedoch nicht allzu spektakulär. Bei dem hier beschriebenen Versuch wird deshalb ein wenig gemogelt. Diese Bemerkung und das nachfolgende Experiment sollen nicht dazu ermutigen, die allgemeine Regel („Niemals Wasser in die Säure, sonst geschieht das Ungeheure“) zu missachten. Bei dem Experiment geht es mehr um den „Showeffekt“ als um eine korrekte Veranschaulichung eines chemisch/physikalischen Phänomens (siehe Punkt 3: „Wie es am besten spritzt“). Nun zum Experiment: Das Reagenzglas mit flachem Boden wird zuerst vorsichtig über der Flamme vorgewärmt (Damit kein Wasserdampf an der kalten Gefäßwand kondensiert und den Trick verrät). Dann wird es einige Zentimeter hoch mit warmem Wasser (60°C oder mehr) gefüllt und ins Becherglas gestellt (siehe Erklärung). Dann wird das Becherglas mit der Spanplatte verschlossen und durch den Trichter wird rasch etwa die gleiche Menge konzentrierte Schwefelsäure in das Becherglas gegossen. Der Inhalt des Reagenzglases gerät ins Kochen, spritzt aus dem Reagenzglas und läuft an den Wänden des Becherglases hinunter. Es entsteht Dampf. Hier das Ganze in Bildern: Wie man auf dem ersten Bild erkennen kann spritzt trotz der Abdeckung ein wenig Säure aus dem Reagenzglas. Man sollte also besser etwas Abstand halten. Hier noch ein Bild, das die Säurespritzer auf dem Papier, das im Becherglas war, zeigt: Von beiden Experimenten gibt es auch ein Video: - Video: auf Bild klicken Erklärung: 1) Chemische Vorgänge beim Verdünnen von konzentrierter Schwefelsäure Schwefelsäure zeigt eine hohe Affinität zu Wasser. Wie groß die Affinität der Schwefelsäure zu Wasser ist, zeigt sich auch darin, dass sie aus organischen Stoffen Hydroxylgruppen und Protonen abspaltet und sie somit verkohlt. Verdünnt man konzentrierte Schwefelsäure, so entstehen zuerst in einer stark exothermen Reaktion verschiedene Hydrate mit kristalliner Struktur. Man kann dafür folgende vereinfachte Gleichung angeben: H2SO4 + n H2O Æ H2SO4 · n H2O ∆H<0 Erst wenn diese Hydrat-Bildung abgeschlossen ist, beginnt die eigentliche Protolysereaktion. Das erklärt auch warum konzentriere Schwefelsäure kaum den elektrischen Strom leitet. In der ersten Protolysestufe findet folgende Reaktion statt: H2SO4 + H2O Æ HSO4 - + H3O+ In der zweiten Protolysestufe (auch wenn die dafür nötige Verdünnung in diesem Experiment nicht erreicht wird) hat man: HSO4 - + H2O Æ SO42- + H3O+ Verantwortlich für die große Wärmefreisetzung ist vor allem die Hydratbildung. Die Reaktionsenthalpie beträgt bei der Verdünnung konzentrierter Schwefelsäure bei 20 °C 95,33 kJ/mol. Die molare Verdampfungswärme von Wasser beträgt bei dieser Temperatur etwa 44 kJ/mol. Die bei der Verdünnung einer Mol Schwefelsäure freigesetzte Energie reicht also aus, um mehr als zwei Mol Wasser zum Verdampfen zu bringen. Das klingt sehr beindruckend, jedoch gibt es einen kleinen Haken bei der Sache. Dazu mehr unter Punkt 4: „Erklärungsversuche“). Bei dem Verdünnungsvorgang können Temperaturen von bis zu 300 °C entstehen. Der Plastikbecher im ersten Experiment besteht aus Polystyrol (PS), einem Thermoplast, dessen Glasübergangstemperatur (Erweichungstemperatur) etwa bei 100°C liegt. Gegenüber der konzentrierten Schwefelsäure besitzt Polystyrol eine relativ gute Beständigkeit. Die bei der Verdünnung der Schwefelsäure entstehenden Temperaturen sind dem Plastikbecher jedoch zu hoch und er beginnt zu zerfließen. 2) Warum kein Wasser in die Schwefelsäure? Gießt man Wasser in konzentrierte Schwefelsäure, so schwimmt das Wasser aufgrund der kleineren Dichte (ρ(H2SO4)= 8356 g·cm-3) oben auf der Schwefelsäure und wird von ihr eingeschlossen. Im Berührungsbereich der beiden Flüssigkeiten entstehen hohe Temperaturen, so dass das Wasser augenblicklich verdampft und aus dem Gefäß schießt, wobei es Schwefelsäure mitreißt. Angeblich kann dabei sogar das Gefäß zerspringen. Aus diesem Grund sollte man die Säure in das Wasser geben und nicht umgekehrt. Am besten tut man dies langsam und unter Rühren, damit die entstehende Wärme schön gleichmäßig verteilt wird und es nicht zu örtlichen Überhitzungen kommt. 3) Wie es am besten spritzt: Normalerweise versucht man ein Spritzen der Säure zu vermeiden. Will man jedoch das Gegenteil erreichen, so sollte man Folgendes beachten: 1) Das Gefäß sollte möglichst eng und hoch sein. In diesem Fall erfüllt das abgeschnittene Reagenzglas diesen Zweck. 2) Dass das Wasser zuerst auf der Schwefelsäure schwimmt ist zwar einer der Gründe, warum es spritzt, wenn man Wasser in Schwefelsäure schüttet, jedoch verhindert die Phasenbildung in einem engen Gefäß, dass sich Säure und Wasser schnell mischen. Es wird also wenig Wärme freigesetzt, und darum spritzt es auch wenig. Gießt man jedoch in einem engen Gefäß, wie dem großen Reagenzglas, Schwefelsäure in Wasser (richtige Reihenfolge!), so sinkt die Schwefelsäue auf den Reagenzglasboden, und auf dem Weg durch das Wasser wird sie unter Wärmefreisetzung teilweise verdünnt, wobei sie das Wasser bis zum Kochen erhitzt. Das dabei im unteren Teil des Reagenzglases schlagartig entstehende gasförmige Wasser drückt das flüssige Wasser darüber mit Wucht aus dem Regenglas. 3) Wie man sich denken kann spielt auch die Temperatur der Schwefelsäure und des Wassers eine große Rolle. Vermischt man im Eisbad gut gekühlte Schwefelsäure mit gut gekühltem Wasser, so spritzt es nicht, ganz gleich in welcher Reihenfolge man es tut (experimentelle Beobachtung). Aufgrund der großen Wärmekapazität von Wasser wird in diesem Fall die entstehende Wärme beim Erhitzen des Wassers schon alle verbraucht, bevor das Wasser überhaupt 100°C erreicht hat. Hat das Wasser jedoch schon am Anfang nahezu 100°C, so dient die entstehende Wärme größtenteils zum Überführen des Wassers in den gasförmigen Zustand und das Wasser beginnt fast augenblicklich zu kochen. 4) Erklärungsversuche: Den Satz unter Punkt 1: „Chemische Vorgänge beim Verdünnen von konzentrierter Schwefelsäure“ kann man durch Umrechnen noch etwas anders formulieren. Dann hat man: „Die bei der Verdünnung von 53,43ml Schwefelsäure freigesetzte Energie reicht also aus, um mehr als 36ml zum Verdampfen zu bringen.“ Beim Verdünnen von Schwefelsäure ist die exotherme Hydratbildung bei einer Konzentration von 66% größtenteils abgeschlossen. Will man also eine Mol 98% Schwefelsäure (53,43ml) so weit verdünnen, dass die freigesetzte Wärmemenge maximal ist, braucht man ungefähr 47,56 ml Wasser (mit dem Mischungskreuz berechnet). Nimmt man an, dass dieses Wasser zuerst auf 100°C gebracht werden muss, so werden weniger als 36ml Wasser effektiv verdampft (da mehr als 36ml Wasser erhitzt werden müssen). Dennoch wird noch immer bei weitem mehr Wasser in den gasförmigen Zustand überführt als man es experimentell beobachten kann. Man darf jedoch nicht vergessen, dass auch die Schwefelsäure, beziehungsweise ein Schwefelsäure-Wassergemisch erwärmt werden muss und die bei der Verdünnung entstehende Wärme somit nicht nur zur Temperaturerhöhung und Verdampfung des Wassers beiträgt. Zudem bildet das Wasser, das die Schwefelsäure verdünnt, mit der Schwefelsäure ein Gemisch mit einem Siedepunkt, der deutlich über 100°C liegt. Somit entsteht in Wirklichkeit viel weniger Wasserdampf, als man auf den ersten Blick denken könnte. • Quellen: * https://lp.uni-goettingen.de/get/text/2575 * http://www.chem-page.de/index.php?option=com_content&view=article&id=2497:schwefelsaeure-undwasser&catid=167:experimente&Itemid=228 * http://www.chemieunterricht.de/dc2/tip/12_98.htm * Tabellen für das Labor (aus der Lab-Tools-Reihe von Merck) * Wikipedia