Elektronischer Sonderdruck für Pathologie und Molekularpathologie
Werbung

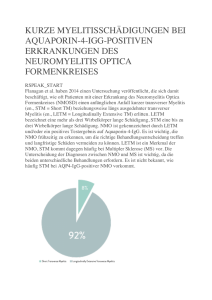
Der Onkologe Organ der Deutschen Krebsgesellschaft e.V. Elektronischer Sonderdruck für E. Wardelmann Ein Service von Springer Medizin Onkologe 2014 · 20:1068–1074 · DOI 10.1007/s00761-014-2709-z © Springer-Verlag Berlin Heidelberg 2014 E. Wardelmann · S. Huss · W. Hartmann Pathologie und Molekularpathologie von Weichteilsarkomen Diese PDF-Datei darf ausschließlich für nichtkommerzielle Zwecke verwendet werden und ist nicht für die Einstellung in Repositorien vorgesehen – hierzu zählen auch soziale und wissenschaftliche Netzwerke und Austauschplattformen. www.DerOnkologe.de Leitthema Onkologe 2014 · 20:1068–1074 DOI 10.1007/s00761-014-2709-z Online publiziert: 9. Oktober 2014 © Springer-Verlag Berlin Heidelberg 2014 E. Wardelmann · S. Huss · W. Hartmann Gerhard-Domagk-Institut für Pathologie, Universitätsklinikum Münster Pathologie und Molekularpathologie von Weichteilsarkomen Weichteilsarkome umfassen eine heterogene Gruppe von Tumoren, deren Subtypisierung im Alltag des Pathologen häufig eine Herausforderung darstellt. Jetzt werden zunehmend spezifische genomische Alterationen entdeckt, von denen ein Teil heute bereits nicht nur eine diagnostische Hilfe bietet, sondern auch auf mögliche Therapie-Targets hinweist. Aufgrund ihrer Seltenheit sind die Methoden zur Detektion dieser Alterationen aber zumeist nur in spezialisierten Instituten etabliert. Eine referenzpathologische Zweitmeinung sollte daher in der Mehrzahl der Fälle die Regel sein. Schwierigkeiten in Diagnostik und Therapie Nach wie vor bereitet die pathomorphologische Diagnostik von Weichteilsarkomen Schwierigkeiten. Auch in der neuen WHO-Klassifikation aus 2013 [1] tauchen mehr als 60 verschiedene Entitäten auf, sodass bei den ohnehin seltenen Weichgewebstumoren jeder einzelne Subtyp noch seltener im Eingang eines einzelnen pathologischen Instituts auftaucht und der Erfahrungshorizont des einzelnen Pathologen für die jeweiligen Sarkomentitäten außerhalb von wenigen deutschen Zentren schmal ist. Hinzu kommt, dass sich bei steigender Zahl definierender molekularer Befunde die Etablierung der entsprechenden Methoden oft wegen zu geringer Inzidenz der verschiedenen Genaberrationen nicht lohnt. Studien zeigen, dass 1068 | Der Onkologe 11 · 2014 ein nicht unerheblicher Teil der Sarkome derzeit nicht korrekt klassifiziert wird. » Auch heute werden noch bis zu 25% aller Sarkome nicht korrekt klassifiziert Die Etablierung molekular gerichteter Therapien fällt im Bereich der Sarkome ebenfalls wegen ihrer Seltenheit schwer, da von seiten der pharmazeutischen Industrie derzeit vornehmlich die häufigen Tumorentitäten wie Mammakarzinom, Lungenkarzinom, Kolonkarzinom und Prostatakarzinom ganz im Vordergrund stehen. Selbst beim Nachweis möglicher therapeutischer Zielstrukturen und bereits vorhandenen Inhibitoren gibt es vergleichsweise wenig innovative Therapiekonzepte; die wenigen angebotenen klinischen Studien rekrutieren bei geringer Inzidenz einzelner Sarkomsubtypen schlecht. Einzige Ausnahme stellt der gastrointestinale Stromatumor dar, bei dem der therapeutische Goldstandard nach operativer Entfernung sowohl adjuvant als auch bei fortgeschrittenem Tumorleiden die Behandlung mit dem Tyrosinkinaseinhibitor Imatinib ist [2, 3]. Epidemiologie Weichteilsarkome machen etwa 1% aller Malignome aus und sind wesentlich seltener als gutartige Weichgewebstumoren. Es handelt sich vorwiegend um eine Erkrankung des höhreren Lebensalters mit einem Altersgipfel zwischen 60 und 80 Jahren [4]. Bei differenzierterer Be- trachtung treten Sarkome aber, abhängig vom jeweiligen Subtyp, durchaus auch schon in jungen Jahren auf, wie z. B. das Synovialsarkom. Das Rhabdomyosarkom ist im Kindesalter wesentlich häufiger anzutreffen als bei Erwachsenen und macht bei Kindern und Heranwachsenden das häufigste Weichteilsarkom aus [5]. Ducimetière et al. [4] haben zwischen 2005 und 2007 im Rhône-Alpes-Gebiet mit 6.000.000 Einwohnern eine Sarkominzidenz von etwa 5 Neuerkrankungen pro Jahr ausgemacht. Hochgerechnet auf Deutschland wäre somit von einer Neuerkrankungsrate von etwa 4000 Sarkomen pro Jahr auszugehen. Tab. 1 TNM-Klassifikation für Weichteil- sarkome (UICC/AJCC 2010) Klassifikation T1 T1a T1b T2 T2a T2b N1 M1 Definition Tumordurchmesser ≤5 cm Oberflächlich Tief Tumordurchmesser >5 cm Oberflächlich Tief Regionäre Lymphknotenmetastasen Fernmetastasen Ein oberflächlicher Tumor ist vollständig oberhalb der oberflächlichen Faszie lokalisiert und infiltriert diese nicht. Hat ein Tumor Kontakt zur Faszie, infiltriert diese oder liegt unterhalb, handelt es sich um eine tiefe Lokalisation. Neben mediastinalen, retroperitonealen und pelvinen Tumoren handelt es sich bei den folgenden Lokalisationen definitionsgemäß um tiefe Tumoren: Kopf, Nacken, Axilla, paraspinal, Leistenbeuge, Schenkeldreieck, Kniekehle, Ellbeuge, Hand- und Fußwurzel, Ferse und Mittelfuß. Leitthema Abb. 1 8 a Fibromyxoides Low-Grade-Sarkom (LGFMS) mit bemerkenswert wenig Pleomorphien der spindeligen blanden Tumorzellen und kollagener myxoider Matrix (HE-Färbung, Vergr. 10:1). b Kräftige MUC-4 Expression in einem LGFMS (Vergr. 20:1). c Nachweis eines Bruchereignisses im FUS-Gen eines LGFMS (Break-apart-Sonde: diagnostisch ist das getrennte rote und grüne Signal) Abb. 2 9 Kräftige nukleäre Expression von ERG („Ets-related gene“) in einem Angiosarkom (Vergr. 20:1) Am häufigsten treten Weichteilsarkome zu etwa 40% an den unteren und zu etwa 15% an den oberen Extremitäten auf. Es folgen Retroperitoneum und Abdomen mit 15–20% und schließlich die KopfHals-Region mit 10%. Als häufigster Sarkomsubtyp sind mit etwa 20% die Liposarkome zu nennen, gefolgt von Leiomyosarkomen und undifferenzierten Sarkomen mit einer Häufigkeit von je ca. 15%. Alle übrigen Subtypen sind seltener [6]. Rolle der Pathologie für die Klassifikation Der Pathologie kommt in der Diagnostik von Weichteilsarkomen eine zentrale Rolle zu. Häufig wird bereits an bioptischem Material die genaue Subtypisierung und das Grading eines Weichteiltumors erwartet, um ggf. auch ein neoadjuvantes Therapiekonzept wie Strahlentherapie, Chemotherapie, isolierte Extremitätenperfusion oder ähnliches in Betracht ziehen zu können. 1070 | Der Onkologe 11 · 2014 DDie Subtypisierung und Graduierung gelingt an Biopsien nur in einem Teil der Fälle. Dies ist durch Samplingfehler oder Fehlerfassung von Nekrosen bedingt. Am Resektat stehen die richtige Subtypisierung, die Dignitätseinschätzung, die Beurteilung der tumorfreien Resektionsränder und das Grading ganz im Vordergrund. Weichteiltumoren werden in folgende 4 Dignitätsgruppen eingeteilt: Fbenigne, Fintermediäre Dignität – lokal aggressiv, Fintermediäre Dignität – selten metastasierend (<2%), Fmaligne. Das Grading erfolgt in Deutschland zumeist nach dem französischen FNCLCCSystem (La Fédération Nationale des Centres de Lutte Contre le Cancer; [7]). Für das Metastasenrisiko von Sarkomen ist dieses Grading nach wie vor der entschei- dende Parameter. Zum Staging wird üblicherweise die TNM-Klassifikation 2010 verwendet [8], die allerdings nach wie vor für alle verschiedenen Sarkomsubtypen nur eine Klassifikation vorhält (. Tab. 1). Histomorphologisch ist zwischen nicht pleomorphen und pleomorphen Weichteiltumoren zu unterscheiden. In der Gruppe der nicht pleomorphen finden sich zahlreiche Entitäten mit klar definierten molekularen Aberrationen, während die pleomorphen Tumoren häufig komplexere Karyotypen aufweisen. Letztere sind entsprechend häufig schwieriger zu klassifizieren, da neben der fehlenden definierenden molekularen Aberration auch die immunhistochemischen Expressionsmuster vielfältig sein können [9]. » Die Immunhistochemie ist in der Sarkomdiagnostik bedeutend Die Immunhistochemie spielt in der Sarkomdiagnostik eine wichtige Rolle, um mögliche Liniendifferenzierungen zu identifizieren oder Hinweise auf mögliche genomische Alterationen zu erhalten. So können die Genprodukte von MDM2 und CDK4 auch immunhistochemisch nukleär nachgewiesen werden und in hoch- und dedifferenzierten Liposarkomen einen Hinweis auf die Amplifikation der entsprechenden Gene geben. Epi­ theliale Marker helfen bei der Diagnostik von Synovialsarkomen und epitheloiden Sarkomen. Myogene Marker sind unerlässlich für die Identifizierung von leiomyomatösen Tumoren, wobei der alleinige Nachweis von glattmuskulärem Aktin Zusammenfassung · Abstract hier nicht ausreicht. Es sollten mindestens zwei derartige Marker (z. B. zusätzlich Desmin/h-Caldesmon) nachgewiesen werden. Für Rhabdomyosarkome ist darüber hinaus ein nukleärer Nachweis von Myogenin und/oder MyoD1 zu fordern. TLE-1 („transducin-like enhancer of split 1“) hat sich als hilfreich in der Diagnostik von Synovialsarkomen erwiesen, MUC-4 wird bei fibromyxoiden Low-Grade-Sarkomen (. Abb. 1) und dem sklerosierenden epitheloiden Fibrosarkom gefunden. Ein INI1-Verlust kann bei epitheloiden Sarkomen und bei einem Teil der malignen peripheren Nervenscheidentumoren nachgewiesen werden. » Ein sehr guter Marker für vaskuläre Tumoren ist ERG Als Marker vaskulärer Tumoren ist ERG („Ets-related gene“) hervorragend geeignet (. Abb. 2). Fibromatosen zeigen typischerweise eine nukleäre Expression von β-Catenin. CD117 und DOG-1 sind von zentraler Bedeutung für die Diagnostik von gastrointestinalen Stromatumoren. Zumeist wird für die richtige diagnostische Zuordnung ein Panel mehrerer Antikörper benötigt. Eine Übersicht zur Bedeutung der Immunhistochemie in der Sarkomdiagnostik liefern Coindre [10] und Fisher [11]. Molekularpathologische Befunde Eine gängige Methode in der molekularpathologischen Diagnostik von Sarkomen ist die Fluoreszenz-in-situ-Hybridisierung (FISH) zur Identifizierung von Translokationen, intrachromosomalen Deletionen oder Inversionen sowie von Amplifikationen. Hierbei können entweder beide Translokationspartner markiert oder nur eine bekannte Bruchstelle in einem der beiden Translokationspartner flankierend sichtbar gemacht werden. Chimäre Fusionsgene können auch mittels rt-PCR nachgewiesen werden, wenn die verschiedenen Varianten bekannt sind. Zum Nachweis spezifischer Mutationen werden häufig die Sanger-Sequenzierung oder neuerdings auch die Parallelsequenzierung angewandt. Die Häufig- Onkologe 2014 · 20:1068–1074 DOI 10.1007/s00761-014-2709-z © Springer-Verlag Berlin Heidelberg 2014 E. Wardelmann · S. Huss · W. Hartmann Pathologie und Molekularpathologie von Weichteilsarkomen Zusammenfassung Hintergrund. Weichteilsarkome sind, verglichen mit anderen Malignome wie z. B. Karzinomen, selten und machen etwa 1% aller malignen Neoplasien aus. Die aktuelle WHOKlassifikation von 2013 definiert mehr als 60 Entitäten. Ziel. Es soll dargestellt werden, welche histomorphologischen und molekularpathologischen Befunde heute in der Sarkomdiagnostik eine Rolle spielen. Ergebnisse und Schlussfolgerungen. Vor allem die molekulare Diagnostik hat zunehmenden Einfluss auf die Subtypisierung und setzt ein breites Methodenpanel sowie eine ausreichende Fallzahl voraus, um sicher eine entsprechende Zuordnung vornehmen zu können. Neben der Relevanz der molekularen Typisierung für die korrekte Diagnose er- hält diese auch zunehmende Wichtigkeit in der Identifizierung von möglichen therapeutischen Zielstrukturen. Mitunter sind für diese bereits Inhibitoren in anderen Tumorentitäten etabliert, sodass ein Einsatz auch bei Sarkomen getestet werden kann. Dies setzt aber voraus, dass die Sarkomdiagnose korrekt gestellt wurde und Patienten über ein zentrales Register identifiziert und klinischen Studien zugeführt werden können. Eine referenzpathologische Zweitbegutachtung und die Aufnahme in ein Sarkomregister sollte daher die Regel sein. Schlüsselwörter Weichteilsarkome · Molekulare Klassifikation · Zielgerichtete Therapie · Therapeutische Zielstrukturen · Sarkomregister Pathology and molecular pathology of soft tissue sarcomas Abstract Background. Soft tissue sarcomas are rare compared to other malignancies such as carcinomas and represent approximately 1% of all malignant neoplasms. The current World Health Organization (WHO) classification from 2013 defines more than 60 different entities. Aim. This article describes the histomorphological and molecular findings which are important for the current diagnostics of sarcomas. Results and conclusion. Most notably molecular diagnostic procedures have an increasing influence on the subtyping of sarcomas which requires a broad panel of molecular procedures and a sufficient number of sarcoma cases to be able to establish the correct diagnosis. Besides the relevance of molecular keit spezifischer reziproker Translokationen liegt bei etwa 15%. Als Folge der Fusion zweier Gene entstehen chimäre Fusionsgene, die entweder einen autokrinen Wachstumsfaktor (wie z. B. PDGFBCOL1A1-Fusionen beim Dermatofibrosarcoma protuberans, CSF1-COL6A3 bei der pigmentierten villonodulären Synovialitis), einen Transkriptionsfaktor (wie z. B. EWS1R-ERG oder FLI beim EwingSarkom, SS18/SSX1, 2 oder 4 beim Synovialsarkom, FUS-DDIT3 beim myxoiden Liposarkom, FUS-CREB3L1/2 beim fibro- diagnostics to establish the correct diagnosis, the results are becoming increasingly more important to identify potential therapeutic targets. In the case of already existing specific inhibitors these may also be used in sarcoma patients. This implies that the sarcoma dia­ gnosis has been done correctly and that patients with a specific sarcoma subtype can be identified through a central registry to be included in a clinical trial. A second opinion by a reference pathologist and the inclusion in such a registry should be the rule. Keywords Soft tissue sarcomas · Molecular classification · Targeted treatment · Therapeutic targets · Central registry myxoiden Low-Grade-Sarkom, . Abb. 1) oder eine Tyrosinkinase (wie z. B. ALK mit verschiedenen Partnern beim inflammatorischen myofibroblastischen Tumor, ETV6-NTRK3 beim infantilen Fibrosarkom) kodieren. Bemerkenswert ist, dass bei Sarkomen recht häufig die Gene EWS1R oder FUS in Translokationen involviert sind. Je nach Translokationspartner resultieren unterschiedliche Sarkomsubtypen. Umgekehrt kann die identische Translokation je nach betroffenem Zelltyp ganz unterschiedliDer Onkologe 11 · 2014 | 1071 Tab. 2 Genomische Alterationen in Weichteilsarkomen Tumorentität Alveoläres Rhabdomyosarkom (ARMS) Alveoläres Weichteilsarkom (ASPS) Angiomatoides fibröses Histiozytom (AFH) Angiosarkom (ASA) Klarzellensarkom (CCS) Infantiles Fibrosarkom (CGFS) Dermatofibrosarcoma protuberans (DFSP) Desmoplastischer klein-blau-rundzelliger Tumor (DSRCT) Endometriales Stromasarkom (ESS) Epitheloides Hämangioendotheliom (EHE) Epitheloides Sarkom (ES) Ewing-Sarkom (EWS) Extrarenaler Rhabdoidtumor (ERT) Extraskelettales myxoides Chondrosarkom (EMCS) Fibromatose (Desmoidtumor) Gastrointestinaler Stromatumor (GIST) Inflammatorischer myofibroblastischer Tumor (IMFT) Fibromyxoides Low-Grade-Sarkom (LGFS) Sklerosierendes epitheloides Fibrosarkom (SEF) Myxoinflammatorisches fibroblastisches Sarkom (MIFS) Solitärer fibröser Tumor (SFT) Synovialsarkom (SS) Tenosynovialer Riesenzelltumor (TGCT) Hoch- und dedifferenziertes Liposarkom (WDLS/DDLS)/atypischer lipomatöser Tumor (ALT) Genomische Aberration t(2;13)(q35;q14) t(1;13)(p36;q14) t(2;2)(p23;q36) t(X;2)(q13;q36) t(X;17)(p11;q25) t(12;16)(q13;p11) t(2;22)(q33;q12) t(12;22)(q13;q12) Missense Mutation Amplifikation t(12;22)(q13;q12) t(2;22)(q33;q12) t(12;15)(p13;q25) t(17;22)(q22;q13) der(22)t(17;22) Ringchromosomen t(11;22)(p13;q12) Fusionsgen PAX3-FOXO1A PAX7-FOXO1A PAX3-NCOA1 PAX3-FOXO4 ASPSCR1-TFE3 TLS-ATF1 EWS1R-CREB1 EWS1R-ATF1 KDR, FLT4 c-MYC EWS1R-ATF1 EWS1R-CREB1 ETV6-NTRK3 COL1A1-PDGFB t(7;17)(p15;q21) t(10;17)(q22;p13) t(1;3(p36.3;q25) JAZF1-JJAZ1 YWHAE-FAM22A/B WWTR1-CAMTA1 YAP1-TFE3 t(8;22)(q22;q11) t(10;22) t(11;22)(q24;q12) t(21;22)(q22;q12) t(7;22)(p22;q12) t(17;22)(q12;q12) t(2;22)(q33;q12) t(16;21)(p11;q22 Homozygote Inaktivierung durch Deletion t(9;22)(q22;q12) t(9;17)(q22;q11) t(3;9)(q12;q22) t(9;17)(q22;q11) Mutationen Mutationen t(2p23) EWS1R-WT1 EWS1R-FLI1 EWS1R-ERG EWS1R-ETV1 EWS1R-E1AF EWS1R-FEV FUS-ERG hSNF/INI1/SMARCB1/BAF47 oder SMARCA4 (BRG1) Verlust EWS1R-CHN TAF2N-CHN TFG-NR4A3 TCF12-NR4A3 CTNNB1, APC KIT, PDGFRA, SDH, NF1, BRAF und andere Gene div. ALK Fusionspartner t(7;16)(q33–34;p11) t(11;16)(p11;p11) FUS-CREB3L2 FUS-CREB3L1 EWS1R-CREB3L1 t(1;10)(p22;q24) Ringchromosomen der(12)(q13–15) t(X;18)(p11;q11) t(X;18)(p11;q11) t(X;18)(p11;q11) t(X;20)(p11;q13) t(1;2)(p13;q37) Deregulation von FGF8+NPM3 Amplifikation von VGLL3 NAB2-STAT6 SS18-SSX1 SS18-SSX2 SS18-SSX4 SS181-SSX1 CSF-COL6A3 Ringchromosomen/ Riesen-/Markerchromosomen Amplifikation von MDM2, CDK4, HMGA2, GLI-SAS che Tumoren verschiedener Liniendifferenzierung hervorbringen. Beispielhaft sei hier die Fusion von ETV6 und NTRK3 genannt, die nicht nur im infantilen Fibrosarkom, sondern auch bei bestimmten Formen der akuten myeloischen Leukämie und beim sekretorischen Mammakarzinom beobachtet wurde [12]. Bei etwa 10% der Sarkome finden sich mehr oder weniger spezifische Amplifikationen, nämlich im Wesentlichen MDM2 und CDK4 beim hoch- und dedifferenzierten Liposarkom. Spezifische somatische Mutationen finden sich in ca. 25% der Weichgewebstumoren. Hier sind v. a. aktivierende KIT- oder PDGFRA-Mutationen beim gastrointestinalen Stromatumor, aktivierende GNAS1-Mutationen beim Myxom und der fibrösen Dysplasie und inaktivierende hSNF5/INI1-Mutationen bei Rhaboidtumoren zu nennen. Eine Übersicht über verschiedene Translokationen bei Sarkomen gibt . Tab. 2. Die restlichen 50% der Tumoren zeigen unspezifische komplexe Karyotypen [4]. » Bei Sarkomen sind häufig die Gene EWS1R oder FUS in Translokationen involviert Durch moderne molekularpathologische Methoden wächst die Liste der mehr oder weniger spezifischen genomischen Aber­ rationen auch in Weichteilsarkomen kontinuierlich. Durch das wachsende pathogenetische Verständnis bestimmter Tumorentitäten steigt die Hoffnung, dass spezifische Zielstrukturen entdeckt werden, die eine nebenwirkungsärmere und zugleich effektivere Sarkomtherapie erlauben. Fazit für die Praxis FDie Aufdeckung der molekularen Mechanismen in der Sarkompathogenese erlaubt heute eine wesentlich differenziertere Subtypisierung von Sarkomen als vor 10 Jahren. FZugleich werden auf diese Weise therapeutische Zielstrukturen entdeckt, die eine molekular gerichtete Therapie erlauben. FDie für die differenzierte molekularpathologische Diagnostik erforderDer Onkologe 11 · 2014 | 1073 Buchbesprechungen lichen Methoden werden aufgrund der Seltenheit der einzelnen Entitäten häufig nur in pathologischen Instituten mit Sarkomexpertise vorgehalten. FEine referenzpathologische Zweitmeinung inklusive einer molekularen Subtypisierung ist gerade bei Weichteilsarkomen anzustreben. Korrespondenzadresse Prof. Dr. E. Wardelmann Gerhard-Domagk-Institut für Pathologie, Universitätsklinikum Münster Albert-Schweitzer-Campus 1, Gebäude D17, 48149 Münster [email protected] Einhaltung ethischer Richtlinien Interessenkonflikt. E. Wardelmann, S. Huss und W. Hartmann geben an, dass kein Interessenkonflikt besteht. Der Beitrag enthält keine Studien an Menschen und Tieren. Literatur 1. Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F (2013) WHO classification of tumours of soft tissue and bone. Bosman FT, Jaffe ES, Lakhani SR, Ohgaki H (Series Editors) World Health Organization Classification of Tumours. IARC Press, Lyon 2. Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST) (2010) Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors: a meta-analysis of 1,640 patients. J Clin Oncol 28:1247–1253 3. Joensuu H, Eriksson M, Sundby Hall K et al (2012) One vs three years of adjuvant imatinib for operable gastrointestinal stromal tumor: a randomized trial. JAMA 307(12):1265–1272 4. Ducimetière F, Lurkin A, Ranchère-Vince D et al (2011) Incidence of sarcoma histotypes and molecular subtypes in a prospective epidemiological study with central pathology review and molecular testing. PLoS One 6(8):e20294 5. Egas-Bejar D, Huh WW (2014) Rhabdomyosarcoma in adolescent and young adult patients: current perspectives. Adolesc Health Med Ther 5:115–125 6. Pisters PW, Leung DH, Woodruff J et al (1996) Analysis of prognostic factors in 1,041 patients with localized soft tissue sarcomas of the extremities. J Clin Oncol 14:1679–1689 7. Coindre JM (2006) Grading of soft-tissue sarcomas: review and update. Arch Pathol Lab Med 130:1448–1453 8. Wittekind C, Meyer HJ (2010) TNM-Klassifikation maligner Tumoren, 7. Aufl. Springer, Berlin 1074 | Der Onkologe 11 · 2014 9. Wardelmann E, Schildhaus HU, Merkelbach-Bruse S et al (2010) Soft tissue sarcoma: from molecular diagnosis to selection of treatment. Pathological diagnosis of soft tissue sarcoma amid molecular biology and targeted therapies. Ann Oncol 21(Suppl 7):vii265–vii269 10. Coindre JM (2003) Immunohistochemistry in the diagnosis of soft tissue tumours. Histopathology 43(1):1–16 11. Fisher C (2011) Immunohistochemistry in diagnosis of soft tissue tumours. Histopathology 58(7):1001–1012 12. Romeo S, Dei Tos AP (2011) Clinical application of molecular pathology in sarcomas. Curr Opin Oncol 379–384 Marshall. B. Rosenberg Gewaltfreie Kommunikation Eine Sprache des Lebens Paderborn: Jungfermann Verlag GmbH 2013, 11.Auflage, 240 S., (ISBN 978-3-87387-454-1 ), 21.90 EUR Mit Erlebnissen, Geschichten und beispielhaften Gesprächen stellt Marshall Rosenberg in seinem Buch alltägliche Lösungen für komplexe Kommunikationsprobleme vor. Dieses Konzept der gewaltfreien Kommunikation (GFK) wurde von Marshall B. Rosenberg entwickelt. Unsere Art zu sprechen führt oft zu Verletzung und Leid - bei uns selbst oder bei anderen. Die GFK hilft uns bei der Umgestaltung unseres sprachlichen Ausdrucks und unserer Art zuzuhören. Das Buch soll anregen, uns ehrlich und klar auszudrücken und gleichzeitig anderen Menschen unsere respektvolle Aufmerksamkeit zu schenken. Somit können wir auf allen Ebenen der Kommunikation, in allen Altersklassen und in den unterschiedlichsten Situationen im Beruf, im Privatleben oder in der Politik erfolgreich kommunizieren. Die Wortwahl ist ausschlaggebend. GFK soll zu mehr Vertrauen und Lebensfreude verhelfen. Komplexe Kommunikationsprobleme könnten mit Hilfe der GFK einfacher gelöst werden. Die Taktiken und Vorschläge in diesem Buch könnten zu sehr viel Verständnis im Umgang mit anderen Menschen und deren Problemen verhelfen. D.A. Groneberg (Frankfurt/Main)