Buch 1.indb - AkadMed.com
Werbung

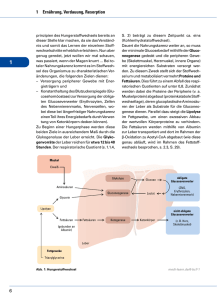
1 Kapitel 1 BIOCHEMIE DER ERNÄHRUNG H. Grunicke 1. Einführung: Ernährung und Stoffwechsel, Stoffwechsellagen Belebte Materie zeichnet sich thermodynamisch durch einen hohen Ordnungsgrad, d. h. niedrige Entropie aus. Die Aufrechterhaltung derartiger Ordnungszustände ist nur bei dauernder Energiezufuhr möglich. Daraus folgt, dass schon unsere bloße körperliche Existenz in Abwesenheit zusätzlicher Arbeitsleistungen energieabhängig ist. Der tatsächliche Energiebedarf des menschlichen Organismus geht schon unter Grundumsatzbedingungen, nicht zuletzt wegen der Bedürfnisse der stoffwechselaktiven Organe, Zentralnervensystem, Herz, Leber, Niere, weit über die zum Strukturerhalt notwendige Energie hinaus und wird durch motorische Aktivität und Stress zusätzlich gesteigert. Der menschliche Organismus gewinnt die für die Körperfunktionen notwendige Energie durch Oxidation verschiedener Energiesubs­trate, die mit der Nahrung zugeführt werden müssen. Nun erfolgt beim Menschen die Nahrungsaufnahme nicht kontinuierlich, sondern nur im Rahmen einer Mahlzeit mit anschließender Resorption der Nahrungsstoffe. Nach Abschluss der Resorption folgt eine unterschiedlich lange Zeit der Nahrungskarenz, eine physiologische Hungerphase, die durch die nächste Mahlzeit beendet wird. Während dieser Postresorptions- oder Hungerphase darf die Zufuhr von Energiesubstraten jedoch nicht unterbrochen werden. Das gilt insbesondere für die Organe mit hohem Energiebedarf wie Herz, Niere und Zentralnervensystem Buch 1.indb 3 (ZNS), wobei das ZNS hinsichtlich der von ihm verwertbaren Energiesubstrate besonders wählerisch ist und auf eine stetige Anlieferung von Glukose angewiesen ist. Damit Hungerphasen überstanden werden können, muss der Organismus während der Resorptionsphase Energiespeicher anlegen, aus denen während der Nahrungskarenz der Energiebedarf, bzw. auch die Bereitstellung bestimmter Energiesubstrate wie der Glukose für das ZNS gewährleistet wird. Die Bildung dieser Energiespeicher erfolgt in hierfür spezialisierten Organen und erfordert eine Vielzahl von Enzymen. Für die Mobilisierung der Energiesubstrate aus den Speichern sind andere Enzymsysteme verantwortlich. Naturgemäß macht es keinen Sinn, dass während der Speicherung die Entspeicherungsmechanismen aktiv sind. Offensichtlich sind organübergreifende Steuerungsmechanismen notwenig, die sicherstellen, dass während der Anlage der Speicher die Entspeicherungsmechanismen ausgeschaltet sind und umgekehrt bei Mobilisierung der gespeicherten Energiesubstrate die speichernden Aktivitäten blockiert werden. Diese Aufgaben obliegen bestimmten Hormonen und Stoffwechselprodukten, deren Ausschüttung und Aktivität jeweils typische Stoffwechsel­ lagen definieren. Eine solche typische Stoffwechsellage ist die Phase nach einer Mahlzeit, während der Resorption der Nahrungsstoffe bei motorischer Ruhe. Während dieser Zeit stehen dem Organismus mehr Energiesubstrate zur Verfügung als er zur Deckung des Energiebedarfes benötigt. Daher 15.10.2009 11:10:39 Kap. 1 H. Grunicke werden die überschüssigen Energieträger für die Bildung der Energiespeicher verwendet. In dieser Situation sorgt in erster Linie Insulin dafür, dass alle zur Energiespeicherung notwendigen Systeme aktiviert und die zur Entspeicherung verwendeten Mechanismen gehemmt werden. Der Stoffwechsel in der Resorptionsphase ist in Kapitel 5 beschrieben. In der Postresorptionsphase muss auf die Energiespeicher zugegriffen werden. Die hierzu notwendigen Regelmechanismen erfolgen bei motorischer Ruhe im Wesentlichen durch Glukagon und Katecholamine (Adrenalin, Noradrenalin). Der Stoffwechsel in der Postresorptions­ phase ist in Kapitel 6 dargestellt. Die Energieverhältnisse ändern sich bei motorischer Aktivität. Hierdurch entsteht schlagartig ein erhöhter Energiebedarf. Zu dessen Deckung wird die Speicherbildung auch in der Resorptionsphase gehemmt und zusätzlich die Bereitstellung von Energiesubstraten aus den Energiespeichern erhöht. Die Steuerung dieser Mechanismen übernehmen die Katecholamine. 2. Nahrungsmittel, Nahrungsstoffe, Einteilung der Nahrungsstoffe Der Organismus braucht aber Nahrungsstoffe nicht nur als Energiesubstrate, sondern ist mit der Tatsache konfrontiert, dass alle Körperbestandteile einem ständigen Ab- und Wiederaufbau unterworfen sind. Für die Erhaltung der Körpersubstanz muss mit der Nahrung das notwendige Baumaterial zugeführt werden. Unter diesen Bausubstraten kommt Substanzen besondere Bedeutung zu, die der Organismus nicht selbst synthetisieren kann. Hierzu zählen die essentiellen Aminosäuren, die essentiellen Fettsäuren (für Details zu diesen Verbindungen siehe Lehrbücher der Biochemie) und die Mineralien, insbesondere Calcium und Phosphat für den Aufbau der Knochensubstanz. Es ist jedoch zu betonen, dass der Organismus bei den mit der Nahrung zugeführten organischen Verbindungen nicht zwischen Ener- gie – und Bausubstraten unterscheidet. Diese Unterteilung ist von didaktischem Nutzen und hilfreich bei Bedarfsermittlungen. Neben den Energie– und Bausubstraten benötigt der menschliche Organismus noch eine Reihe von Stoffen, die in geringen Mengen im Wesentlichen für katalytische Zwecke verwendet werden. Zu diesen sogenannten Wirksubs­ traten zählen die Vitamine, die Spurenelemente wie Eisen, Kupfer, Mangan, Zink, Jodid, Selen u. a. m., sowie Mineralien wie Natrium, Kalium, Magnesium, Chlorid. Bezüglich der Nahrung unterscheiden wir zwischen den Nahrungsmitteln wie Milch, Fleisch, Brot etc. und den Nahrungsstoffen. Während die Nahrungsmittel komplexe Stoffgemische darstellen, sind Nahrungsstoffe chemisch definierte Verbindungen oder Verbindungsklassen wie Kohlenhydrate, Lipide, Proteine, Vitamine etc. Bei den Nahrungsstoffen können wir nochmals zwischen resorbierbaren und nichtresorbierbaren, d. h. unverdaulichen Stoffen unterscheiden. Die unverdaulichen Nahrungsstoffe werden als Bal­ laststoffe bezeichnet. Hierzu zählen vor allem Bestandteile pflanzlicher Zellwände und Fasern (Biesalski, 2004). Die Tatsache, dass sie unverdaulich sind, bedeutet nicht, dass die Ballaststoffe nur unnötigen Ballast darstellen. Von Ernährungswissenschaftlern wird die Wichtigkeit einer ausreichenden Zufuhr von Ballaststoffen immer wieder betont (Kluthe, 2004). Einige Ballaststoffe haben ein hohes Wasserbindungsvermögen, sie quellen daher im Darm und beeinflussen auf diese Weise die Darmmotilität, sowie die Viskosität des Chymus und der Faeces. Andere haben Ionenaustauschaktivität und binden z. B. Gallensäuren. Schließlich hat eine ballaststoffreiche Nahrung in der Regel einen höheren Sättigungseffekt als eine ballaststoffarme Nahrung. Da der Gehalt an Energiesubstraten bei ballaststoffreicher Ernährung in der Regel niedriger ist als der von ballaststoffarmen Nahrungsmitteln, schützt eine ballaststoffreiche Ernährung vor einer unerwünschten Überernährung und deren 4 Buch 1.indb 4 15.10.2009 11:10:39 Folgeerscheinungen: Adipositas, Diabetes, Bluthochdruck, koronare Herzkrankheiten. 3. Biologische Wertigkeit der Nahrung Aus den geschilderten biochemischen Funktionen der Ernährung ergibt sich eine Reihe von Kriterien zur Beurteilung der biologischen Wertigkeit einer Nahrung: Die Nahrung sollte isokalorisch sein, d. h. den Energiebedarf zur Deckung des Grundumsatzes, darüber hinausgehender Arbeitsleistungen und der Wärmeproduktion befriedigen. Sie sollte aber weder hypo- noch hyperkalorisch sein. Sowohl eine Unter- als auch eine Überernährung sind auf die Dauer mit der Gesundheit nicht vereinbar. Die Nahrung sollte eine ausreichende Zufuhr der essentiellen Bausubstrate garantieren. Zur Deckung des Bedarfes an essentiellen Aminosäuren werden vom jungen Erwachsenen täglich ca. 0,8 g Protein/kg Körpergewicht benötigt. Für Säuglinge, Kleinkinder und Schwangere gelten höhere Werte (WHO, FAO, UNO Report, 1985). Der Bedarf von älteren Menschen ist noch Gegenstand von laufenden Diskussionen. Diese Mengenangabe geht davon aus, dass eine gemischte Kost bestehend aus tierischem und pflanzlichem Eiweiß zugeführt wird. Tierisches Eiweiß hat generell eine höhere biologische Wertigkeit als pflanzliches Protein. Biologisch hochwertige Proteine sind reich an essentiellen Aminosäuren und enthalten diese in einem molaren Verhältnis, in dem sie vom menschlichen Organismus zur Proteinbiosynthese verwendet werden. Es gibt verschiedene Methoden zur Bestimmung der biologischen Wertigkeit von Protein, z. B. die Messung der Stickstoffretention nach Verabreichung einer bestimmten Proteinmenge oder Fütterungsversuche an Ratten. Unabhängig von der Messmethode zeigen tierische Proteine generell eine höhere biologische Wertigkeit als pflanzliche Eiweiße. Als Faustregel gilt daher, dass von der täglich zuzuführenden Proteinmenge ca. 50 % tierisches Eiweiß sein Biochemie der Ernährung sollten. Bei rein vegetarischer Ernährung ist daher der Zusammensetzung der Proteine größte Aufmerksamkeit zu widmen. Zur Deckung des Bedarfes an essentiellen Fettsäuren werden täglich etwa 0,8 –1 g Fett pro kg Körpergewicht benötigt. Pflanzliche (nicht gehärtete) Fette sind im Allgemeinen reich an ungesättigten und auch mehrfach ungesättigten essentiellen Fettsäuren, ebenso einige tierische Fette wie Fischöl und Hühnerfett. Von den mehrfach ungesättigten Fettsäuren zeichnen sich die ω-3-Fettsäuren (z. B. Linolensäure) durch eine gefäßprotektive Wirkung aus. Ein Verhältnis von ω-6- (z. B. Linolsäure) zu ω-3-Fettsäuren von 5 : 1 scheint im Sinne der Gefäß- und kardioprotektiven Wirkung besonders günstig zu sein und wird daher von Ernährungswissenschaftlern empfohlen (Enig et al., 1991). Eine Reihe pflanzlicher Fette und Öle zeichnet sich durch einen hohen Gehalt an ω-3-Fettsäuren aus. Vereinfacht lässt sich somit sagen, dass von dem täglichen Bedarf von 0,8 –1 g Fett pro kg Körpergewicht möglichst viel ungehärtetes pflanzliches Fett oder Fischfett sein sollte. Als quantitatives Maß ist das Verhältnis von Lipiden mit mehrfach ungesättigten (polyunsaturated) Fettsäuren zu solchen mit gesättigten (saturated) Fettsäuren, der sogen. P/S-Quotient sinnvoll. Dieser Quotient sollte möglichst > 1 sein. Derzeit liegt er bei durchschnittlicher Kost bei 0,33 (Biesalski, 2004). Für den Aufbau der Knochensubstanz sollten täglich 0,8 g Calcium und 3,7 g Phosphat zugeführt werden. Schließlich ist für eine ausreichende Zufuhr an Wirksubstraten (Vitamine, Spurenelemente und Mineralien) mit der Nahrung Sorge zu tragen. Zur Feststellung des Bedarfes an Wirksubstraten sei auf die einschlägigen Empfehlungen der Fachgesellschaften (Deutsche Gesellschaft für Ernährung, 1991; National Academy of Sciences, 1980) verwiesen. Es sei jedoch betont, dass Hypovitaminosen und Mangelerscheinungen an bestimmten Spurenelementen in den entwickelten Industrieländern bei Erwachsenen extrem 5 Buch 1.indb 5 15.10.2009 11:10:40 Kap. 1 H. Grunicke selten sind, so dass eine Supplementierung über Nahrungsergänzungsstoffe – mit Ausnahme von einer Jodid-Zufuhr in den betreffenden Jodmangelgebieten – nicht erforderlich ist. Dies gilt natürlich nicht für Menschen, die durch Alter oder Krankheit unselbständig sind. In diesen Fällen ist der Gehalt insbesondere an labilen Vitaminen bei der Zubereitung und dem Transport der Nahrung, aber auch die ausreichende Nahrungsaufnahme zu überwachen. Die geschilderten Erfordernisse werden am besten durch eine gemischte Kost erfüllt („Vollkost“ nach dem Prinzip der vollwertigen Ernährung der Deutschen Gesellschaft für Ernährung, 1991). Bei dieser gemischten Kost sollten Proteine etwa 15 %, Fette 30 % und Kohlenhydrate 55 % des Energiebedarfes decken. Bei zu geringer Kohlenhydratzufuhr werden zur Deckung des Glukosebedarfes resorbierte Aminosäuren zur Glukoneogenese verwendet, was zu einer Beeinträchtigung der Proteinbiosynthese führen kann. Ferner kommt es zu einer Ketoazidose, da die Ketonkörpersynthese stimuliert wird (siehe Kapitel 6 ). 4. Nahrungsstoffe als Energieträger 4.1. Energiebedarf Der Energiebedarf errechnet sich als Summe von Grundumsatz, Erhaltungsbedarf und Leistungsbedarf. Der Grundumsatz (GU) wird 12 –14 Stunden nach der letzten Nahrungsaufnahme, liegend, bei motorischer Ruhe und Indifferenztemperatur 27– 31 °C gemessen. Alternativ zum Grundumsatz wird gelegentlich der Ruhe-Nüchtern-Umsatz (RNU) bestimmt. Die Messung des RNU erfolgt im Sitzen bei 24 – 26 °C Raumtemperatur und in leichter Bekleidung. Die Werte des RNU in kJ/min liegen etwa 5 % über denen des GU. Die unter diesen Bedingungen gemessene Arbeit umfasst die chemische Arbeit für Synthesen bei Wachstum, Umbau und Speicherung, osmotische Arbeit bei Transportprozessen und mechanische Arbeit (Herz-Kreislauf, Atmung, Erhaltung des Muskeltonus). Der RNU macht etwa 60 –75 % des Gesamtenergieumsatzes aus. 50 % des RNU entfällt auf den Energiebedarf von ZNS, Leber, Niere und Herz. Grundumsatz und Ruhe-Nüchtern-Umsatz sind abhängig von Alter, Geschlecht, Körpergewicht, Körperfettmasse, psychischem Zustand und Bluthormonspiegeln, insbesondere von Katecholaminen und Thyroxin. Vereinfachte Berechnungsformeln für den Grundumsatz wurden von der WHO publiziert (WHO, 1985). Der Grundumsatz eines erwachsenen, 75 kg schweren Mannes liegt nach dieser Berechnung bei ca. 7250 kJ/d (1734 kcal/d). Der Erhaltungsbedarf errechnet sich aus der zusätzlichen Energiemenge, die für Nahrungsaufnahme, Verdauung und Resorption, Regeneration von Geweben, Thermoregulation sowie postprandiale Thermogenese und unvermeidbare motorische Aktivitäten aufgewendet werden muss. Der Leistungsbedarf entsteht durch eine über den Erhaltungsbedarf hinausgehende motorische Aktivität, sowie physiologische Leistungen durch Wachstum, Schwangerschaft und Laktation. So beträgt der Energiemehrbedarf bei Büroarbeit etwa das 1,4-fache, bei schwerer körperlicher Arbeit, etwa im Baugewerbe das 3 – 6-fache des Grundumsatzes (Noack, 2004). Die Messung des Energieverbrauches erfolgt in der Regel indirekt durch Bestimmung der Sauerstoffaufnahme. Dies ist deshalb gerechtfertigt, weil die Energiegewinnung nahezu ausschließlich durch Oxidation der Energiesubstrate, im Wesentlichen Kohlenhydrate, Fette und Proteine erfolgt. Durch Kalorimetrie lässt sich die bei der Oxidation der einzelnen Energiesubstrate freiwerdende Energie als Wärme bestimmen. Die durchschnittlichen Brennwerte betragen für Kohlenhydrate 17,2 kJ (4,1 kcal)/g; für Fette 38,9 kJ (9,3 kcal)/g und für Proteine 22,6 kJ (5,4 kcal)/g. Der physiologische Brennwert der Proteine liegt allerdings unter dem kalorimetrisch gemessenen Bruttoenergiewert, da 6 Buch 1.indb 6 15.10.2009 11:10:40 ein Teil der bei der Oxidation der Aminosäuren gewonnenen Energie für die Harnstoffsynthese aufgebracht werden muss und ferner ein Teil des aufgenommenen Proteins in Form nicht resorbierter Aminosäuren und deren Stoffwechselprodukten ausgeschieden wird. Der physio­ logische Brennwert der Proteine ist daher mit 17,2 kJ (4,1 kcal)/g anzusetzen. Errechnet man die beim Verbrauch von einem Liter Sauerstoff bei der Oxidation der einzelnen Energiesubstrate freigesetzte Energiemenge, so ergeben sich als sogenannte energetische Äquivalente Werte von 21,0/19,7/19,3 kJ für Glukose, Triolein und Alanin und damit ein Durchschnittswert von 20 kJ (4,8 kcal)/l O2 (Noack, 2004). So lässt sich über den Sauerstoffverbrauch die Höhe des Energieumsatzes etwa unter Grundumsatz-Bedingungen ermitteln. Die Bestimmung des sogenannten Respira­ torischen Quotienten in der Atemluft erlaubt die Identifikation des zum Zeitpunkt der Messung vom Organismus verwendeten Energiesubstrates. Der Respiratorische Quotient ist definiert als das Verhältnis von gebildeten mol CO2 zu verbrauchten mol O2. Die Werte errechnen sich aus der Stöchiometrie der biologischen Oxidation definierter Energiesubstrate und betragen für Glukose 1,0; für Palmitinsäure 0,696 und für Alanin 0,83. Diese Werte entsprechen den Werten der Hauptenergiesubstrate: Kohlenhydrate, Triglyzeride, Proteine. Durch Messung der arteriovenösen Differenz von O2 und CO2 lässt sich mit Hilfe des respiratorischen Quotienten das bevorzugte Energiesubstrat einzelner Organe in den verschiedenen Stoffwechsellagen bestimmen. 4.2. Energiegewinnung Der Organismus ist keine Wärmekraftmaschine. Er kann die bei der Oxidation der Substrate freiwerdende Wärme nicht zum Antrieb endergoner (energieverbrauchender) Reaktionen verwenden. Aus diesem Grunde versucht der Organismus, einen möglichst großen Teil Biochemie der Ernährung der bei der Oxidation freiwerdenden Energie in Form von chemischer Energie zu speichern. Er bewerkstelligt dies durch Kopplung der exergonen Oxidation mit der endergonen Synthese „energiereicher“ Phosphate. Diese sind Adenosintriphosphat (ATP) und im Muskel Kreatinphosphat. Die im ATP, bzw. Kreatinphosphat gespeicherte Energie kann nun zum Antrieb endergoner Reaktionen verwendet werden. Der thermodynamische Wirkungsgrad der Energie­ gewinnung aus den Energiesubstraten der Nahrung ergibt zum Beispiel für Glukose bei aerobem Abbau 58 – 64 %. Diese Werte errechnen sich aus der freien Energie der Glukoseoxidation unter physiologischen Konzentrationen für Glukose, O2 und CO2 mit ∆G’ = 2866,5 kJ und einer ATP-Ausbeute von 30 – 32 mol/mol Glukose, für die unter physiologischen Konzentrationen von ADP, ATP, Phosphat in Abhängigkeit von den zugrunde gelegten lokalen Konzentrationen zwischen 1658 bis 1840 kJ aufzubringen wären. Die Verwendung von chemischer statt Wärmeenergie bringt erhebliche Vorteile. So lässt sich chemische Energie speichern und im Gegensatz zu Wärme auch ohne wesentliche Verluste transportieren. Zusammenfassend: Der Organismus gewinnt die notwendige Energie durch Oxidation der mit der Nahrung zugeführten Energiesubs­ trate. Die bei der Oxidation freiwerdende Energie wird zum Aufbau der „energiereichen“ Phosphate ATP und Kreatinphosphat benutzt. Die bei der Spaltung von ATP und Kreatinphosphat freiwerdende Energie wird zum Antrieb endergoner (energieverbrauchender) Prozesse eingesetzt. Die Energieausbeute, d. h. der thermodynamische Wirkungsgrad liegt nicht bei 100 %. Mindestens 30 % der Energie wird in Form von Wärme frei. Diese Wärme wird z. T. für die Thermoregulation benutzt. Eine Erniedrigung des thermodynamischen Wirkungsgrades führt zu einer Steigerung der Wärmeabgabe. Dies wird physiologisch durch Entkopplungsproteine (uncoupling proteins, UCPs) bewirkt. Diese Proteine entkoppeln – bis zu einem gewissen Grad – die 7 Buch 1.indb 7 15.10.2009 11:10:40 Kap. 1 H. Grunicke Energiegewinnung durch die Atmungskette in den Mitochondrien von der damit gekoppelten oxidativen Phosphorylierung. Sie erniedrigen den P/O-Quotienten, d. h. die pro mol O2 synthetisierten mol ATP. Wie im Kapitel 3 beschrieben wurde, sind bei der üblichen gemischten Kost die wesentlichen Energiesubstrate die Kohlenhydrate, die in der Regel überwiegend in Form der Polymeren Stärke und Glykogen (α-glykosidische Poly-(1 → 4),(1 → 6)-Glukose) oder in geringerem Maße als Dimere wie Saccharose (α-Glukosyl(1 → 2)-β-Fruktosid)oderLaktose(β-Galaktosyl(1 → 4)-Glukosid) aufgenommen werden, ferner die Triglyzeride und die Proteine. Kohlenhydrate und Proteine werden bei der Verdauung in ihre Monomere (Glukose, Fruktose, Galaktose, Aminosäuren) gespalten und nach Resorption als solche zum Teil zur Energiegewinnung oxidiert. Die Triglyzeride werden im Darm in Fettsäuren, Glycerin und Monoglyceride gespalten, in der Darmmukosa zu Triglyzeriden resynthetisiert und als Bestandteile der Chylomikronen in das Blut abgegeben. In der Peripherie werden die Triglyzeride hydrolytisch gespalten und nach Reveresterung vorwiegend im Fettgewebe gespeichert. Bei Bedarf werden durch intrazelluläre Lipasen Fettsäuren aus den Speicherfetten freigesetzt, die als Energiesubstrate verwendet werden. Die Leber bildet aus Fettsäuren Ketonkörper (β-Hydroxybutyrat, Azetoazetat), die insbesondere bei Nahrungskarenz zur Energiegewinnung von Hirn, Herz, Muskel und Niere dienen, wie in Kapitel 6.1 ausführlicher dargestellt ist. Welche Energiebeträge durch Oxidation dieser Nährstoffe gewonnen werden können ergibt sich aus den oben beschriebenen Brennwerten. Zur Deckung des Energiebedarfes wäre es im Prinzip gleichgültig, welches Energiesubstrat verwendet wird, d. h. unter rein energetischen Gesichtspunkten wären die Energiesubstrate austauschbar. Allerdings gilt dies in der Praxis nur in eingeschränktem Maße, da einige Organe wie das ZNS oder die Erythrozyten auf eine ständige, ausreichende Glukosezufuhr angewiesen sind. Aminosäuren können über die Glukoneogenese zur Glukosesynthese herangezogen werden, daher sind Kohlenhydrate und Proteine als Energielieferanten untereinander austauschbar. Für die Triglyzeride gilt das nur bedingt, da eine Glukoneogenese aus (geradzahligen) Fettsäuren nicht möglich ist und der Glyzerinanteil quantitativ unzureichend ist. 4.3. Energiespeicherung Nach Aufnahme einer Mahlzeit, in der Resorptionsphase stehen dem Organismus mehr Energiesubstrate zur Verfügung, als zur Deckung des unmittelbaren Energiebedarfes notwendig sind. Die nicht für die unmittelbare Energieversorgung benötigten Nährstoffe werden zur Anlage von Energiespeichern verwendet, von denen der Körper während der Nahrungskarenz zehrt. Als Energiespeicher dienen Glykogen, Triglyzeride und Proteine. Die Energiespeicherung erfolgt bevorzugt in hierfür spezialisierten Organen. Glykogen wird bevorzugt in der Leber und der Muskulatur gespeichert. Die maximale Speicheraktivität ist begrenzt und beträgt für die Leber ca. 10 % des Organgewichtes von etwa 1,5 kg, für den Skelettmuskel etwa 1 % des Organgewichtes von ca. 30 kg bei einem erwachsenen Mann. Damit verfügt der Organismus über maximal 450 g Glykogen, was einer Energiereserve von 7560 kJ (1800 kcal) entspricht, was nicht einmal dem täglichen Energiebedarf bei ruhigem Sitzen, wofür etwa das 1,2-fache des Grundumsatzes benötigt werden, entspricht. Die Speicherung von Triglyzeriden erfolgt in erster Linie im Fettgewebe. Die Menge an gespeichertem Triglyzerid ist sehr variabel und beträgt beim normalgewichtigen erwachsenen Mann zwischen 8 und 14 kg, bei der Frau 10 – 20 kg. Das entspricht einer gespeicherten Energiemenge zwischen 317 600 kJ (75 906 kcal) und 794 000 kJ (189 766 kcal), was theoretisch für den Energie- 8 Buch 1.indb 8 15.10.2009 11:10:40 bedarf bei leichter Arbeit für 37– 94 Tage ausreichen würde. Unter biologischen Bedingungen geht diese Rechnung nicht auf, da aus dem Triglyzerid allein der Glukosebedarf nicht gedeckt werden kann. Dennoch stellt das Fettgewebe einen gewaltigen, in der Tat den größten Energiespeicher dar. Neben Glykogen und Triglyzerid dient körpereigenes Protein – vor allem im Sklelettmuskel als weiterer Energiespeicher. Von den rund 4,8 kg Muskelprotein eines erwachsenen Mannes sind ca. 2 kg für den Energiestoffwechsel mobilisierbar. Das entspricht einer Energiereserve von 36 200 kJ (8 652 kcal) oder dem Energiebedarf für ca. 4 Tage. Allerdings gibt es kein besonderes Speicherprotein, sondern es werden bei Bedarf körpereigene, funktionelle Proteine für den Energiebedarf verwendet. Die Verwendung von Triglyzerid als Haupt­ energiespeicher erscheint äußerst sinnvoll. Im Vergleich zu Kohlenhydrat und Protein hat Triglyzerid einen 2,2 – 2,3fach höheren Brennwert pro g. Darüber hinaus lässt sich Fett sehr viel raumsparender speichern als Glykogen oder Protein. Dies folgt aus der geringen Wasserbindungskapazität von Fett verglichen mit Kohlenhydraten oder Protein. 1 Gramm Triglyzerid bindet etwa 0,15 ml Wasser. Protein und Glykogen benötigen zur Speicherung ca. 5 bis 10 ml Solvatationswasser pro g. 10 kg Fett enthalten die gleiche Energiemenge wie 23,6 kg Glykogen. 10 kg Triglyzerid nehmen ein Volumen von 11,5 l ein. Die Speicherung der energieäquivalenten Menge an Glykogen würde jedoch ein Volumen von ca 260 l einnehmen. Hinzu kommt, dass Fett ein schlechter Wärmeleiter ist und das sehr ausgedehnte Unterhautfettgewebe die Wärmeverluste an die Umgebung reduziert, so dass weniger Energie für die Thermoregulation aufgewendet werden muss. 4.4. Energiebilanz Eine ausgeglichene Energiebilanz liegt vor, wenn sich Energieaufnahme und Energieverbrauch Biochemie der Ernährung decken. Die Kontrolle erfolgt in der Regel über das Körpergewicht, welches bei ausgeglichener Energiebilanz im Kontrollzeitraum konstant bleiben sollte. Ob dieses Körpergewicht ein erwünschtes Ausmaß hat, wird z. B. mit Hilfe des „Body Maß Index (BMI)“ gemessen. Der BMI errechnet sich als der Quotient aus Körpergewicht in kg dividiert durch das Quadrat der Körpergröße in Metern. Als Normalbereich gelten bei Europäern Werte zwischen 18,5 und 25 kg/m2. Für eine genauere Beurteilung des Ernährungszustandes steht eine Reihe zusätzlicher Parameter zur Verfügung (Schutz, 2004). Durch Reduktion der über die Nahrung zugeführten Energiemenge lässt sich – bei ausreichender Zufuhr an essentiellen Nahrungsstoffen und Wirksubstraten – eine ausgeglichene Energiebilanz auf niedrigerem Niveau erzielen. Bei Nagern zeigt eine solche Kalorienrestriktion eine signifikante Verlängerung der Lebensspanne. Ähnliche Effekte wurden bereits bei Saccharomyces und Drosophila gefunden (Wood et al., 2004; Wolf, 2006). Es wird diskutiert, dass diese Effekte auf einer Induktion von „silent information regulators (SIRTs)“ beruhen. SIRTs oder Sirtuine sind Histondeazetylasen und bewirken möglicherweise eine Hemmung der Transkription von Genen, deren Aktivität mit Alterungsprozessen korreliert ist (Wood et al., 2004; Wolf, 2006). Übersteigt die zugeführte Energiemenge den Energieverbrauch, liegt eine positive Ener­ giebilanz vor. Eine längere Zeit andauernde positive Energiebilanz führt zu Übergewicht und schließlich zur Adipositas mit einem stark erhöhten Risiko an Diabetes, Hypertonie, koronaren Herzerkrankungen, Schlaganfall, verminderter Lungenfunktion und Malignomen zu erkranken. Eine länger andauernde negative Energiebi­ lanz führt zur Erniedrigung des Körpergewichtes und einer Umstellung des Stoffwechsels. Um die Versorgung von Hirn und Erythrozyten mit Glukose, von der pro Tag etwa 180 g benötigt werden, zu gewährleisten, werden zunächst die Glykogenreserven der Leber abgebaut. Diese 9 Buch 1.indb 9 15.10.2009 11:10:41 Kap. 1 H. Grunicke sind mit ca. 150 g jedoch sehr gering und müssen durch Glukoneogenese aus Aminosäuren ergänzt werden. Diese Aminosäuren können bei Nahrungskarenz nur durch Abbau körpereigener Proteine gewonnen werden. Eine Umstellung der Energieverwertung im Gehirn führt nun zu einer drastischen Einsparung der Glukoneogenese aus Aminosäuren. Diese Einsparung wird erreicht durch die Verwendung von Ketonkörpern als Energiesubstrate. Im Hunger ist die Lipolyse im Fettgewebe und damit die Freisetzung von Fettsäuren erhöht. Die Fettsäuren dienen zur Energieversorgung aller Organe – außer Hirn und Erythrozyten. Ein Teil – ca 25 % – werden von der Leber zu Ketonkörpern umgewandelt, die von einigen Geweben wie Herz, Nieren und Muskel ebenfalls als Energiequellen verwendet werden können. Im Hirn erfolgt im Hunger eine Induktion der Ketonkörper-(β-Hydroxybutyrat, Azetazetat)verwertenden Enzyme. Dies erlaubt, den Glukosebedarf des Hirns auf etwa die Hälfte des Verbrauches bei ausgeglichener Energiebilanz zu senken und damit den Proteinabbau im Muskel auf etwa ein Viertel des Normalwertes zu reduzieren. 5. Substratfluss nach einer Mahlzeit bei motorischer Ruhe Nach einer Mahlzeit wird der Organismus mit Energiesubstraten (Kohlenhydrate, insbesondere Glukose, Fette, Aminosäuren) überschwemmt. Unter diesen Bedingungen deckt der Organismus seinen Energiebedarf überwiegend durch die Glukose als dominierendes Energiesubstrat. Bei motorischer Ruhe übersteigt das Angebot an Energiesubstraten jedoch bei weitem den momentanen Energiebedarf, daher werden in dieser Stoffwechsellage die nicht zur Energiegewinnung benötigten Substrate zur Anlage von Energiespeichern verwendet. Die Bildung der Energiespeicher (Glykogen, Triglyzerid, Protein) ist energieabhängig. Der Energiebedarf der Speicherung beträgt jedoch nur einen Bruchteil der bei der Verwertung der Speicher zur Verfügung stehenden Energiemenge. Die bei der Synthese der Energiespeicher freiwerdende Wärme bildet zusammen mit der gleichfalls energieabhängigen Resorption der Nahrungsstoffe im Darm die sogenannte postprandiale Wärme. Die Anlage der Energiespeicher wird durch Insulin reguliert. Die Insulinsekretion wird durch den Anstieg der Blutglukosekonzentration nach einer Mahlzeit stimuliert. 5.1. Stoffwechsel der Kohlenhydrate Der Kohlenhydratanteil der Nahrung liegt in der Regel bei über 50 %. Die Hauptmenge wird beim Erwachsenen in Form der Polymere Stärke und Glykogen zugeführt. Abhängig von den Ernährungsgewohnheiten wird ein mehr oder weniger großer, in der Regel jedoch geringerer Teil als Disaccharide in Form von Saccharose und Laktose aufgenommen. Beim gestillten Säugling ist allerdings Laktose die hauptsächliche Kohlenhydratquelle. Glykogen und Stärke werden bei der Verdauung zu Glukose abgebaut und als solche resorbiert. Laktose wird in Glukose und Galaktose gespalten. Die Galaktose wird nach Phosphorylierung in der Leber über UDP-Galaktose zu UDP-Glukose epimerisiert und auf diese Weise in den Glukosestoffwechsel geschleust. Zur Energiegewinnung wird UDP-Glukose über Glukose-1-phosphat in Glukose-6-phosphat umgewandelt und über Glykolyse und Zitratzyklus abgebaut. UDP-Glukose ist direktes Substrat der Glykogensynthese. Saccharose wird wie Laktose im Darm durch Disaccharidasen gespalten. Die Spaltprodukte sind Glukose und Fruktose. Fruktose wird nach Phosphorylierung in der Leber mit Hilfe der Aldolase B in Dihydroxyazetonphosphat und Glyzerinaldehyd gespalten, die über die Glykolyse in den Glukosemetabolismus eingeschleust werden. Nach einer kohlenhydratreichen Mahlzeit- was bei einer gemischten Kost der Regel entspricht – steht somit der Glukosemetabolismus im Mittelpunkt des Stoffwechselgeschehens. 10 Buch 1.indb 10 15.10.2009 11:10:41 Durch diesen Stoffwechsel werden die Monosaccharide Glukose, Galaktose und Fruktose über Glykolyse und Zitratzyklus zu CO2 und H2O abgebaut (Details vergleiche Lehrbücher der Biochemie). Dabei wird das dominierende Substrat, Glukose, von allen Organen zur Energiegewinnung verwertet. In den Erythrozyten läuft der Glukoseabbau allerdings nur über die Glykolyse zum Laktat, da diese Zellen wegen des Fehlens von Mitochondrien das Pyruvat nicht im Zitratzyklus weiter abbauen können. In praktisch allen anderen Zellen erfolgt die Energiegewinnung während der Resorptionsphase durch den oxidativen Glukoseabbau, wobei der Löwenanteil des dabei gewonnen ATPs durch die oxidative Phosphorylierung gebildet wird. Hierbei werden die bei der Glukoseoxidation gebildeten Reduktionsäquivalente in Form von NADH über die Atmungskette auf Sauerstoff übertragen. Die dabei freiwerdende Energie wird durch die mit der Atmungskette gekoppelte oxidative Phosphorylierung zur Synthese von ATP verwendet, wobei – wie oben erläutert – etwa 30 mol ATP pro mol Glukose gewonnen werden. In der Regel stehen jedoch während der Resorptionsphase bei motorischer Ruhe wesentlich mehr Kohlenhydrate zur Verfügung als zur Deckung des Energiebedarfes während dieser Stoffwechsellage benötigt werden. Mit diesen überschüssigen Kohlenhydraten werden die Energiespeicher aufgefüllt. Diese Speicherung erfolgt zunächst in Form von Glykogen, bevorzugt in der Leber und im Muskel. Wie im Kapitel 4.3 beschrieben wurde, ist die Speicherkapazität für Glykogen beschränkt. Sind die Glykogenspeicher gefüllt, so wird der Rest der mit der Nahrung aufgenommenen Kohlenhydrate über die Liponeogenese zur Fettsynthese verwendet und als Triglyzerid im Fettgewebe gespeichert. Exzessive „Kohlenhydratmast“ führt somit zur Adipositas („Fettsucht“). Biochemie der Ernährung 5.1.1. Regulation der Energiegewinnung und -speicherung aus Kohlenhydraten Welche Mechanismen sorgen dafür, dass sich die Energielieferung an den Energiebedarf anpasst? Wodurch erfolgt die Umschaltung von Glukoseabbau zu Speicherung in Form von Glykogen? Wie „merkt“ der Körper, dass die Glykogenspeicherkapazität erschöpft ist und wodurch erfolgt die Steuerung der Liponeogenese aus Kohlenhydraten? Die wesentliche Regelgröße für den Energiestoffwechsel ist die intrazelluläre ATP- Konzentration bzw. das ATP : ADP + AMP Verhältnis. Überschreitet der Quotient einen Schwellenwert, werden Schrittmacherenzyme der Glykolyse und des Zitratzyklus gehemmt. Eine weitere Regelgröße ist die NADH-Konzentration. Ein Anstieg von NADH signalisiert, dass die Kapazität der Atmungskette zur Oxidation von NADH erschöpft ist. Eine weitere NADH-Lieferung durch Glukoseabbau würde somit nicht zu einer Steigerung der Energiegewinnung beitragen. Erhöhte NADH-Spiegel hemmen eine Reihe von Schlüsselenzymen des Zitratzyklus, ferner die Einschleusung von Pyruvat in den Zitratzyklus durch die Pyruvatdehydrogenase. Zusätzlich zur Hemmung durch ATP und NADH bewirken sich anstauende Metabolite des Glukosestoffwechsels wie Glukose-6-phosphat, Zitrat, Azetyl-CoA und Oxalazetat eine Drosselung des Glukoseabbaus über Glykolyse und Zitratzyklus. Wie bereits erwähnt, sind in der Regel mindestens 50 % der im Rahmen einer Mahlzeit aufgenommenen Nahrungsstoffe Kohlenhydrate, insbesondere Glukose. Die im Darm resorbierte Glukose flutet über die Pfortader zur Leber und bewirkt dort eine Steigerung der Glukoseaufnahme, sowie neben einer Stimulation der Glykolyse insbesondere eine Aktivierung der Glykogensynthese. Die mit Hilfe eines Transportproteins, GLUT-2, aufgenommene Glukose wird im Hepatozyten zu Glukose-6-phosphat phosphoryliert, welches Ausgangsprodukt aller von der Glukose ausgehenden Stoffwechselwege ist. 11 Buch 1.indb 11 15.10.2009 11:10:41 Kap. 1 H. Grunicke Ein Teil des Glukose-6-phospates wird über Glykolyse und Zitratzyklus zur Energieproduktion verwendet. Hat der energieliefernde Glukoseabbau seine Kapazitätsgrenze erreicht, kommt es zum Anstau von Glukose-6-phosphat und einer dadurch (mit)bewirkten Stimulation der Glykogensynthese. Allerdings reicht der Anstieg des Glukose-6-phosphates nicht aus, um die volle Aktivierung der Glykogensynthese zu erreichen. Maßgeblich hierfür ist Insulin. Der in der Resorptionsphase erfolgende Anstieg der Blutglukosekonzentration bewirkt eine Ausschüttung von Insulin aus den Depots im endokrinen Teil des Pankreas. Insulin induziert die Glukokinase und bewirkt damit einen weiteren Anstieg von Glukose-6-phosphat, vor allem aber stimuliert Insulin die Glukoseaufnahme im Muskel und im Fettgewebe, aktiviert die Glykolyse, steigert die Glykogensynthese vor allem in der Leber und im Skelettmuskel und hemmt den Glykogenabbau. Die Steigerung der Glukoseaufnahme in der Muskulatur und im Fettgewebe und der erhöhte Glukosemetabolismus in der Leber, dem Fettgewebe und dem Muskel bewirken eine rasche Senkung des postprandialen Blutglukosespiegels. Insulin steigert die Glykogensynthese durch Aktivierung einer Kaskade von Enzymen, die schließlich zu einer Überführung des Schlüsselenzyms der Glykogensynthese, der Glykogensynthase, in die aktive, dephosphorylierte Form führen. Gleichzeitig hemmt es den Glykogenabbau durch Senkung des intrazellulären cAMP Spiegels. Insulin induziert Enzyme der Glykolyse, d. h. steigert die Synthese dieser Enzyme, was längerfristig bei Überernährung mit kohlenhydratreicher Kost vor allem für die Liponeogenese aus Kohlenhydraten bedeutsam ist, wie später zu besprechen sein wird. Die Beendigung der Glykogenbildung wird zum Teil durch das Glykogen selbst bewirkt. Ab einer bestimmten Speichermenge stimuliert das Glykogen direkt (Muskel) oder indirekt (Leber) eine Überführung der aktiven Glykogensynthase in die inaktive, phosphorylierte Form. Von entscheidender Bedeutung ist jedoch der Abfall der Blutzuckerkonzentration, der wiederum zu einer raschen Erniedrigung des Insulinspiegels führt. Insulin wird im Serum durch reduktive Spaltung sehr rasch abgebaut. Die Halbwertzeit von zirkulierendem Insulin beträgt 7–15 Minuten (Molnar et al., 1972). Wie bereits mehrfach erläutert wurde, ist die Speicherkapazität für Glykogen begrenzt. Überschüssiges, mit der Nahrung zugeführtes Kohlenhydrat wird zur Liponeogenese verwendet und als Triglyzerid im Fettgewebe gespeichert. Dabei finden – vor allem in der Leber – Glykogensynthese und Liponeogenese aus Kohlenhydrat nicht in voneinander abgesetzten Phasen, sondern weitgehend parallel statt. Die Liponeogenese aus Kohlenhydrat verwendet Metabolite der Glykolyse. Das in der Glykolyse gebildete Pyruvat wird durch die Pyruvatdehydrogenase zu Azetyl-CoA oxidiert, welches Ausgangssubstrat für die Synthese langkettiger (bevorzugt C16 und C18) Fettsäuren ist. Der Glycerolanteil des Triglyzerids stammt ebenfalls aus der Glykolyse und wird durch Reduktion und Dephosphorylierung von Dihydroxyazetonphosphat gebildet. Die Fettsäuresynthese aus Pyruvat ist ein komplexer Prozess, bei dem das im Cytosol gebildete Pyruvat über einen bestimmten Transporter in das Mitochondrium geschleust werden muss, um von der Pyruvatdehydrogenase zu Azetyl-CoA oxidiert werden zu können. Da die Fettsäuresynthese wieder im Cytosol stattfindet, muss das Azetyl-CoA wieder aus dem Mitochondrium hinausgebracht werden, was nach Reaktion mit Oxalazetat zu Zitrat erfolgt, welches dann im Cytosol wieder in Azetyl-CoA und Oxalazetat gespalten wird. Für die biochemischen Details sei auf Lehrbücher der Biochemie verwiesen. Für die Fett­ säuresynthese ist NADPH erforderlich, welches über den Hexosephosphatweg generiert wird, der gleichfalls vom bereits mehrfach erwähnten Glukose-6-phosphat abzweigt. Insulin induziert Schlüsselenzyme der Glykolyse und der Fettsäuresynthese und aktiviert somit die Liponeogenese aus Kohlenhydrat. 12 Buch 1.indb 12 15.10.2009 11:10:41 Biochemie der Ernährung Die in der Leber gebildeten Triglyzeride werden in Form der VLDL-Lipoproteine an das Blut abgegeben. In extrahepatischen Geweben – in der Resorptionsphase bei motorischer Ruhe vor allem im Fettgewebe – wird mit Hilfe der Lipoproteinlipase der Triglyzeridanteil des VLDL gespalten. Die freiwerdenden Fettsäuren werden von der Fettzelle aufgenommen und intrazellulär zu Triglyzeriden reverestert, die nun als Energiespeicher zur Verfügung stehen. Die Lipoproteinlipase wird durch Insulin induziert, das somit alle wesentlichen Schritte bei der Liponeogenese aus Kohlenhydrat stimuliert. Gleichzeitig hemmt Insulin durch Senkung des cAMP Spiegels die Lipolyse im Fettgewebe. Außer in der Leber findet die Liponeogenese aus Kohlenhydraten vor allem im Fettgewebe statt. Auch dieser Prozess wird durch Insulin als Haupthormon der Resorptionsphase stimuliert. Insulin steigert die Glukoseaufnahme in die Fettzellen durch Aktivierung des Glukosetransporters GLUT-4. Nur ein geringer Teil der aufgenommenen Glukose wird von der Fettzelle für die Energiegewinnung verbraucht. Der Löwenanteil der Glukose wird zur Liponeogenese verwendet, wobei die gleichen Prozesse wie in der Leber ablaufen, nur mit dem Unterschied, dass das synthetisierte Triglyzerid in der Fettzelle verbleibt und nicht als Lipoprotein an das Blut abgegeben wird. 5.2. Stoffwechsel der Lipide Lipide werden mit der Nahrung ganz überwiegend in Form von Triglyzeriden aufgenommen, daher werden wir uns hauptsächlich mit dem Stoffwechsel dieser Verbindungen befassen. Die im Rahmen einer Mahlzeit aufgenommenen Triglyzeride werden nach Spaltung in Fettsäuren, Monoglyzeride und Glycerin, in Form von sogenannten gemischten Mizellen resorbiert. In den Mukosazellen erfolgt eine Resynthese zu Triglyzeriden, die anschließend als Bestandteile der Chylomikronen über die Lymphe an das Blut abgegeben werden. Im Fettgewebe werden die Triglyzeride der Chylomikronen durch die schon erwähnte Lipoproteinlipase gespalten. Die Fettsäuren werden von der Fettzelle aufgenommen und zu Triglyzeriden resynthetisiert. Allerdings wird nicht der gesamte Triglyzeridanteil der Chylomikronen gespalten. Ein Rest von etwa 20 % verbleibt in den so genannten Chylomikronen-Remnants. Diese werden zur Leber transportiert, dort aufgenommen, und die Triglyzeride nach Spaltung und Resynthese von der Leber als Bestandteil der VLDL-Lipoproteine abgegeben. Durch diesen Mechanismus wird eine nahezu vollständige Deponierung des Nahrungsfettes im Fettgewebe ermöglicht. Insulin kontrolliert die Triglyzeridspeicherung im Fettgewebe durch Induktion der Lipoproteinlipase und Aktivierung der Triglyzeridsynthese. Die mit der Nahrung aufgenommenen ungesättigten Fettsäuren werden bevorzugt zur Synthese von Phospholipiden verwendet, die wesentliche Bestandteile der Membranen und der Lipoproteine sind. Die Arachidonsäure sowie die essentiellen Fettsäuren Linolsäure und Linolensäure dienen darüber hinaus als Ausgangssubstrate für die Biosynthese der Prosta­ glandine, Thromboxane und Leukotriene. Mit der Nahrung aufgenommenes Cholesterin wird von der Mukosazelle in Chylomikronen verpackt und gelangt nach Abspaltung des Triglyzeridanteiles der Chylomikronen als Bestandteil der Chylomikronen-Remnants zur Leber. In der Leber wird ein Teil des Cholesterins zu Gallensäuren metabolisiert oder als freies Cholesterin mit der Gallenflüssigkeit ausgeschieden. Ein Teil wird die Leber als Bestandteil der VLDL-Liproteine verlassen, die nach Umbau zu den LDL-Lipoproteinen das Cholesterin auf extrahepatische Gewebe verteilen. Eine Reduktion des Cholesterinanteiles in der Nahrung führt in der Regel nur zu einer geringfügigen ca. 10 %igen Senkung des Plasmacholesterinspiegels, da bei geringerer Cholesterinaufnahme die endogene Cholesterinsynthese aktiviert wird. Allerdings sind „Cholesterinsensitive“ Individuen bekannt, die stärker auf 13 Buch 1.indb 13 15.10.2009 11:10:42 Kap. 1 H. Grunicke eine cholesterinarme Diät reagieren. Bei einer Steigerung der Cholesterinzufuhr werden die körpereigene Cholesterinsynthese so wie die Expression des LDL-Rezeptors reprimiert, so dass – ausgenommen bei Cholesterin-sensitiven Individuen – eine Steigerung der Cholesterinaufnahme um ca. 100 mg/Tag nur zu einem relativ geringen Anstieg des Plasmacholesterins um ca. 2 mg/dl führt (Warburg et al., 2004). 5.2.1. Regulation der Lipidspeicherbildung Wie im Kapitel 4.3 erläutert wurde, ist der Triglyzeridspeicher von ganz besonderer Bedeutung für die Sicherstellung der Energieversorgung. Es ist daher nicht überraschend, dass sowohl Bildung wie Abbau dieser Speicher unter strenger Kontrolle stehen. Dabei erfolgt die Regulation der Fettsäure- und der anschließenden Triglyzeridsynthese sowohl auf metabolischer als auch auf hormonaler Ebene. Insbesondere bei fettarmer Ernährung ist eine stark erhöhte Liponeogenese aus Glukose zu beobachten. Wie unter oben beschrieben, ist die Oxidation von Pyruvat zu Azetyl-CoA durch die Pyruvatdehydrogenase ein Schlüsselereignis bei der Biosynthese von Fettsäuren aus Glukose. Dieser Schritt wird durch Insulin aktiviert. Das geschwindigkeitsbestimmende Enzym der Fettsäuresynthese aus Azetyl-CoA ist die AzetylCoA-Carboxylase. Dieses Enzym wird metabolisch durch Zitrat aktiviert und durch langkettige, aktivierte Fettsäuren (Azyl-CoA) gehemmt. Die Aktivierung durch Zitrat ist sinnvoll, da ein erhöhter Zitratspiegel signalisiert, dass der Zitratzyklus mit größtmöglicher Kapazität läuft und eine weitere Einschleusung von Azetyl-CoA in den Zitratzyklus nicht zu einer Stimulation der Energiegewinnung führen kann. Eine Erhöhung des Spiegels an aktivierten Fettsäuren zeigt an, dass eine weitere Steigerung der Fettsäurebiosynthese nicht erforderlich ist. Hunger und motorische Aktivität führen zu Stoffwechsellagen, in denen der Körper auf die Energiespeicher zur Deckung des Energiebedar- fes zurückgreifen muss. Unter diesen Bedingungen wird die Energiespeicherung zu Gunsten der Energieversorgung zurückgefahren. Bei Energiemangelzuständen, die zu einer Erhöhung der AMP-Konzentration führen, wird die ATP-verbrauchende Fettsäurebiosynthese durch Inaktivierung der Azetyl-CoA-Carboxylase mit Hilfe der AMP-abhängigen Kinase (AMPK) gedrosselt. Die nachfolgenden Schritte der Fettsäurebiosynthese werden von einem Multienzymkomplex, der Fettsäuresynthase, katalysiert. Dieses Enzym wird metabolisch durch erhöhte Spiegel von aktivierten Fettsäuren gehemmt, während Insulin die Fettsäuresynthase induziert. Insulin induziert die Transkription der Fettsäuresynthasegene durch Aktivierung des Transkriptionsfactors SREBP-1 c (sterol response element binding protein). Auch die Induktion der Glukokinase durch Insulin erfolgt wahrscheinlich durch Aktivierung von SREBP-1 c. Dieser Transkriptionsfaktor ist ebenfall an der Induktion des ersten Enzyms der Triglyzeridsynthese, der Glycerophosphat-Azyltransferase beteiligt (Horton et al., 2003). Phosphorylierung durch die AMP-abhängige Proteinkinase (AMPK) hemmt dieses Enzym. Zusammenfassend: Die Bildung der Triglyzeridspeicher wird metabolisch durch Zitrat und AMP, hormonell durch Insulin stimuliert. Die Größe der Fettspeicher ergibt sich im Prinzip aus dem Gleichgewicht zwischen Synthese und Abbau über die Lipolyse. Wie adipöse Individuen zeigen, ist die Kapazität der Lipidspeicher jedoch fast unbegrenzt. Bei Menschen, die über längere Zeit eine ausgeglichene Energiebilanz aufweisen und folglich ein konstantes Körpergewicht zeigen, sind jedoch offenbar noch weitere Regelmechanismen wirksam, welche die Größe der Fettspeicher kontrollieren. Ein Teil dieser Regulation scheint durch das Leptin wahrgenommen zu werden (Aguilera et al., 2008). Das vom ob-Gen kodierte Peptidhormon wird hauptsächlich im weißen Fettgewebe synthetisiert und an das Blut abgegeben. Die Menge des gebildeten Leptins ist proportional zur Kör- 14 Buch 1.indb 14 15.10.2009 11:10:42 perfettmasse. Übergewichtige Personen weisen höhere Blut-Leptinspiegel auf als Normalgewichtige. Eine Verringerung der Energiezufuhr bewirkt eine Erniedrigung der Leptinsynthese und damit der Plasmakonzentration an Leptin. Die Leptinsynthese wird durch Insulin und Glukokortikoide induziert. Leptin bindet an Rezeptoren im Zentralnervensystem und peripheren Geweben, u. a. in den Nieren, dem Fettgewebe und der Lunge. Im Hirn findet sich eine hohe Dichte an Leptinrezeptoren im Hypothalamus und im Plexus chorioideus. Im Hypothalamus reprimiert Leptin u. a. die Synthese des Neuropeptid Y. Neuropeptid Y übt einen stark appetitsteigernden Effekt aus. Leptin kann somit über seine appetitzügelnde Wirkung die Aufnahme der Energiesubstrate reduzieren und damit die Größe der Fettspeicher beeinflussen. Die Bindung von Leptin an periphere Rezeptoren scheint in diesen Geweben den Energieverbrauch zu stimulieren. Der diesem Effekt zugrunde liegende Mechanismus ist noch unklar. Deletion oder Inaktivierung der Leptinallele bei der Maus führt bei den Tieren zur Fettsucht (obese mice). Damit ist im Tierversuch ein Zusammenhang zwischen Fettspeicherung und Leptinwirkung erwiesen. Beim Menschen scheint dieser Zusammenhang aber komplexer zu sein. Bei adipösen Patienten fand sich – wie bereits erwähnt – bislang keine Erniedrigung der Leptinspiegel. Eine Resistenz des Leptinrezeptors als mögliche Ursache der Adipositas wäre denkbar, konnte aber bisher nicht gezeigt werden. Adiponektin ist ein weiteres der vom Fettgewebe synthetisierten Adipozytokine. Die Spiegel an Adiponektin liegen mit 5 –10 mg/ml millionenfach über den Leptin-Spiegeln, die sich im Nanogrammbereich bewegen. Adiponektin stimuliert die β-Oxidation der Fettsäuren und hemmt die Lipogenese durch Aktivierung der AMP abhängigen Kinase (AMPK) und Repression des oben erwähnten Transkriptionsfaktors SREB1-c. Adiponektin-Spiegel sind bei Personen mit hoher visceraler Fetteinlagerung und Insulinresistenz erniedrigt. Biochemie der Ernährung Neben der Wirkung auf den Lipidstoffwechsel zeigen sowohl Leptin als auch Adiponektin immunmodulatorische Effekte und beeinflussen die Synthese von Entzündungsmediatoren. Für Details der neueren Ergebnisse der biologischen Funktionen der Adipocytokine und ihrer Rolle bei der Pathogenese der mit Adipositas einhergehenden Erkrankungen sei auf die Übersichtsarbeiten von Tilg et al., 2006 sowie Gualillo et al. 2007 verwiesen. 5.3. Stoffwechsel der Proteine Die mit der Nahrung aufgenommenen Proteine werden im Darm zu Aminosäuren gespalten. Ein Teil der Aminosäuren der Nahrungsproteine wird zur Energieversorgung der Leber und der Enterozyten des Darms verwendet, wobei der Stickstoff von der Leber zur Harnstoffsynthese verwendet wird, während die Enterozyten den Stickstoff in Form von Citrullin fixieren. Der überwiegende Teil dieser Aminosäuren wird jedoch im Skelettmuskel und in geringerem Maße auch von der Leber zur Proteinbiosynthese verwendet. Die Leber gibt die von ihr synthetisierten Proteine überwiegend in Form von Plasmaproteinen an das Blut ab. Der Muskel bildet Enzym- und Strukturproteine. Wie in Kapitel 4.3 beschrieben wurde, dient ein Teil des körpereigenen Proteins auch als Energiespeicher. Diese sogenannte „labile Proteinreserve“ beträgt beim 70 kg schweren Erwachsenen etwa 2 kg, bei einer Gesamtproteinmenge von 6 kg. Im Gegensatz zu den Kohlenhydrat- und Fettspeichern gibt es jedoch kein eigenes Speicherprotein, sondern es werden körpereigene, funktionelle Proteine bei Bedarf abgebaut. Der wesentliche Proteinspeicher ist die Skelettmuskulatur. Die Speicherkapazität des Muskels ist aber begrenzt. Die Masse des Muskelproteins bleibt konstant. Bei einem Überangebot an Nahrungsprotein kommt es nicht zu einer Überproduktion von Proteinspeichern, vielmehr werden nach Erschöpfung der Kapazität der Proteinspeicher die überschüssigen Ami15 Buch 1.indb 15 15.10.2009 11:10:42 Kap. 1 H. Grunicke nosäuren der Liponeogenese zugeführt und als Fett gespeichert. 5.3.1. Regulation des Protein- und Aminosäurestoffwechsels in der Resorptionsphase, Stickstoffbilanz Die Regulation der Bildung von Speicherproteinen und der Aminosäurehomöostase in der Resorptionsphase erfolgt durch die intrazellulären Aminosäurespiegel, das Insulin und den Energiestatus. Die Anflutung von Aminosäuren aus Nahrungsproteinen stimuliert in der Leber – in Abhängigkeit vom Aminosäurespiegel- den Abbau zu CO2 und Harnstoff. Etwa 20 % der von der Leber aufgenommenen Aminosäuren werden für die Proteinsynthese verwendet. Dieser Prozess wird wahrscheinlich ebenfalls durch den Anstieg der intrazellulären Konzentration der Aminosäuren aktiviert. Neben dem der Energiegewinnung dienenden Abbau zu CO2 und Harnstoff sowie der Proteinsynthese wird ein beträchtlicher Teil der Aminosäuren für eine Reihe von anderen Synthesen verwendet. So werden die Kohlenstoffskelette einiger Aminosäuren nach Entfernung der Aminogruppe durch Transaminierung zur Lipidsynthese eingesetzt. Andere dienen zur Synthese von Purinund Pyrimidinbasen, wobei diese Synthesewege isoliert in Abhängigkeit vom Bedarf der jeweiligen Endprodukte reguliert werden. Es wird angenommen, dass etwa 25 % der resorbierten Aminosäuren die Leber passieren und in den systemischen Kreislauf gelangen. Insulin stimuliert die Aufnahme der Aminosäuren in den Muskel und aktiviert dort gemeinsam mit den Aminosäuren die Proteinsynthese. Die Steigerung der Proteinsynthese durch erhöhten Aminosäureinflux und Insulin wird wesentlich durch die Proteinkinase mTOR (mammalian target of rapamycin) reguliert (Wullschleger et al. 2006). mTOR stimuliert die Proteinsynthese durch Aktivierung der Translationsaktivität und der Biogenese der Ribosomen. Energie- mangel führt zu einer Aktivierung der AMP-abhängigen Kinase (AMPK). Die aktivierte AMPK hemmt die Aktivierung von mTOR. Die mit der Nahrung aufgenommenen Aminosäuren vermischen sich mit den durch den Abbau körpereigener Proteine gebildeten Aminosäuren in einem Aminosäurepool. Der tägliche Proteinturnover beim Menschen wird bei einem 70 kg schweren männlichen Erwachsenen mit etwa 300 g (entsprechend 375 g Aminosäuren) geschätzt. Die tägliche Proteinzufuhr aus der Nahrung beträgt in Westeuropa im Durchschnitt 100 g pro Tag. Die den Nahrungsaminosäuren entsprechende Menge wird in der Resorptionsphase von der Leber teils zu CO2 und Harnstoff abgebaut, teils für Synthesen verwendet, und vom Muskel zur Auffüllung der Proteinspeicher eingesetzt. Während der Postresorptionsphase aktiviert die Leber die Glukoneogenese aus Aminosäuren. Die dabei dem Pool entnommenen Mengen werden durch Proteolyse – vor allem im Muskel – wiederaufgefüllt. Die Stickstoffbilanz ist beim Erwachsenen in der Regel ausgeglichen, d. h. die in Form von Protein pro Tag aufgenommene Stickstoffmenge – bei 100 g Protein wären dies ca. 16 g N – entspricht der täglichen Stickstoffausscheidung. Die Stickstoffausscheidung erfolgt im Wesentlichen mit dem Urin als Harnstoff, Ammoniak, Kreatinin und Harnsäure, wobei der Harnstoff mit ca. 85 % den Löwenanteil stellt. Geringe Mengen werden als nichtresorbiertes Protein und in das Darmlumen sezernierte Proteine mit den Fäzes ausgeschieden. Wird die Proteinzufuhr verringert, so erniedrigt sich auch die ausgeschiedene Stickstoffmenge und die Bilanz bleibt ausgeglichen. Erst wenn die zugeführte Proteinmenge ein Minimum von 30 g pro Tag unterschreitet, übersteigt die N-Ausscheidung die N-Aufnahme und die Bilanz wird negativ. Diese minimale Proteinmenge, die noch mit einer ausgeglichenen Stickstoffbilanz vereinbar ist, wird auch als „Bilanzminimum“ bezeichnet. Unterhalb des Bilanzminimums übersteigt der Proteinabbau die Neusynthese und es kommt zu Proteinverlus- 16 Buch 1.indb 16 15.10.2009 11:10:42 ten, die bei längerer Dauer zu Proteinmangelzuständen mit entsprechenden Krankheitsbildern wie Kwashiokor, Marasmus u. ä. führen. Selbst wenn die Proteinaufnahme auf Null reduziert wird, werden täglich etwa 3 g Stickstoff, die einer Proteinmenge von 20 g entsprechen ausgeschieden („endogenes Minimum“). Dieser beim endogenen Minimum ausgeschiedene Stickstoff stammt ausschließlich aus dem nicht vollständig abschaltbaren Proteinturnover. Beim wachsenden Organismus, aber auch unter dem Einfluss anaboler Hormone findet sich eine positive Stickstoffbilanz, d. h. N-Ausscheidung < N-Aufnahme. 6. Substratfluss in der Postresorptionsphase und bei Nahrungskarenz In der Postresorptionsphase und bei Nahrungskarenz muss der Organismus auf die Energiespeicher zurückgreifen. Außerdem ist sicherzustellen, dass die Organe, welche auf Glukose als Energieträger angewiesen sind (Hirn, Blutzellen) ausreichend mit Glukose versorgt werden. In dieser Stoffwechsellage sind die bei der Anlage der Energiespeicher verwendeten Mechanismen Glykogensynthese, Triglyzeridsynthese und Proteinsynthese inaktiv, stattdessen findet sich in der Leber eine gesteigerte Glykogenolyse, im Fettgewebe eine erhöhte Lipolyse und im Muskel eine Aktivierung der Proteolyse. Die bei der Glykogenolyse in der Leber freigesetzte Glukose wird an das Blut abgegeben und dient als Energiesubstrat für ZNS und Blutzellen. Die Glykogenreserven des Muskels können für die Energieversorgung anderer Organe nicht herangezogen werden, da der Muskel nicht in der Lage ist, die nach Freisetzung in phosphorylierter Form vorliegende Glukose zu dephosphorylieren. Ihm fehlt das Enzym Glukose-6-Phosphatase. Die phosphorylierte Glukose kann die Zellmembran nicht passieren und kann somit im Muskel nur für den Eigenbedarf verwendet werden, was bei motorischer Aktivität auch der Fall ist. Biochemie der Ernährung Da die Glykogenreserven der Leber wegen ihrer geringen Kapazität bald einmal erschöpft sind, wird zur Sicherstellung der Glukoseversorgung die Glukoneogenese aus Aminosäuren und Laktat aktiviert. Dies geschieht in erster Linie in der Leber und in geringerem Maße auch in der Niere. Die von der Leber und der Niere zur Glukoneogenese verwendeten Aminosäuren stammen vorwiegend aus dem Aminosäureabbau im Muskel. Die Energieversorgung der nicht-glukoseabhängigen Organe erfolgt in der Postresorptionsphase und im Hunger durch Oxidation von Fettsäuren. Die Fettsäuren werden durch Aktivierung von Lipasen aus den Triglyzeriden freigesetzt und zirkulieren gebunden an Albumin im Blut. Die Leber verwendet einen Teil der zirkulierenden freien Fettsäuren zur Biosynthese von Ketonkörpern (Azetoazetat, β-Hydroxybutyrat), die vom Hirn aber auch von Niere, Herz- und Skelettmuskel als Energiesubstrate verwendet werden können. 6.1. Regulation und Koordination der Substratflüsse in der Postresorptionsphase und bei Nahrungskarenz Die Umschaltung von Energiespeicherung in der Resorptionsphase zu Entspeicherung in der Postresorptionsphase erfolgt hormonell durch Ausschüttung von Glukagon und Katecholaminen, verbunden mit einem Abfall des Insulinspiegels. Die Glukagon-Freisetzung aus den α-Zellen der Langerhansschen Inseln des Pankreas wird durch den Abfall der Glukosekonzentration stimuliert. Der Anstieg der Glukagon-Konzentration ist in der Postresorptionsphase begleitet von einem Abfall des Insulinspiegels. Die Glukagonsekretion wird jedoch auch durch Aminosäuren stimuliert. Daher findet sich nach Aufnahme einer gemischten Kost sowohl ein Anstieg des Insulins als auch des Glukagons, jedoch führt der Kohlenhydratanteil zu einem Überwiegen 17 Buch 1.indb 17 15.10.2009 11:10:43 Kap. 1 H. Grunicke der Insulinsekretion. Nach einer proteinreichen Mahlzeit überwiegt hingegen die Glukagonsekretion, was durch Stimulation der Glykogenolyse und der Glukoneogenese eine Hypoglykämie verhindert. In der Postresorptionsphase ist jedoch – wie bereits erwähnt – der Abfall des Blutglukosespiegels der entscheidende Auslöser für die Glukagonfreisetzung. Glukagon wirkt vor allem in der Leber, wo es eine Steigerung der Glykogenolyse, bei gleichzeitiger Hemmung der Glykogensynthese und eine Aktivierung der Glukoneogenese, sowie eine Hemmung der Glykolyse bewirkt. Die Stoffwechseleffekte von Glukagon werden vermittelt durch einen Anstieg des intrazellulären cAMPSpiegels. Aktivierung des Glukagon-Rezeptors der Hepatozyten durch das Hormon bewirkt eine Stimulation der Adenylatzyklase, welche die Synthese von cAMP aus ATP katalysiert. Der erhöhte intrazelluläre cAMP-Spiegel aktiviert die cAMP-abhängige Proteinkinase (PKA), die durch Phosphorylierung der Glykogenphosphorylase-kinase eine Aktivierung der Glykogenolyse und durch Phosphorylierung der Glykogensynthase eine Hemmung der Glykogensynthese bewirkt. Auch die Steigerung der Glukoneogenese durch Glukagon ist cAMP vermittelt und beruht auf einer Erniedrigung der Konzentration von Fruktose-2,6-Bisphosphat durch Phosphorylierung der Phosphofrukto-2-Kinase. Längerfristig erfolgt zusätzlich eine Induktion von Schlüsselenzymen der Glukoneogenese durch Aktivierung des cAMP-bindenden Transkriptionsfaktors CREB (cAMP-response-elementbinding-protein). Nach Bindung von cAMP bindet CREB an CRE (cAMP-response-element) Bindungsstellen im Promoter der cAMP responsiven Gene, die für Schlüsselenzyme der Glukoneogenese kodieren. Glukagonrezeptoren finden sich nicht nur in der Leber, sondern auch in anderen Geweben, so auch im Fettgewebe. Im Fettgewebe bewirkt Glukagon eine Aktivierung der hormonsensitiven Lipase, die cAMP-abhängig durch Phosphorylierung mittels der PKA stimuliert wird und eine hydrolytische Spaltung der Triglyzeride unter Freisetzung von freien Fettsäuren bewirkt. Die in der Postresorptionsphase und bei Nahrungskarenz zu beobachtende gesteigerte Lipolyse im Fettgewebe wird jedoch in erster Linie durch Katecholamine (Adrenalin, Noradrenalin) verursacht. Die Katecholaminsekretion erfolgt durch Stimulation des sympathischen Nervensystems bedingt durch den „Hungerstress“. Bindung der Katecholamine an β2-Rezeptoren aktiviert die hormonsensitive Lipase durch cAMP-abhängige Phosphorylierung. Die Katecholamin-induzierte Lipolyse ist jedoch nicht in allen Fettzellen in gleichem Maße ausgeprägt. Gynoide Adipozyten, die sich bevorzugt in geschlechtsspezifischen Fettdepots der Frau finden, exprimieren neben den β2- auch α2-Rezeptoren. Aktivierung der α2-Rezeptoren verursacht jedoch eine Hemmung der Adenylatzyklase, und wirkt somit antagonistisch zur Wirkung der β2-Rezeptoren. Die Triglyzeridspeicher der gynoiden Adipozyten werden somit durch die Katecholamine kaum oder gar nicht beeinflusst (Arner, 1988). Im braunen Fettgewebe werden die durch Katecholaminwirkung freigesetzen Fettsäuren zur Wärmeproduktion eingesetzt. Die Wärmegewinnung geschieht durch β-Oxidation der Fettsäuren und partielle Entkopplung der oxidativen Phosphorylierung vom Elektronenfluss in der Atmungskette durch das Entkopplungsprotein UCP-1 (Thermogenin) (Affourtit et al. 2007). Adrenalin und Noradrenalin induzieren die Synthese des Thermogenins (Fukuda et al., 2003). An der bei Nahrungskarenz gesteigerten Lipolyse im Fettgewebe ist neben der hormonsensitiven Lipase offenbar noch eine weitere Triglyzeridlipase, die „adipose triglyceride lipase, ATGL“, in größerem Maße beteiligt (Raben et al., 2005). Die Regulation der ATGL ist noch weitgehend ungeklärt. In der Leber bewirken die Katecholamine über eine Aktivierung von β1-Rezeptoren und nachfolgende Stimulation der Adenylatzyklase 18 Buch 1.indb 18 15.10.2009 11:10:43 eine Steigerung der Glykogenolyse bei gleichzeitiger Hemmung der Glykogensynthese. Katecholamine sind potente Hemmer der Insulinsekretion. Freisetzung der Katecholamine bewirkt somit eine rasche Senkung des Insulinspiegels und damit eine Hemmung der Liponeogenese im Fettgewebe und der Muskulatur. Die gesteigerte Lipolyse durch Glukagon und Katecholamine bei gleichzeitiger Hemmung der Liponeogenese bewirkt eine Erhöhung der Konzentration an freien Fettsäuren im Blut. Diese dienen einerseits als Energiesubstrate für die meisten Gewebe, einschließlich der Leber, aber mit Ausnahme des ZNS und der Erythrozyten. Die erhöhte Lipolyse bei gleichzeitiger Hemmung der Triglyzeridsynthese führt zu einer Steigerung der β-Oxidation der Fettsäuren. In der Leber wird durch die Fettsäureoxidation mehr Azetyl-CoA gebildet als für die Energieversorgung erforderlich wären. Das überschüssige Azetyl-CoA wird von der Leber zur Ketonkörpersynthese verwendet. Die Verwendung von Fettsäuren als Energiesubstrate spart Glukose zu Gunsten der glukoseabhängigen Organe. Dieser Effekt wird noch verstärkt durch die Ketonkörpersynthese, die sich charakteristischerweise in der späten Postresorptionsphase und besonders bei längerer Nahrungskarenz, beim Fasten, findet. Ketonkörper werden von Herz, Skelettmuskel, Niere, vor allem aber vom Hirn als Energiesubstrate verwendet. Beim Fasten steigt die Ketonkörperaufnahme des Hirns auf das 20fache des Wertes in der frühen Postresorptionsphase. Ketonkörper decken in dieser Stoffwechsellage bis zu 70 % des Energiebedarfes des Gehirns. Für die obligaten glukoseverbrauchenden Zellen und Gewebe muss der Organismus etwa 180 g Glukose pro Tag bereitstellen. Durch die Verwendung der Ketonkörper als Energiesubstrate verringert sich der tägliche Glukosebedarf auf ca. 80 g/24 Stunden. Da bei Nahrungskarenz der überwiegende Teil der Glukose durch Glukoneogenese aus Aminosäuren gebildet wird, die wiederum durch Abbau körpereigener Proteine bereitgestellt werden, ist durch die Verwendung Biochemie der Ernährung der Ketonkörper eine wesentliche Reduktion des Proteinabbaues von 75 g/24 Std. in der frühen Postresorptionsphase auf etwa 20 g bei längerer Nahrungskarenz möglich. Freie Fettsäuren steigern in der Leber die Ketonkörpersynthese durch Induktion der an der Ketonkörperbildung beteiligten Enzyme. Der Effekt der freien Fettsäuren auf die Genexpression wird u. a. durch Peroxysomen-Proliferatoraktivierte Rezeptoren (PPARs) vermittelt (Kota et al., 2005). PPARs sind Transkriptionsfaktoren, die mit Retinoatrezeptoren vom Typ RXR Heterodimere bilden. In der Leber führt die Aktivierung von PPARα zur Induktion von Enzymen für den Fettsäureabbau, insbesondere durch Induktion der Carnitin-Azyl-Transferase und damit einem beschleunigten Transport in die Mitochondrien, ferner zur Steigerung der Synthese der Enzyme für die Ketonkörpersynthese und zur Repression der Schlüsselenzyme für die Biosynthese der Fettsäuren. Im Muskel erhöhen PPARγ und PPARδ die Transkription von Genen für Enzyme der β-Oxidation. Wie die Wirkungen der freien Fettsäuren signalisieren, wird die hormonelle Stoffwechselregulation in der Postresorptionsphase und besonders bei Nahrungskarenz ergänzt durch metabolische Regelkreise, die teils über Aktivierung/Inaktivierung von Enzymen, teils durch Beeinflussung der Genexpression wirken. Eine wichtige Funktion bei der Umschaltung des Stoffwechsels von Energiespeicherung zu Energielieferung kommt der AMP-abhängigen Kinase (AMPK) zu. Ein Abfall des intrazellulären ATP-Spiegels und eine dadurch bewirkte Stimulation der Adenylatkinase haben einen Anstieg des AMP zu Folge, der wiederum die AMPK aktiviert. Die aktive AMPK hemmt die Synthesen von Protein, Fettsäuren und Glykogen, stimuliert die Glykolyse und die β-Oxidation der Fettsäuren. Diese, durch direkte Enzymphosphorylierungen bewirkten Effekte, werden ergänzt durch Beeinflussung der Genexpression. AMPK, aber auch die PKA (cAMP-abhängige Kinase) regulieren durch Phosphorylierung den Transkriptionsfak19 Buch 1.indb 19 15.10.2009 11:10:43 Kap. 1 H. Grunicke tor ChREBP (carbohydrate-response-elementbinding-protein). AMPK- bzw. PKA katalysierte Phosphorylierung von ChREBP blockiert dessen Translokation in den Kern und hemmt damit die Expression der Pyruvatkinase, Azetyl-CoACarboxylase und der Fettsäuresynthase (Dentin et al., 2005). Von großer Bedeutung für die Energieversorgung in der Postresorptionsphase ist schließlich die Proteolyse. Die durch Proteolyse körpereigener Proteine freigesetzten Aminosäuren bilden die Hauptquelle für die Glukoneogenese und sichern damit die Versorgung glukoseabhängiger Zellen und Organe (ZNS, Erythrozyten, Nierenmark) in dieser Stoffwechsellage. Glukagon und Katecholamine aktivieren die Proteolyse. Der diesen Effekten zu Grunde liegende Mechanismus ist jedoch noch weitgehend unklar. Zum Teil dürfte die Regulation der Proteinsynthese über das bereits erwähnte mTOR verlaufen, während die Kontrolle der Proteolyse – zumindest partiell – durch den Transkriptionsfaktor FoxO erfolgt. Insulin und andere anabole Hormone aktivieren die Proteinkinase mTOR und damit die Proteinbiosynthese durch Aktivierung einer Proteinkinase B (PKB) vermittelten Kaskade. Phosphorylierung von FoxO durch die PKB verhindert dessen Translokation in den Kern und damit die Expression der für die muskelspezifischen Ubiquitin-konjugierenden Enzyme wie MuRF-1 und Atrogin-1 kodierenden Gene (Glass, 2005; Léger et al., 2006). Da die Ubiquitinierung Voraussetzung für die Proteolyse ist, würde durch diesen Mechanismus die unter Insulin zu beobachtende Stimulation der Proteinsynthese und gleichzeitige Hemmung der Proteolyse – zu mindest zu einem Teil – erklärt. Bei niedrigen Insulinspiegeln, würde die Inaktivierung von FoxO ausbleiben und dadurch die Proteolyse aktiviert werden. Gleichzeitig wäre die Proteinsynthese reduziert, da die PKB unter diesen Bedingungen nicht aktiviert ist. Katecholamine und niedrige Blut-Glukosespiegel hemmen die Insulinsekretion. Die Proteolyse-steigernden Effekte von Adrenalin, Norad- renalin und Glukagon sind daher wahrscheinlich indirekte Wirkungen verursacht durch eine Hemmung der Insulinsekretion. Literaturverzeichnis Affourtit C, Crichton PG, Parker N, Brand MD (2007) Novel uncoupling proteins. Novartis Found Symp 287: 70 – 80; discussion 91 Aguilera CM, Gil-Campos M, Canete R, Gil A (2008) Alterations in plasma and tissue lipids associated with obes­ ity and metabolic syndrome. Clin Sci (Lond) 114(3): 183 – 93 Arner P (1988) Role of antilipolytic mechanisms in adipose tissue distribution and function in man. Acta Med Scand 723: 147– 52 Biesalski HK (2004) Ballaststoffe. In: Biesalski HK, Fürst P, Kasper H, Kluthe R, Pölert W, Puchstein Ch, Stähelin HB (Hrsg) Ernährungsmedizin. Thieme, Stuttgart, S 69 –73 Dentin R, Benhamed F, Pegorier JP, Foufelle F, Viollet B, Vaulont S, Girard J, Postic C (2005) Polyunsaturated fatty acids suppress glycolytic and lipogenic genes through the inhibition of ChREBP nuclear protein translocation. J Clin Invest 115(10): 2843 – 5 4 Deutsche Gesellschaft f. Ernährung (1991) Empfehlungen für die Nährstoffzufuhr. 5. Aufl., Umschau, Frankfurt Enig MG, Atal S, Keeney M, Sampugna J (1990) Isomeric trans fatty acids in the U. S. diet. J Am Coll Nutr 9(5): 471– 86 Fukuda H, Hirakawa T, Iritani N (2007) Nutritional and hormonal regulation of uncoupling protein gene expression in rat adipocytes. J Nutr Sci Vitaminol 53(5): 426 – 31 Glass DJ (2005) Skeletal muscle hypertrophy and atrophy signaling pathways. Int J Biochem Cell Biol 37(10): 1974 – 8 4 Gualillo O, Gonzalez-Juanatey JR, Lago F (2007) The emerging role of adipokines as mediators of cardiovascular function: physiologic and clinical perspectives. Trends Cardiovasc Med 17(8): 275 – 83 Horton JD, Shah NA, Warrington JA, Anderson NN, Park SW, Brown MS, Goldstein JL (2003) Combined analysis of oligonucleotide microarray data from transgenic and knockout mice identifies direct SREBP target genes. Proc Natl Acad USA 100(21): 12 027– 32 Kluthe R (2004) Ernährung im Erwachsenenalter. In: Biesalski HK, Fürst P, Kasper H, Kluthe R, Pölert W, Puchstein Ch, Stähelin HB (Hrsg) Ernährungsmedizin. Thieme, Stuttgart, S 212 – 223 Kota BP, Huang TH, Roufogalis BD (2005) An overview on biological mechanisms of PPARs. Pharmacol Res 51(2): 85 – 94 20 Buch 1.indb 20 15.10.2009 11:10:43 Leger B, Cartoni R, Praz M, Lamon S, Deriaz O, Crettenand A, Gobelet C, Rohmer P, Konzelmann M, Luthi F, Russel AP (2006) Akt signalling through GSK-3beta, mTOR and Foxo1 is involved in human skeletal muscle hypertrophy and atrophy. J Physiol 576: 923 – 33 Molnar GD, Taylor WF, Langworthy AL (1972) Plasma immunoreactive insulin patterns in insulin-treated diabetics. Studies during continuous blood glucose monitoring. Mayo Clin Proc 47(10): 709 –19 National Academy of Sciences (1980) Food and Nutrition Board: Recommended diatory allowances. Washington DC Noack R (2004) Energiehaushalt. In: Biesalski HK, Fürst P, Kasper H, Kluthe R, Pölert W, Puchstein Ch, Stähelin HB (Hrsg) Ernährungsmedizin. Thieme, Stuttgart, S 28 – 41 Raben DM, Baldassare JJ (2005) A new lipase in regulating lipid mobilization: hormone-sensitive lipase is not alone. Trends Endocrinol Metab: TEM 16(2): 35 – 6 Schutz Y (2004) Bestimmung des Ernährungszustandes. In: Biesalski HK, Fürst P, Kasper H, Kluthe R, Pölert Biochemie der Ernährung W, Puchstein Ch, Stähelin HB (Hrsg) Ernährungsmedizin. Thieme, Stuttgart, S 19 – 27 Tilg H, Moschen AR (2006) Adipocytokines: mediators linking adipose tissue, inflammation and immunity. Nature Rev Immunol 6(10): 772 – 83 Warburg U, Assmann R (2004) Hyperlipoproteinämien. In: Biesalski HK, Fürst P, Kasper H, Kluthe R, Pölert W, Puchstein Ch, Stähelin H B (Hrsg) Ernährungsmedizin. Thieme, Stuttgart, S 376 – 390 WHO/FAO/UNO report (1985) Energy and protein requirements. In: WHO technical support series No 724, Geneva Wolf G (2006) Calorie restriction increases life span: a molecular mechanism. Nutr Rev 64: 89 – 92 Wood JG, Rogina B, Lavu S, Howitz K, Helfand SL, Tatar M, Sinclair D (2004) Sirtuin activators mimic caloric restriction and delay ageing in metazoans. Nature 430(7000): 686 – 9 21 Buch 1.indb 21 15.10.2009 11:10:43