Endokrinologie-Skript 1) Cushing-Syndrom (CS) - Leipzig
Werbung
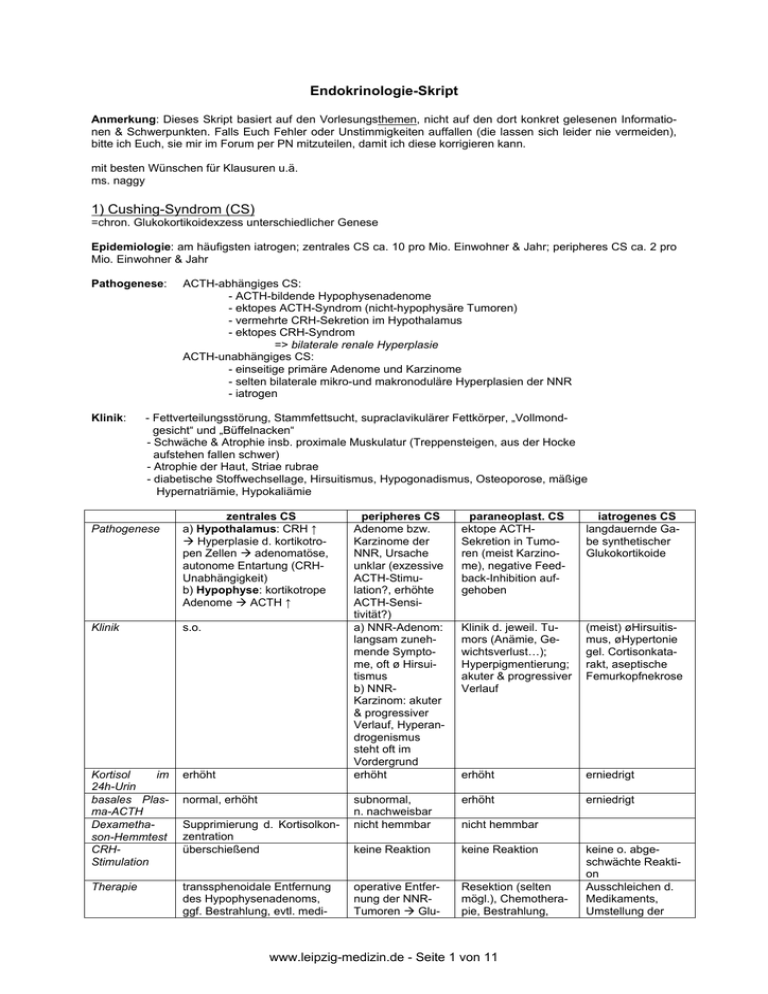
Endokrinologie-Skript Anmerkung: Dieses Skript basiert auf den Vorlesungsthemen, nicht auf den dort konkret gelesenen Informationen & Schwerpunkten. Falls Euch Fehler oder Unstimmigkeiten auffallen (die lassen sich leider nie vermeiden), bitte ich Euch, sie mir im Forum per PN mitzuteilen, damit ich diese korrigieren kann. mit besten Wünschen für Klausuren u.ä. ms. naggy 1) Cushing-Syndrom (CS) =chron. Glukokortikoidexzess unterschiedlicher Genese Epidemiologie: am häufigsten iatrogen; zentrales CS ca. 10 pro Mio. Einwohner & Jahr; peripheres CS ca. 2 pro Mio. Einwohner & Jahr Pathogenese: Klinik: ACTH-abhängiges CS: - ACTH-bildende Hypophysenadenome - ektopes ACTH-Syndrom (nicht-hypophysäre Tumoren) - vermehrte CRH-Sekretion im Hypothalamus - ektopes CRH-Syndrom => bilaterale renale Hyperplasie ACTH-unabhängiges CS: - einseitige primäre Adenome und Karzinome - selten bilaterale mikro-und makronoduläre Hyperplasien der NNR - iatrogen - Fettverteilungsstörung, Stammfettsucht, supraclavikulärer Fettkörper, „Vollmondgesicht“ und „Büffelnacken“ - Schwäche & Atrophie insb. proximale Muskulatur (Treppensteigen, aus der Hocke aufstehen fallen schwer) - Atrophie der Haut, Striae rubrae - diabetische Stoffwechsellage, Hirsuitismus, Hypogonadismus, Osteoporose, mäßige Hypernatriämie, Hypokaliämie Pathogenese zentrales CS a) Hypothalamus: CRH ↑ Æ Hyperplasie d. kortikotropen Zellen Æ adenomatöse, autonome Entartung (CRHUnabhängigkeit) b) Hypophyse: kortikotrope Adenome Æ ACTH ↑ Klinik s.o. Kortisol im 24h-Urin basales Plasma-ACTH Dexamethason-Hemmtest CRHStimulation erhöht Therapie transsphenoidale Entfernung des Hypophysenadenoms, ggf. Bestrahlung, evtl. medi- normal, erhöht Supprimierung d. Kortisolkonzentration überschießend peripheres CS Adenome bzw. Karzinome der NNR, Ursache unklar (exzessive ACTH-Stimulation?, erhöhte ACTH-Sensitivität?) a) NNR-Adenom: langsam zunehmende Symptome, oft ø Hirsuitismus b) NNRKarzinom: akuter & progressiver Verlauf, Hyperandrogenismus steht oft im Vordergrund erhöht paraneoplast. CS ektope ACTHSekretion in Tumoren (meist Karzinome), negative Feedback-Inhibition aufgehoben iatrogenes CS langdauernde Gabe synthetischer Glukokortikoide Klinik d. jeweil. Tumors (Anämie, Gewichtsverlust…); Hyperpigmentierung; akuter & progressiver Verlauf (meist) øHirsuitismus, øHypertonie gel. Cortisonkatarakt, aseptische Femurkopfnekrose erhöht erniedrigt subnormal, n. nachweisbar nicht hemmbar erhöht erniedrigt keine Reaktion keine Reaktion operative Entfernung der NNRTumoren Æ Glu- Resektion (selten mögl.), Chemotherapie, Bestrahlung, nicht hemmbar www.leipzig-medizin.de - Seite 1 von 11 keine o. abgeschwächte Reaktion Ausschleichen d. Medikaments, Umstellung der kamentöse Überbrückung bis Wirkeintritt m. Mitotan (Adrenokortikolytikum), Ketoconazol (Inhibitor NNR-Enzyme), bei ausbleibendem Therapieerfolg bilaterale Adrenalektomie kokortikoidsubstitutionstherapie kann nötig werden, Karzinom: schlechte Prognose (Mikrometastasen Lunge!) medikamentöse Therapie des CS Medikamente 2) Nebennierenrindeninsuffizienz (NNRI) Prävalenz: 4-11 Fälle/100.000 EInwohner primäre NNRI (Mb. Addison) Schädigung aller 3 Rindenschichten betroffene Areale Pathogenese - autoimmune Prozesse (SchmidtSyndrom, Carpenter-Syndrom) - Infektionen (Tuberkulose, Histoplasmose, Cryptokokkose, CMV bei AIDS) - Metastasen, Amyloidose, Hämochromatose, Adrenalektomie, kongenitale adrenale Hypoplasie, ACTH- ResistenzSyndrome (alle selten) - Medikamente (Etomidat, Ketoconazol, Suramin, Metyrapon, Phenytoin, Barbiturate) bei Patienten mit eingeschränkter Hypophysen-Nebennierenachse - Hämorrhagie durch antikoagulative Therapie oder hämorrhagische Infarzierung im Rahmen einer Sepsis (Meningokokken, gramnegative Erreger) Æ Waterhouse-Friedrichsen-Syndrom Klinik + klinische Manifestation ab 90%iger Zerstörung des Gewebes, vor allem durch Cortisol- und Aldosteronmangel (Androgenmangel weniger gravierend) + Kompensation der chronischen Formen zunächst durch Steigerung der ACTHProduktion Æ Hyperpigmentierung (Handlinien, Gesicht…) +beginnende Dekompensation zeigt sich in Gewichtsverlust (+ Übelkeit, Erbrechen, Durchfall), Leistungminderung (Muskelschwäche), Hypotonie, Hypoglykämie, ausfallende Scham- und Achselbehaarung (wg. Androgenmangel), psychische Veränderungen (verringerter Antrieb, depressive Verstimmung) + Symptomatik d. akuten NNRI (Addison-Krise bei unerkannter NNRI, unzureichender Kortikoidtherapie bei bekannter NNRI, Waterhouse-FriedrichsenSyndrom, Hämorrhagie) : Übelkeit und Erbrechen, Durchfall, Hypovolämie, Salzverlust, Exsikkose, diffuser Abdominalschmerz, starke Hypotonie Æ Kreislaufschock, Schwäche, Somnolenz, Hyperkaliämie, Hyponatriämie Hormonstatus: Plasma-ACTH ↑↑, Cortisol ↓↓; Cortisol im 24h-Harn, ACTHStimulationstest (nicht in akuter Phase!); Elektrolyte; Immunologische Tests, CT… Diagnostik Therapie Cortisol-, Mineralkortikoid- und Volumensubstitution, ggf. Therapie d. Grunderkrankung (Antibiose etc.), Kontrollen (RR, E-lyte, ACTH…) sekundäre NNRI Ausfall d. Zonae fasciculata & reticularis - ACTH-Mangel durch Hypophyseninsuffizienz (Hypophysenadenome, Kraniopharyngeome, Entzündungen, Traumata, Metastasen, Sheehan-Syndrom [postpartale Blutung & Nekrose d. Hypophyse]) - ausserdem kann Ursache sein: akuter Glukokortikoidentzug (Atrophie d. betroffenen Zonen durch verminderte ACTH und CRHSekretion) - Ausfall von Glukokortikoiden und Androgenen (Fähigkeit zur Aldosteronsynthese bleibt meist erhalten, da diese vorwiegend durch das Renin-Angiotensin-System reguliert wird) + Hypoplasie der NNR, oft TSHund GH-Sekretion mitbetroffen + Klinik ähnlich primärer NNRI, keine Hyperpigmentierung (ACTH zu niedrig), geringerer Volumenmangel, kaum Elektrolytstörungen (eher durch Erbrechen & Durchfall) + in der chronischen Form auch Arthralgien und Myalgien, orthostatische Hypotonie, Blässe + Cortisolspiegel kann anfangs normal bleiben, jedoch keine/eingeschränkte Fähigkeit zur Stressreaktion CRH-Belastungstest (Unterscheidung hypothalamische o. hypophysäre Ursache), Bildgebung Hypophyse & Sellaregion, BasalACTH und Basal-Cortisol wie bei primärer NNRI, ohne Mineralkortikoide www.leipzig-medizin.de - Seite 2 von 11 tertiäre NNRI Ausfall d. Zonae fasciculata & reticularis - Insuffizienz d. Hypothalamus (Bestrahlung, Traumata, Raumforderungen, Sarkoidose) wie sekundäre NNRI wie sekundäre NNRI wie sekundäre NNRI 3) Autonome Schilddrüse und Mb. Basedow Epidemiologie: 1-2% der erwachsenen Bevölkerung hat eine Hyperthyreose, die Hälfte davon Autonomie & MB Epidemiologie Pathogenese Klinik Diagnostik Morbus Basedow (MB) Frauen häufiger betroffen, exogene Faktoren können zum Ausbruch führen (Jodzufuhr durch Kontrastmittel, Medikamente) + Autoantikörper gg. Thyreotropinrezeptor (TRAK) Æ Wirkung wie TSH Æ Suppression von TSH durch hohe T4-Spiegel (AK wirken länger als TSH) + meist auch TPO (AK gg. Thyroidea-Peroxidase) und TAK (AK gg. Thyreoglobulin) + Assoziation mit HLA A1, B8, DR3 +innerhalb weniger Wochen + Merseburger-Trias: Exophtalmus, Struma, Tachykardie + endokrine Orbitoopathie: extraorbitale Muskel- und Fibroblastzellen tragen TSH-Rezeptor-Antigen Æ T-Lymphozyteninfiltration (entzündliche Schwellung d. Muskulatur, Mukopolysaccharidproduktion d. Fibroblasten (Exophtalmus)); Orbitopathie kann bei noch euthyreoter SD auftreten! Æ engmaschige Kontrolle/Ausschluss anderer Erkrankungen +prätibiales Myxödem: bilaterale indurierte Schwellungen an Tibia und Knöchelregion, Juckreiz, Blasenbildung und Ulzeration sind möglich + Akropachie: diffuse Schwellung an Fingern und Handrücken, später Auftreibung der Finger- und Zehenendglieder Æ subperiostale ossifizierende Periostitis (auch bei behandeltem MB mgl.) +katabole Stoffwechsellage: erhöhte Thermogenese, Glycogen-, Cholesterin- & Proteinabbau Æ erhöhtes Schwitzen, Schlaflosigkeit, Unruhe, Gewichtsabnahme, Haarausfall +erhöhte Herzfrequenz, Muskelkontraktion, Nervenerregbarkeit, beschleunigter Abbau der NNR-Hormone Æ Tremor, Hyperkinesien, Sinustachykardien, Tachyarrhythmien, hohe Blutdruckamplitude + Struma (nicht obligatorisch): Schwirren, auskultat. Rauschen (durch erhöhte Vaskularisation) + thyreotox. Krise: durch Jodexposition, Manipulation (OP), Exsikkose Æ Wasserverlust, hohe HF, Fieber, Erbrechen, Durchfälle, Verstärkung des endokrinen Psychosyndroms von Erregungsphasen (Stadium I) über Halluzinationen (II) bis hin zum Koma (III) Æ Letalität 30-50% Æ Vorgehen: Thiamazol i.v. (Hemmung d. Hormonsynthese), dann Iodid i.v. (Hemmung d. Hormonausschüttung, nicht bei Iod-induzierter thyreotox. Krise!), evtl. Plasmapherese & subtotale Thyreoidektomie; begleitend: Volumen-, E-lyt- & Kaloriensubstitution, Betablocker, Glukokortikoide, Sedativa, Thromboseprophylaxe, Temperatursenkung, Überwachung + Blickdiagnose, Labor sichert Befund + Hormonstatus: erhöhtes T3, T4 bei supprimiertem TSH + Antikörperbestimmung: TPO, TAK, TRAK, MAK (mikrosomale Schilddrüsenantikörper), jedoch nicht bei allen Pat. m. Immunhyperthyreose nachweisbar! +Bildgebung: Sono (SD diffus echoarm, keine Knoten), MRT (Ausschluss anderweitiger Erkrankungen der Orbita), Szintigra- www.leipzig-medizin.de - Seite 3 von 11 Autonome Schilddrüse 50% d. Hyperthyreosen +funktionelle Autonomie (TSH-unabhängig) von herdförmigen, meist knotigen Arealen +Proliferation aus normalen Schilddrüsenfollikeln über Jahre hinweg (Stadium d. euthyreoten Autonomie) ( somatische Mutation +Hyperthyreose meist durch exzessive Jodzufuhr induziert (Pharmaka, Kontrastmittel) + ursächlich evtl. wachstumsfördernde Peptide (eGF? IGF-1?), die viell. von der SD gebildet werden + tox. autonomes Adenom: Mutation d. TSH-Rezeptors + langsame Progression d. Symptome + spontane Remission nicht zu erwarten + autonomes Areal muss nicht zwangsweise zur Hyperthyreose führen, jedoch Gefahr d. Entwicklung einer manifesten Hyperthyreose z.B. durch Jodexposition + Symptomatik wie bei MB (außer Immunspezifische Symptome: Orbitopathie, Akropachie…) + lokales Druckgefühl, Knoten kann als kosmetisch störend empfunden werden + kardiovaskuläre Auswirkungen & Beeinträchtigung d. Knochenstoffwechsels häufig Grund f. Ablation + Szintigraphie: verstärkte Speicherung in umschriebenen Herd, bei dekompensiertem autonomen Adenom übriges Schilddrüsengewebe supprimiert (durch TSHDrosselung), Sonographi- phie (gleichmäßig verstärkte Speicherung in der gesamten SD) + cave: in der Schwangerschaft TBG ↑ Æ T3 & T4 ↑, TSH ↓ (Stimulation durch hCG) Æ Hyperthyreose häufige Fehldiagnose Therapie + medikamentös, Thyreostatika (Euthyreose v.a. auch vor OP wichtig): Carbimazol, Thiamazol, Propylthiouracil, Perchlorat (selten, jedoch Prophylaxe bei Jodexposition durch Hemmung der Jodidaufnahme) Æ 1 Jahr Therapie, dann Auslassversuch, 50 % d. Pat.: dauerhafte Remission + OP: Indikationen: große Struma, zusätzl. Knoten, Gravidität, Kindesalter, Jodexposition, Ablehnung d. RJ-Therapie, Komplikationen: Hypoparathyreoidismus, Rekurrensparese; aber: sofortiger Wirkeintritt + vor OP muss mit Thyreostatika Euthyreose angestrebt werden, sonst Gefahr thyreotox. Krise, wenn nötig „Plummerung“ (hochdosierte Iodidgabe Æ Durchblutungsminderung, bessere Operabilität) + Radioiod-Strahlentherapie: kleine SD, Ablehnung OP/erhöhtes OP-Risiko; Wirkeintritt erst nach 2-3 Monaten +regelmäßige Kontrollen, weil: Komplikation: Späthypothyreose +Nikotin-Abstinenz (Rauchen verstärkt Orbitopathie) sche Darstellung eines oder mehrerer Knoten (Bildgebung wichtig für Differentialdiagnose) + Supressionsszintigramm: Verabreichung von Trijodthyronin oder L-Thyroxin über einige Tage – nur autonome Areale reichern weiterhin an + TRH-Test: Beurteilung des TSH-Anstiegs (supprimiert bei Autonomie) + Hormonstatus: erhöhtes T3, T4 bei niedrigem/nicht nachweisbarem TSH + zunächst medikamentös, Spontanremission jedoch seltener als bei MB, als Dauertherapie ungeeignet (außer bei multimorbiden, inoperablen Patienten) + operative & Radiojodtherapie wie bei MB + Ablation wichtig v.a. bei Patienten, bei denen Untersuchungsmethoden mit Jodanwendung zu erwarten sind (Herzkatheter etc.) endokrine Orbitopathie: Stadium 0 I II III IV V VI Definition keine Zeichen & Symptome keine Symptome, nur Zeichen: Dalrymplesches Z. (Oberlidretraktion), Möbiussches Z. (Konvergenzschwäche), Graefsches Zeichen (Oberlid bleibt bei Blicksenkung zurück), Stellwagsches Zeichen (seltener Lidschlag), Glanzauge, weite Lidspalte, Bellsches Phänomen (Aufwärtsbewegung der Augäpfel bei Augenschluss) ist u.U. aufgehoben, starrer Blick Bindegewebsbeteiligung (periorbitales Ödem (Chemosis), Augentränen, Fremdkörpergefühl, evtl. Lichtempfindlichkeit) Exophtalmus (>22mm) IIIa leicht, IIIb deutlich, IIIc stark ausgeprägt; behinderter Lidschluss= Lagophtalmus Beteiligung der extraorbitalen Augenmuskeln (retrobulbäre Schmerzen, Paresen Æ Unscharf- & Doppelsehen, ausgeprägte Konvergenzschwäche, Heberschwäche) Corneabefall Visusverschlechterung durch Druck auf N. opticus bis hin zur Erblindung Struma: euthyreote Struma: - sonografisch Sichtbare Vergrößerung (Männer >25 ml, Frauen >18ml), diffuse oder knotige Hyperplasie ohne Entzündungszeichen - Klassifikation: diffus, einknotig, mehrknotig - Jodmangelgebiete Æ endemische Struma (>10% d. Kinder vergrößerte SD) - Kompensation d. Jodmangels durch TSH-Stimulation Æ Wachstum, außerdem Disposition (Faktoren noch nicht bekannt) - weitere Ursachen („sporadische Struma“): genetische Defekte der SD-Hormonsynthese, stru migene Substanzen (Medikamente wie Thyreostatika, Lithium…), lokale Wachstumsfaktoren (IGF-1, eGF, fGF, VIP…) - Histologie: große kolloidgefüllte Follikel mit flachem Epithel, Zysten durch Verschmelzung, Nekrosen durch Kompression des umliegenden Gewebes sowie unzureichende Vaskularisation www.leipzig-medizin.de - Seite 4 von 11 - Klinik: kleinere Strumen oft nicht störend, evtl. kosmetisch, bei weiterem Wachstum Einen gung d. Halsorgane: Trachea Æ Dyspnoe, Ösophagus Æ Dysphagie, N. recurrens Æ Heiser keit, Vv. jugulares internae Æ Einflussstauung, Zyanose, Schwellung v. Hals & Gesicht - Diagnostik: Sono, Palpation (verschieblich), SD-Parameter (normal) - Therapie: Beseitigung d. Jodmangels, bei anderen Formen L-Thyroxingabe, ggf. OP multinodöse Struma: - sonographische Beurteilung der Knoten und ggf. Selektion zur Feinnadelaspirationszytologie (bspw. bei Mikrokalzifikation, suspektes Vaskularisierungsmuster inder Doppler-Sono, Hypofunktion) - bei komplett knotigem Umbau Entscheidung zw. Verlaufsbeobachtung und chirurgischer Therapie - häufig mechanische Einschränkungen Æ Lufu, nativ-CT, MRT - effektive Volumenreduktion durch Radioiodtherapie möglich Hypothyreose (HT) 1 pro 4000 Neugeborene, 1% d. erwachsenen Bevölkerung Definition Pathogenese Klinik Diagnostik Therapie primäre HT sekundäre HT tertiäre HT zentrale Steuerung ist intakt, SD selbst ist nicht zur insuffiziente thyreoHypothalamusHormonsynthese befähigt trope Zellen des HVL Insuffizienz + Ursachen: fehlende Anlage, Zerstörung durch + Hypophysentumor, + Anlagedefekt, Tumor, EntzünThyreoditis (Hashimoto-T. häufigste Ursache f. -trauma, HT), Tumor, extremer Jodmangel, postoperativ, dung, idiopathisch entzündung, idiopathisch nach Radiojodtherapie, Überdosierung von Thyreostatika und Lithium, genetische Defekte d. SDHormonsynthese + Autoimmunthyreoditis: durch aktivierte T-Zellen, Autoimmunantikörper, erbliche Disposition + verminderte Wärmeproduktion, Störungen d. Fett- und Eiweißstoffwechsels, der Muskelkontraktion und der Herzfrequenz +beim Kind gestörte Gehirn- und Skelettentwicklung + Müdigkeit, Psychose, Obstipation, Zyklusstörungen & Impotenz, Muskelkrämpfe, verlangsamte Reflexe, Gewichtszunahme, Karpaltunnelsyndrom, Bradykardie, Myxödem, Frieren, allg. Schwäche + Myxödem-Koma: durch Überanstrengung, schwerer Infekt, Auskühlung Æ Somnolenz, Koma, Untertemperatur, respiratorische Azidose, Hyponatriämie, Hypochlorämie, gel. Hypoglykämie Æ Volumensubstitution, L-Thyroxin i.v., Glukokortikoide i.v., evtl. Betablocker + TSH-Screening beim Neugeborenen + Bildgebung Hypo+ TRH, TSH, T3, + Labor: erhöhtes Basal-TSH, erniedrigte periphere physe T4 niedrig SD- Hormone, hypochrome Anämie, BSG erhöht, +TRH-Test (kein + Anstieg d. SDAnstieg) Hormone bei TRHHypercholesterinämie, CK erhöht Gabe + Sono: durchgemachte Entzündungen stellen sich + TSH & T3, T4 niedrig, TRH hoch als echoarm dar + SD-Antikörper: wenn positiv, gel. auch andere Endokrinopathien (Diabetes mellitus, Morbus Addison) + langsam gesteigerte Hormonsubstitution (sonst pektanginöse Beschwerden), v.a. ältere Menschen (+ niedrigere Dosen) Schilddrüsenknoten: Epidemiologie: 20-30% d. Erwachsenen knotige Veränderungen der SD Klassifikation: benigne: Kolloidknoten, follikuläres Adenom, Zyste, Hashimoto-Thyreoditis, De-QuervainThyreoditis maligne: Karzinome mit C-Zell-Differenzierung (medullär, gemischt C-Zell-follikulär), Karzinome mit Follikeldifferenzierung (follikulär, papillär, anaplastisch, gering differenziert), Lymphom, Metastasen, anderes SD-Karzinom Klinik: asymptomatisch, mit SD-Symptomatik, mechanische Kompression diagnostische Möglichkeiten: Untersuchung: Anamnese, Inspektion, Palpation (Verschieblichkeit, LKSchwellungen), Labor (TSH (wichtigster Screeningparameter Funktionsstörung), FT3, FT4, Calcitonin (Parameter f. medulläres SD-Carcinom), SD-Antikörper (TPOÆHashimoto-T., TRAKÆMb. Basedow)), Bildgebung (CT, Sonographie, MRT), funktionelle Bildgebung (Szintigraphie), Histologie (Feinnadelbiopsie), zukünftig: Molekularbiologie (Genexpressionsmuster) Anamnese: Erstauftreten, Progression, Qualität d. Beschwerden, familiäres Auftreten von SD-Erkrankungen, andere Therapien (Bestrahlung, Medikamente) Sonographie: 7,5-12 MHz-Schallkopf, Beurteilung v. Volumen (f. beide Lappen getrennt), Parenchymstruktur, Knoten (Anzahl, Lage, Größe, Morphologie, Echomuster, Kalzifikationen), Hals-LK Æ Aussagen zur Dignität selten sicher möglich www.leipzig-medizin.de - Seite 5 von 11 Szintigraphie: Untersuchung m. 99mTc o. 123I zur Unterscheidung hypo-, normo- und hyperfunktionelle Knoten; Auflösungsgrenze ca. 10mm, geringer prädiktiver Wert zum Malignomnachweis, bei Nachweis einer Autonomie hilfreich f. therapeutische Konsequenzen (vermeidung v. Jodexzess, Indikation zur Abtragung) Feinnadelaspirationszytologie: wichtigstes Verfahren zur Dignitätsbeurteilung, minimale Größe von 10mm empfohlen, bei nicht palpablem Knoten Sonographische Kontrolle, Gewinnen eines aussagekräftigen Aspirats durch fächerförmiges Punktieren verschiedener Knotenareale Therapie: abhängig von Dignität d. SD-Knotens: euthyreoter SD-Knoten: OP-Indikation bei mechanischer Beeinträüchtigung, Malignomverdacht, Angst d. Patienten vor maligner Entartung o. kosmetischer Störung; medikamentöse Behandlung mit Jodid und Levothyroxin möglich SD-Malignome: Therapieziel ist vollständige Abtragung d. Malignoms, meist mit anschließender Radioiodtherapie, danach Substitutionstherapie (Euthyreose, TSH-Suppression); bei medullärem SD-Karzinom molekulargenetische Untersuchung und Abklärung weiterer endokriner Neoplasien Verlaufskontrollen: v.a. Labor- und Sonographiegestützt, Intervalle und Vorgehen je nach Befund Akromegalie: 3-4 Neuerkrankungen pro Mio. Einwohner und Jahr Hyposhysenadenom m. Hypersekretion v. Somatotropin und IGF-1 (sekundär) Æ Wachstum v. Organen, Knochen, Weichteilen (v.a. Kopf, Hände, Füße), Stoffwechselstörungen (Diabetes mellitus) - normalerweise: GHRH und Hypoglykämie wirken stimulierend auf GH, Somatostatin und Blutzuckeranstieg hemmend; GH stimuliert Proteinsynthese, Fettsäurefreisetzung, IGF-1-Bildung (haupts. Leber) - häufigste Symptome: Hyperhidrose, Parästhesien an Händen (Karpaltunnelsyndrom) und Füßen, Kopfschmerzen, Müdigkeit, Arthralgien, Libidoverlust, Impotenz, Amennorhoe, Hypertonie, Schlafapnoe (durch Makroglossie) - bei Akromegalie vor Schluss d. Epiphysenfugen entsteht Gigantismus (Riesenwuchs mit akromegalen Zügen) - nach Pubertät Reaktivierung des enchondralen und periostalen Wachstums, Gelenkveränderungen durch Knorpelwachstum, Splanchnomegalie, Vergrößerung von Händen und Füßen, Vergröberung der Gesichtszüge - häufig Hyperprolaktinämie Æ Galaktorrhoe - Drucksymptome an Hirnnerven (z.B. Gesichtsfeldausfälle) - Diagnostik: Labor: IGF-1 erhöht, GH-Bestimmung nur unter Glukose-Suppressionsversuch; neuroradiologischer Adenomnachweis (MRT; ektope GH und GHRH-Sekretion extrem selten) - DD: MEN-1-Syndrom, Akromegaloid (konstitutionelle Eigenart des Phänotyps) - Therapie: Operation (transnasal-transsphenoidal, Erhaltung normaler Hypophysenfunktion), Bestrahlung (Röntgen o. Protonen, Wirkung erst nach Monaten bis Jahren), Medikation (Dopaminagonisten, Octreotid [Somatostatinanalogon]) Æ mehrfache i.m.-Injektion am Tag nötig, Pegvisomant (GH-Rezeptorantagonist)) - verminderte Lebenserwartung, frühzeitige Therapie anzustreben, Nachsorge Prolaktinom Epidemiologie: Inzidenz: 6 pro 100.000 Einwohner Prolaktin-produzierendes Adenom des HVL, unklare Mutation, Altersgipfel zw. 30. und 40. LJ, in 20% d. Fälle MEN-I-assoziiert Klassifikation: Mikroadenom (in 10% d. Fälle zu Lebzeiten nicht entdeckt, Frauen 20mal häufiger als Männer, geringe Wachstumstendenz), Makroadenom (Frauen und Männer gleich häufig, oft Wachstumstendenz) Klinik: + Galaktorrhoe, Suppresion der Gonadotropinsekretion Æ verminderte Sexualhormone Æ Libido- und Potenzverlust, Oligo- bis Aspermie (Männer); Oligomenorrhoe, Amenorrhoe, Menorrhagie (Frauen); Osteoporose + Druck der Makroadenome auf Chiasma opticum Æ Sehfeldstörungen; Kopfschmerz, Hypophyseninsuffizienz Diagnostik: +Frauen früher als Männer durch Zyklusstörungen erkannt, bei Männern bei Erstdiagnose oft schon Gesichtsfeldeinschränkungen + Labor: Prolaktin stark erhöht (normal: 2-15ng/ml); Bildgebung: MRT (Sicherung & Größenbestimmung Adenom) DD: andere Hypophysenadenome (Unterbinden den Transport von Prolaktininhibierendem Dopamin), Hypothyreose, chron. Niereninsuffizienz, Leberzirrhose, Medikamente (Dopaminantagonisten (Metoclopramid, Phenothiazine), Antidepressiva, Neuroleptika, H2-Blocker, Reserpin,Verapamil, Opiate), Schwangerschaft, Laktation, Stress, Schlaf Therapie: Dopaminagonisten (z.B. Bromocriptin, Cabergolin), nur bei nichtansprechen d. Therapie o. Größenzunahme transnasale-transsphenoidale Resektion, Bestrahlung Hormon-inaktive Hypophysentumoren >25% d. hypophysären Adenome, sezernieren häufig Untereinheiten d. Glykoproteine (FSH, LH, TSH) - Erkennung erst durch lokale Tumorwirkung (Gesichtsfeldeinschränkungen, sekundäre Hyperprolaktinämie [siehe DD Prolaktimom]) www.leipzig-medizin.de - Seite 6 von 11 - Diagnostik: Bestimmung aller Hypophysenhormone z. A. sezernierendes Adenom (häufig Pseudoprolaktinom), Bestimmung periphere Hormone (Cortisol, T3, T4, Testosteron, Östradiol, IGF-1) z. A. Insuffizienz durch Druck Makroadenom; Perimetrie, CT, MRT - Therapie: medikamentöse Therapie nicht ausreichend (außer Substitutionen), OP, häufige Rezidivrate, dann Bestrahlung Phäochromozytom (PZ) = Überfunktion d. chromaffinen Gewebes d. Nebennierenmarks (NNM) Æ Katecholaminproduktion; 90% intraadrenal, 10% extradrenal (Ganglien d. sympathischen Nervensystems) Inzidenz: 1-2/100.000; ca. 0,2 % d. Hypertoniker - Teil d. MEN-II-Syndroms (zus. m. medullärem SD-Karzinom & primärem Hyperparathyroidismu), von-HippelLindau-Syndrom, Neurofibromatose Typ 1, familiäres Paragangliom; ca. 10% d. PZ maligne; famil. Häufung Pathogenese: 1/3 d. Pat. Adrenalinexzeß Æ Tachykardien, 2/3 d. Pat. Adrenalin- & Noradrenalinexzeß Æ Hypertonus, Tachykardien; malignes PZ bildet vermehrt Dopamin Æ kardiale Dekompensation Klinik: Schweißausbrüche, dauerhafter oder paroxysmaler Hypertonus (Spitzen bis zu 300mmHg), Kopfschmerzen, Palpitationen, Nervosität, Tremor, Gewichtsverlust, Tachykardie Diagnostik: Verdacht bei: schwerer Retinopathie bei neu diagnostiziertem Hypertonus, therapierefraktärem Hypertonus Labor: Bestimmung d. Katecholamine im 24-h-Urin, Normetanephrin und Metanephrin im Plasma, Clonidin (zentraler alpha-2-Agonist)-Suppressionstest Æ Abfall um mehr als 50% d. bereits Anfangs erhöhten Katecholaminwerte, molekulargenetische Abklärung; Bildgebung: MRT und CT d. Nebenniere, bei malignem PZ Octreotid-Szintigraphie - Abklärung familiäre Erkrankungen: z.B. Neurofibromatose-1 (Café-au-lait-Flecken, stammbetonte Neurofibrome…) Therapie: benignes PZ: laparoskopisch, möglichst unter Erhalt d. Organfunktion, vorher medikamentöse Therapie mit α-Blockern (Phenoxybenzamin, Prazosin, Doxazosin); malignes PZ: nuklearmedizinisch (131I-MIBG) Conn-Syndrom/ primärer Hyperaldosteronismus (PHA) Hyperaldosteronismus = vom Renin-Angiotensin-System partiell oder vollständig unabhängige Aldosteronsekretion Æ erhöhte Na-Rückresorption (ENaC, Na-K-ATPase) Æ Kaliurie, vermehrte Wasseransammlung im Intra- und Extrazellularraum Æ Hypertonie Epidemiologie: hypokaliämische Variante: 0,5-2% d. Hypertoniepatienten, 75% Aldosteronproduzierendes Adenom d. NNR, 25% idiopathische Hyperplasie, normokaliämische Variante: 8% d. Hyertoniepat., 75% bilaterale Hyperplasie, 25% Adenom Æ 10% d. Hypertoniepatienten betroffen! Pathogenese: Klinik: Hypertonie ÆSpätfolgen d. Hypertonus (kardio- & zerebrovaskuläre Ereignisse), linksventrikuläre Hyperplasie… Labor: Hypokaliämie, Hypernatriämie, Hyporeninämie Diagnostik: Screening durch Feststellung des Aldosteron-Renin-Verhältnisses bei Hypertonikern mit schwerem, schlecht einstellbarem Hypertonus, spontaner Hypokaliämie, junge Hypertoniepat., Pat. mit unverhältnismäßig ausgeprägten Organschäden (vor Bestiimung wenn mgl. Umstellung/Absetzen d. Medikation) Diagnosesicherung durch Fludrocortison-Suppressionstest Æ keine Aldosteronsuppression bei PHA-Pat. (cave: Überwachung wg. Hypokaliämien, hypertensiven Krisen), Kochsalzbelastungstest (Suppression v. Aldosteron), außerdem: Captopriltest und oraler Kochsalzbelastungstest, Unterscheidung Adenom/bilaterale Hyperplasie: Orthostasetest (Adenom: kein/kaum Aldosteronanstieg – bilaterale Hyperplasie: Aldosteronanstieg >30%) ; CT/MRT NNR; Katheterisieren der Nebennierenvenen unter Durchleuchtung Æ Bestimmung des Aldosteron/Kortisol-Quotienten Æ >3 Adenom, <3 Hyperplasie Therapie: Salzrestriktion; OP: bei Adenom. unilaterale Adrenektomie Æ wenn Hypoaldosteronismus nach OP Æ Substitution m. Fludrocortison Medikamente: bei Hyperplasie. Mineralkortikoidantagonisten (Spironolacton, Eplerenon), Kaliumsparende Diuretika (Amilorid, Triamteren) Î während jeder Therapie engmaschige Kontrolle v. Elektrolyten, Kreatinin und RR Adipositas =über das Normalmaß hinausgehende Körperfettvermehrung, ab BMI>30 (Übergewicht ab BMI>25) Epidemiologie: Prävalenz: 60% d. Erwachsenen übergewichtig o. adipös, steigende Prävalenz bei Kindern und Jugendlichen Pathogenese: Kalorienaufnahme höher als –verbrauch (häufigste Ursache); Endokrinopathien (Mb. Cushing, Hypothyreose…), Medikamente (durch Steigerung des Appetits oder Drosselung des Antriebs, Förderung von Lipogenese: trizyklische Antidepressiva, atypische Neuroleptika, Glukokortikoide, Insulin…); seltene genetische Erkrankungen (z.B. primäre zentrale Leptinresistenz) www.leipzig-medizin.de - Seite 7 von 11 Klassifikation: Normalgewicht Übergewicht (Präadipositas) Adipositas Grad I Adipositas Grad II Adipositas permagna BMI in kg/m² 18,5-24,9 25-29,9 30-34,9 35-39,9 >40 Klinik: Dyspnoe, schnelle Ermüdbarkeit, Intertrigo, Striae, Hyperhidrose, erhöhtes Risiko für KHK, Kolon-, Prostata- und Mammacarcinom, Diabetes mellitus, Thrombembolien, Apoplex, Frauen: Hyperandrogenismus (Hirsuitismus, sek. Amenorrhoe, Akne), Arthropathien Diagnostik: Erfassung d. Fettverteilungsmusters, Ausschluss Endokrinopathien, Erfassung risikorelevanter Parameter (RR, Lipide, BZ…) Therapie: konservativ: Motivation und Anleitung d. Patienten zur Gewichtsreduktion durch Ernährungsberatung (kalorienreduzierte, ballaststoffreiche Mischkost) & Bewegungssteigerung; medikamentöse Therapie: Orlistat (Lipasehemmer), Rimonabant (CB1-Blocker, erhöht Adiponektin), Sibutramin; bei BMI>40 evtl. operative Therapie (Magenband, Magenbypass) metabolisches Syndrom = Symptom-/Risikofaktorkomplex, keine Diagnose! (WHO 1998) - verringerte Glukosetoleranz durch Insulinresistenz, hohe Plasmatriglyceride (>150mg/dl), niedriges HDL (♀>50mg/dl, ♂>40mg/dl), essentielle Hypertonie (>130/85), abdominale Fettsucht (Taillenumfang, Waist-to-HipRatio) Æ erhöhtes Herz-Kreislaufrisiko (ab mehr als 3 d. 5 Kriterien) Fettgewebe als endokrine Drüse - v.a. abdominelles Fettgewebe m. Entstehung metabolisches Syndrom assoziiert; Fettverteilungsmuster abhängig von Alter, Geschlecht, Bewegungsgewohnheiten, Gesamtkörperfettmasse, genetischen Faktoren - Sekretion verschiedener Adipokine (=alle vom Fettgewebe sezernierten Stoffe) - Adiponektin: antiproliferativ, antiinflammatorisch, insulinsensitivierend, antidiabetisch, antiartherogen, Senkung des Herzinfarktrisikos, negative Korrelation mit Menge des Fettgewebes - Leptin (“Sättigungshormon”, Wirkung im Hypothalamus: Sättigung, Energieumsatzsteigerung; bei adipösen Personen Leptinrestistenz) Æ erhöhter Leptinspiegel Risikofaktor für Mamma-Ca - IL-6 (große Bedeutung für Insulinresistenz durch Hemmung der Bildung von Glukosetransportern, hemmt Lipogenese, fördert Lipolyse), IL-8, IL-10 TNF-α (reduziert Insulinwirkung über Hemmung der Phosphorylierung d. Insulinrezeptors, Beeinträchtigung der Bildung des Glukosetransportes GLUT4), CRP Æ chronische Inflammation, Erhöhung der Genese von Arteriosklerose - Resistin (Assoziation mit o.g. inflammatorischen Markern und Koronarverkalkung) - Angiotensinogen adipositasassoziierte Hypertonie - PAI-1 (Plasminogenaktivator-Inhibitor-1) als Risikofaktor für thromboembolische Komplikationen Æ Inhibitor der Fibrinolyse - IGF-I (Regulation von Proliferation, Apoptose und Differenzierung von Zellen) - 11β-HSD1 katalysiert die Umwandlung von Kortison und Kortisol - Steroidhormone durch P450-Aromatase-Aktivität des Fettgewebes erhöhte Östrogenkonzentration Æ Gynäkomastie beim Mann; verminderte SHBG (Sexualhormonbindendes Globulin)-Konzentration durch Hyperinsulinämie Æ mehr freie Östrogene und Androgene Æ Tumorerkrankungen, PCO - PCO-Syndrom: Leptin stimuliert LH-Sekretion Æ vermehrte LH-Freisetzung+Hyperinsulinämie Æ verstärkte Stimulation d. Theca interna Æ Induktion v. Zysten, Hyperandrogenämie Æ Hirsuitismus, Akne, Oligo- und Amenorrhoe bis hin zur Infertilität - Regulation immunologischer Prozesse Æ zahlreiche Stoffe, die nicht nur mit metabolischem Syndrom assoziiert sind, sondern auch mit Tumorerkrankungen Diabetes mellitus Typ 1 & 2 Epidemiologie Klassifikation Diabetes mellitus Typ 1 Inzidenz: 8-17/100.00, jährliche Steigerung um 3-4% Typ 1A (Autoimmun) Æ komplexes genetisches Geschehen, Verdacht der Triggerung durch Virusinfektion (evtl. Enteroviren) Æ Angriff d. Inselzellen durch humorale und zelluläre Abweht Typ 1B (idiopathisch, bisher nur in Japan beobachtet) Æ Ursache unklar (HbA1c Diabetes mellitus Typ 2 Prävalenz d. Diabetes insg.: 5%, davon 90-95% Typ-2- Diabetiker mono- (Mutation d. Insulinrezeptors, d. Glukokinasegens, v. Transkriptionsfaktorgenen…) und polygene Formen www.leipzig-medizin.de - Seite 8 von 11 Klinik Diagnostik Therapie Glukosetoleranztest Komplikationen Langzeitkomplikationen normal, Inselzellen atrophisch ohne Autoimmunreaktion) Zerstörung der B-Zellen Æ abnehmende Insulinsekretion Æ Hyperglykämie, Glucosurie, Aminoazidämie (durch gesteigerte Proteolyse), Ketoazidose (exzessive Lipolyse Æ viel Acetyl-CoA Æ Ketonkörper Initialsymptome: Polyurie, Polydipsie Æ Exsikkose Æ ischämische Abdominalschmerzen, Gewichtsverlust, Appetitlosigkeit, Ketoazidose (häufig bei Erstdiagnose) Æ 30% komatös o. stupurös Æ Kussmaul’sche Atmung, Aceton-Geruch, tlw. Fieber, Tachykardie, Hypotonie + disponierende Faktoren: Adipositas, bewegungsarmer Lebensstil + Insulinresistenz: gestörte Aufnahme und Verwertung im Muskelgewebe, Verminderte antilipolytische Wirkung im Fettgewebe Æ Dyslipidämie Æ Risikofaktor für KHK, gestörte Hemmung der Glycogenolyse und Gluconeogenese in der Leber Æ erhöhter NBZ + häufig jahrelang symptomlos und zufällig entdeckt, auch im Rahmen von Spätschäden (KHK) +Initialsymptome: Polyurie, Polydipsie, Gewichtsverlust trotz Polyphagie, Parästhesien, Sehstörungen, Pruritus, Furunkulose hoher BZ, hoher HbA1c, niedriges C- Glukose im Harn (fast immer beweisend, Peptid (im Harn), bei Ketoazidose pH & da sie erst ab sehr hohen BZ-Werten Bicarbonat erniedrigt, Antikörpernachweis auftritt), NBZ, postprandialer BZ, Glukosetoleranztest, HbA1c, C-Peptid (Bestimmung der Restfunktion d. Pankreas) im Plasma o. Harn Einstellung durch Insulintherapie, Einstel- nicht-medikamentös: Gewichtsreduktion, len des Blutzuckerwertes Æ HbA1c als körperliche Aktivität. Patientenschulung Langzeitparameter orale Antidiabetika: Metformin (Drosselung Insulintherapie: 1) Kombination aus Ba- d. hepatischen Glukosesekretion), Pioglisalisulin mit Insulin Boli schnell wirkenden tazon & Rosiglitazon (senken periphere Insulinresistenz), Sulfonylharnstoffe, ReInsulins zu den Mahlzeiten paglinid & Nateglinid (steigern die Insulin2) Insulinpumpe sekretion), Acarbose & Miglitol (hemmen immer: Patientenschulung! Kohlenhydratresorption) Insulintherapie: Anhebung des Basalinsulins, abendliche Gabe von Mischinsulin, verhinderung postprandialer Hyperglykämien durch Gabe von Insulinboli Diagnostische Kriterien 2h-OGTT: Werte Vollblut venös/kapillär in mmol/l: normale Glukosetoleranz: <6,7/<7,8 – gestörte Glukosetoleranz: 6,7-10,0/7,8-11,0 – Diabetes mellitus: >10,0/>11,0 Hyperglykämie mit Ketoazidose und Coma diabeticum (meist bei Diabetes mell. Typ 1, Entwicklung über Stunden, Mortalität ca. 5%), Exsikkose, Hypotonie, Tachykardie, Stupor Æ Beseitigung des Flüssigkeits- und Insulindefizits, Hypokaliämie oft durch Azidose verdeckt Æ Kaliumkomtrolle und ggf –substitution unter der Therapie nichtketotisches hyperosmolares Koma: vorwiegend bei Diabetes mell. Typ 2, Mortalität 15-50%! massive Hyperglykämie Æ hohe Osmolarität (350-400 mosmol/l) ohne Azidose/Acetonurie Æ sehr langsame Volumensubstitution, da Gefahr eines Hirnödems Hypoglykämisches Koma: schwere Hypoglykämie bei BZ Werten unter 40-50 mg/dl, Pat. handlungsunfähig; bei BZ-Werten <20mg/dl treten bereits nach 5 min irreversible ZNS-Schäden ein; Symptome: plötzliche Bewusstlosigkeit, Bewusstseinstrübung bis hin zum Koma, Therapie: Sicherung d. Vitalfunktionen, Glukosezufuhr (Richtwert: 0,5g Glukose/kg KG erhöhen den BZ um 100mg/dl) Æ mikrovaskuläre Komplikationen: Endothelzellen hyperglykämisch, da sie Glukoseeinstrom nicht drosseln können Æ Sauerstoffradikale Æ Verdickung der Basalmembran, Steigerung der Gefäßpermeabilität, verminderte NO-Freisetzung Æ gestörte Endothelfunktion, vermehrte Ansammlung von Plasmaproteinen an der Gefäßwand, Gefäßverschluss und Zellverlust (v.a. in Retina, Glomeruli u. Vasa nervorum d. peripheren Nerven) Æ Retinopathie: Frühstadium Hintergrundretinopathie: punktförmige Blutungen, Mikroaneurysmen durch stärker geschlängelte Venolen, dann strichförmige Blutungen m. harten Exsudaten (Fibrin-Lipid-Protein-Einlagerungen), dann Mikroinfarkte mit weichen Exsudaten („Cotton-Wool-Herde“) danach proliferative Retinopathie Neovaskularisationen aus ischämischen Netzhautarealen Æ Fibrosierungen, Netzhautablösungen, Glaukom Makulopathie: Makulaödem, Blutungen, harte Exsudate Æ Erblindung, kaum therapeut. Maßnahmen möglich, auch ohne proliferative Retinopathie Æ Neuropathie: vor allem durch o.g. mikrovaskuläre Prozesse, reversibel und irrever- www.leipzig-medizin.de - Seite 9 von 11 sibel Æ Demyelinisierungen, Axonverlust distale symmetrische Polyneuropathie: nacheinander Verlust der versch. Sensibilitäten an Füßen & (seltener) Händen Æ Komplikation: Läsionen der Füße (gefördert durch Mikroangiopathien) werden nicht rechtzeitig bemerkt Æ diabetisches Fußsyndrom Æ Fußpflege! akute schmerzhafte Neuropathie, chronische schmerzhafte Neuropathie, Mononeuropathie, proximale motorische Neuropathie, autonome Neuropathie Æ diabetische Nephropathie (diabet. Glomerulosklerose): wie bei anderen Angiopathien, Bildung von AGES (Advanced Glycation End-Products); initiale Hyperfiltration durch Steigerung d. Reninaktivität Æ erhöhtes Skleroserisiko Histologie: verdickte Basalmembran, Expansion mesangiale Matrix Æ sklerotische Knoten Klinik/Diagnostik: zunächst Mikroalbuminurie & Hypertonie, dann Abnahme der GFR, Proteinurie, bestehender Hypertonus bis hin zur terminalen Niereninsuffizienz Therapie: Prophylaxe durch optimale Diabeteseinstellung; im Frühstadium Gabe v. ACE-Hemmern o. AT1-Rezeptorblockern zur Senkung d. glomerulären Hypertonie; später können Dialyse und Nierentransplantation nötig werden Æ makrovaskuläre Komplikationen: beschleunigte Artherosklerose durch Endothelschädigung Æ chemotaktischer Faktor für Monozyten, Expression v. Adhäsionmolekülen, verstärkte Permeabilität für Plasmafaktoren (z.B. Lipoproteine) Æ thrombogenes Atherom entsteht durch LDL-phagozytierende Monozyten subendothelial (+ Stimulation d. Wachstums Extrazellulärmatrix) Æ Zusammenspiel v. Dyslipidämie & gestörter Endothelfunktion Æ KHK, pAVK Æ Infektionen: Schwächung d. Immunsystems (v.a. zelluläre Immunantwort) Æ etwas anfälliger f. Infektionen, v.a. aber schwererer Verlauf Endokrine Komata/Notfälle Diabetes: Coma diabeticum, nichtketotisches hyperosmolares Koma, hypoglykämisches Koma s. o. Schilddrüse: Myxödemkoma, thyreotoxische Krise s.o. Hyperkalzämische Krise: meist als Folge d. paraneoplastischen Syndroms (v.a. Plasmozytom, Mamma-Ca & nichtkleinzelliges Bronchial-Ca), primärer Hyperparathyreoidismus, chron. Niereninsuffizienz; Symptome: Adynamie, Muskelschwäche, initial Polyurie & Polydipsie, später Exsikkose & Anurie, Bewusstseinseinschränkungen bis hin zum Koma, Übelkeit, Erbrechen, Arrhythmie, Tachykardie, Oberbauchschmerzen Therapie: Sicherung der Vitalfunktionen, Rehydratation, forcierte Diurese, evtl. Hämodialyse, Kalziumkarenz, Therapie d. jeweiligen Ursache (Bisphosphonate bei Tumor, Glukokortikoide bei Sarkoidose, Plasmozytom & Vitamin-D-Intoxikation) Hypokalzämie: gesteigerte neuromuskuläre Erregbarkeit (Krämpfe) Ursachen: Hypoparathyreoidismus, Störungen des Vitamin-D-Haushalts, Hypomagnesiämie, Hyperphosphatämie, vermehrte Kalziumbildung Symptome: Hand- und Fußspasmen (Pfötchenstellung, Kribbelparästhesien (z.B. um den Mund herum)) bis hin zu generalisierten Krämpfen Therapie: Kalziumglukonat o. –chlorid, ggf. Sedierung Addisonkrise: s.o. Osteoporose =Skeletterkrankung, gekennzeichnet durch verminderte Belastbarkeit und erhöhtes Frakturrisiko Epidemiologie: weltweit häufigste Skeletterkrankung, Prävalenz: 12% d. Männer und Frauen zw. 50 u. 79 Jahren Klassifikation: idiopathische juvenile O. (Kinder zw. 8. und 14. LJ), postmenopausale O. (Frauen zw. 51 & 75 J., ca 30% d. Frauen), Altersosteoporose (>75 J., wg. verminderter Mobilität, unzureichende Kalziumzufuhr, eingeschränkter Vitamin-D-Metabolismus, milder Hyperparathyreoidismus) + auch: Einteilung nach T-Score der Knochendichtemessung (Schweregrad) + nicht-generalisierte, lokale Osteoporoseformen (Inaktivitätsosteoporose, Algodystrophie, periprothetische Osteopenie) Pathogenese: Missverhältnis zwischen Knochenbildung & -resorption Æ negative Bilanz Æ Struktur- und Materialverlust Æ reduzierte mechanische Belastbarkeit (Æ Frakturanfälligkeit); Ursachen: Östrogenmangel nach Menopause, Inaktivität, Medikamente (Glukokortikoide, Schilddrüsenhormone, Lithium…); sekundäre Osteoporose z.B. durch Endokrinopathien (Hyperthyreose, Diabetes mellitus…), neoplastische Knochenerkrankungen, chronisch-entzündliche Erkrankungen, chron. Erkrankungen von Niere, Lunge, Leber und Gastrointestinaltrakt etc. Klinik: Abnahme der Körpergröße, Kyphosierung der Brustwirbelsäule bis hin zur Berührung RippenbogenBeckenkamm Æ leichte Vorwölbung d. Bauches, Tannenbaumphänomen: Falten vom Rücken zu den Flanken, Gangunsicherheit, Atemnot durch Einenung Diagnostik: Knochendichtemessung, im Röntgenbild fällt osteopenische Knochenstruktur auf (erst ab Verlust v. 30% d. Knochenmaterials), im fortgeschrittenen Stadium Wirbelkörperfrakturen; Labor: Kalzium, anorganisches Phosphat, AP www.leipzig-medizin.de - Seite 10 von 11 Therapie: Kalzium- und Vitamin-D-Substitution, antiresorptive Therapie (Bisphosphonate, Raloxifen), osteoanable Therapie (Teriparatid, Strontium), Schmerztherapie, Physiotherapie; Prophylaxe: Sturzprophylaxe, Mobilisierung, Nikotin- und Alkoholkarenz… Hyperparathyreoidismus Definition Pathogenese Klinik DD Diagnostik Therapie primärer H. autonome Parathormonsekretion Æ Calciumresorption im Darm, Calciummobilisierung im Knochen und Calciumrückresorption in der Niere gesteigert Æ Hyperkalzämie meist solitäres (80%), selten multiples (5%) Adenom, Hyperplasie (15%), sehr selten Karzinom meist klinisch asymptomatische Hyperkalzämie, nach langer Zeit „Stein (Nephrolithiasis)-, Bein (Knochenschmerzen)-, und Magenpein (peptische Gastroduodenalulzera)“, Übelkeit, Erbrechen, Inappetenz, Polyurie, Polydipsie, QT-Verkürzung, Depression, Osteopenie hyperkalzämische Krise: s. o. 60% d. Hyperkalzämien sind Tumorbedingt (paraneoplastisch durch PTHrPSekretion oder osteolytisch), andere Ursachen f. Hyperkalzämie: Immobilisation, Vitamin D-Intoxikation, Hyperthyreose, Medikamente (Thiazide, Lithium), FHH (familiäre hypokalziurische Hyperkalzämie) Labor: Gesamtkalzium, ionisiertes Kalzium, intaktes Parathormon, Parathormon-related Peptide (PTHrP), Vit. D3, knochenspezif. AP, Kreatinin Bildgebung: evtl. Sonographie, Szintigraphie in schweren Fällen OP: Exstirpation Adenom bzw. bei Hyperplasie alle E.körperchen, Reimplantation eines (halben) E. in den M. brachioradialis (leichtere Erreichbarkeit bei Rezidiv), evtl. Konservierung d. übrigen E. Æ Möglichkeit der Reimplantation bei postoperativem Hypoparathyreoidismus in leichten Fällen konservative Behandlung: Motivation zur körperlichen Aktivität, Vitamin-D und Kalziumzufuhr vermindern, regelmäßige Kontrollen, evtl. Einsatz v. Bisphosphonaten, ÖstrogenGestagen-Präparate bei postmenopausalen Frauen sekundärer H. erhöhte Parathormonproduktion aufgrund Hypokalzämie Æ kompensatorische Epithelkörperchenhyperplasie Hypokalzämien z.B. durch Niereninsuffizienz, Malabsorption, verminderte Sonnenlichtexposition, Leberzirrhose… tertiärer H. persistierende vermehrte Parathormonsekretion nach sekundärem Hyperparathyreoidismus Hyperplasie d. Epithelkörperchen bei sek. H. bleibt nach Kalziumnormalisierung bestehen Therapie d. Ursache: Vitamin-D-Substitution, Phosphatrestriktion… evtl. chirurgisch www.leipzig-medizin.de - Seite 11 von 11











