Klausur 03 - Technische Universität Braunschweig
Werbung
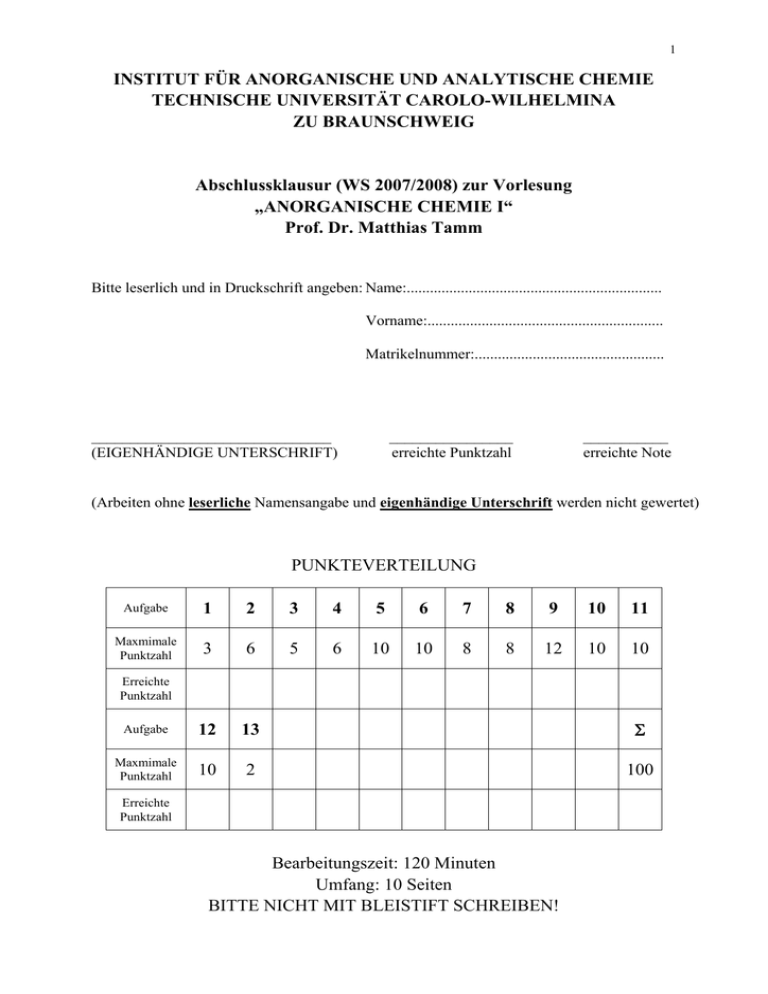
1 INSTITUT FÜR ANORGANISCHE UND ANALYTISCHE CHEMIE TECHNISCHE UNIVERSITÄT CAROLO-WILHELMINA ZU BRAUNSCHWEIG Abschlussklausur (WS 2007/2008) zur Vorlesung „ANORGANISCHE CHEMIE I“ Prof. Dr. Matthias Tamm Bitte leserlich und in Druckschrift angeben: Name:.................................................................. Vorname:............................................................. Matrikelnummer:................................................. _______________________________ (EIGENHÄNDIGE UNTERSCHRIFT) ________________ erreichte Punktzahl ___________ erreichte Note (Arbeiten ohne leserliche Namensangabe und eigenhändige Unterschrift werden nicht gewertet) PUNKTEVERTEILUNG Aufgabe 1 2 3 4 5 6 7 8 9 10 11 Maxmimale Punktzahl 3 6 5 6 10 10 8 8 12 10 10 Aufgabe 12 13 Σ Maxmimale Punktzahl 10 2 100 Erreichte Punktzahl Erreichte Punktzahl Bearbeitungszeit: 120 Minuten Umfang: 10 Seiten BITTE NICHT MIT BLEISTIFT SCHREIBEN! 2 1. Das Element Sauerstoff bildet drei Isotope mit acht, neun und zehn Neutronen. Geben Sie für jedes Isotop das vollständige Elementsymbol inklusive Massen- und Ordnungszahl an! 2. Geben Sie Bruttogleichungen für die folgenden Reaktionen an: a) Elektrolyse von Wasser; b) Elektrolyse von geschmolzenem Lithiumhydrid; c) die Reaktion von Calciumhydrid mit Wasser; d) die Verbrennung von Wasserstoff; e) die Reaktion von Magnesium mit verdünnter Salpetersäure f) die Reaktion von Wasserstoff mit CuO. 3. Skizzieren Sie jeweils ein MO-Diagramm für das Diwasserstoff-Molekülkation (H2+) und für das Diwasserstoff-Molekülanion (H2⎯)! Skizzieren Sie jeweils das einfach besetzte Molekülorbital (SOMO)! Welche Bindungsordnung ergibt sich jeweils? 3 4. Wenn man vom radioaktiven Radon absieht, sollte man für das Element Xenon die reichhaltigste Edelgaschemie erwarten. Warum? Cäsiumoctafluoroxenat, Cs2[XeF8], ist eine der thermodynamisch stabilsten Edelgasverbindungen. Geben Sie durch Reaktionsgleichungen eine Synthese aus den Elementen an! Welche Struktur besitzt das Anion in dieser Verbindung? Ist diese Struktur im Einklang mit der VSEPR-Theorie? 5. Xenontetrafluorid hydrolysiert bei der Reaktion mit Wasser unter Disproportionierung. Dabei wird u. a. Xenontrioxid gebildet. Formulieren Sie eine Gleichung für diese Reaktion! Xenontrioxid kann in alkalischer Lösung mit dem starken Oxidationsmittel Ozon in Perxenate überführt werden. Durch Zugabe konzentrierter Schwefelsäure kann das gasförmige Anhydrid Xenontetraoxid gewonnen werden. Formulieren Sie die entsprechenden Reaktionsgleichungen und geben Sie für alle auftretenden Xenon-Sauerstoffverbindungen Lewis-Formeln und die jeweilige Oxidationszahl des Xenons an! 4 6. Die unten stehende Abbildung zeigt die Kristallstruktur des Iod-Charge-TransferKomplexes mit Trimethylamin, N(CH3)3. Der Iod-Iod-Abstand beträgt 283 pm (vgl. 272 pm im elementaren Iod), der N-I-Abstand 227 pm. Erläutern Sie die Bindungsverhältnisse und die lineare Geometrie des Komplexes unter Verwendung geeigneter Molekülorbitale! Vergleichen Sie die Lage der Absorptionsbande des Iod-Amin-Komplexes mit derjenigen des elementaren Iods und erklären Sie die relative Lage! Gibt man Kaliumiodid zu einer wässrigen Iodlösung, so bildet sich u. a. das TriiodidAnion. Geben Sie eine Lewis-Formel für dieses Anion an! Skizzieren Sie ein qualitatives MO-Diagramm für die Bindung in diesem Anion und zeichnen Sie die resultierenden Molekülorbitale! Welche Bindungsordnung ergibt sich? 5 7. Sagen Sie die Strukturen der folgenden Verbindungen voraus: a) ICl4⎯ b) BrF2+ c) ClF4+ d) IF7 e) IF6+ f) BrF5 Wie würden Sie ausgehend von IF3 eine Verbindung mit pentagonal-planarer Struktur synthetisieren? Geben Sie eine entsprechende Reaktionsgleichung an! 8. Singulett-Sauerstoff kann durch Reaktion von Natriumhypochlorit mit Wasserstoffperoxid erhalten werden. Formulieren Sie eine entsprechende Reaktionsgleichung und geben Sie für alle beteiligten Reaktionspartner die jeweiligen Oxidationszahlen an! Singulett-Sauerstoff emittiert bei der Umwandlung in Triplett-Sauerstoff rotes Licht mit einem Absorptionsmaximum bei ca. 650 nm, was einer Energie von ca. 184 kJ mol-1 entspricht. Die Energiedifferenz zwischen Triplett- und Singulett-Sauerstoff beträgt aber nur 92 kJ/mol-1. Klären Sie diesen vermeintlichen Widerspruch ausführlich, auch unter Berücksichtigung bindungstheoretischer Aspekte, auf! 6 9. Vergleichen Sie einige Eigenschaften von Wasser und Schwefelwasserstoff (Strukturen, physikalische Eigenschaften) und erklären Sie die Unterschiede! Beschreiben Sie die Bindungsverhältnisse im Wassermolekül durch ein qualitatives MODiagramm! Hinweis: Für die Punktgruppe C2v (gewinkelt) treten die Symmetrierassen a1, b1 und b2 auf. Zeichnen Sie alle besetzten Molekülorbitale! Zeichnen Sie die Strukturen der Oxonium-Ionen [H3O]+ und [H5O2]+! 7 10. Geben Sie eine Lewis-Formel für das Hydrazin-Molekül (Diazan) an! Welche Gründe können für die relative Schwäche der N-N-Bindung angeführt werden? Natriumazid lässt sich u. a. durch eine Komproportionierungsreaktion aus Hydrazin und Natriumnitrit synthetisieren. Formulieren Sie eine Reaktionsgleichung unter Angabe der jeweiligen Stickstoff-Oxidationszahlen! Durch Reaktion von Nitrosylchlorid (NOCl) mit Natriumazid lässt sich eine Verbindung der Zusammensetzung N4O isolieren. Formulieren Sie die Reaktionsgleichung und geben Sie Lewis-Formeln sowohl für einen kovalenten als auch einen ionischen Aufbau der Verbindung an! Wie könnte ein entsprechendes P4O-Molekül synthetisiert werden und welche Struktur könnte es besitzen? 8 11. Silicium kristallisiert im kubischen Diamantgitter. Zur Erinnerung: Die kubische Diamantstruktur ist stark verwandt mit der Zinkblende-Struktur (ZnS). Skizzieren Sie unter Verwendung des unten stehenden Hilfspolyeders die Elementarzelle des Siliciums! Welche Koordinationszahl erreicht jedes Siliciumatom? Erläutern Sie unter Diskussion der Bindungsverhältnisse, warum Silicium keine graphitanaloge Struktur bildet! Vergleichen Sie Calciumcarbid, CaC2, und Calciumsilicid, CaSi2. Diskutieren Sie die Ladung, die Bindungsverhältnisse und die Strukturen der jeweiligen Anionen! 9 12. Erklären Sie die unterschiedlichen Eigenschaften von Kohlenstoffdioxid und Siliciumdioxid unter Diskussion der jeweiligen Bindungsverhältnisse und Strukturen mit Hilfe der VB-Theorie! Siliciumdioxid ist das Anhydrid verschiedener Kieselsäuren, von denen sich die entsprechenden Silicate ableiten. Geben Sie für die folgenden Silicate jeweils die korrekte Ladung des Anions an und zeichnen Sie eine Lewis-Formel für das jeweilige Anion bzw. einen Ausschnitt aus der jeweiligen Anionenstruktur! a) Thortveitit, Sc2(Si2O7) b)Spodumen, LiAl(Si2O6) Hinweis: Wenn Sie die wahrscheinliche Ladung des Scandiums ermitteln wollen, genügt ein Blick ins beigefügte Periodensystem. Zeichnen Sie mit Hilfe einer Lewis-Formel einen allgemeinen Ausschnitt aus der Struktur von Siliconen! Wie kann man die Stärke der Si-O-Bindungen erklären? 10 13. Wer hat wofür im Jahre 2007 den Nobelpreis für Chemie erhalten? Just a little help: