Medizinische Muschelproteine
Werbung

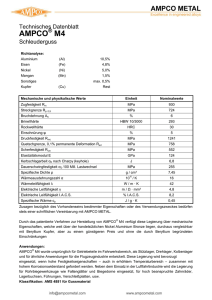
Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Medizinische Muschelproteine In der Natur ist Kleben die dominierende Fügetechnik. Die Bioadhäsion von Molekülen bildet die Basis bei der Entstehung aller Lebewesen. Es führt weiter bis zu makroskopischen Klebstoffen tierischen Ursprungs, die in ihrer Funktion und Form unseren Klebverbindungen ähneln. Die Medizintechnik will solche Verbindungen nachahmen. Der Natur nachempfundene Klebstoffe helfen heilen Klaus Rischka* und Ingo Grunwald, Bremen Klebstoffe sind empfindlich gegenüber Wasser. In der Natur ist die Anwesenheit von Wasser in lebenden Systemen der Normalfall und die Probleme sind seit Jahrmillionen gelöst. Die zugrundeliegenden Mechanismen zeigt das Beispiel der Miesmuschel Mytilus edulis, deren Klebstoff gut erforscht ist. Daraus lassen sich Erkenntnisse für neue medizinisch-biomimetische, also die Natur nachahmende Klebstoffe gewinnen. Medizinische Klebstoff Stand der Technik Gängige Techniken zur Fixierung von Weichgeweben in der Medizin sind Klammern und Nähen. Bei der cardiovaskularen Chirurgie und bei Eingriffen an Organen ist Kleben die bessere Technik. Es gibt derzeit drei chemische Klassen medizinischer Klebstoffe: Cyanacrylate, Fibrin- und Gelatine-basierende Formulierungen. Cyanacrylat-basierende Klebstoffe bestehen aus Octyloder Butyl-2-cyanoacrylat (Abb. 1). Ersteres bildet stabilere, biegsamere Klebverbindungen und verschließt Hauteinschnitte, oberflächliche Fleischwunden und Kopfhautwunden. Nachteilig wirken die Abbauprodukte, hauptsächlich Formaldehyd und Alkylcyanate, die Entzündungsreaktionen und Heilungsstörungen hervorrufen können. Das Protein Fibrin in Fibrin-basierenden Klebstoffen entsteht in der Blutgerinnungskaskade aus Fibrinogen und Thrombin. Anschließend oligomerisiert es und vernetzt mit dem Enzym Faktor XIII (Abb. 2). Fibrin-basierende Klebstoffe finden sich u.a. in der Thorax- und kardiovaskulären Chirurgie. Allerdings sind die Klebeigenschaften nicht ideal und es besteht das Risiko der viralen Kontamination, da die Klebstoffe aus humanem Blut gewonnen werden. Eine weitere Klebstoffklasse sind Gelatine-basierende Systeme tierischen Ursprungs. Weitere Klebstoffkomponenten sind Resorcin und Aldehyde. Typische Anwendungsfelder sind das Verkleben von Blutgefäßen und Organen. Ein Nachteil dieses Klebstoffs ist seine geringe Klebfestigkeit. Außerdem können die toxischen Aldehydkomponenten das umliegende Gewebe reizen und das Polymer ist kaum biologisch abbaubar. Zudem bergen tierische Komponenten das Risiko der Übertragung von Krankheiten auf den Menschen. Chivers und Wolowacz [1] verglichen die Klebkräfte medizinischer Klebstoffe an geklebten Schweinehäuten, knorpeln und -knochen (Tab. 1). Medizinische Klebstoffe sollen kovalente Bindungen mit dem umgebenden Gewebe (Adhäsion) und mit sich selber (Kohäsion) in einer feuchten Umgebung in wenigen Minuten ausbilden [2]. Dabei muss die biologische Funktion des geklebten Gewebes unbeeinflusst bleiben. Darüber hinaus sollte der Klebstoff bioabbaubar sein und die Abbauprodukte dürfen weder toxisch noch teratogen, kanzerogen oder mutagen sein. Kleben im Wasser Geringe Wassermengen sind beim Klebeprozess notwendig, um Polymerisationen beispielsweise von Cyanacrylaten zu initiieren. Auf scheinbar trockenen Oberflächen sind unter normalen Umweltbedingungen mehrere Moleküllagen Wasser irreversibel immobilisiert. Klebstoffe wechselwirken mit ihren polaren Seitenketten mit diesen Schichten. Größere Mengen von Wasser führen dagegen zum Versagen von Klebverbindungen. Abb. 3 zeigt Degradationsmechanismen einer gehärteten Klebstoffschicht. Der Klebstoff wird in seiner Kohäsionskraft durch Quellung, Plastifizierung, Erosion und Hydrolyse geschwächt. Die Adhäsion zwischen Klebstoff und Festkörper wird durch überschüssiges Wasser in der Grenzschicht verringert. Darüber hinaus führt das Kleben in Anwesenheit von zu viel Wasser zu weniger festen Klebverbindungen, da die reaktiven polaren Gruppen mit Wasser wechselwirken und deshalb nicht mehr für die Adhäsion zur Verfügung stehen. Dieses Problem besteht sowohl bei den molekularen, in unserem Körper ständig ablaufenden, bioadhäsiven Phänomenen als auch bei marinen Organismen.Eine entscheidende Stoffklasse bei biologischen Klebphänomenen sind Proteine. Das sind Polymere, die sich aus Aminosäuren zusammensetzen. Jedes Protein besitzt eine charakteristische Aminosäurensequenz, die die zwei- und dreidimensionale Struktur sowie die Funktion bestimmt. Proteine fungieren im menschlichen Körper z.B. als Katalysatoren (Enzyme), Transporter (Hämoglobin) oder Baustoffe (Kollagene). Der Klebstoff der Miesmuschel Die gemeine Miesmuschel (Mytilus edulis) bildet dauerhafte, feste Klebverbindungen in Wasser. Die Muschel haftet mit Byssusfäden über eine Plaque (Klebstoffpunkt) am Substrat (Abb. 4). Die Plaque besteht hauptsächlich aus als Mytilus edulis foot protein (Mefp) bezeichneten Proteinen und ist das biologische Analogon zu einem technischen Klebstoff. Die Miesmuschel klebt an Oberflächen wie Stein, Holz, Schiffsrümpfen aus Stahl und Kunststoffen wie Polypropylen und Teflon. Eine zentrale Rolle spielt Mefp-1, das aus Folgen von zehn Aminosäuren besteht [4]. Diese Dekapeptideinheit (Abb. 5) wiederholt sich etwa 75- bis 80-mal und enthält nach . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: der Biosynthese enzymatisch modifizierte Aminosäuren wie Hydroxyprolin (Hyp) und Dihydroxylphenylalanin (Dopa). Die polaren Seitenketten schaffen ausgeprägte Wechselwirkungen zu polaren Molekülen auf den Substratoberflächen. Mefp-1 ist sowohl für die Adhäsion als auch für die Kohäsion verantwortlich und kann von der Klebfestigkeit mit einem Epoxid- oder Cyanacrylat-Klebstoff verglichen werden.Mefp-2 ist ein cysteinhaltiges Protein mit im Gegensatz zu Mefp-1 nur in geringen Mengen Dopa und ohne weitere modifizierte Aminosäuren [5]. Dieses Protein ist für die Ausbildung der schaumartigen Struktur des Klebstoffs verantwortlich. Mefp-3 ist das kleinste Protein im Klebstoff [6] und besitzt wie Mefp-5 einen hohen Dopa-Anteil [7]. Beide fungieren als Haftvermittler zu Oberflächen. Mefp-4 [8] stabilisiert ähnlich wie Mefp-2 die Plaque-Struktur. Bemerkenswert ist der hohe Dopa-Anteil im Klebstoff, der sie zur Schlüsselaminosäure sowohl für die Adhäsion als auch für die Kohäsion [9] macht (Abb. 6). Die Catechol-Untereinheit von Dopa bildet stabile Metallkomplexe (A), welche die gute Adhäsion auf metallischen Oberflächen bewirken. Die Hydroxylgruppen fungieren sowohl als Wasserstoffbrückendonoren als auch als -akzeptoren (B), was Wechselwirkungen zu polaren Gruppen auf Substratoberflächen und innerhalb des Klebstoffs ermöglicht. Entscheidend für die Kohäsion sind kovalente Vernetzungen, die zum einen durch 1,4-MichaelAdditonen mit Aminogruppen der Lysin-Seitenketten (C) und zum anderen durch radikalische Dimerisierung der Catecholreste untereinander (D) entstehen.In der Natur initiiert eine Catechol-Oxidase die Quervernetzung enzymatisch (Härtungszeit etwa drei Minuten). In vitro startet die Härtung durch oxidierende Agenzien wie NaIO4 oder H2O2. Auch Metallionen wie Ferrate oder Manganate fördern die Quervernetzung [10]. Gewinnung des Miesmuschelklebstoffs Gängige Methoden zur Gewinnung des Muschelklebstoffs basieren auf der Extraktion des Proteingemisches aus dem Byssusfaden. Für ein Gramm Klebstoff sind 10.000 Muscheln notwendig, was eine große Verschwendung natürlicher Ressourcen bedeutet. Zudem lässt sich damit reiner Klebstoff nicht isolieren. Aminosäuresequenzen mit modifizierten Aminosäuren wie Dopa (aus Tyrosin) und Hyp (aus Prolin) lassen sich nicht standardmäßig in den klassischen Expressionssystemen im Labor- oder industriellen Maßstab herstellen. In der Regel ist die Behandlung der isolierten Proteine mit Enzymen notwendig, um z.B. Tyrosin in Dopa umzuwandeln. Des Weiteren müssen sich Produktionsprozesse von rekombinanten Proteinen für medizinische Anwendungen an regulatorischen Richtlinien wie der Good Manufacturing Practice (GMP) orientieren. Die Festphasenpeptidsynthese ist eine alternative Methode zur Herstellung kleiner Proteine und Peptide. Die Verwendung modifizierter Aminosäuren ist hier unproblematisch. Diese Methode ist jedoch limitiert durch die Zahl und Sequenz der Aminosäuren des angestrebten Proteins/Peptids. Die maximale Länge der Sequenzen beträgt 70 bis 100 Aminosäuren. Längere Sequenzen lassen sich aber durch chemische Ligation zweier Peptidfragmente erzielen. Im Handel ist ein Extrakt aus dem Klebstoff der Miesmuschel zur Fixierung von Zellen in Laboratorien erhältlich. Dieses Produkt wurde bereits in vivo an Kaninchen mit transplantierten Knorpelzellen getestet [11]. Dabei heilte die mit Muschelproteinen geklebte Gruppe besser als die mit Fibrin fixierte. Dennoch sind medizinische Klebstoffe, die auf Muschelproteinen basieren oder Segmente von diesen enthalten, zurzeit nicht kommerziell erhältlich. Synthetischer Muschelklebstoff In den vergangenen Jahren wurden verschiedene Ansätze verfolgt, die Potenziale des Muschelklebstoffs und seiner Einzelkomponenten für den Menschen nutzbar zu machen. Hybridsysteme, basierend auf synthetischen Polymeren und der Dopa-Aminosäure, wurden für die Herstellung von Hydrogelen für medizinische Applikationen synthetisiert. Diese Gele zeichnen sich durch verbesserte adhäsive und kohäsive Eigenschaften aus. In allen Fällen wurde die Dopa-Einheit an Polyethylenglykol (PEG) geknüpft [12]. Copolypeptide aus Dopa und Lysin entstanden und wurden durch Zugabe von Tyrosinase, Fe3+, H2O2 oder IO4vernetzt [13]. Modelltripeptide von Mefp-1 wurden mit der Sequenz (XTyr-Lys)n (mit X = Gly, Ala, Ser, Leu, Phe, Ile oder Pro) dargestellt [14]. Dopa-modifizierte verzweigte PEGs dienten zum Kleben von Schweinehäuten. Bei Zug-Scherproben zeigte die PEG-Dopa-Kombination eine 3,5-fach höhere Festigkeit verglichen mit Fibrin-fixierten Proben [15].Auf Miesmuschelprotein basierende Klebstoffe können ein alternativer Ansatz bei der Entwicklung neuer medizinischer Klebstoffe sein. s t Literatur [1] R. A. Chivers, R. G. Wolowacz, Int. J. Adhesion and Adhesives 1997, 17, 137-132. [2] R. L. Strausberg, R. P. Link, Tibtech 1990, 8, 53-57. [3] J. H. Waite, Int. J. Adhesion and Adhesives 1987, 7, 9-14. [4] J. H. Waite, J. Biol. Chem. 1983, 258, 2911-2915.[5] L. M. Rzepecki, K. M. Hansen, J. H. Waite, Bio. Bull. 1992, 183, 123-137. [6] V. V. Papov, T. V. Diamond, K. Biemann, J. H. Waite, J. Biol. Chem. 1995, 270, 20183- 20192. [7] J. H. Waite, X. X. Qin, Biochemistry 2001, 40, 2887-2893. [8] V. Vreeland, J. H. Waite, L. Epstein, J. Phycology 1998, 34, 1-8. [9] a) M. Yu, J. Hwang, T. J. Deming, J. Am. Chem. Soc. 1999, 121, 5825-5826. b) T. J. Deming, Curr. Op. Biol. Chem. 1999, 3, 100-105. [10] M. J. Sever, J. T. Weisser, J. Monahan, S. Srinivasan, J. J. Wilker, Angew. Chem. 2004, 116, 454-456. [11] M. I. Pitman, D. Menche, E. K. Song, A. Ben-Yishay, D. Gilbert, D. A. Grande Bull. Hosp. Jt. Dis. Orthop. Inst. 1989, 49, 213-220. [12] a) B. P. Lee, J. L. Dalsin, P. B. Messersmith, Polymer. Prep. 2001, 42, 151-152. b) B. P. Lee, K. Huang, F. N. Nunalee, K. R. Shull, P. B. Messersmith, J. Biomater. Sci. Polymer Edn. 2004, 15, 449-464. c) K. Huang, B. P. Lee, D. R. Ingram, P. B. Messersmith, Biomacromolecules 2002, 3, 397-406. d) B. P. Lee, J. L. Dalsin, P. B. Messersmith, Biomacromolecules 2002, 3, 1038- 1047. [13] M. Yu, T. J. Deming, Macromolecules 1998, 31, 4739-4745. [14] H. Tatehata, A. Mochizuki, T. Kawashima, S. Yamashita, H. Yamamoto, J. Appl. Polymer Sci. 2000, 76, 929-937. [15] S. A. Burke, M. Ritter-Jones, B. P. Lee, P. B. Messersmith, Biomed.Mater. 2007, 2, 203. - Dr. Klaus Rischka, . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: arbeitet seit 2002 als wissenschaftlicher Mitarbeiter am Fraunhofer Institut für Fertigstellung und Angewandte Materialforschung (IFAM) auf dem Gebiet der Biomolekulares Oberflächen- und Materialdesign. Dabei befasst er sich u.a. mit der Darstellung peptidbasierter Klebstoffe und antimikrobieller Oberflächen. - Dr. Ingo Grunwald, ist seit 2004 Projektmanager in der Arbeitsgruppe Biomolekulares Oberflächen- und Materialsdesign am Fraunhofer Institut für Fertigstellung und Angewandte Materialforschung (IFAM). Er arbeitet an der Entwicklung von biomemetischen und bioaktiven Oberflächen. t Ergebnisse auf einen Blick - Die Miesmuschel bildet dauerhafte, feste Klebverbindungen in Salzwasser. Dabei sorgen Proteine für gute Haftung an verschiedenen Untergründen. - In der Natur wird das Kleben enzymatisch initiiert, in vitro startet die Härtung durch oxidierende Agenzien wie NaIO4 oder H2O2. - Miesmuschelproteine können ein Ansatz bei der Entwicklung medizinischer Klebstoffe sein. . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Knorpel Knochen Haut Butyl-2cyanoacrylat 1,0 MPa 1,4 MPa 1,2 MPa GRF 0,15 MPa 0,20 MPa 0,07 MPa Fibrin 0,005 MPa 0,011 MPa 0,019 MPa . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Abb. 4: Miesmuschel, haftend an einer antihaft-beschichteten Pfanne . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Abb. 5: Dekapeptiduntereinheit von Mefp-1 . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Abb. 6: Reaktionsmöglichkeiten von 3,4-Dihydroxylphenylalanin . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Abb. 1: Cyanacrylate für medizinische Anwendungen . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Abb. 2: Blutgerinnungskaskade im menschlichen Körper . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000 Quelle/Publication: Farbe und Lack Ausgabe/Issue: 07/2008 Seite/Page: Abb. 3: Degradationsmechanismen eines gehärteten Klebstoffs [4] . Vincentz Network +++ Plathnerstr. 4c +++ D-30175 Hannover +++ Tel.:+49(511)9910-000