Halogenierung
Werbung
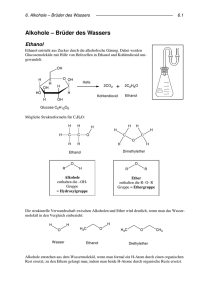
ORGANISCHE CHEMIE Chloralkane Chloralkane (Alkylhalogenide) H H H C C H Cl Cl • allgemeine Formel R-X (X= F, Cl, Br, I) • wenig polare Verbindungen • wasserunlöslich, gut fettlöslich, nicht brennbar • häufig toxisch (Leber, ZNS) und cancerogen • wichtige chemische Ausgangsstoffe (Substitution von X durch andere Gruppen) H2ClC-CClH2 Verwendung von Alkylhalogeniden • Insektizide und Herbizide • Mittel zur Feuerbekämpfung • Reinigungsmittel • Kühlflüssigkeit Halogenhaltige Naturstoffe sind relativ selten, die meisten organischen Halogenverbindungen werden künstlich hergestellt. Nomenklaturregeln für Chloralkane H 1) Nomenklatur analog zu Alkanen, Alkenen und Alkinen H H C C H Cl Cl 2) Angaben zu Halogensubstituenten • Position (möglichst kleine Zahl) • Anzahl • Art des Halogens 2 C-Atome: ethan 2 Cl-Atome: 1,2-Dichlor 1,2-Dichlorethan Br Cl 6 C-Atome: hexan 1 Br-Atom an C 3: 3-Brom 3-Bromhexan (nicht 4-Bromhexan) Cl 7 C, 1 Doppelbindung: 1-hepten 1 Seitenkette an C-5: 5-Methyl 3,3-Dichlor-5-methyl-1-hepten Herstellung von Chloralkanen Halogenierung von Alkanen Startreaktion Kettenreaktion Kettenabbruchreaktion Cl2 Addition an Alkene hν Cl + Cl Cl + CH4 CH3 + HCl CH3 + Cl2 CH3Cl + Cl CH3 + Cl CH3Cl CH3 + CH3 CH3-CH3 Cl Cl2 + Cl Die Halogenierung von Alkanen ist eine typische Radikalkettenreaktion. Herstellung von Chloralkanen Halogenierung von Alkanen Addition an Alkene Addition von Halogenen (X-X) ergibt Dihalogenalkane. Addition von Halogenwasserstoff (H-X) ergibt Monohalogenalkane. C C + Cl-Cl Cl C C Cl C C + H-Cl H C C Cl Wichtige Halogenalkane Dichlormethan CH2Cl2 Halothan • Lösungsmittel • niedriger Siedepunkt • Narkosemittel Cl H C Cl F H F Br C C F H Cl Chloroform • Lösungsmittel • früher Narkotikum • in hohen oralen Dosen mutagen und Lebergift • bildet bei Oxidation das hochgiftige Phosgen Cl H C Cl Cl CHCl3 + 1/2 O2 C Cl O + HCl Cl Wichtige Halogenalkane Tetrachlorethylen Cl • Lösungsmittel • Putzmittel (Fettlöser) • Textilreinigungsmittel • industrielle Entfettung von Metallen Cl C Cl Tetrachlorkohlenstoff • γ-Hexachlorcyclohexan • sehr starkes Atemgift • früher als Insektizid verwendet • heute verboten Cl Cl • Lösungsmittel • Feuerlöschmittel • mutagen, toxisch • Einsatz heute stark eingeschränkt “Lindan” C Cl Cl C Cl Cl Cl Cl Cl Cl Cl Reaktionen von Chloralkanen (Nucleophile) Substitution (SN) Eliminierung H C C Cl C C + H-Cl Die Eliminierung von Halogenwasserstoff (H-X) aus Halogenalkanen wird durch hohe Temperaturen und starke Basen begünstigt. Es entstehen Alkene. Die Eliminierung ist die Umkehrung der Addition. Cl C C H C + B C _ + Cl Cl _ C C _ + HB Reaktionen von Chloralkanen: Nucleophile Substitution (SN) _ Y R R δ+ δ− C X Y R R R R X C R Y C R + X _ R Die zwei Einzelschritte der Substitution können gleichzeitig (SN2) oder nacheinander (SN1) erfolgen: • Angriff eines Nucleophils • Ablösung des Halogenidanions (Abgangsgruppe) Polare Lösungsmittel begünstigen die Reaktion. Durch nucleophile Substitution an Halogenalkanen ist eine Vielzahl von Verbindungen herstellbar. Beispiele für Produkte durch SN-Reaktionen von Halogenalkanen: Y = OH- : Alkohole Y = CN- : Nitrile Y = Hal- : andere Halogenalkane Y = NH3 / RNH2 / R2NH : Amine Y = NO2- : Nitroalkane Y = RO- : Ether F FCKW (Fluorchlorkohlenwasserstoffe) Eigenschaften • farblose, niedrigsiedende Flüssigkeiten • untoxisch, unbrennbar, unkorrosiv • chemisch extrem inert • “Freone” (USA) / “Frigene” (Europa) Verwendung • Treibgase in Spraydosen • Kühlmittel (Kühlschränke, Klimaanlagen) Cl C F F Freon 11: CCl3F, 24°C Freon 12: CCl2F2, -30°C Freon 13: CClF3, -81°C Freon 21: CHCl2F, 9°C Freon 22: CHClF2, -41°C Freone sind so inert, daß sie bis in die äußere Stratosphäre gelangen, wo sie von der äußerst energiereichen Sonnenstrahlung in Radikale zerlegt werden. Diese Radikale katalysieren den Zerfall von Ozon und sind somit für den Abbau der lebenswichtigen Ozonschicht (“Ozonloch”) verantwortlich. Stratosphärisches Ozon stellt einen natürlichen Filter gegen die kurzwellige, für Lebewesen tödliche UV-Strahlung dar. F Cl FCKWs und das Ozonloch C F F Die durch Sonnenstrahlung in der Stratosphäre gebildeten Radikale wirken katalytisch. Chlorradikale sind dabei besonders gefährlich. Sie bewirken die Zersetzung von Ozon zu Sauerstoff in einer Kettenreaktion. Ein Chlorradikal kann dabei bis zu 20000 Ozonmoleküle vernichten! F F C F Cl hν F F Cl C + Cl F + O3 ClO + O3 2 O3 ClO + O2 Cl + 2 O2 3 O2 Behandelte Stoffklassen und Reaktionsmechanismen Alkylhalogenide: (Nucleophile) Substitution _ Y R R δ+ δ− C X Y R R Alkylhalogenide: Eliminierung R H C C R X C R Cl Y C R +X _ R C C + H-Cl ORGANISCHE CHEMIE Alkohole 2 Alkohole • allgemeine Formel R-OH • funktionelle Gruppe: -OH (Hydroxygruppe) • enthalten neben C und H auch O 4 OH 1 3 5 CH3-CH2-CH2-CH2-CH2-OH Name Anzahl C Formel _______________________________________________ Methanol 1 CH3OH Ethanol 2 CH3-CH2-OH 1-Propanol 3 CH3-CH2-CH2-OH 2-Propanol 3 CH3-CHOH-CH3 1-Butanol 4 CH3-CH2-CH2-CH2-OH 2-Butanol 4 CH3-CHOH-CH2-CH3 Alkohole bilden eine homologe Reihe, die Ketten werden jeweils um eine CH2-Gruppe verlängert. OH Alkohole, ROH Eigenschaften: • polare Verbindungen • Niedere Alkohole sind gut mit Wasser mischbar, Methanol, Ethanol und Propanol sogar vollständig. • Alkohole >C5 sind schlechter mit Wasser mischbar. • Langkettige Alkohole verhalten sich ähnlich wie die zugrundeliegenden Kohlenwasserstoffe. • Relativ hohe Siede- und Schmelzpunkte • Ausbildung von Wasserstoffbrückenbindungen • geradkettige oder verzweigte Struktur Die Einteilung der Alkohole erfolgt nach der Anzahl der Reste am Hydroxy-Kohlenstoff. R R R CH2-OH primär R CH-OH sekundär R C-OH tertiär R Nomenklaturregeln für Alkohole 3 1) Benennung des Kohlenstoffgerüstes (Hauptkette, Seitenketten) analog zu Kohlenwasserstoffen (Alkanen / Alkenen / Alkinen), Endung -ol 2) Position der Hydroxygruppe durch eine (möglichst kleine) Zahl angeben (geht vor -en, -in etc.) 3) Alternativ ist die Bezeichnung als “Hydroxyalkan” möglich 2 OH 3 1 CH3-CH-CH2-OH CH3 2-Methyl-1-propanol 1 OH 2 CH3-CH2-CH2-CH2-OH 4 1-Butanol (1-Hydroxybutan) OH 2 4 1 3 CH3-CHOH-CH2-CH3 2-Butanol (2-Hydroxybutan) Nomenklatur von Alkoholen OH Br 4 3 4-Brom-1-butanol OH 2-Propen-1-ol (Allylalkohol) OH 2 1 OH 4-Methyl-cyclohexan-1,2-diol HO 1 2 1 C OH 2 3 2-Methyl-2-propanol (tert-Butanol) 1-Phenylethanol (1-Phenyl-1-ethanol) OH 4 5 OH 2 3 CH3 1 CH3 CH3-CH-CH-C-CH-OH Längste Seitenkette: 5 Kohlenstoffe: Pentan 2 Seitenketten: 2,4-dimethyl Hydroxygruppe: 1-ol 1 2 4 3 6 5 7 8 F Längste Seitenkette: 8 Kohlenstoffe: octa 2 Doppelbindungen an C 3 und 5: 3,5-octadien 2 Substituenten an C 3 und C 5: 3-ethyl-5-fluor Hydroxygruppe an C 2: 2-ol 2,4-Dimethyl-1-pentanol 3-Ethyl-5-fluor-3,5-octadien-2-ol Die Wasserstoffbrückenbindung H2O: Sdp. 100°C H2S: Sdp. -60°C Die H-Brückenbindung tritt auf, wenn Wasserstoff an ein stark elektronegatives Element (O, auch N) gebunden ist, wie z.B. in Wasser, Alkoholen und Aminen. Dies führt zu einer unsymmetrischen Ladungsverteilung der OH-Bindung. Der Wasserstoff ist stark positiviert und kann nun mit anderen elektronegativen Atomen wechselwirken. • Keine kovalente Bindung • geringe Bindungsenergie, aber große Wirkung (O-H: 431 kJ/mol, H-Brücke: 21 kJ/mol) Effekte der H-Brückenbindung: • hohe Siedepunkte durch Assoziatbildung - H2O: 100°C / H2S: -60°C - Ethanol: 78°C, Ethan: -24°C • Strukturbildung in Naturstoffen: - Dimerbildung von Säuren - Faltung von Proteinen - Helixstruktur der DNA - Fibrillenbildung in Cellulose R δ− R O H O δ− H δ+ R O H Eigenschaften von Alkoholen OH • Alkohole reagieren sehr schwach sauer, das Proton am Sauerstoff kann abgegeben werden. • Metallsalze der Alkohole heißen Alkoholate. Sie werden durch Reaktion von metallischem Natrium mit wasserfreiem Alkohol hergestellt. CH3-CH2-CH2-OH + Na CH3-CH2-CH2-O _ Na+ + H2 Alkoholate sind in Wasser nicht beständig und reagieren zurück zu Alkoholen. CH3-CH2-CH2-O _ Na+ + H2O CH3-CH2-CH2-OH + NaOH Herstellung von Alkoholen: Addition von Wasser an Alkene C C H + H-OH C C OH Technische Synthese von Ethanol: Addition von Wasser an Ethen H H C C H + H-OH H+ H H H H C C H H OH Technische Synthese von 2-Propanol: Addition von Wasser an Propen H C H H H C + H-OH CH3 H+ H3C C OH CH3 Herstellung von Alkoholen: Substitution von Halogenalkanen _ HO R R δ+ δ− C Cl R HO R R C R Cl HO C R R + Cl R Alkohole sind allgemein durch nucleophile Substitution (SN) an Halogenalkanen mittels Hydroxidionen (z.B. durch Natronlauge) herstellbar. Polare Lösungsmittel begünstigen die Reaktion. 1-Propanol aus 1-Chlorpropan Cl HO OH _ + Cl _ _ Reaktionen der Alkohole: Eliminierung Alkohole eliminieren Wasser, wobei Alkene gebildet werden. H C C OH C C + H-OH Herstellung von Alkoholen: Reduktion +2 -2 _ C O + H H O C _ H+ +1 0 -2 +1 H C O-H Carbonylverbindungen (Stoffe mit der Gruppe C=O) werden durch Hydridionen (H-) zu Alkoholen reduziert. Als Hydridionenquellen werden Metallhydride eingesetzt: - Lithiumaluminiumhydrid (LiAlH4, sehr reaktiv) - Natriumborhydrid (NaBH4, auch in Wasser verwendbar) O R O OH H H _ R H H _ H _ H H _ R O OR´ R O C OH C R R´ R R´ OH H primärer Alkohol Carbonsäuren, Ester und Aldehyde werden zu primären Alkoholen reduziert, Ketone zu sekundären Alkoholen. Wichtige Alkohole: Methanol H H C OH H • Methanol wurde früher durch trockenes Erhitzen von Holz hergestellt (“Holzgeist”). Es stammt aus den -OCH3-Gruppen im Lignin. • Heute wird Methanol aus Synthesegas (Hydrierung von Kohlenmonoxid) hergestellt, Weltjahresproduktion 10 Mio Tonnen. CO + 2 H2 ZnO-Cr2O3 400°C, 150 atm CH3-OH • Methanol ist giftig (letale Dosis: 25 g), führt zur Erblindung. • Methanol ist in Spuren in vielen alkoholischen und nichtalkoholischen Getränken enthalten. Es stammt aus den Pektinen (in Schalen von Citrusfrüchten, Äpfeln etc.). • Methanol wird im Körper zu Formaldehyd und Ameisensäure oxidiert, Ameisensäure (H-COOH) ist für die toxische Wirkung verantwortlich. Wichtige Alkohole: Ethanol Ethanol wird industriell durch Addition von Wasser an Ethen oder durch alkoholische Gärung hergestellt (“Weingeist”). H H C H C + H-OH H H+ H H H C C H H OH • Ethanol ist giftig (letale Dosis: 200 g). Der Abbau erfolgt in der Leber durch das Enzym Alkoholdehydrogenase. • Ethanol bildet mit Wasser ein Azeotrop bei 95.57% Ethanol / 4.43% H2O. Ein Azeotrop ist ein konstant siedendes Stoffgemisch, das durch Destillation nicht weiter auftrennbar ist. • Zur Entfernung des Wassers (“absoluter Alkohol”) setzt man beim Destillieren CaO zu, das das Wasser als Ca(OH)2 bindet. Ethanol: alkoholische Gärung Ethanol wird industriell aus pflanzlichen Abfällen (z.B. aus der Zuckerproduktion) durch alkoholische Gärung hergestellt. Bei der alkoholischen Gärung wird durch Hefen Glucose (Traubenzucker) in Ethanol und CO2 umgewandelt. 2 CO2 + 2 CH3-CH2-OH C6H12O6 Das Zwischenprodukt der Reaktion, Brenztraubensäure, ist auch das Endprodukt des Kohlenhydratstoffwechsels (Glykolyse). HOOC Glucose C H3C O - CO2 H H O AlkoholC dehydrogenase H C OH CH3 NAD H + H+ CH3 NAD+ Ethanol: biochemische Entgiftung • Die biochemische Entgiftung von Ethanol erfolgt durch Oxidation (Dehydrierung) zu Acetaldehyd, katalysiert durch das Enzym Alkoholdehydrogenase, im weiteren danach zu Essigsäure. • Das Enzym ist auch in Hefen an der Entstehung von Ethanol durch alkoholische Gärung beteiligt (umgekehrter Prozess). • Das Enzym enthält Zink und benötigt NAD / NADH als Coenzym. • Es katalysiert sowohl Oxidation (Entgiftung) als auch Reduktion (Gärung in Hefen), ist daher eine Oxidoreduktase. H O H NH2 H O C H CH3 + N R Ethanol H H NAD+ H O C O NH2 + CH3 N Acetaldehyd R NAD H + H+ Ethanol: Bestimmung des Blutalkohols Bestimmung nach Widmark Alkohol wird durch Kaliumdichromat (rot) zu Essigsäure oxidiert, wobei grünes Chromoxid entsteht (Röhrchentest). 2 K2Cr2O7 + HCl + 3 C2H5OH 2 Cr2O3 + 4 KCl + 5 H2O + 3 CH3COOH Alkoholdehydrogenase-Reaktion Die Konzentration an gebildetem NADH wird photometrisch bestimmt. O Enzym CH3-CH2-OH + NAD+ H3C C + NADH + H+ H • Der Alkoholabbau im Organismus erfogt mit konstanter Geschwindigkeit (unabhängig von der Konzentration). • Ein Fehlen des Enzyms Alkoholdehydrogenase führt zu gesteigerter Alkoholempfindlichkeit. • Alkoholunverträglichkeit kann auch chemisch induziert werden (“Antabus”: Kalkstickstoff, Disulfiram, CS2). Propanol, Butanol und Pentanol Die Propanole, Butanole und Pentanole sind wichtige Lösungsmittel. Alkohole mit 5 Kohlenstoffatomen werden auch als Amylalkohole bezeichnet. Einige der niedrigen Alkohole sind Bestandteil von Fuselölen, die bei der alkoholischen Gärung aus Aminosäuren entstehen können. Formel CH3-CH2-CH2-OH CH3-CH-CH2-OH CH3 CH3-CH-CH2-CH2-OH CH3 CH3-CH2-CH-CH2-OH CH3 Alkohol (Fuselöl) 1-Propanol (Propylalkohol) 2-Methyl-1-propanol (iso-Butylalkohol) 3-Methyl-1-butanol (iso-Amylalkohol) 2-Methyl-1-butanol Aminosäure Glutaminsäure Valin Leucin Isoleucin Höhere Alkohole findet man in Pflanzenölen (C-6 bis C-12) oder im Bienenwachs (C-30, C-32). Mehrwertige Alkohole (Diole, Triole, Polyole) H 1,2-Ethandiol (Glycol, Ethylenglycol) H C OH H • viskose Flüssigkeit • süßer Geschmack • hoher Siedepunkt (197°C) HO • Wasserstoffbrückenbindungen • hygroskopisch (wasseranziehend) • Verwendung als Bremsflüssigkeit, Frostschutzmittel und zur Erzeugung von Polyesterharzen C OH H O H C OH H C OH H OH C ox. O C OH H OH Glycol ist giftig. Es wird zu Oxalsäure oxidiert, welche mit CaIonen unlösliches Calciumoxalat bildet (Verstopfung der Nierentubuli, Nierensteine). Mehrwertige Alkohole (Diole, Triole, Polyole) 1,2,3-Propantriol (Glycerin, Glycerol) HO OH • viskose Flüssigkeit, hygroskopisch OH • sehr polar, sehr hoher Siedepunkt (290°C) durch Wasserstoffbrücken • Bestandteil von allen Ölen und Fetten (Fette: Tri-Ester aus Glycerin und langkettigen Fettsäuren) • Verwendung als Salbenbestandteil (zum Feuchthalten), Bestandteil von Druckerschwärze • Erzeugung von Glycerintrinitrat (Nitroglycerin) H C OH H C OH H C OH H H H H C OH H C OH H C OH H H 3 HNO3 H C O NO2 H C O NO2 H C O NO2 H Nitroglycerin ist extrem schlagempfindlich und wird mit Kieselgur stabilisiert (Dynamit). Mehrwertige Alkohole (Diole, Triole, Polyole) Xylit (Xylitol) • Zuckerersatzstoff • Antikarieswirkung (Kaugummis) • gewonnen aus dem Zucker Xylose (5 C: Pentose) CH2OH H C OH HO C H H C OH CH2OH Sorbit (Sorbitol) • durch Reduktion von Glucose (6 C: Hexose) • Vorkommen in Vogelbeeren (Sorbus aucuparia) • “Diabetikerzucker” • halbe Süßkraft von Rohrzucker CH2OH H C OH HO C H H C OH H C OH CH2OH Xylit und Sorbit gehören zu den Zuckeralkoholen, die aus Zuckern durch Reduktion erhalten werden. Es sind weiße, gut kristallisierende, süß schmeckende Substanzen. Behandelte Stoffklassen und Reaktionsmechanismen Alkohole: • Addition • Eliminierung • Substitution • Reduktion C C + H-OH H C C OH C C C + H-OH H C OH _ HO R R δ+ δ− C Cl EtherR +2 -2 _ C O + H R R C HO R Cl HO R H C C R + Cl R O _ H+ +1 0 -2 +1 H C O-H _