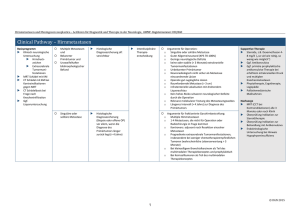
Behandlungsergebnisse bei Patienten mit zervikalen
Werbung

Aus der Universitätsklinik für Hals-Nasen-Ohrenheilkunde und Kopf-und Halschirurgie der Ruhr-Universität am St. Elisabeth-Hospital Bochum Direktor: Prof. Dr. med. S. Dazert Behandlungsergebnisse bei Patienten mit zervikalen Lymphknotenmetastasen und unbekanntem Primärtumor ( CUP ) Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Martina Stillger aus Dortmund 2007 Dekan: Referent: Koreferent: Prof. Dr. med. G. Muhr Prof. Dr. med. S. Dazert PD Dr. med. A. Schmelzer Tag der mündlichen Prüfung: 29. November 2007 3 Inhaltsverzeichnis 1 Einleitung 1.1 Einführung in die Thematik ……………………………………………11 1.2 Begründung für die Durchführung der Untersuchung ……………….14 2 Überblick über verwendete anatomische und onkologische Klassifikationen, diagnostische und chirurgische Methoden 2.1 Klassifikation der zervikalen Lymphknotenstationen, Nomenklatur der Halslymphknoten, historischer Abriß …………………………….15 2.2 Lymphogene Metastasierungsrichtung und Metastasierungshäufigkeit im Kopf-Hals-Bereich in Abhängigkeit vom Tumorsitz ………………18 2.3 Klassifikation des Tumorstadiums nach TNM ………………………..20 2.4 Histologische Tumorklassifikation und histologische/histochemische Untersuchungsmethoden ………………………………………………..22 2.5 Diagnostisches Vorgehen ………………………………………………..28 2.5.1 HNO-fachärztliche Untersuchungen einschließlich chirurgischer Exploration 2.5.2 Bildgebende Diagnostik 2.5.3 Tumormarker 2.6 Neck Dissektionen ……………………………………………………….34 2.7 Tonsillektomie …………………………………………………………...36 4 3 Patientenkollektiv und Methoden 3.1 Strukturierung des Patientenkollektivs und Behandlungszeitraum …37 3.2 Diagnostik ………………………………………………………………..37 3.3 HNO-ärztliche Operationen ………………………………………….…38 3.4 Klassifikation der befallenen Lymphknoten …………………………..38 3.5 Bestimmung des Tumorvolumens /Lymphknotenvolumens …………38 3.6 Strahlentherapie ………………………………………………………...39 3.7 Chemotherapie ………………………………………………………….41 3.8 Nachsorge ……………………………………………………………..…43 3.9 Methodik der Untersuchung und Strukturierung der Daten ………..43 3.10 Analyse der anamnestischen Daten ……………………………….…...45 3.11 Statistik ………………………………………………………….…...….46 4 Ergebnisse 4.1 Analyse der Patientendaten ……………………………………..….…..48 4.1.1 Epidemiologische Daten (Patientenzahl, Alter, Geschlecht, Behandlungsdauer, Nachbeobachtungszeit) 4.1.2 Histologie, Tumorstadium und Grading 4.1.3 Risikofaktoren: Hb, BMI, Tumorvolumen 5 4.2 Analyse der Therapiedaten …………………………………………….49 4.2.1 operative Therapie 4.2.2 Strahlentherapie 4.2.3 Chemotherapie 4.2.4 Kombinationstherapien 4.3 Überlebensanalysen ………………………………………………….…..51 4.3.1 Gesamtüberleben im Gesamtkollektiv 4.3.2 Rezidivfreies Überleben im Gesamtkollektiv 4.3.3 Metastasenfreies Überleben im Gesamtkollektiv 4.3.4 Subanalyse Gesamtüberleben in Bezug auf das Tumorvolumen 4.3.5 Subanalyse rezidivfreies Überleben in Bezug auf das Tumorvolumen 4.3.6 Subanalyse Gesamtüberleben mit versus ohne Tonsillektomie 4.3.7 Subanalyse Rezidivfreies Überleben mit versus ohne Tonsillektomie 4.3.8 Subanalyse Überleben in Bezug auf posttherapeutische Entdeckung des Primärtumors 4.4 Prognostische Relevanz der Subanalysenkriterien …...……………….59 4.5 Gesamtprognose …………………………………………………………60 5 Diskussion 5.1 Behandlungsergebnisse in der Literatur ………………………………61 5.2 Abhängigkeit der Behandlungsergebnisse von Patienten- und Tumorkriterien ………………………………………………..……..….62 5.2.1 Relevanz von Hb und BMI 5.2.2 Relevanz des Tumorvolumens 5.2.3 Relevanz von N-Status und kapselüberschreitendem Wachstum 5.2.4 Relevanz der posttherapeutischen Entdeckung des Primärtumors 6 5.3 Abhängigkeit der Behandlungsergebnisse von der Art der Onkologischen Therapie ………………………………………….……...67 5.3.1 Relevanz der Strahlentherapie 5.3.2 Relevanz der Chemotherapie 5.3.3 Relevanz der Operation der Lymphabflußwege 5.3.4 Relevanz der Tonsillektomie 5.4 Gesamtprognose ……………………………………………………….....76 5.5 Nebenwirkungen und Akzeptanz der Therapie ………………….…….77 6 Zusammenfassung 7 Literaturverzeichnis 7 Abbildungsverzeichnis Abbildung 1 Halslymphknotenregionen nach Robbins Abbildung 2 Bestrahlungszielvolumen Abbildung 3 Kaplan-Meier-Kurve des Gesamtüberlebens Abbildung 4 Kaplan-Meier-Kurve des lokalrezidivfreien Überlebens Abbildung 5 Kaplan-Meier-Kurve des metastasenfreien Intervalls Abbildung 6 Kaplan-Meier-Kurve des Gesamtüberlebens der Patienten mit einem Tumorvolumen oberhalb beziehungsweise unterhalb des Medians Abbildung 7 Kaplan-Meier-Kurve der Patienten mit rezidivfreien Überleben bei einem Tumorvolumen oberhalb beziehungsweise unterhalb des Medians Abbildung 8 Kaplan-Meier-Kurve des Gesamtüberlebens mit versus ohne Tonsillektomie Abbildung 9 Kaplan-Meier-Kurve des rezidivfreien Überlebens mit versus ohneTonsillektomie Abbildung 10 Primärtumornachweis 8 Tabellenverzeichnis Tabelle 1 Halslymphknotenmetastasen und möglicher Primärtumorsitz Tabelle 2 Diagnostisches Vorgehen Tabelle 3 Fragebogendesign CUP-Syndrom Tabelle 4 Patienten- und Behandlungsdaten Tabelle 5 Kreuztabelle Überlebensanalysen Tabelle 6 Literaturstudien zur Behandlung des CUP-Syndroms mit zervikaler Lymphknotenmetastasierung 9 Verzeichnis der Abkürzungen CUP Cancer of Unknown Primary 1 TNM Tumorklassifikationssystem (Tumor, Nodulus, Metastase) 3 HNO Fachgebiet der Hals-Nasen-Ohren-Heilkunde 4 Hb Hämoglobin 4 BMI Body Mass Index 4 N-Status Nodal Status 5 CT Computer Tomographie 11 MRT Magnet Resonanz Tomographie 11 FDG-PET Fluordeoxyglycose Positronen Emissions Tomographie 11 HP-Virus Human Papilloma Virus 11 PCR Polymerase Chain Reaction 11 ICD International Classifikation of Diseases 12 MUP Metastasen eines unbekannten Primärtumors 12 MKG Fachgebiet der Mund-Kiefer-Gesichts-Chirurgie 12 Gy Gray, Einheit der Energiedosis 14 UICC Unio internationalis contra cancrum 20 pN postoperative histopathologische Klassifikation Nodulus 20 R-Faktor Residualfaktor, Residualtumor 21 WHO World Health Organization 22 EBV Epstein-Barr-Virus (Herpetoviridae) 23 N-CAM Neurales Zelladhäsionsmolekül 25 HMB-45 Tumormarker Melanom Antikörperklon 27 Melan-A Tumormarker Melanom Antikörperklon 27 LCA Leucocyte common antigen 27 CD-Epitope Cluster Domain Oberflächenantigene 27 NSE Neuronspezifische Enolase 27 HCG Human chorionic gonadotropin 27 AFP Alpha Fetoprotein 27 TTF-1 Thyreoidaler Transskriptionsfaktor 1 27 PSA Prostataspezifisches Antigen 27 B-Bild Brightness - Scan Sonographie 30 CEA Carzinoembryonales Antigen 33 SCCA Squamous Cell Carcinoma Antigen 33 10 CYFRA 21-1 Cytokeratinfragment, Zytokeratinmarker 33 ND Neck Dissektion 34 RND Radikale Neck Dissektion 34 MRND Modifizierte radikale Neck Dissektion 34 SND Selektive Neck Dissektion 34 ERND Erweiterte radikale Neck Dissektion 35 TE Tonsillektomie 36 KOF Körperoberfläche 41 CBDA cis-Diammin (1,1-cyclobutandicarboxylato)platin, Carboplatin 42 DNA Desoxyribonucleinsäure 42 G-Phase Gap1-Phase des Zellzyklus 42 S-Phase Synthesephase des Zellzyklus 42 CDDP cis-Diamindichoroplatin(II), Cisplatin 42 LDH Lactat Dehydrogenase 44 KSO Kolmogoroff-Smirnov-Omnibustest 46 RCT Radio/Chemotherapie 47 RT Radiotherapie 47 CT Chemotherapie 47 OP Operation 47 LK Lymphknoten 47 LAW Lymphabflußwege 47 TTV Total Tumor Volume 47 KI Konfidenzintervall 52 EORTC European Organisation for Research and Treatment of Cancer 69 IMRT Intensitätsmodulierte Radiotherapie 69 CTV Clinical Target Volume 69 PTV Planning Target Volume 69 5-FU 5-Fluor-Uracil 72 11 1 1.1 Einleitung Einführung in die Thematik Für Patienten wie für Ärzte stellt die Diagnose „Zervikale Lymphknotenmetastasen bei unbekanntem Primärtumor“ auch in Zeiten hocheffizienter Diagnostik, Operationen und Therapiemodalitäten immer wieder eine Herausforderung dar. Die Tumorentität ist insgesamt selten. Bei bis zu 2-10 % der diagnostizierten zervikalen Lymphknotenmetastasen wird ein Primärtumor nicht gefunden [13, 15, 56, 58, 61] und selbst nach Obduktionen bleibt in 10-20% der Fälle der Primarius immer noch unentdeckt. [45] Bei einem Durchschnittsalter von 54 Jahren sind Männer etwas häufiger als Frauen betroffen (m : w = 3,5:1). [22] Grundsätzlich ist in dieser Situation als Primärtumor ein Tumor im HNO-Bereich wahrscheinlich. Mit modernen bildgebenden Verfahren (CT, MRT, PET) wurden die Möglichkeiten der klinischen Diagnostik zwar deutlich verbessert [7, 24, 44], jedoch hat sich bisher keine der Methoden als richtungsweisend für die Diagnose des okkulten Primärtumors herausgestellt. Zusätzliche Untersuchungsmethoden, wie zum Beispiel die Detektion des Ebstein-BarrVirus in Lymphknotenmetastasen als Hinweis auf ein Nasopharynxkarzinom oder die Bestimmung eines HP-Virus (Human Papilloma Virus) mittels PCR (Polymerase Chain Reaktion) zum Nachweis eines Oropharynxkarzinomes wurden inzwischen beschrieben. [12, 30, 37, 39] Der Einsatz serologischer Tumormarker sowie immunhistochemische, zytogenetische und molekularbiologische Methoden (micro-arrays) werden in Zukunft wahrscheinlich noch weitere Möglichkeiten in der Primärdiagnostik eröffnen. [7, 11, 20, 24] Die Analyse der Literatur zeigt jedoch, daß das Management sowohl hinsichtlich der Diagnoseverfahren, der histologischen Aufarbeitung oder der Determination von Onkogenen [18] noch nicht abschließend beurteilt werden kann. Auf dieser Ebene sind die biochemische und immunhistochemische Forschung bemüht, aussagekräftige Diagnosefaktoren zu entwickeln. 12 Inzwischen wird die vorliegende Tumorsituation als eigenes Krankheitsbild „CUP-Syndrom“ genannt. Das CUP-Syndrom (ICD C77.0 ) ist eine klinische Diagnose und wird im deutschen Sprachgebrauch mit „Metastasen eines unbekannten Primärtumors“ (MUP) erklärt, im angloamerikanischen Sprachraum bedeutet CUP „ Cancer of Unknown Primary Site“ oder „Carcinoma with Unknown Primary“ oder „Carcinoma of Unknown Primary Syndrome“. Definitionsgemäß wird dieses Syndrom als der initiale histologische Nachweis einer (Lymphknoten-) Metastase eines malignen Tumors bezeichnet, die mit den derzeitigen klinischen Untersuchungsmöglichkeiten zum Zeitpunkt der Diagnosestellung ohne Hinweis auf den ursprünglichen Tumor bleibt und entweder zufällig oder durch eine neu aufgetretene Symptomatik bei einer ansonsten unauffälligen Tumoranamnese durch den Patienten bemerkt wurde. [20] Beim zervikalen CUP-Syndrom werden die befallenen Lymphknoten in der Regel von den Patienten selbst getastet und stellen sich meist als solitäre, nicht schmerzhafte Verdickungen im Halsbereich dar. Bei 25% kommt auch ein Befall mehrerer Regionen vor, 10% contralateral, 15% ipsilateral. [54] Im Prinzip kann es sich differentialdiagnostisch bei einer Lymphknotenvergrößerung im Halsbereich auch um eine gutartige Lymphadenopathie handeln oder um einen metastatischen Befall einer Neubildung, deren Lokalisation bekannt ist. Auch die Tumorentstehung aus aberriertem branchiogenem Gewebe (aus einer lateralen Halszyste-oder fistel) wurde diskutiert [4, 7, 20, 54], stellt aber eine absolute Rarität dar. Sie wird nur in Ausnahmefällen in die Überlegungen zur Primärtumorsuche einbezogen. Überwiegend finden sich Plattenepithelkarzinome unterschiedlichen Differenzierungsgrades, was ebenfalls für einen Ursprung der Geschwulst im Kopf-HalsBereich spricht. Aber auch Adenokarzinome, die eher dem Speicheldrüsen- und dem Thoraxbereich zuzuordnen sind, kommen vor. Sie sind jedoch wesentlich seltener. Deutlich seltener ist der Lymphknotenbefall durch Maligne Lymphome, Maligne Melanome oder Schilddrüsentumoren. 13 Zur intensiven Primärtumorsuche werden zunächst die üblichen Untersuchungen des HNOBereiches im Sinne von Spiegel- und Lupenuntersuchungen eingesetzt. Falls sich bis dahin noch kein Hinweis auf den Primarius ergibt, wird das weitere Vorgehen ähnlich eines diagnostischen Stufenplanes mittels Panendoskopie mit multiplen Biopsien der verdächtigen aber auch der unverdächtigen Regionen in Kombination mit operativen Eingriffen unterschiedlicher Radikalität zur Histologiegewinnung und Aufarbeitung eingeleitet. Parallel hierzu erfolgt die Diagnostik mit bildgebenden Verfahren. In Bezug auf die Therapiemöglichkeiten setzt das zervikale CUP-Syndrom ein hohes Maß an interdisziplinärer Kooperation zwischen den Operateuren (HNO-Ärzte oder MKGChirurgen), den Pathologen, den Strahlentherapeuten, den Internistischen Onkologen und den nachsorgenden Ärzten voraus, um ein akzeptables Therapieergebnis hinsichtlich der lokalen Kontrolle, der Nebenwirkungen und letztendlich auch des Überlebens zu erzielen. Die optimale Behandlungsstrategie für die Situation „ Halslymphknotenmetastasen bei unbekanntem Primärtumor“ ist nach wie vor nicht geklärt. Die Behandlungskonzepte sind sehr unheitlich. Immer wieder versuchte Abwägungen zwischen Unter- und Übertherapie bestimmten die historische Entwicklung der verschiedenen Strategien. Die Behandlungsempfehlungen reichen von alleiniger Operation bis zur Bestrahlung ausgedehnter Zielvolumina und Chemotherapie. Der Erhalt der Lebensqualität gewann ebenso entscheidende Bedeutung für den Behandlungserfolg. 14 1.2 Begründung für die Durchführung der Untersuchung Die Besonderheit dieser bösartigen Erkrankung, bei der ein Primärtumor trotz bestehender zervikaler Lymphknotenmetastasierung auch nach systematischer Suche nicht nachweisbar ist, war Anlaß, diese Untersuchung durchzuführen. Vor dem zuvor genannten Hintergrund einer kontroversen Diskussion zur optimalen Diagnostik und Therapie soll diese Arbeit einen Beitrag hinsichtlich klinischer Behandlungsmethoden außerhalb kontrollierter klinischer Studien bieten und deren Ergebnisse veranschaulichen. In einer retrospektiven Analyse sollte als eine Form der Qualitätskontrolle dargestellt werden, daß eine Strahlenbehandlung, so wie wir sie durchführten, mit einer Gesamtdosis von ca. 60 Gy - sowohl als Bestrahlung am Linearbeschleuniger als auch in Form einer Kobaltbestrahlung - in etwa der Hälfte der Fälle mit bzw. ohne Applikation einer radiosensibilisierenden Chemotherapie akzeptable Ergebnisse bei der Behandlung des CUP-Syndroms erbringt. Ebenso sollten beim Gesamtüberleben und der lokoregionären Tumorkontrolle die Einflüsse von Operationen (Tonsillektomie, Neck Dissektionen), Risikofaktoren und des eventuell später doch noch erfolgten Primärtumornachweises untersucht werden, sowie die Akzeptanz der Therapie durch die Patienten veranschaulicht werden und unsere Ergebnisse mit Ergebnissen aus der Literatur verglichen werden. Die spezielle wissenschaftliche Fragestellung lautete: 1. Kann durch die Identifikation prädiktiver Faktoren wie Tumorvolumen, Alter oder Gesamtdosis die Therapie zervikaler Lymphknotenmetastasen eines CUP-Syndroms individualisiert werden und sind Auswirkungen auf das Gesamtüberleben und die lokoregionale Tumorkontrolle zu beobachten? 2. Ist eine Chemo/Radiotherapie der alleinigen Strahlentherapie überlegen? 15 2 Überblick über verwendete anatomische und onkologische Klassifikationen, diagnostische und chirurgische Methoden 2.1 Klassifikation der zervikalen Lymphknotenstationen, Nomenklatur der Halslymphknoten, historischer Abriß Von den etwa 1000 Lymphknoten des menschlichen Körpers ist beim (jugendlichen) Erwachsenen etwa ein Drittel im sogenannten pharyngo-zervikalen Segment anzunehmen. [45, 50] Die Terminologie und anatomische Zuordnung dieser ungefähr 300 zervikofazialen Lymphknoten wurde seit Anfang des 20. Jahrhunderts immer wieder und zum Teil auch grundlegend verändert. Die erste fundierte Nomenklatur der Halslymphknoten geht auf Rouviére (1932) [47] zurück. 1963 beschrieb Suárez [53] die zervikalen Lymphknotengruppen auf der Basis der faszialen Kompartmentbildung des Halses. Lindberg (1972) [31] verließ die von Rouviére beschriebene, überwiegend anatomisch orientierte Gruppierung der Halslymphknoten und unterteilte das lymphonoduläre System auf der Grundlage pathophysiologischer Mechanismen. Dadurch veränderte sich die Aufmerksamkeit hinsichtlich des in Abhängigkeit der Primärtumorlokalisation wahrscheinlichen Sitzes okkulter Metastasen. Seit der Arbeit von Shah et al. 1981 [49] gab es eine Vielzahl mehr oder weniger geringfügiger Veränderungen einzelner Regionen [60]. Daneben hat sich seit 1984 eine weitere Nomenklatur nach Som [50] etabliert. Die heute international akzeptierte Terminologie und Klassifizierung der Halslymphknoten der American Academy of Otolaryngology – Head an Neck Surgery beruht auf der Unterteilung der Halslymphknoten nach Robbins [15, 42, 43] in sechs Level, welche 8 Lymphknotengruppen einschließen. 16 Die Halslymphknoten werden danach folgendermaßen unterteilt ( Abbildung 1): Abbildung 1 : Halslymphknotenregionen nach Robbins 1. Submentale /submandibuläre Lymphknotengruppe ( Level I). 2. Tiefe kraniojuguläre Lymphknotengruppe ( Level II ). 3. Tiefe mediojuguläre Lymphknotengruppe ( Level III ). 4. Tiefe kaudojuguläre Lymphknotengruppe ( Level IV ). 5. Lymphknotengruppe des posterioren Halsdreiecks „ Accessoriusgruppe“ ( Level V). 6. Lymphknotengruppe parapharyngeal, retropharyngeal, prätracheales, „vorderes Kompartment“ ( Level VI ). 17 In den Lymphknotengruppen der Level I, II, V werden je zwei Untergruppen (sublevels) nach Suen und Goepfert [55] und nach Robbins selbst, unterschieden. [43] Level I wird in I A : submentale Lymphknotengruppe und in I B : submandibuläre Lymphknotengruppe unterteilt. Level II Wird in eine Lymphknotengruppe medial (II A) und lateral (II B) des Nervus accessorius unterteilt. Level V Wird in Lymphknotengruppen oberhalb (VA) und unterhalb (VB) einer gedachten Linie durch das Krikroid unterschieden, bzw. getrennt durch den Musculus omohyoideus. Level I wird begrenzt von dem Körper der Mandibula, dem vorderen Bauch des contralateralen Musculus digastricus sowie dem vorderen und hinteren Bauch des ipsilateralen Musculus digastricus. Level II reicht von der Schädelbasis bis zur Karotisbifurkation (chirurgische Landmarke). Nach dorsal wird sie begrenzt durch die laterale Grenze des Musculus sternocleidomastoideus. Level III reicht von der Karotisbifurkation bis zur Kreuzung des Musculus omohyoideus mit der Vena jugularis interna (chirurgische Landmarke). Level IV reicht von der Kreuzung des Musculus omohyoideus mit der Vena jugularis interna bis zur Klavikula. Die dorsalen und ventralen Begrenzungen der Regionen III und IV entsprechen denjenigen der Region II. Level V beinhaltet alle Lymphknoten des sogenannten posterioren Dreiecks. Die Begrenzungen werden nach hinten gebildet durch die Vorderkante des Musculus trapezius, nach vorne durch die Hinterkante des Musculus sternocleidomastoideus und nach kaudal durch die Klavikula. Level VI reicht von der Höhe des Zungenbeines bis zum Jugulum. Die laterale Begrenzung ist beidseits medial der Arteria carotis lokalisiert. In dieser Einteilung in sechs Regionen werden die retroaurikulären und subokzipitalen Lymphknoten, die als lymphogener Metastasierungsort maligner Tumoren des Hinterkopfes eine Bedeutung haben, nicht berücksichtigt. Auch die parotidealen Lymphknoten, die den lymphogenen Abfluß von Glandula Parotis, Wange, Augenlidern und Oberlippe darstellen, sind nicht enthalten. [15, 60] 18 2.2 Lymphogene Metastasierungsrichtung und Metastasierungshäufigkeit im Kopf – Hals- Bereich in Abhängigkeit vom Tumorsitz Die Lokalisation der Lymphknotenmetastasen kann Hinweise geben auf die möglichen Lokalisationen eines okkulten Primärtumors im Kopf-Hals-Bereich. [9] So ist es bei Befall eines submentalen Lymphknotens unwahrscheinlich, daß der Primärtumor im Bereich des Nasopharynx zu finden ist, während caudal zervikale und supraklavikuläre Lymphknotenmetastasen ihren Ursprung eher in einem Bronchial- oder einem hoch sitzenden Ösophaguskarzinom haben. [15, 54] Nasopharynx: Der Lymphabfluß des Nasenrachenraums zieht zu den retropharyngealen Lymphknoten (Level VI) und auch zu den Lymphknoten der Regionen II und V (tiefe kraniojuguläre Lymphknotengruppe / „Accessoriusgruppe“). Noch häufiger als das Plattenepithelkarzinom ist hier das lymphoepitheliale Karzinom des Nasenrachenraumes mit einem oftmals frühen und fast regelmäßigem Befall der regionalen Lymphknoten anzutreffen. Nasenhaupthöhle/ Nasennebenhöhle: Die von der Nasenhaupthöhle und den Nasennebenhöhlen ausgehenden Karzinome metastasieren initial am häufigsten in die Region I, in die retropharyngealen und parotidealen Lymphknoten sowie in die Lymphknoten der Region II. Lippen und Mundhöhle: Der lymphogene Abfluß der Unter- und Oberlippe fließt vorwiegend zu den Lymphknoten der Region I und der der Oberlippe, zusätzlich zu den Lymphknoten im Bereich der Glandula parotis. Plattenepithelkarcinome der vorderen Zweidrittel der Zunge drainieren überwiegend in die Lymphknoten der Region I, vom Zungenrand und hinterem Zungenkörper zusätzlich in die Lymphknoten der Halslymphknotenregion II. 19 Oropharynx: Der Lymphabfluß des Zungenrandes und der Tonsilla palatina erfolgt zu den Lymphknoten der Regionen II und III, vereinzelt auch zu den retropharyngelaen Lymphknoten. Hypopharynx: Aus dem Hypopharynxraum fließt die Lymphflüssigkeit überwiegend zu den Lymphknoten der Regionen II und III. Der Lymphabfluß der Rachenhinterwand erfolgt meist zunächst in retropharyngeale Lymphknoten, deren Lymphe an die Lymphknoten der Regionen II und III weitergeleitet wird. Larynx: Die Lymphflüssigkeit der supraglottischen und größtenteils auch der glottischen Regionen fließt gemeinsam mit der Lymphe des kranialen Hypopharynxabschnittes überwiegend zu den Lymphknoten der Regionen II und III. Die subglottische Lymphe fließt zu den Lymphknoten der Regionen III sowie zu den Lymphknoten der Region IV ab. Haut: Plattenepithelkarzinome der Haut machen einen Anteil von 20% der bösartigen Hauttumoren aus, wobei die Mehrzahl der Tumoren an der Haut des Kopfes auftritt. Karzinome der sonnenexponierten Haut führen in ca. 5% zu Lymphknotenmetastasen. Diese sind bevorzugt in den Lymphknoten im Bereich der Glandula parotis lokalisiert. Eine Sonderstellung nehmen Plattenepithelkarzinome der Ohrmuschel ein, für die Lymphknotenmetastasen in bis zu 11% beschrieben werden. [15, 54, 60] 20 2.3 Klassifikation des Tumorstadiums nach TNM Analog zum oben genannten lautet die Beschreibung der regionären Lymphknoten der Kopf-Halsregion nach der TNM-Klassifikation der UICC (International Union against Cancer): [51, 63, 64] (1) Submentale Lymphknoten (2) Submandibuläre Lymphknoten (3) Kraniale jugulare (tiefe zervikale) Lymphknoten (4) Mediale jugulare (tiefe zervikale) Lymphknoten (5) Kaudale jugulare (tiefe zervikale) Lymphknoten (6) Dorsale zervikale (oberflächliche zervikale) Lymphknoten entlang des N. accessorius (7) Supraklavikuläre Lymphknoten (8) Prälaryngeale*, prätracheale und paratracheale Lymphknoten (Level IV) (9) Retropharyngeale Lymphknoten (10) Parotis-Lymphknoten (11) Wangenlymphknoten (12) Retroaurikuläre und okziptale Lymphknoten *Anmerkung: Die prälaryngealen Lymphknoten werden als „Delphi-Lymphknoten“ bestimmt. N / pN Klassifikation der UICC (International Union against Cancer) [51, 63, 64] Die Definitionen der N-Kategorien für alle Kopf-Halsbezirke (außer der Schilddrüse) lauten: N / pN Regionäre Lymphknoten. N / pN X Regionäre Lymphknoten können nicht beurteilt werden. N / pN 0 Keine regionären Lymphknotenmetastasen. N / pN 1 Metastase(n) in solitärem ipsilateralem Lymphknoten, 3 cm oder weniger in größter Ausdehnung. 21 N / pN 2 Metastase(n) in solitärem ipsilateralem Lymphknoten, mehr als 3 cm, aber nicht mehr als 6 cm in größter Ausdehnung oder in multiplen ipsilateralen Lymphknoten, keine mehr als 6 cm in größter Ausdehnung, oder in bilateralen oder contralateralen Lymphknoten, keine mehr als 6 cm in größter Ausdehnung. N / pN2a Metastase(n) in solitärem ipsilateralem Lymphknoten, mehr als 3 cm, aber nicht mehr als 6 cm in größter Ausdehnung. N / pN2b Metastasen in multiplen ipsilateralen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung. N / pN2c Metastasen in bilateralen oder contralateralen Lymphknoten, keiner mehr als 6 cm in größter Ausdehnung. N / pN3 Metastase(n) in Lymphknoten, mehr als 6 cm in größter Ausdehnung. Anmerkung: In der Mittellinie gelegene Lymphknoten gelten als ipsilateral. R-Faktor (Residualtumor) [51, 63] Der R-Faktor beschreibt das Vorhandensein von Residualtumoren nach einer Behandlung. RX Vorhandensein von Residualtumor kann nicht beurteilt werden. R0 Kein Residualturmor. R1 Mikroskopischer Residualtumor. R2 Makroskopischer Residualtumor. 22 2.4 Histologische Tumorklassifikation und histologische / histochemische Untersuchungsmethoden Die histologische Klassifikation hat bei Diagnostik und Therapie eines CUP-Syndroms einen hohen Stellenwert, da der Kopf-Hals-Bereich aufgrund seiner komplexen Anatomie sowie durch das Vorkommen einer großen Vielfalt an gutartigen und bösartigen epithelialen, mesenchymalen und lymphatischen bzw. hämatologischen Neoplasien gekennzeichnet ist. [5, 20, 41] Beim zervikalen CUP-Syndrom Plattenepithelkarzinome, gefolgt von finden sich mit undifferenzierten 73% am Karzinomen häufigsten (16%) und lymphoepithelialen Karzinomen (6%) sowie Adenokarzinomen und Melanomen (4%). In diesem Zusammenhang ist zu beachten, daß das Auftreten von undifferenzierten Lymphknotenmetastasen häufig auf metastasierende undifferenzierte Karzinome, Sarkome, diffuse histiozytäre Lymphome und metastasierende Melanome hinweisen kann. [22] Um diesem zu entsprechen, muß der Pathologe eine repräsentative Gewebsprobe sowie ausführliche klinische Informationen erhalten. Diese sollten immer Angaben zur Vorgeschichte, Berufsanamnese, Genußmittelanamnese, Symptomatologie, Lokalisation der Metastasen, klinische Befunde und Hinweise auf Ergebnisse bildgebender Verfahren enthalten. Umgekehrt erhoffen sich dann die Kliniker Informationen bzw. Hinweise zur Lokalisation des Primärtumors. Plattenepithelkarzinom der Schleimhäute Das Plattenepithelkarzinom des oberen Aerodigestivtraktes wird von der WHO definiert als maligner epithelialer Tumor mit plattenepithelialer Differenzierung, charakterisiert durch ein vom histologischen Malignitätsgrad abhängiges Ausmaß an Hornbildung und Vorhandensein von Interzellularbrücken. Als Hauptrisikofaktoren gelten mit unterschiedlicher Wichtung in verschiedenen Lokalisationen langjähriger Alkohol- und Nikotinkonsum bzw. Abusus. 23 Sonderformen des Plattenepithelkarzinoms - Verruköses Karzinom Das verruköse Karzinom umfaßt etwa 1 % aller Plattenepithelkarzinome im Kopf-HalsBereich mit Hauptlokalisation im Mundraum (73%, vor allem bukkal) bzw. Kehlkopf (11%). Es manifestiert sich vorzugsweise im 7. und 8. Lebensjahrzehnt. Als pathogen wird ein Teil der Fälle mit Tabakkauen in Zusammenhang gebracht. Verruköse Karzinome neigen zu Rezidiven mit lokal aggressivem Wachstum. - Spindelzellkarzinom Dieser Variante sind etwa 0,3-1,3% aller Plattenepithelkarzinome zuzurechnen. Mit einem Durchschnittsalter von 70 Jahren betreffen sie bevorzugt das höhere Lebensalter. Zur sicheren Abgrenzung von Weichgewebstumoren sind zusätzliche immunhistochemische Untersuchungen erforderlich. Auch hier ergibt sich eine Korrelation mit Nikotinabusus. Eine Dominanz bei Männern und eine hohe Rate an Lymphknotenmetastasen (33-60%) unterstreicht den epithelialen Ursprung dieser Tumoren. Sie besitzen generell einen hohen Malignitätsgrad. Die Mortalitätsraten sind mit 34-77%, je nach Lokalisation, vergleichsweise hoch. - Basaloides Plattenepithelkarzinom Diese seltenere Untergruppe umfaßt ca. 1 % aller Plattenepithelkarzinome und manifestiert sich bevorzugt im Parapharyngealraum und Supraglottisbereich sowie im Zungengrund. Der hohe Malignitätsgrad und ein häufig fortgeschrittenes Tumorstadium bedingen eine schlechte Prognose. - Lymphoepitheliales (undifferenziertes) Karzinom Die Nomenklatur dieses Tumortyps war lange Zeit uneinheitlich (Lymphoepitheliom, Schmincke-Tumor, Transitionalzellkarzinom usw. ) Die aktuelle WHO-Klassifikation unterscheidet das lymphoepitheliale (undifferenzierte) Karzinom vom nicht- keratinisierenden Plattenepithelkarzinom. Bei beiden wird eine transformierende Wirkung durch EBV postuliert. Daneben treten im Nasopharynx selten auch nicht- EBV-assoziierte klassische verhornende Plattenepithelkarzinome auf. 24 Das lymphoepitheliale Karzinom manifestiert sich neben anderen selteneren Lokalisationen insbesondere im Nasopharynx. In Europa tritt es vergleichsweise selten auf, in Südostasien zählt es zu den häufigsten malignen Tumoren. Die Altersverteilung ist zweigipflig mit Dominanz im 2. und 6. Lebensjahrzehnt. Pathognomonisch sind eine hohe Rate an Lymphknotenmetastasen, oftmals dorsal des Musculus sternocleidomastoideus auch bilateral sowie hämatogene Metastasen. Eine primäre klinische Manifestation durch zervikale Lymphknotenmetastasen ist häufig. Gelegentlich ist ein okkulter Primärtumor im Nasopharynx erst bei wiederholter Biopsie nachweisbar. Der hohe Malignitätsgrad und das meist fortgeschrittene Tumorstadium bedingen eine ungünstige Prognose. Der Tumor zeichnet sich jedoch über eine vergleichsweise hohe Strahlensensibilität aus. Histomorphologisch vergleichbare Tumoren manifestieren sich im Kopf-Hals-Bereich vor allem in den Gaumentonsillen und im Zungengrund. Sie zeigen eine dem lymphoepithelialen Nasopharynxkarzinom vergleichbare klinische Manifestation mit großen, schnell wachsenden Lymphknotenmetastasen bei häufig kleinem, z.T. okkulten Primärtumor. Adenokarzinome Die überwiegende Mehrzahl von primären Adenokarzinomen des Kopf-Hals-Bereiches entwickelt sich in den Speicheldrüsen. - Sinonasales Adenokarzinom Etwa 75% dieser Karzinome werden pathogenetisch mit Holzstaub-Exposition in Zusammenhang gebracht. Männer sind zu 80% betroffen. Deshalb ist eine genaue Erhebung der Berufsanamnese wichtig zur Einleitung eines Berufskrankheitenverfahrens. Die Tumoren entstehen besonders häufig im Siebbeinbereich, oder in Nasenhaupt- und Kieferhöhle. Prognostisch ungünstig ist eine Infiltration in die Orbita oder die Schädelbasis. Todesfälle resultieren überwiegend aus einer lokalen Tumorprogression. 25 Adenoid-cystisches Karzinom In den meisten Fällen wird das adenoid-cystische Karzinom als ein infiltrierender maligner Speicheldrüsentumor mit dem charakterischen histologischen Merkmal siebartig durchlöcherter Epithelstränge und zunächst mäßiggrader Aggressivität diagnostiziert. Es zeichnet sich durch ein ausgeprägt infiltratives Wachstum in die perineuralen Bindegewebs-und Gefäßscheiden aus. Typisch für diesen Tumor ist der klinisch oft langsame Verlauf. Die Wahrscheinlichkeit einer lokoregionalen Lymphknotenmetastasierung ist geringer als die der Fernmetastasierung. Der Altersgipfel liegt zwischen dem 45. und 50. Lebensjahr, wobei beide Geschlechter in etwa gleich häufig betroffen sind. Großzelliges / hellzelliges Karzinom Es wird als eine eine histologische Gruppe mit Riesenzellen und hellzelliger Komponente in der WHO Klassifikationen aufgeführt. Jedoch scheint es sich oft um Varianten von Plattenepithel-, oder Adeno-, oder mischzelligen Karzinomen zu handeln. Großzellige Karzinome mit neuroendokrinen Charakteristika sind mit einer ungünstigen Prognose behaftet. Kleinzelliges Karzinom Es handelt sich um anaplastische, zytoplasmaarme Tumorzellen mit teils rundlichen (lymphocytenähnlichen), teils langgestreckten Zellkernen. Die Zellen schließen in ihrem Zytoplasma elektronenmikroskopisch nachweisbare Serotoningranula ein, weisen Reste einer neuroendokrinen Differenzierung auf und exprimieren neuronspezifische Enolase sowie die embryonale Form des neuralen Zelladhäsionsmoleküls (N-CAM). Zusammen mit dem Bronchuskarziniod bzw. als dessen maligne Variante werden sie zu den (bronchialen) neuroendokrinen Karzinomen mit ungünstiger Prognose gerechnet. 26 Weichgewebs- und Knochentumoren Eine Vielzahl unterschiedlicher Knochen- und Weichteilgewebstumoren manifestiert sich, jedoch mit geringer Häufigkeit im Kopf-Hals-Bereich. Sie metastasieren sehr selten hämatogen. - Rhabdomyosarkome Sie betreffen mit 34-44% den Kopf-Hals-Bereich und manifestieren sich meist als schnell wachsende und oft Parapharyngealraum knöchern und verschiedenen Subtypen infiltrierende Nasennebenhöhlen. Tumoren, Zur bevorzugt sicheren in Orbita, Differenzierung der sind meist immunhistochemische Untersuchungen mit unterschiedlichen Antikörpern erforderlich. - Olfaktorisches Neuroblastom (früher Aesthesioneuroblastom) Dieser ist ein seltener neuroendokriner maligner Tumor, der seinen Ausgang von der olfaktorischen Schleimhaut nimmt und sich im Bereich der Nasennebenhöhlen bzw. der vorderen Schädelbasis manifestiert. Es besteht eine zweigipflige Altersverteilung um das 15. und 55. Lebensjahr. Klinisch stehen Behinderung der Nasenatmung, Sehstörungen, Kopfschmerzen und Anosmie im Vordergrund. Auch hier sind immunhistochmische Untersuchungen zur Abgrenzung zu anderen Tumoren erforderlich. In Abhängigkeit von der Histologie der Halslymphknotenmetastasen lassen sich Rückschlüsse auf den möglichen Primärtumorsitz ziehen, wie in Tabelle 1 dargestellt. Tabelle 1: Halslymphknotenmetastase und möglicher Primärtumorsitz ↓ Adenokarzinom ↓ Schilddrüse Lunge Mamma Ovar Speicheldrüsen Halslymphknotenmetastase ↓ ↓ Plattenepithel Karzinom Kleinzelliges Karzinom Möglicher Primärtumorsitz ↓ ↓ Kopf-HalsBereich Lunge Ösophagus ↓ Undifferenziertes Karzinom ↓ Lunge Lunge Ösophagus Kopf-HalsBereich Ösophagus Mamma Ovar 27 Histologische und immunhistochemische Untersuchungsmethoden Zunächst werden die histologischen Präparate mit Hämatoxylin-Eosin eingefärbt und dann in Abhängigkeit des Befundes sowie der klinischen Informationen einer immunhistochemischen Untersuchung zugeführt. Diese umfassen die Reaktionen auf Zytokeratine, Vimentin, HMB-45, Melan-A, LCA (leucocyte common antigen), CD-Epitope, NSE (neuronspezifische Enolase), Chromogranin, HCG, AFP, TTF-1, Thyreoglobulin, PSA sowie Östrogen-ProgesteronRezeptoren. Definitionsgemäß führen immunhistochemische Untersuchungen bei Vorliegen eines CUPSyndroms durchaus nicht immer zur Identifizierung des Primärtumors, sie sind aber bei nicht differenzierten Malignomen und undifferenzierten Karzinomen wichtig zur Charakterisierung des Neoplasmas und somit zur Abschätzung der Prognose und zur Festlegung therapeutischer Strategien. [20, 41] 28 2.5 Diagnostisches Vorgehen Allgemein ist zu sagen, daß sich bei Vorliegen einer oder mehrerer zervikaler Lymphknotenmetastasen die klinische Diagnostik auf die Suche eines möglichen Primärtumors im Hals-Nasen-Ohrenbereich fokussiert. Notwendige Untersuchungen bei einem symptomatischen Patienten umfassen zunächst – nach ausführlicher Anamnese – die klinische Untersuchung, die Inspektion des Halses und die orientierende Palpation der verdickten Halslymphknoten. Zur zusätzlichen Diagnostik stehen verschiedene technische Möglichkeiten - sowohl nicht-invasive als auch invasive - zur Verfügung, wie in der Tabelle 2 dargestellt. Tabelle 2: Diagnostisches Vorgehen - Anamnese - Körperliche Untersuchung mit Palpation und Inspektion des Halses und der gesamten peripheren Lymphknotenstationen - Lymphknotenpunktion - Panendoskopie mit multiplen Probebiopsien - Tonsillektomie - Sonographie des Halses/ Halslymphknoten - CT/MRT des Halses - FDG-PET (optional) - Röntgenaufnahme des Thorax - Abdomensonographie - Skelettszintigraphie - Labor, Tumormarker 29 2.5.1 HNO-fachärztliche Untersuchungen einschließlich chirurgischer Exploration Zur Primärtumorsuche, Ausdehnungsbestimmung und zur histologischen Sicherung einer Metastasierung im Kopf-Hals-Bereich wird im Anschluss an die HNO- Spiegeluntersuchung (in der Regel einschließlich Endoskopie von Nasenhaupthöhle und/oder Nasennebenhöhlen, Nasopharynx, Hypopharynx und Larynx) die sogenannte Panendoskopie mit ausgedehnter Probeentnahme aller suspekten Bereiche in Allgemeinnarkose durchgeführt. Die Forderung nach der routinemäßigen Durchführung dieser diagnostischen Maßnahmen leitet sich davon ab, daß die exogenen Noxen, welche überwiegend Ursache von KopfHals-Tumoren sind, auf die Schleimhaut des gesamten oberen Aerodigestivtraktes einwirken und somit die gesamte Schleimhaut dem Risiko einer Karzinomentstehung ausgesetzt ist. Die Panendoskopie umfaßt im Einzelnen: - Ösophagoskopie (starr, bevorzugt flexibel), - Hypopharyngoskopie, - Mikrolaryngoendoskopie (unter mikroskopischer Kontrolle), - Nasopharyngoskopie sowie - Tracheoskopie, - Bronchoskopie. Zur dezidierten Tumorsuche im Rahmen der Panendoskopie müssen systematisch alle verdächtigen Läsionen aus Zungengrund, Nasopharynx und Hypopharynx sowie aller sonstigen suspekten Regionen biopsiert werden. Diagnostische chirurgische Maßnahmen, die abhängig vom Ausmaß der Metastasierung sinnvoll sind, umfassen die Lymphknoten-Probeexcision und die weiter unten besprochene Neck Dissektion und Tonsillektomie. Sie dienen somit dem operativen Staging und ggf. auch der Therapie. Es können aber auch Feinnadelpunktionen der auffälligen Lymphknoten unter sonographischer Führung oder CT-gesteuert erfolgen. 30 2.5.2 Bildgebende Diagnostik Bei der Wahl der diagnostischen Bildgebungsverfahren spielen die Lokalisation der Lymphknotenmetastasen wie auch die daraus resultierenden therapeutischen Konsequenzen eine entscheidende Rolle. Da in der Kopf-Hals-Region überwiegend differenzierte Fragestellungen zu beantworten und komplexe anatomische Strukturen zu untersuchen sind, werden an die Untersuchungstechnik, die apparative Ausstattung und die fachkundige Bewertung hohe Anforderungen gestellt. [16, 23, 24, 32, 45] Als bildgebende Standarduntersuchung gilt heutzutage die B-Bild-Sonographie. Sie zählt zu den sehr weit verbreiteten Bildgebungstechniken, ist aber wie keine andere von der Erfahrung des Untersuchers abhängig. Eine objektive Dokumentation ist oftmals schwierig. Da es in der Kopf-Hals-Region – wie bereits oben beschrieben - ca. 300 Lymphknoten gibt und mit der Sonographie weder alle Lymphknotenregionen noch das lymphatische Gewebe des Naso- und Oropharynx erfaßt werden können, ist die Aussagekraft der Sonographie für ein hinreichend genaues Lymphknotenstaging deutlich eingeschränkt. Die ergänzende Bildgebung umfaßt die Diagnostik der lokalen Tumor /Lymphknotenausbreitung, vorzugsweise durch Computertomographie (CT) und Magnetresonanztomographie (MRT). Die Computertomographie (CT) vermag sowohl einen Primärtumor als auch die Lympknotenstationen adäquat darzustellen. Hierzu ist allerdings eine intravenöse Kontrastmittelinjektion unerläßlich. Die Indikation zur CT-Untersuchung bei Kopf-Hals-Malignomen ist von der zu untersuchenden Region und der zu beantwortenden Fragestellung abhängig. Aufgrund der häufig eingeschränkten Kooperationsfähigkeit der Patienten und der durch Schlucken verursachten Bewegungsartefakte ist heutzutage die CT im Spiralmodus vorzuziehen. [24] 31 Die Magnetresonaztomographie (MRT) ist hinsichtlich des Weichteilkontrastes allen anderen bildgebenden Verfahren deutlich überlegen. Während Tumoren in der CT vorwiegend aufgrund ihrer raumfordernden Wirkung und ihres Kontrastmittelenhancements identifiziert werden, zeichnet sich Tumorgewebe in der MRT durch deutlich unterschiedliche Relaxationszeiten und Signalintensitäten aus. Infolgedessen können Tumoren direkt dargestellt und von peritumorösen Ödemen unterschieden werden. Auch die Differenzierung von vitalen Tumoranteilen gelingt mit der MRT besser. Abgesehen von diesen allgemeinen Vorteilen können spezielle Fragestellungen mit der MRT gezielt geklärt werden, so daß gelegentlich die Kombination aus CT und MRT angezeigt sein kann. Allerdings können weder Sonographie noch CT oder MRT eine verläßliche Differenzierung zwischen benignen oder malignen Läsionen leisten. Sie können die palpatorische Beurteilung des Halses nicht ersetzen, aber ergänzen. In Einzelfällen ist es heutzutage möglich, zusätzliche Untersuchungsverfahren wie die Positronenemissionstomographie (FDG-PET) im Anschluß durchzuführen zu lassen. Die PET mit F-18-Fluordeoxyglucose (FDG) erlaubt die Darstellung malignen Gewebes. Ziel der Untersuchung ist die Darstellung von Primär- und Zweittumoren sowie von Metastasen. Der Mechanismus der Aufnahme von FDG in maligne Zellen basiert auf der gesteigerten Glykolyse und der vermehrten Expression von Glukosetransportern im Vergleich zu normalen Geweben. Diese Glukosestoffwechselsteigerung kann durch Tumorgewebe oder durch Entzündungen hervorgerufen werden, so daß eine Differenzierung zwischen beiden Entitäten schwierig oder nicht möglich sein kann. Die diagnostische Aussagekraft der PET wird darüber hinaus durch einen erhöhten Blutzuckerspiegel bei Diabetikern deutlich beeinträchtigt. Stoffwechselerhöhungen durch Muskelaktivität, wie sie beim Sprechen und beim starken Schlucken vorkommen, limitieren ebenfalls die Wertigkeit der PET. Aufgrund ihrer geringeren räumlichen Auflösung ist die PET jedoch auf die CT und die MRT angewiesen, die Tumorinvasionen durch ihre guten räumlichen Auflösungen und durch unterschiedliche Gewebekontraste leichter nachweisen können. Die FDG-PET ermöglicht es, Informationen über den Stoffwechsel eines okkulten Primärtumors und seiner Metastasen zu erhalten, kann aber auch mit einer Rate von 15-46% falsch positive Ergebnisse liefern. 32 Der Stellenwert dieser Untersuchung ist also noch nicht definitiv geklärt, in aktuellen Publikationen werden in 20-24% der Fälle vorher okkulte Primärtumoren entdeckt. Wegen der eingeschränkten Verfügbarkeit und des hohen Kostenaufwandes ist sie aber bisher nicht als Routinediagnostik etabliert. [23] Die Skelettszintigraphie mit 99m Technetium kann als Teil- oder Ganzkörperskelettszintigraphie durchgeführt werden. Die Untersuchung erfolgt in einer 3-Phasen-Technik. Es wird eine Erhöhung des Knochenumsatzes, die nicht tumorspezifisch ist, nachgewiesen. Bei Entzündungen ist der Stoffwechsel auch erhöht. Eine Differenzierung zwischen Entzündung und Malignom ist oft nicht möglich. Außerdem führen alte Traumen oder degenerative Veränderungen häufig zu falsch positiven Befunden. Eine lokale Knocheninvasion durch einen Tumor wird jedoch mit hoher Sensitivität schon im Frühstadium nachgewiesen. Im Rahmen des Tumorstagings dient die Technetium-Szintigraphie dem Nachweis von Fernmetastasen im knöchernen System . Daneben erfolgen eine Röntgenuntersuchung des Thorax in zwei Ebenen und die Abdomensonographie zum Ausschluß einer weiteren Metastasierung oder zum Nachweis des Primärtumors. Bei fortgeschrittenen Malignomen sollte im Rahmen der Primärdiagnostik eine CT-Untersuchung des Thorax und des Abdomens erfolgen. 2.5.3 Tumormarker Tumormarker sind Makromoleküle, die im Blut oder in anderen Körperflüssigkeiten zirkulieren und deren Auftreten oder Konzentrationsveränderungen mit dem Entstehen oder Wachstum von bösartigen Tumoren des Menschen in Beziehung stehen. Sie werden auf oder in Tumorzellen oder auch durch Induktion anderer Zellen produziert. Serologische Tumormarker bei HNO-Tumoren sind weder genügend spezifisch noch genügend sensitiv für diagnostische Zwecke, sie sind somit für Screening –Untersuchungen nicht indiziert. 33 Ihre eigentliche Bedeutung liegt daher in der Einengung des möglichen histologischen Typs, der Definition des Ausmaßes der Erkrankung und damit der Prognose und nicht zuletzt der Therapie-Überwachung bzw. Hinweisen auf ein Rezidiv oder Metastasen. [20, 28, 41] Von den serologischen Tumormarkern haben bei Malignomen im Hals-Nasen-OhrenBereich das CEA (karzinoembryonales Antigen) , das SCCA (Squamous Cell Carcinoma Antigen) und der Zytokeratinmarker CYFRA 21-1, NSE (Neuronspezifische Enolase) und Chromogranin eine gewisse Bedeutung. Das CEA ist ein Glykoprotein, welches zur Familie der Immunglobuline gehört. Für die HNO-Tumoren wird eine leicht geringere Sensitivität als für das SCCA beschrieben. Bei Rauchern liegen die Werte etwas höher als bei Nichtrauchern. Das SCCA ist auch ein Glykoprotein, welches in Plattenepithelkarzinomen die Funktion eines Strukturproteins hat und ggf. Hinweise auf den Differenzierungsgrad geben kann. Für die Plattenepithelkarzinome im HNO-Bereich zeigt SCCA eine enge Korrelation der Serumkonzentration mit Tumorstadium und Therapieerfolg. Beim CYFRA 21-1 handelt es sich um ein wasserlösliches Zytokeratin-19-Fragment, welches in normalen Epithelzellen und in Tumorzellen epithelialen Ursprungs – insbesondere in der Lunge- exprimiert wird. Es tritt eher nur in den späten Tumorstadien auf und ist somit als additiver Marker zum SCCA zu bestimmen. Als serologische Marker neuroendokriner Zellen sind die Neuronspezifische Enolase (NSE) und Chromogranin zu erwähnen. Allen Zellen des „diffusen neuroendokrinen Systems“ ist die Fähigkeit gemeinsam, biogene Amine und/oder Polypeptide (oder Transmittersubstanzen) zu bilden und zu speichern. Diese Zellprodukte können als Hormone auf endokrinem Weg entfernte, auf parakrinem Weg benachbarte Zielzellen stimulieren oder sie können als Neurotransmitter fungieren. 34 2.6 Neck Dissektionen Definition: Die Entfernung aller Lymphknoten einschließlich des umgebenden Fett- und Bindegewebes der gesamten Halsseite oder bestimmter regionärer Lymphknotengruppen (sogenannte Level). [2] Indikationen: -Manifeste oder wahrscheinliche Halslymphknotenmetastasen bei bekanntem Primärtumor -Lymphknotenmetastasen bei unbekanntem Primärtumor (CUP-Syndrom) Klassifikation der Neck Dissektionen: [2, 15, 55, 60, 61] Indikation / Therapeutisches Ziel: Kurative Neck Dissektion zur Entfernung gesicherter Halslymphknotenmetastasen. Elektive Neck Dissektion bei nicht nachgewiesenen, jedoch nach Art und Lokalisation des Tumors sehr wahrscheinlichen Halslymphknotenmetastasen. Die unterschiedlichen Operationsarten der Neck Dissektionen werden aufgrund der oben ausgeführten Halslymphknotenklassifikation folgendermaßen unterteilt: [54, 55] 1. Radikale Neck Dissektion (RND): Basisverfahren der zervikalen Lymphadenektomie mit Entfernung der Lymphknotengruppen Level I-V, Resektion der V. jugularis interna, des M. sternocleidomastoideus und des N. accessorius. 2. Modifizierte radikale Neck Dissektion (MRND): Entfernung aller Lymphknotengruppen Level I-V unter Erhalt einer oder mehrerer nicht-lymphatischer Strukturen. 3. Selektive Neck Dissektion (SND): Resektion von mindestens zwei, aber weniger als fünf Lymphknotengruppen, Erhalt von mindestens einer nicht-lymphatischen Strukur. 4. Erweiterte radikale Neck Dissektion (ERND): Entfernung zusätzlicher Lymphknotengruppen (z.B. intraparotideale Lymphknoten) oder nicht-lymphatischer Strukturen (z.B. Glandula Parotis, Schilddrüse). 35 5. Funktionelle Neck Dissektion (MRND Type III): Entspricht operationstechnisch prinzipiell der RND mit Entfernung des gesamten Fett- und Bindegewebsblockes einschließlich der Lymphknoten en bloc, jedoch unter Erhalt von Nervus accessorius, Musculus sternocleidomastoideus, Vena jugularis interna und gelegentlich Schonung der zervikalen Plexusanteile. Eine Resektion der Lymphknotengruppe des Level I (submentale, submandibuläre Lymphknoten) ist nicht erforderlich, wenn ihre Mitbeteiligung unwahrscheinlich erscheint. Beim CUP-Syndrom und Operabilität des Patienten wird meistens die ipsilaterale Lymphknotendissektion in Form einer „Modifiziert Radikalen Neck Dissektion“ durchgeführt. Lassen sich jedoch pathohistologisch Lymphknotenmetastasen nachweisen, wäre es wünschenswert, gleichzeitig eine elektive contralaterale ND durchzuführen, auch wenn klinisch kein Anhalt für eine zervikale Metastasierung auf dieser Seite besteht. Fakultativ könnte auch eine „Selektive Supraomohyoidale Neck Dissektion“ der Gegenseite erfolgen. Deren onkologischer Wert ist zwar bei sonographisch unauffälligen Verhältnissen umstritten, insbesondere wenn eine postoperative Strahlenbehandlung des Halses erfolgen soll. [61] In jedem Fall ist aber zu berücksichtigen, daß eine funktionelle und ästhetisch-kosmetische Beeinträchtigung in Kauf genommen werden muß. Bei technischer Inoperabilität kann die Operationsindikation nach Durchführung einer primären Radiotherapie erneut geprüft werden. Reddy et al. [40] berichten, daß die Tumorkontrollrate nach Neck Dissektion im Gegensatz zur Probeexcision mit 90% versus 48% erheblich höher liegt. Auch die Rate des tumorfreien 5-Jahresüberlebens ist mit Neck Dissektion versus Biopsie vor der Strahlentherapie mit 61% gegenüber 37% günstiger. Die Halslymphknotenausräumung ist somit bereits ein wesentlicher Bestandteil der Therapie. 36 2.7 Tonsillektomie Eine ipsilaterale Tonsillektomie (TE) führt in bis zu 26% der Fälle zur Entdeckung eines ansonsten inapparenten Primärtumors [29, 34]. Deshalb wird eine geplante, möglichst bilaterale Tonsillektomie als Teil der diagnostischen Aufarbeitung bei Patienten mit zervikalem CUP-Syndrom gefordert, da die Tonsillen neben dem Nasopharynx und dem Zungengrund der häufigste Sitz unentdeckter Primärtumoren sind. Insbesondere bei singulärem subdigastrischen, mittlerem jugulocarotidischen oder submandiublärem Lymphknotenbefall. Wird in den Tonsillen der Primärtumor entdeckt, kann gegenüber einem CUP-Syndrom das Zielvolumen bei der Bestrahlung eingeschränkt werden. 37 3 Patientenkollektiv und Methoden 3.1 Strukturierung des Patientenkollektivs und Behandlungszeitraum Das Studienkollektiv umfaßte ausschließlich Patienten, die einen zytologisch und / oder histologisch gesicherten Nachweis einer z e r v i k a l e n Lymphknotenmetastasierung eines Tumors aufwiesen, der weder durch Anamnese, klinische Untersuchungen, Laboruntersuchungen, operatives Staging im Sinne von Lymphknotenexcisionen, Panendoskopien des Aerodigestivtraktes und der Nasennebenhöhlen mit multiplen Probeentnahmen oder durch invasive/nicht invasive bildgebende Untersuchungen detektierbar war. Diese Vorgabe entspricht der zuvor in der Einleitung erwähnten Definition des CUP-Syndroms. Die Daten der vorliegenden retrospektiven Analyse stammen von 84 Patienten, die über einen Zeitraum von 15,4 Jahren nachbeobachtet wurden und zwischen Oktober 1990 und März 2006 in der Radiologischen Klinik, Abteilung für Strahlentherapie des St. Josef Hospitals in Bochum strahlentherapeutisch behandelt wurden. Die Datenerhebung konnte im März 2006 abgeschlossen werden. 3.2 Diagnostik Die Voruntersuchungen zur Erstdiagnosestellung CUP-Syndrom und auch die operative Behandlung erfolgten mehrheitlich in der Hals-Nasen-Ohren Abteilung des St. Elisabeth Hospitals, Bochum gefolgt von der Klinik für Mund-Kiefer- und Gesichtschirurgie im Knappschaftskrankenhaus, Bochum. Die übrigen Patienten wurden aus weiter entfernten Kliniken (Mund-Kiefer-und Gesichtschirurgie in Hattingen) zugewiesen. 38 3.3 HNO-ärztliche Operationen Bei Vorliegen eines CUP-Syndroms erfolgte die chirurgische Behandlung des Lymphabflußgebietes im Sinne der oben beschriebenen Neck Dissektionen entweder als funktionelle oder radikale Neck Dissektion bzw. unilaterale Lymphknotenexstirpation. Zusätzlich wurden ein - oder beidseitige Tonsillektomien durchgeführt. 3.4 Klassifikation der befallenen zervikalen Lymphknoten Die Klassifikation der befallenen zervikalen Lymphknotenstationen beruhte auf der oben beschriebenen Einteilung nach Robbins und die histologische Klassifikation auf der vorliegenden histopathologischen Befundung der beiden Pathologischen Institute der RuhrUniversität Bochum. Das operative Staging erfolgte in den oben aufgeführten unterschiedlichen Kliniken, so daß unsererseits lediglich eine Überprüfung stattfand, ob eine Neck Dissektion und wenn ja, ein- oder beidseitig, bzw. als Funktionelle ND oder als Modifiziert Radikale ND durchgeführt wurde, oder ob lediglich eine Lymphknoten-Probeexcision erfolgte. Des weiteren erfaßten wir, ob die Patienten eine ein- oder beidseitige Tonsillektomie erhalten hatten. 3.5 Bestimmung des Tumorvolumens/Lymphknotenvolumens Zur Einschätzung des Lymphknotenvolumens/ Tumorvolumens wurden zunächst die sichtbaren, vergrößerten Lymphknoten in allen CT-Schnitten dargestellt. Unter Verwendung der Scala (üblicherweise ca. 5-7 cm Länge) die in jeder Serie mit abgebildet wird, wurden die peripheren Begrenzungen nachgezeichnet, d.h. umfahren und daraus die Fläche in der Schicht berechnet. So entstanden Querschnittsflächen in vielen Ebenen, getrennt durch die Distanz zwischen den einzelnen CT-Schnitten. Die Distanz bzw. Schichtdicke zwischen den CT-Schnitten (3 mm oder 5 mm) wurde anschließend mit der Fläche multipliziert, dann Lymphknotenvolumens herangezogen. aufaddiert und so zur Berechnung des 39 3.6 Strahlentherapie In unserer Abteilung wurden die meisten Patienten mit zervikalen Lymphknotenmetastasen bei unbekanntem Primärtumor unter kurativem Aspekt einer Bestrahlung sämtlicher zervikaler Lymphknotenstationen und sämtlicher Pharynxetagen unterzogen. S. Abbildung 2. Abbildung 2: Bestrahlungszielvolumen Es wurde als Prämisse angenommen, daß ein anteriores Mundbodenkarzinom, ein Karzinom der Nasennebenhöhlen oder ein Speicheldrüsenkarzinom wohl relativ unwahrscheinlich sei, bzw. ein kleines mehr submukös entwickeltes Karzinom der Pharynxetagen jedoch u. U. klinisch und bilddiagnostisch schwer zu diagnostizieren sei. Eine eventuell vorliegende Übertherapie durch die Bestrahlung möglicherweise nicht befallener Regionen wurde unter diesem kurativen Aspekt bewußt in Kauf genommen. Zur Sicherstellung der arbeitstäglichen Reproduzierbarkeit erhielten alle Patienten eine für sie speziell angepaßte Lagerungsmaske. Um Gebiete, die nicht mitbestrahlt werden sollten auszublenden, wurden individuelle Satelliten angefertigt. 40 Die Feldkontrollen erfolgten in regelmäßigen Abständen mittels „beam´s eye view“ am Linearbeschleuniger, am Kobaltgerät durch Röntgen-Verifikationsaufnahmen. Die Bestrahlungstechnik entsprach im Prinzip der postoperativen Strahlenbehandlung von Kopf-Hals-Tumoren. Das Zielvolumen wurde in unserer Klinik aus den o.g. Gründen in der überwiegenden Zahl der Fälle großzügig gewählt und umfaßte über laterale Felder alle Pharynxetagen d.h. den Nasopharynx, Oropharynx und Hypopharynx sowie den beidseitigen zervikalen Lymphabfluß. Bei Befall der submandibulären Lymphknoten wurde auch die Mundhöhle mit in das Bestrahlungsvolumen eingeschlossen. (Manchmal wurde in dieser Situation der Nasopharynx geschont). Die kraniale, obere Feldgrenze war der Boden der Keilbeinhöhle mit Einschluß des Nasopharynxdaches. Es wurde über durchgehende lange seitliche Felder von der o.g. oberen Feldgrenze nach kaudal bis an die Supraclavikulargruben bestrahlt. Nach ventral wurde der weiche Gaumen, nach dorsal wurden die Dornfortsätze der Halswirbelsäule knapp eingeschlossen. Zur Schonung des Rückenmarkes erfolgte nach 36-40 Gy eine Feldaufteilung in ein ventrales und ein dorsales Zielvolumen. Im dorsalen Feldanteil wurde eine Aufsättigung der Lymphabflußwege mit Elektronen einer individuell adaptierten Energie vorgenommen. Ventral wurde weiter mit X6 Photonen bestrahlt. Die Gesamtdosis orientierte sich am Tumorstadium, an der körperlichen Verfassung und am Behandlungsziel (kurativ/palliativ). Angestrebt wurden 59,4 Gy bei einheitlichen Einzeldosen von 1,8 Gy in konventioneller Fraktionierung, wobei die Toleranzdosen der mit erfaßten Strukturen, insbesondere die des Rückenmarkes, berücksichtigt wurden. In besonderen Risikosituationen (marginale Resektion, R1-Resektion, ausgedehnte Lymphangiosis carcinomatosa, infiltratives extrakapsuläres Wachstum) wurde lokal kleinvolumig bis auf 66,0 Gy aufgesättigt. Die Einzeldosis wurde täglich an 5 aufeinanderfolgenden Werktagen appliziert. Insgesamt erstreckte sich die strahlentherapeutische Behandlung über einen Zeitraum von 6 bis 8 Wochen. Üblicherweise erfolgte die Therapie unter ambulanten Bedingungen. In speziellen Fällen, wie z.B. reduzierter Allgemeinzustand, Multimorbidität oder auch schlechte Verträglichkeit nahmen wir die Patienten auf unserer radioonkologischen Station zur supportiven Therapie auf. 41 3.7 Chemotherapie Für eine kombinierte Strahlen- und Chemotherapie des zervikalen CUP-Syndroms sprechen eine Reihe von Gründen, die aus der Behandlung von Kopf-Hals-Tumoren bekannt sind. Trotzdem hat der Einsatz einer simultan oder sequentiell applizierten Chemotherapie bei Halsmetastasen eines unbekannten Primärtumors keinen gesicherten Stellenwert. Radiosensitizer bzw. elektroaffine Substanzen erhöhen die Strahlenwirkung für hypoxische Zellen. Zytotoxische Chemotherapeutika addieren ihre Antitumorwirkung zu derjenigen der ionisierenden Strahlung oder potenzieren sie sogar. Nachteilig ist, daß eine kombinierte Anwendung oftmals auch zu verstärkten akuten Nebenwirkungen führt. In diesem Fall setzt sich die Toxizität der simultanen Chemo/Radiotherapie aus den beiden Komponenten zusammen. Liegt ein Organ, an dem sich die unerwünschten Nebenwirkungen des Zytostatikums klinisch oder subklinisch manifestieren, mit einem relevanten Volumen im Bestrahlungsfeld, können sich die Toxizitäten von Radiotherapie und Chemotherapie addieren (Additive Toxizität). Hat das Chemotherapeutikum radiosensibilisierende Eigenschaften, kann die Toxizität noch ausgeprägter sein als die Summe der zu erwartenden Einzeltoxizitäten von Radiotherapie und Zytostatikatherapie (Supraadditive Toxizität). Bei der Auswahl geeigneter Zytostatika sollte der kooperative Effekt im Sinne einer synergistischen bzw. additiven Zytotoxizität am Tumor respective an den Lymphknotenmetastasen berücksichtigt werden. Eine Kombination von Chemo- und Strahlentherapie im simultanen Therapieansatz, wie er in unserer Klinik durchgeführt wird, wirkt am zu bestrahlenden Gewebe dosisintensivierend und verhindert eine (akzelerierte) Repopulierung der Tumorzellen. Darüber hinaus kann durch den Einsatz der Chemotherapie auch eine Reduktion der Fernmetastasenrate versucht werden. Die in unseren Therapieschemata applizierten Zytostatika Carboplatin und Cisplatin werden im folgenden charakterisiert (s. Seite 42). Carboplatin wurde überwiegend in einer Dosierung von 60 mg/m2 KOF oder 100 mg absolut an 5 aufeinander folgenden Tagen in 2 Kursen angewandt. Das Zyklusintervall betrug 28 Tage. Das Chemotherapeutikum Cisplatin wurde in 2 Kursen bei einem Intervall von 28 Tagen mit 17,5 mg/m2 KOF 5 x Woche dosiert. 42 Verwendete Chemotherapeutika: [1] A) Carboplatin (CBDA), Platinderivat cis-Diammin(1,1-cyclobutandicarboxylato) platin Wirkmechanismus: kovalente Bindung von Platinkomplexen an DNA und Proteine, „cross-linking“, zellzyklusspezifisch: G1-/S-Phase. Metabolismus: intrazelluläre Bildung reaktiver Platinkomplexe. Elimination: renale Ausscheidung von Ausgangssubstanz (60%) und Metaboliten (40%), Nebenwirkungen: Knochenmark: Myelosuppression (dosislimitierend), insbesondere prolongierte Thrombozytopenie, Leukozytopenie und kumulative Störung der Erythropoese. Gastrointestinaltrakt: Übelkeit/Erbrechen, Appetitlosigkeit, Mukositis. Leber: transienter Transaminasenanstieg. Nieren: selten Nephrotoxizität, insbesondere bei inadäquater Hydratation. Haut: selten Alopezie, Erythem, allergische Reaktionen, Pruritus. Nervensystem: selten periphere Neurotoxizität (vor allem bei Patienten >65 Jahre), selten Hörstörungen oder Optikusneuritis. Sonstiges: Infertilität, Fieber, Schüttelfrost. Kontraindikation: Nierenfunktionsstörungen, Exsikkose, vorbestehende Hörstörungen, akute Infekte. Therapie: Zugelassene Indikationen: Tumoren im Kopf-Hals-Bereich, Zervixkarzinom, epitheliales Ovarialkarzinom, kleinzelliges Bronchialkarzinom, andere solide Tumoren. B) Cisplatin (CDDP), Platinderivat, cis-Diamindichoroplatin(II) Wirkmechanismus:kovalente Bindung von Platinkomplexen an DNA und Proteine, „cross-linking“, zellzyklusspezifisch: G1-/S-Phase. Metabolismus: Bildung reaktiver Platinkomplexe. Elimination: renale Ausscheidung von Ausgangssubstanz und Metaboliten (90%), biliäre Exkretion (10%). Nebenwirkungen: Knochenmark: Myelosuppression, Leukozytopenie, Thrombozytopenie. Herz-Kreislauf: selten Rhythmusstörungen, Herzinsuffizienz. Gastrointestinaltrakt: starke Übelkeit/Erbrechen, (prolongiert, Dauer > 24 h), Appetitlosigkeit, Mukositis, Diarrhoe, Enteritis. Leber: transienter Transaminasenanstieg. Nieren: Elektrolytveränderungen (Abfall von Ca2+, Mg2+, K+,Na+) kumulative Nephrotoxizität mit Tubulusschädigung (dosislimitierend). Haut: Alopezie, Dermatitis, allergische Reaktionen Nervensystem: Ototoxizität und periphere Neurotoxizität (dosislimitierend, kumulativ, ab Gesamtdosen >100-200 mg/m2), Geschmacksstörungen, selten fokale Enzephalopathie, Sehstörungen, Optikusneuritis, Schwindel. Lokale Toxizität (Paravasate): lokale Phlebitis, paravasal z.T. nekrotisierend. Sonstiges: Infertilität. Kontraindikation: Nierenfunktionsstörungen, Exsikkose, vorbestehende Hörstörungen, akute Infekte. Therapie: Zugelassene Indikationen: Tumoren im Kopf-Hals-Bereich, Bronchial-,Ösophagus-, Zervix-,Endometrium-,Ovarial- und Blasenkarzinom, malignes Melanom. 43 3.8 Nachsorge Die onkologische Nachsorge des größten Teiles der Patienten wurde in regelmäßigen 3-monatigen Intervallen durch die Hals-Nasen-Ohren-Klinik im St. Elisabeth-Hospital in Bochum und auch in der Klinik für Mund-Kiefer-und Gesichtschirurgie des Knappschaftskrankenhauses in Bochum durchgeführt. 3.9 Methodik der Untersuchung und Strukturierung der Daten Zur Datenerfassung (epidemiologische Patientendaten, Tumorausbreitung Behandlungsmodalitäten, Nebenwirkungen und weiterer Krankheitsverlauf) wurde ein strukturierter Fragebogen entwickelt. (Tabelle 3) 44 Tabelle 3: Fragebogendesign CUP-Syndrom Patientendaten: Geschlecht Alter bei Erstdiagnose Risikoprofile: Body Mass Index (BMI) Hämoglobinkonzentration vor Therapie (g/dl) Tumormarker: CEA, SCCA, LDH Tumordaten: Tumorvolumen (cm3) N-Stadium Grading Lokalisation der Lymphknotenmetastasen Histologie Behandlungsdaten: Keine OP der Lymphabflußwege Lymphknotenexstirpation Neck Dissektion einseitig/beidseitig Art der Neck Dissektion Tonsillektomie einseitig / beidseitig Strahlentherapie Kobalt 60 / Linearbeschleuniger Zielvolumen Technik Gesamtdosis Einzeldosis Chemotherapie ja/nein Art des Chemotherapeutikums Dosis pro m2 KOF Anzahl der Zyklen Krankheitsverlauf: Primarius Manifestation eines Primarius im Verlauf? Zeitpunkt der Diagnose Art /Lokalisation des Primarius Tumorstadium Rezidiv Lokalisation erneuter LK-Metastasen Zeitpunkt des Rezidivs Dauer des rezidivfreien Überlebens Dauer des Gesamtüberlebens Todesursache Befindlichkeit des Patienten Xerostomie Geschmacksstörung Krankheitsverlauf / sonstige Lebensqualität 45 3.10 Analyse der anamnestischen Daten Die Analyse der Daten erfolgte retrospektiv aus den strahlentherapeutischen Krankenakten der Patienten, die die gesamten Daten der Diagnostik, der Therapie und der regelmäßigen HNO-ärztlichen Nachuntersuchungen enthielten. Sämtliche 84 Patientenakten konnten anhand der erfaßten Daten ausgewertet werden. Bei einigen Patienten waren mittels Aktenrecherche wichtige Punkte nicht abschließend zu klären, so daß die Details anhand des ausgearbeiteten Fragebogens entweder telefonisch mit dem Patienten selbst bzw. schriftlich oder fernmündlich durch die nachbehandelnden Hausärzte und Fachärzte erfragt wurden. Zusätzlich war in 5 Fällen eine Einsicht der Krankenakten des St. Elisabeth-Hospitals erforderlich. In 1 Fall mußte zur endgültigen Beurteilung das Bürgerbüro der Stadtverwaltung in Bochum schriftlich um Auskunft gebeten werden. Bei einigen bereits verstorbenen Patienten gelang darüber hinaus die Klärung unbeantworter Fragen durch Telefonate mit den Angehörigen. 46 3.11 Statistik Die im Untersuchungszeitraum behandelten Patienten wurden aus rechnergestützten Datenbanken der Abteilung rekrutiert. Die Datenerfassung erfolgte retrospektiv aus den entsprechenden Patientenakten der Archive der Abteilung für Strahlentherapie und der anderen zuvor genannten zuweisenden Kliniken. Zur Erleichterung der Vorgehensweise wurde ein standardisiertes Auswertungsschema mit dem digitalen Datenverarbeitungsprogramm Microsoft Access (Version 2002) entworfen, welches die unten aufgeführten Gesichtspunkte enthält. Als Überlebenszeiten bzw. rezidivfreie Zeiten wurden die Zeiten ab dem Zeitpunkt der Erstdiagnosestellung bis zum Eintritt des Todesereignisses bzw. Rezidivs bzw. des letzten Kontaktes gewertet. Die Schätzung der Überlebensfunktionen erfolgte nach der Methode von Kaplan-Meier [19] mit dem Statistik Programm MedCalc – Version 8.1.0.0, der Vergleich zwischen den Überlebensfunktionen auf Signifikanz wurde mit dem Kolmogoroff-Smirnov-Omnibustest (KSO-Test), durchgeführt. [3] Weitere statistische Methoden waren die Cox-Regressionsanalyse und der Logrank Test. Die Arbeit wurde an einem Personal Computer in dem Programmsystem Microsoft Word bzw. Windows XP/ Home Edition Version 2002 Service Pack 2 geschrieben. 47 4 Ergebnisse Die genaueren Patienten- und Therapiedaten für das Gesamtkollektiv sind in der Tabelle 4 dargestellt. Tabelle 4: Patienten- und Behandlungsdaten Alter Body Mass Index Therapiedauer Gesamtdosis Einzeldosis Median 60 Minimum 34 Maximum 89 24,96 20,38 34,89 49 16 70 59,40 21,60 69,40 1,80 1,80 2,00 Totales Tumor Volumen TTV 14,59 ,50 370,19 Hämoglobin-Konzentration 12,90 8,20 16,50 Geschlecht Histologie Grading Nodal-Status Therapie Count Männlich 66 78,57% Weiblich 18 21,42% Plattenepithelkarzinom 75 89,28% Großzelliges Karzinom 5 5,95% Adenokarzinom 2 2,38% 1 1,19% 1 1,19% Adenoid-cystisches Karzinom Neuroendokrines Karzinom 1 1 1,19% 2 29 34,52% 3 48 57,14% 4 1 1,19% x 5 5,92% 1 21 25,00% 2 39 46,42% 3 24 28,57% OP + RCT 24 28,57% OP + RT 42 50,00% RCT 10 11,90% RT Chemotherapie TE ND OP LAW 8 9,52% Carboplatin 16 52,94% Cisplatin 18 47,05% keine CT 50 59,52% keine TE 44 52,38% TE 40 47,61% keine ND 24 28,57% ND 60 71,42% Unilaterale ND 43 Bilaterale ND LK-Exstirpation Keine OP der LAW RT TE LK Column N% = Radiotherapie = Tonsillektomie = Lymphknoten CT = Chemotherapie ND = Neck Dissketion LAW = Lymphabflußwege RCT = Radio/Chemotherapie OP = Operation TTV = Totales Tumor Volumen 17 51,19% 20,23% 9 10,71% 15 17,85% 48 4.1 Analyse der Patientendaten 4.1.1 Epidemiologische Daten ( Patientenzahl, Alter, Geschlecht, Behandlungsdauer, Nachbeobachtungszeit ) Insgesamt wurden 84 Patienten zwischen Oktober 1990 und März 2006 bestrahlt und nachbeobachtet (186 Monate). Die Therapiedauer dauerte längstens 70 Tage und im kürzesten Fall 16 Tage, bei einem Medianwert von 49 Tagen. Von den untersuchten Patienten waren 66 (78,57 %) männlichen Geschlechts und 18 (21,42%) weiblichen Geschlechts. Der jüngste Patient war bei Diagnosestellung 34 Jahre, der älteste Patient 89 Jahre alt. Der Altersmedian lag bei 60 Jahren. Die mediane Nachbeobachtungszeit der lebenden Patienten betrug 32 Monate (2-128 Monate). 4.1.2 Histologie, Tumorstadium, Grading Definitionsgemäß (UICC 2001) kann bei zervikaler Lymphknotenmetastasierung eines unbekannten Primärtumors das Ausmaß des Tumors nicht klassifiziert werden, bzw. es liegt kein Anhalt für einen Primärtumor vor. So wurde das T (Tumor)- Stadium bei allen 84 Patienten als T0 bezeichnet. In dem untersuchten Patientenkollektiv wurden die N-Stadien sämtlich histopathologisch als pN-Stadien erfaßt. Ein pN1 Stadium fand sich bei 21 Patienten (25,0%), ein pN2-Stadium bei 39 Patienten (46,4%) und ein pN3-Stadium bei 24 Patienten (28,6%). Die überwiegende Zahl der Patienten unseres Kollektives ( n = 75; 89,28% ) hatten Lymphknotenmetastasen eines Plattenepithelkarzinoms, in 5 Fällen lag eine Metastase eines großzelligen Karzinoms vor ( 5,95%). Bei nur 2 Patienten lag histologisch ein Adenokarzinom vor (2,38%) vor, ein Patient hatte eine Metastase eines neuroendokrinen Karzinoms (1,19%), ein weiterer Patient hatte eine Metastase eines adenoid-cystischen Karzinoms (1,19%). 49 Die Verteilung des Gradings ist folgendermaßen zu beschreiben: Eine hohe Differenzierung (G1) fand sich bei einem der Patienten (1,19%), ein mittelgradig (G2) differenzierter Tumor war bei 29 (34,52%) der Fälle nachweisbar, eine niedrige Differenzierung (G3) war bei den meisten, nämlich 48 Patienten (57,14%) zu finden. In 1 Fall (1,19%) wurde von einer anaplastischen Differenzierung (G4) ausgegangen und in 5 weiteren Fällen (5,92 %) war der exakte Differenzierungsgrad nicht mehr eruierbar (GX). 4.1.3 Risikofaktoren Hämoglobin-Konzentration, Body Mass Index und Tumorvolumen Als Risikofaktoren wurden die Hämoglobin-Konzentration (g/dl) vor Therapiebeginn, der Body Mass Index (BMI) und das Tumorvolumen hinzugezogen. Bei einem prätherapeutischen Hämoglobin-Minimumwert von 8,2 g/dl und einem Maximumwert von 16,5 g/dl lag der Medianwert bei 13,0g/dl. Der Median des BMI fand sich bei 24,1 (Minimum 20,4 und Maximum 33,9). Der Medianwert des Tumorvolumens des untersuchten Gesamtkollektivs betrug 14,6 cm3. Die Spannweite war mit minimal 0,5 cm3 und 370,2 cm3 breit gefächert. 4.2 4.2.1 Analyse der Therapiedaten Operative Therapie Von den untersuchten Patienten hatten 15 Patienten (17,85%) nach der histologischen Diagnosestellung keine weitergehende Operation der Lymphabflußwege erhalten. In 9 Fällen (10,71%) erfolgte eine zusätzliche unilaterale Exstirpation befallener Lymphknoten. Die restlichen 60 Patienten erhielten eine Neck Dissektion, wobei eine weitere Aufschlüsselung in ein- oder beidseitige ND vorgenommen wurde: bei 43 Patienten (51,19%) wurde eine unilaterale, bei 17 Patienten (20,23%) eine bilaterale Neck Dissektion durchgeführt. 50 40 Patienten (47,61 %) wurden auf der Suche nach dem Primärtumor einer Tonsillektomie unterzogen, 44 Patienten (52,38%) wurden nicht tonsillektomiert. Bei den Operierten erfolgte eine beidseitige TE in 32 Fällen (80,0%) und eine einseitige TE in 8 Fällen (20,0%). 4.2.2 Strahlentherapie 79 Patienten wurden an einem Linearbeschleuniger bestrahlt und 5 der Patienten erhielten die Strahlentherapie noch an einem Kobaltgerät. 8 Patienten (9,52%) erhielten bei sehr fortgeschrittenem Lokalbefund nach Histologiegewinnung eine alleinige definitive Strahlentherapie ohne Operation und ohne Chemotherapie. Die Gesamtdosis lag im Median bei 59,4 Gy (Spannweite: 21,6-69,4 Gy) bei einer Einzeldosis von 1,8 Gy pro Tag in allen Fällen (n = 84). Ein Patient hatte die Bestrahlung nach 21,6 Gy wegen einer schweren Mukositis und Xerostomie abgebrochen und ließ sich nicht überzeugen, die Behandlung fortzusetzen. 4.2.3 Chemotherapie Bei 34 Patienten (40,47%) wurde eine Chemotherapie durchgeführt, 50 Patienten (59,52%) erhielten keine Chemotherapie. Die verwendeten Chemotherapeutika waren Carboplatin bei 16 Patienten (47,05%) und Cisplatin bei 18 Patienten (52,94%). 4.2.4 Kombinationstherapien Eine Operation (OP) und adjuvante Radiotherapie (RT) erfolgte bei 42 Patienten (50,0%), während eine Operation mit nachfolgender kombinierter Radio/Chemotherapie (RCT) bei 24 Patienten (28,57%) durchgeführt wurde. In 10 Fällen (11,90 %) wurde nach alleiniger histologischer Sicherung eine primäre Radio/Chemotherapie appliziert. (Die verbleibenden 8 Patienten erhielten k e i n e Kombinationstherapie, sondern eine alleinige Radiotherapie). 51 4.3 Überlebensanalysen Zur Übersicht sind die verschiedenen Überlebensraten in Tabelle 5 aufgeführt. Die Parameter Rezidivfreies Überleben und Metastasenfreies Überleben beziehen sich jeweils auf das Gesamtüberleben. Tabelle 5: Kreuztabelle Überlebensanalysen 5-J-Überleben Mittel -95%KI- +95%KI Gesamtüberleben 0,48 0,35 0,61 Rezidivfreies ÜL 0,65 0,53 0,78 Metastasenfreies ÜL 0,89 0,75 1,03 4.3.1 Gesamtüberleben im Gesamtkollektiv Das Gesamtüberleben der behandelten Patienten ist in Abbildung 3 dargestellt. Abbildung 3: Kaplan-Meier-Kurve des Gesamtüberlebens Das Gesamtüberleben nach 5 Jahren betrug 48% (95%KI 0,35-0,61). (Nach 1 Jahr betrug es 78% und nach 10 Jahren 45%). Die mediane Nachbeobachtungszeit der noch lebenden Patienten (Minimum-Maximum) erstreckte sich über 32 Monate bei einer Spannweite von 2-128 Monaten. 52 4.3.2 Rezidivfreies Überleben im Gesamtkollektiv (in Bezug auf das Gesamtüberleben) 24 Patienten erlitten ein Lokalrezidiv. Aus den Unterlagen konnte nicht immer eindeutig identifiziert werden, ob es sich hierbei um „in-field“-Rezidive oder Rezidive am Feldrand oder außerhalb des Bestrahlungsfeldes handelte. Abbildung 4: Kaplan-Meier-Kurve des lokalrezidivfreien Überlebens (bezogen auf das Gesamtüberleben) Aus Abbildung 4 wird die Wahrscheinlichkeit des lokalrezidivfeien Überlebens bezogen auf das Gesamtüberleben nach Erstdiagnosestellung ersichtlich. Das lokalrezidivfreie 5-Jahres-Überleben betrug 65% (95%KI 0,53-0,78). Der mittlere Zeitpunkt, ein Rezidiv zu erleiden, lag bei 64 Monaten. Nach 12 Monaten betrug die Wahrscheinlichkeit des rezidivfreien Überlebens 75% und nach 120 Monaten 57%. 53 4.3.3 Metastasenfreies Überleben (in Bezug auf das Gesamtüberleben) Bei 20 Patienten entwickelte sich leider während der Nachbeobachtungszeit eine Fernmetastasierung. Abbildung 5: Kaplan-Meier-Kurve des metastasenfreien Intervalls (bezogen auf das Gesamtüberleben) In Abbildung 5 werden metastasenfreie Intervalle bezogen auf das Gesamtüberleben zur Darstellung gebracht. Bei einem 95% Konfidenzintervall (0,75-1,03) betrug es nach 1 Jahr 98%, nach 5 Jahren 89%, nach 10 Jahren war kein Unterschied abzulesen. Eine Kurvenverlaufsveränderung zeichnet sich nach 56 Monaten ab. Der mittlere Zeitpunkt, eine erneute Fernmetastasierung zu erleiden, lag bei 63 Monaten. 54 4.3.4 Subanalyse Gesamtüberleben in Bezug auf das Tumorvolumen Abbildung 6: Kaplan-Meier-Kurve des Gesamtüberlebens der Patienten mit einem Tumorvolumen oberhalb bzw. unterhalb des Medians In Abbildung 6 wird das Gesamtüberleben in Abhängigkeit vom Tumorvolumen dargestellt. Bei Patienten mit einem prätherapeutischen Tumorvolumen, welches kleiner oder gleich dem Median 14,6 cm3 (Minimum 0,5 cm3, Maximum 370,2 cm3) (1,549; 95% KI 1,01-2,179) ermittelt wurde, betrug nach 12 Monaten die Überbenswahrscheinlichkeit 91,3 % gegenüber 61,5%, wenn ein größeres Tumorvolumen vorlag. Nach 60 Monaten ergaben sich Werte von 76,5% vs. 30%. Nach 120 Monaten lag das Gesamtüberleben in der günstigen Prognosegruppe bei 62%, während es sich in der ungünstigen Prognosegruppe nach 120 Monaten auf 12,3% verringerte. Mittels der Cox´schen Proportional Hazards Regressionsanalyse wurde ein statistisch signifikantes Modell mit dem Tumorvolumen (p<0,001), dem Alter (p=0,05) und der Gesamtdosis (p=0,08) als unabhängige prognostische Faktoren für das Gesamtüberleben identifiziert. 55 4.3.5 Subanalyse Rezidivfreies Überleben in Bezug auf das Tumorvolumen 1,0 TV <= Median Rezidivfreies Überleben 0,8 TV > Median 0,6 0,4 0,2 0,0 0 24 48 72 96 120 144 Zeit (Monate) Abbildung 7: Kaplan-Meier-Kurve der Patienten mit rezidivfreiem Überleben bei einem Tumorvolumen oberhalb beziehungsweise unterhalb des Medians Die Subanalyse (Abbildung 7) hinsichtlich des rezidivfreien Überlebens bezogen auf das Tumorvolumen zeigt, daß auch hier ein Tumorvolumen kleiner oder gleich dem Median das rezidivfreie Überleben beeinflußt. Die Patienten lebten länger ohne Rezidivbildung. Bei Patienten mit einem Tumorvolumen größer als der Median liegt die Möglichkeit innerhalb eines Jahres nach Erstdiagnose ein Rezidiv zu erleiden bei 63,5%. Dies bedeutet, dass das Tumorvolumen auch für das rezidivfreie Überleben relevant ist. 56 4.3.6 Subanalyse Gesamtüberleben mit versus ohne Tonsillektomie (TE) 1,0 Gesamt-Überleben 0,8 TE 0,6 0,4 0,2 keine TE 0,0 0 24 48 72 96 120 144 Zeit (Monate) Abbildung 8: Die Kaplan-Meier-Kurve des Gesamtüberlebens mit vs. ohne Tonsillektomie Betrachtung der verschiedenen Therapieansätze in Abbildung 8 ergab für die Patienten mit operativer Entfernung der Tonsillen (TE) einen medianen Überlebensvorteil von 3,308 Monaten (95% KI 1,360-8,848). 57 4.3.7 Subanalyse Rezidivfreies Überleben mit versus ohne Tonsillektomie (TE) 1,0 1,0 TE TE TE TE Rezidivfreies Überleben Rezidivfreies Überleben 0,8 0,8 0,6 keine TE keine TE 0,6 0,4 0,4 0,2 0,2 0,0 0,0 24 0 0 Abbildung 9: 48 24 72 48 96 72 Zeit (Monate) Zeit (Monate) 120 96 120 144 144 Kaplan-Meier-Kurve des rezidivfreien Überlebens mit vs. ohne Tonsillektomie (TE) Auch in dieser Kaplan-Meier-Kurve (Abbildung 9) wurden die unterschiedlichen Therapiemodalitäten Tonsillektomie / keine Tonsillektomie in Bezug auf das rezidivfreie Überleben analysiert. Patienten mit TE überlebten länger rezidivfrei (Median 4,053 Monate; 95% KI 1,200-13,689) als Patienten, die keine Tonsillektomie erhielten. 58 4.3.8 Subanalyse Überleben in Bezug auf posttherapeutische Entdeckung des Primärtumors Im Behandlungsverlauf wurde bei 6 Patienten (7,14 %) ein Primärtumor diagnostiziert. Davon hatten 2 Patienten ein Hypopharynx-Karzinom, 2 weitere Patienten ein Oberkieferkarzinom, 1 Patient erlitt ein Tonsillenkarzinom und 1 anderer Patient ein Zungenrandkarzinom (Abbildung 10). Abbildung 10: 1 Patient 1 Patient Zungenrandkarzin om 2 Patienten Tonsillenkarzino m Hypopharynxkarzi nom 2 Patienten Oberkieferkarzino m Primärtumornachweis Primärtumornachweis nach erfolgter Therapie 3 Patienten verstarben und 3 Patienten lebten noch bei Abschluß der Auswertung (je 3,75%). Die Manifestation des Primarius erfolgte recht unterschiedlich nach 12 - 4 - 36 - 96 - 19 - 2 = 169 Monaten. Das Minimum lag bei 2 Monaten, das Maximum bei 96 Monaten, so daß sich ein Mittelwert von 33,8 Monaten ergab. 59 4.4 Prognostische Relevanz der Subanalysenkriterien Bezüglich der statistischen Relevanz der Subgruppenanalysen wurden bei univarianter Betrachtung die Merkmale Tonsillektomie, Chemotherapie, Hämoglobin-Konzentration, Alter und Tumorvolumen einschließlich 95%iger Konfidenzintervalle und p-Werte für das Gesamtkollektiv untersucht. Dabei ergab sich zunächst kein statistisch gesicherter Einfluß. Bei multivarianter Betrachtung für das Zielkriterium Gesamtüberleben erwiesen sich die Merkmale Tonsillektomie (TE) beziehungsweise Operation ja/nein, das Tumorvolumen und grenzwertig auch das Alter als relevant. Für den Endpunkt Rezidivfreies Überleben waren nur die Merkmale TE und Tumorvolumen relevant. Diese Variablen wurden bereits zuvor mit der Kaplan-Meier Methode analysiert. Das Merkmal Neck Dissektion wurde nicht untersucht, da die Fallzahl zu gering war und aus diesem Grunde keine Aussage zu erwarten war. Somit ist das Risiko, an dieser Tumorerkrankung zu versterben oder ein Rezidiv zu erleiden für Patienten mit einem Tumorvolumen kleiner oder gleich dem ermittelten Median geringer, als bei einem Tumorvolumen, welches über dem berechneten Median liegt. Bei der Analyse der verschiedenen Therapieansätze verblieb die Tonsillektomie als statistisch bedeutsamstes Merkmal, d.h. nach erfolgter Tonsillektomie ist das Gesamtüberleben günstiger als ohne operative Entfernung der Tonsillen und auch das rezidivfreie Überleben verbessert sich. 60 4.5 Gesamtprognose Insgesamt konnten die Daten von 84 Patienten ausgewertet werden. Die mediane Nachbeobachtungszeit der noch lebenden Patienten betrug 32 Monate (2-128 Monate). Das 5-Jahres-Gesamtüberleben ergab einen Wert von 48 % (95%KI 0,35-0,61%). Auf diesen Wert bezogen betrugen die Tumorkontrolle im Sinne eines Metastasenfreien 5-Jahres-Überlebens 89% (95%KI 0,75-1,03%) und für das Lokalrezidivfreie 5-Jahres-Überleben 65% (95%KI 0,53-0,77 %). Während der Nachbeobachtungszeit verstarben 36 Patienten, dies entspricht einem prozentualen Wert von 42,86%. Umgekehrt lebten zum Ende der Auswertung im März 2006 noch 48 Patienten (57,14%). 61 5 Diskussion 5.1 Behandlungsergebnisse in der Literatur Das CUP-Syndrom mit zervikaler Lymphknotenmetastasierung stellt eine eher ungewöhnliche und insgesamt seltene Tumorentität dar. Trotzdem gibt es eine erhebliche Anzahl von Arbeiten [5, 6, 7, 10, 13, 17, 21, 26, 36, 40, 52, 56, 58, 59], die sich mit diesem Krankheitsbild in unterschiedlicher Zielsetzung beschäftigen s.Tabelle 6. Die Berichte in der Literatur beziehen sich überwiegend auf unizentrisch betreute, heterogene Patientenkollektive, die retrospektiv aufgearbeitet wurden. In den Arbeiten variieren die Zeitintervalle der Nachbeobachtung und auch die Patientenzahlen stark, so daß die Vergleichsmöglichkeiten dieser retrospektiven unizentrischen Arbeit mit 84 Patienten bei einer Nachbeobachtungszeit von 15,4 Jahren nicht immer einfach waren. Um der unterschiedlichen Zusammensetzungen der Kollektive bezüglich der therapeutischen Varianten und der unterschiedlichen Endpunkte gerecht zu werden, wird die Diskussion sowohl in Bezug auf Patientenkollektive mit vergleichbaren Parametern als auch die Therapieergebnisse des eigenen Gesamtkollektives im Vergleich zu anderen Untersuchungskollektiven geführt. Übereinstimmend mit den meisten retrospektiven CUP-Studien ist die Geschlechts- und Altersverteilung auch in unserer Arbeit folgendermaßen zu beschreiben: Männer erkrankten deutlich öfter als Frauen. Das mediane Alter der Patienten lag bei 60 Jahren. Unbestritten ist auch, dass weitaus am häufigsten Lymphknotenmetastasen eines Plattenepithelkarzinomes diagnostiziert werden – hier gefolgt von großzelligen Karzinomen, Adenokarzinomen sowie neuroendokrinen bzw. adenoid-cystischen Karzinomen. Die unterschiedlichen Differenzierungsgrade verteilten sich prozentual mehrheitlich auf die mittleren bis niedrigen Gradings. In den meisten Fällen lagen auch in unserer Untersuchung im Vergleich zu anderen Untersuchungen [7, 13, 52, 58, 61] fortgeschrittenere Lymphknotenmetastasierungen vor. 62 5.2 Abhängigkeit der Behandlungsergebnisse von Patienten-und Tumorkriterien 5.2.1 Relevanz von Hb und BMI Ein erheblicher Resistenzfaktor in der Strahlentherapie ist die Tumorhypoxie. Die zelluläre Strahlenempfindlichkeit hängt wesentlich von der Sauerstoffkonzentration während der Bestrahlung ab. Anoxische Tumorzellen sind etwa um den Faktor 3 strahlenunempfindlicher als gut mit Sauerstoff versorgte Zellen. Diese Feststellungen sind unter dem Begriff „Sauerstoffeffekt“ bekannt. Bei der Bestrahlung werden zunächst die strahlenempfindlichen, gut mit Sauerstoff versorgten Zellen abgetötet, so daß direkt nach der Radiatio ein hoher Anteil aller überlebenden klonogenen Tumorzellen hypoxisch ist. Mit zunehmender Zeit nach Bestrahlung nimmt der Anteil hypoxischer Zellen jedoch wieder ab. Dieses Phänomen wird als Reoxygenierung bezeichnet. [38] Sowohl für die Anämie als auch für das Rauchen konnte ein bedeutender ungünstiger Effekt (Anstieg der hypoxischen Zellfraktion) und damit auf die Tumorwirkung einer Strahlentherapie gezeigt werden. Um diesen negativen Einfluß hypoxischer Tumorzellen auf die Ergebnisse der Strahlenbehandlung zu verringern, ist es wichtig, den Hämoglobinwert zu kennen bzw. durch geeignete Maßnahmen diese Risikofaktoren vor Therapiebeginn zu beseitigen. Auch die Autoren Grau et al. [13] und Christiansen et al. [35] fragten in ihren Arbeiten nach dem Hämoglobinwert als prädiktivem Faktor. Ein Wert im oberen Normbereich wurde als günstig angegeben. In unserer eigenen Arbeit wurde die Hämoglobin-Konzentration nicht als signifikanter Faktor für das Gesamtüberleben identifiziert. Den Body Mass Index (BMI) haben wir zwar erfragt, jedoch nicht statistisch ausgewertet. 63 5.2.2 Relevanz des Tumorvolumens Bei jeder Tumorerkrankung ist man bemüht, Parameter zu bestimmen, die Auskunft geben über den weiteren Krankheitsverlauf. Speziell bei Tumorleiden erwartet man tumorspezifische Eigenschaften, welche mit Therapiebeginn ermittelt werden und Auskunft geben über das Risiko der Tumorprogredienz. Patientengruppen mit höherem Risiko einer Tumorprogredienz sollen von Gruppen mit niedrigerem Risiko abgegrenzt werden. Risikoprofile sind jedoch nicht eindimensional, vielmehr ergibt sich das individuelle Risiko erst aus dem Zusammentreffen mehrerer Faktoren. So ist es möglich, Risikofaktoren falsch zu beurteilen, wenn nicht bekannt ist, ob das untersuchte Kollektiv in Bezug auf bestimmte Faktoren selektiert war. In diesem Zusammenhang haben wir in unserer Untersuchung das Tumorvolumen bestimmt. Zu dessen Ermittlung wurden Angaben aus den prätherapeutischen bildgebenden Verfahren der Patientenakten aller genannten Kliniken herangezogen. Anhand unserer eigenen Untersuchungsergebnisse konnte ein eindeutiger Prognosevorteil für Patienten mit einem prätherapeutischen Tumorvolumen, welches kleiner oder gleich dem Median (1,549 cm3 , 95% KI 1,01-2,179) ermittelt wurde, festgestellt werden. Die Patienten lebten signifikant länger (p<0,001) als diejenigen Patienten, deren Tumor größer als der Median gemessen wurde. Dies bedeutet, daß hinsichtlich des Gesamtüberlebens das Tumorvolumen statistisch signifikant erscheint. (Abb. 6) Die Patienten lebten auch signifikant länger ohne Rezidivbildung (p<0,003) als diejenigen Patienten mit einem Tumorvolumen größer als der Median. Dies bedeutet also, daß auch für das rezidivfreie Überleben das Tumorvolumen eine statistische Signifikanz darstellt. (Abb.7) Die Erfassung des Tumorvolumens ist somit als unabhängiger Prognosefaktor zu werten. Bei unserer retrospektiven Analyse waren zwar nur routinemäßig durchgeführte bildgebende Verfahren auswertbar, die statistische Signifikanz bestätigt aber die wissenschaftliche Fragestellung. 64 Das Tumorvolumen kann aus diesem Grunde „prospektiv“ herangezogen werden bei der Entscheidungsfindung zu einer adäquaten individualisierten Therapie bzw. zur Beurteilung des erforderlichen Umfangs eines Nachsorgeprogramms aber auch in retrospektiver Sicht und zwar insbesondere zur Beurteilung der durchgeführten Therapieform. 5.2.3 Relevanz von N-Status und kapselüberschreitendem Tumorwachstum Die hohe Inzidenz von zervikalen Lymphknotenmetastasen allgemein bei Tumoren der Kopf-Hals-Region resultiert einerseits aus der üppigen lymphatischen Versorgung dieser Region, andererseits aus der Schwierigkeit der Untersuchung möglicher Tumorregionen des Halses, was eine Zeitverzögerung in der Diagnosestellung und somit oftmals ein bereits fortgeschrittenes Krankheitsstadium zum Diagnosezeitpunkt bedeutet. Der Lymphknotenstatus in Größe und Anzahl, aber auch die lokalen Charakteristika wie Fixierung, Kapselüberschreitung oder Gefäßeinbruch haben Einfluß auf den Krankheitsverlauf. Beim CUP-Syndrom mit zervikaler Lymphknotenmetastasierung wird der Nodalstatus als einer der wichtigsten Prognosefaktoren angesehen [6, 10, 13, 21, 56, 59] und für die beiden Stadien pN1 und pN2 eine signifikant bessere Prognose als für ein pN3 Stadium beschrieben. Insbesondere in den Arbeiten von Grau et al. [13] (p=0,0008) und Tong et al. [56] (p= 0,0001) konnte dieses bestätigt werden. Erstaunlicherweise beschrieben Strojahn et al. [52] und auch Christiansen et al. [5], daß der pN-Status der Erkrankung keinen statistisch signifikanten (p=0,15) Einfluß auf das Überleben ihrer Patienten hatte, wohl aber bei Vorliegen eines extrakapsulären Wachstums. Dieses zeigte eine statistische Relevanz (p= 0,01, respective p=0,04). Auch in der Arbeit von van der Planken et al. [57] war das kapselüberschreitende Wachstum als Prognosefaktor statistisch signifikant (p=0,038). Suen et al. berichten von einem Abfall der 3-Jahres-Überlebensrate bei Kapselüberschreitung auf 28%, ohne diese lag der Wert bei 52% [54, 55]. Wir haben diese Endpunkte in unserem Kollektiv nicht untersucht. 65 5.2.4 Relevanz der posttherapeutischen Entdeckung des Primärtumors In unserem Patientengut wurde bei 6 Patienten (7,14 %) im weiteren Verlauf der Erkrankung der Primärtumor ersichtlich (Abbildung 10). Bei 2 Patienten wurde ein Hypopharynx-Karzinom, bei 2 Patienten ein OberkieferKarzinom, bei 1 Patient ein Tonsillenkarzinom und bei 1 Patient ein Zungenrandkarzinom diagnostiziert. Keiner der Primärtumoren war infraclavikulär lokalisiert. 4 der genannten Patienten hatten initial Plattenepithelkarzinommetastasen, einmal lagen Lymphknotenmetastasen eines großzelligen Karzinoms und einmal die eines adenoidcystischen Karzinoms vor. In diesen beiden letzten Fällen enttarnte sich später ein Oberkiefer-Karzinom. Die Patienten waren zuvor alle mit einer Gesamtdosis von 60 Gy mit großen Bestrahlungsfeldern behandelt worden. In den Arbeiten von Reddy et al. [40] und Weir et al. [59] wird verdeutlicht, daß in ausgedehnten, beidseitigen Bestrahlungsfeldern weniger häufig Primärtumoren (nur 1x) auftraten als in kleinen, einseitigen Feldern (6x). In der Literatur werden spätere Primärtumoren mit einer Häufigkeit von 8 bis 44% beschrieben s. Tabelle 6. [29, 36, 40, 52, 58, 59] Einer unserer noch lebenden Patienten, bei dem sich in der Nachbeobachtungszeit ein Hypopharynx-Karzinom als Primärtumordiagnose herausstellte, erhielt daraufhin eine kombinierte Radio/Chemotherapie. Es wurden nochmals 54 Gy appliziert und 2 Cyclen einer radiosensibilisierenden Chemotherapie mit Cisplatin (17,5 mg / m2 KOF) verabreicht. Zuvor hatte er keine Chemotherapie erhalten. Die initiale Strahlentherapie war mit einer Gesamtdosis von 59,4 Gy bei einer Einzeldosis von 1,8 Gy durchgeführt worden. Zum Abschluss der Untersuchung im März 2006 war der Patient wohlauf. Haas et al. [17] beschreiben eine Verbesserung der Prognose, wenn der Primärtumor im Follow-up entdeckt wird, da sich daraus – wie in unserem Fall - eine neue Behandlungsoption ergeben kann. Werner et al. [62] schlugen sogar vor, die Patienten erst dann einer Strahlentherapie zuzuführen, wenn in der Folgezeit der primäre Tumor entdeckt wird. 66 Daß sich durch die Aufdeckung des inapparenten Tumors die Prognose verschlechtert, wird dagegen in der Literatur von Dunst et al. [7] sowie Fernandez et al. [10] angegeben. Auch Reddy et al. [40] bemerken, daß nur 20% der Patienten, bei denen nach Primärtherapie ein Primarius gefunden wurde, 5 Jahre überlebten. Kirschner et al. [25] hingegen berichten von einer besseren Prognose, da der Primarius überwiegend ja im Epi-, Meso-, Hypopharynx und Larynxbereich vermutet wird und unter der Vorstellung einer Homogenbestrahlung mittels großer Felder in jedem Fall erfaßt wird. Bei 3 unserer 6 Patienten lag initial ein pN1 Stadium vor, bei 2 Patienten ein pN2b bzw. pN2c Stadium und 1 Patient hatte ein pN3 Stadium. Die Daten korrelieren mit den Angaben von Reddy et al. [40]. Sie beschreiben ebenfalls eine höhere Rate an entdeckten Primärtumoren bei niedrigem pN-Status (33% vs. 16%). Die 3 Patienten mit pN1 Stadium überlebten, bei 2 von ihnen war histologisch eine Plattenepithelkarzinommetastase (G2 und G3) und bei dem anderen Patienten eine Metastase eines adenoid-cystischen Karzinoms (G2) diagnostiziert worden. Die drei anderen Patienten verstarben. In unserer Untersuchung waren nach Aufdeckung des Primärtumors (6 Fälle) Überlebende und Verstorbene numerisch gleich verteilt, d.h. 3 Überlebende, 3 Verstorbene, so daß hier eine Bewertung schwierig ist. Die längste Überlebenszeit unserer Patienten mit diagnostiziertem Primarius betrug 8,5 Jahre. Analog zu mehreren retrospektiven Studien [6, 13, 37] ist die spätere Primärtumormanifestation weniger häufig als das Auftreten von Rezidiven zu beobachten. Auch in unserem Patientengut war dies festzustellen. Die sonstige Rezidiventstehung erscheint unklar. Es ist denkbar, daß es zu einer lokalen Reklonierung überlebender Tumorzellen kommt, die gegenüber der Strahlentherapie resistent blieben, sich wie parenchymatöse Organzellen mit niedrigem biologischem Zellumsatz verhalten und ein erneutes Tumorwachstum ermöglichen. 67 5.3 Abhängigkeit der Behandlungsergebnisse von der Art der OnkologischenTherapie 5.3.1 Relevanz der Strahlentherapie Die Strahlentherapie mit ihren Komponenten Gesamt-und Einzeldosis, Fraktionierung und Feldgröße ist im Behandlungskonzept des CUP-Syndroms mit zervikaler Lymphknotenmetastasierung fest etabliert. Jedoch gehen die Meinungen über die Strahlentherapiemodalitäten in der Literatur auseinander. Die vielfach untersuchten Konzepte reichen – je nach palliativer oder kurativer Intention – von einer kleinvolumigen ipsilateralen Bestrahlung des Halses bis hin zu ausgedehnten Strahlentherapiefeldern. [13, 25, 36, 40, 52, 59] Radiotherapie wird anstelle oder zusätzlich zu chirurgischen Maßnahmen angewandt. Eine großvolumige prophylaktische Mitbestrahlung des Pharynxschlauches wie auch der beidseitigen zervikalen Lymphabflusswege erscheint indiziert, um den bis dahin inapparenten Primärtumor im Kopf-Hals-Bereich mitzubehandeln [25]. Logischerweise müßten hieraus verbesserte lokoregionäre Tumorkontrollraten und eventuell auch höhere Gesamtüberlebensraten resultieren. In einer großen dänischen retrospektiven Untersuchung [13] wurde allerdings im Gegensatz zu o.g. kein eindeutiger Überlebensvorteil der großvolumigen Technik gegenüber der ipsilateralen Halsbestrahlung gesehen. Bei unserem Patientenkollektiv umfaßte das Zielvolumen - über opponierende laterale Felder von der Keilbeinhöhle bis zu den Claviculae - den Nasopharynx, den Oropharynx und den Hypopharynx sowie den beidseitigen zervikalen Lymphabfluß. Bei Befall der submandibulären Lymphknoten wurde auch die Mundhöhle mit in das Bestrahlungsvolumen eingeschlossen. Im Gegensatz zu verschiedenen anderen Untersuchungen [13, 36, 59], wo in speziellen Fällen (reduzierter Allgemeinzustand, Multimorbidität oder auch nur einseitiger Befall) die Bestrahlungsfelder auf die ipsilaterale Seite begrenzt wurden, haben wir diese unilaterale Technik nicht durchgeführt. 68 In der Untersuchung von Reddy und Marks [40] war das 5-Jahres-Überleben bei Bestrahlung aller Lymphabflusswege mit 53% und die Rezidivrate mit 8% deutlich günstiger als ein Wert von 47% bzw. 44%, wenn nur eine einseitige Elektronen- Bestrahlung erfolgte. Andererseits sahen Reddy et al. [40] in der einseitigen Bestrahlung keinen Nachteil hinsichtlich der Tumorkontrolle, wenn zuvor eine Operation erfolgte, wohl aber hinsichtlich der Vermeidung von contralateralen Lymphknotenmetastasen respective Tumorneuentstehung. In der Palliativsituation kann auch in Übereinstimmung mit Weber et al. [58] die Bestrahlung auf die betroffene Halsseite beschränkt werden. Die Untersuchungen von Strojan [52] konnten zeigen, daß eine signifikante Korrelation zum Überleben (p<0,04) hinsichtlich der Wahl der Felder (bilateral mit Lymphabflußwegen vs. unilateral) zu bemerken ist. Auch Weir et al. [59] berichteten, daß große beidseitige Felder durchaus eine statistisch signifikante Korrelation (p<0,07) bezüglich des Überlebens zeigen. In unserer eigenen Arbeit haben wir diese Endpunkte nicht untersuchen können, da alle Patienten bilateral bestrahlt wurden. Bei der Entscheidungsfindung für große oder kleine Bestrahlungsfelder ist möglicherweise die Tatsache hilfreich, daß unter der Annahme einer Prognoseverschlechterung bei späterer Primärtumormanifestation vorsichtshalber ausgedehnte Bestrahlungsfelder zur Miterfassung des möglichen Tumorgewebes verwendet werden sollten. Aus diesem Grunde empfehlen Colletier et al. [6] die beidseitige Bestrahlung sämtlicher Pharynxetagen inclusive aller Lymphabflußwege mit großen Feldern. Erkal et al. [8] überprüften in ihrer Arbeit verschiedene Untersuchungen (Weir [59], Reddy [40] , Colletier [6], Grau [13]) hinsichtlich der Vorteile einer operativen Behandlung in Kombination mit Radiotherapie (sowohl kleine ipsilaterale Felder als auch ausgedehnte bilaterale Felder) gegenüber einer alleinigen chirurgischen Behandlung. Auch hier wird deutlich, daß nach einer chirurgischen Behandlung, gefolgt von einer ausgedehnten Strahlentherapie, bessere 5-Jahres-Überlebensraten, bessere lokale Tumorkontrollraten und weniger lokoregionale Rezidive resultieren. Die Ergebnisse unserer Untersuchung stimmen hiermit überein. Um letztendlich genaue Auskunft über das richtige Bestrahlungsvolumen zu erhalten, wurde seitens der EORTC eine prospektive randomisierte Studie initiiert. 69 Es werden eine postoperative eingeschränkte ipsilaterale Radiatio mit einer ausgedehnten beidseitigen Bestrahlung inclusive der Gebiete eines möglichen Primärtumorsitzes innerhalb der Mucosa verglichen. (Intergroup Study EORTC 24001-22005, „Randomised phase III study on the selection of the target volume in postoperative radiotherapy for cervical lymph node metastases of squamous cell carcinoma from an unknown primary [CUP] “). Die Ergebnisse stehen noch aus. Verschiedentlich wird in der Literatur bei Vorliegen ungünstiger Faktoren, wie z.B. undifferenzierter Histologie, ausgedehntem Lymhknotenbefall oder Kapseldurchbruch die Applikation einer intensivierten akzelerierten / hyperfraktionierten Bestrahlung vorgeschlagen. [7] Bei den Patienten unserer Untersuchung kam diese Form der Bestrahlungstherapie nicht zur Anwendung. Ob die heutzutage immer häufiger angestrebte Konformale Strahlentherapie oder die IMRT (Intensitätsmodulierte Radiotherapie) mit dreidimensionaler (3D)-Planung die Ergebnisse der zuvor genannten Bestrahlungsarten verbessern können, bleibt abzuwarten. Bei diesen Techniken ist eine sehr exakte Kenntnis der Drainage der einzelnen Lymphknotenstationen im Kopf-Hals-Bereich zur Definition der zu behandelnden CTV’s (Clinical Target Volume) und PTV’s (Planning Target Volume) erforderlich. Gregoire et al. [15] gaben in ihrer ausführlichen Arbeit zu bedenken, daß in der Regel wohl eine ipsilaterale lymphatische Drainage zu erwarten ist, einige Strukturen aber, wie der weiche Gaumen, die Tonsille, die Zungenbasis, die Rachenhinterwand und der Nasopharynx auch bilateral drainieren. (siehe hierzu auch Kapitel 2.2 Lymphogene Metastasierung). In diesem Zusammenhang ist vielleicht das Sentinel-Node-Konzept hilfreich. Bei diesem Konzept geht man von der Vorstellung aus, daß die Metastasierung eines Malignoms über den ersten drainierenden Lymphknoten, den sogenannten Wächterlymphknoten (Sentinel Node) erfolgt und die anschließende Metastasierung über diesen dann weiter verläuft. [62] 70 Die Darstellung dieses 1. Lymphknotens kann z.B. durch eine Farbstoffinjektion, eine Injektion einer radioaktiv markierten Substanz (z.B. Technetium) oder kombiniert mit beiden Stoffen erfolgen, um dann mit Hilfe einer Gamma-Sonde die Anreicherung zu messen bei gleichzeitiger guter Sichtbarkeit der Färbung. Ob eine Kontrastmittelinjektion mit anschließender radiologischer Darstellung möglich ist, kann an dieser Stelle nicht beantwortet werden. Die Sentinel-Node Methode ist für den Chirurgen bei der Überlegung der Operationstechnik (Art der durchzuführenden Neck Dissektion) nützlich, könnte aber auch für den Strahlentherapeuten bei der Festlegung des CTV (Clinical taget volume) eine gute Hilfe sein. Bei der herkömmlichen Technik der gegenüberliegenden Felder besteht im Grunde keine Notwendigkeit, den Tumor bzw. die Lymphknotenausdehnung von der Seite her in Richtung der Medianlinie zu definieren, da die sogenannten opponierenden Gegenfelder diese Bereiche per se mit erfassen. Obwohl nach Erkal et al. [8] vorschlagen wurde, die Bestrahlungsfelder und Feldgrößen auch in Abhängigkeit vom Befallsmuster der Lymphknoten zu wählen, haben wir bei unserem Patientenkollektiv in der Regel immer ausgedehnte Bestrahlungsfelder verordnet, also auch nach cranial bis zum Boden der Keilbeinhöhle, da im Nasopharynxbereich ein häufiger Ort unentdeckter Neoplasien zu erwarten ist. Hinsichtlich der Strahlentherapie waren somit die Feldgrößen der Bestrahlungsfelder nicht zu klein gewählt und zusätzlich hatten unsere Patienten eine durchaus akzeptable Gesamtdosis von 50,4-69,4 Gy erhalten. Die Mehrzahl der Patienten waren also insgesamt in kurativer Intention behandelt worden. Die Gesamtbehandlungszeit umfaßte den Zeitraum von Bestrahlungsbeginn bis zum Strahlentherapieende unter Einbeziehung aller Pausen, also auch der bestrahlungsfreien Wochenenden. In den 40er bis 60er Jahren wurde meist nicht klar zwischen der Gesamtbehandlungszeit und der Anzahl der Fraktionen unterschieden. Man ging davon aus, daß eine Veränderung der Gesamtbehandlungszeit keinen Einfluß auf die Tumorkontrolle habe. In der Folgezeit wurde man aber auf den möglichen negativen Einfluß der Repopulierung Therapiepausen) aufmerksam. [38] (Proliferation klonogener Tumorzellen in 71 Nach Grau et al [13] liegt ein signifikanter negativer Einfluß (p=0,02) durch eine verlängerte Behandlungszeit (50+ Tage) im Vergleich zu kürzen Konzepten vor. In unserer Untersuchung lag der Median der Therapiezeit bei 49 Tagen, konnte aber nicht als statistisch signifikant identifiziert werden. 5.3.2 Relevanz der Chemotherapie In den Therapierichtlinien zur Behandlung von Kopf-Hals-Tumoren allgemein orientiert sich der Einsatz der Chemotherapie am Tumorstadium, am Resektions-Status und an der Histologie. Während in den frühen Stadien die Operation im Vordergrund steht, wird bei inoperablen und fortgeschrittenen Stadien eine Chemo/Radiotherapie angestrebt. Gleiches gilt prinzipiell auch für die CUP-Syndrome mit zervikalem Lymphknotenbefall. Eine alleinige medikamentöse Tumortherapie kann für diese Tumoren wegen der fehlenden kurativen Potenz nicht mit kurativer Intention eingesetzt werden. Auch sind die Langzeitergebnisse der Chemotherapie insbesondere bei Adenokarzinomen bisher enttäuschend [1]. Außerdem entwickelt sich schnell eine Resistenz. Beim Lokalrezidiv in einem vorbestrahlten Gebiet ist eine Zytostatikatherapie nur mäßig wirksam wegen der schlechten Durchblutung als Folge einer Gefäßrarefizierung, so daß in Risikofällen der Einsatz in der Primärtherapie zu empfehlen ist. Bei Fernmetastasierungen kann sie zu einer passageren Remission führen. Die alleinige medikamentöse Therapie hat ihre Bedeutung im Rahmen einer palliativen Zielsetzung wegen der günstigen Wirkung auf tumorbedingte Beschwerden einschließlich quälender Schmerzen oder Verkleinerung großer, verunstaltender Tumoren. Die kombinierte Strahlen- und Chemotherapie bei der Behandlung zervikaler Lymphknotenmetastasen eines CUP-Syndroms ist noch nicht als Standardtherapie zu sehen, obwohl bekannt ist, daß eine Reihe von Zytostatika eine Sensibilisierung der Tumorzellen für die nachfolgende Strahlentherapie bewirken. 72 Die Toxizität der Chemotherapeutika wird in der Regel von der Applikationsweise (Bolusgabe, Dauerinfusion), von der Gesamtdosis und dem Zeitplan der Anwendung bestimmt, die Toxizität der Strahlentherapie hängt unter anderem von der applizierten Dosis, der zeitlichen und örtlichen Dosisverteilung, dem durchstrahlten Volumen und dem bestrahlten Gewebetyp ab und setzt somit Erfahrungen in der supportiven Behandlung hämatologischer und organbezogener Toxizitäten voraus. [14, 35, 38] Die in dieser Untersuchung verwendeten Chemotherapeutika wurden auf der Seite 42 beschrieben. In unserem radiosensibilisierende Patientenkollektiv Chemotherapie entweder erhielten postoperativ die Patienten oder als eine primäre Radio/Chemotherapie. Als Indikationen waren die höheren pN-Stadien in Verbindung mit einer bereits vorliegenden Fernmetastasierung sowie eine R1, R2 Situation vorgesehen. Ein abnehmender Differenzierungsgrad war ebenso eine Indikation zur Applikation einer Strahlen- und Chemotherapie. Die Tabelle 6 verdeutlicht, daß insgesamt nur vergleichsweise selten [5, 17, 25, 36, 56] und zudem auch nur mit kleinen Fallzahlen, Kombinationstherapien aus Radiatio und Zytostatika appliziert werden. Iganej et al. [21] berichten in ihrer Untersuchung - obwohl sie selbst keine Zytostatikatherapie applizierten – daß durch eine Chemo/Radiotherapie die lokoregionale Tumorkontrolle und auch das Überleben nach Kombinationstherapie insbesondere bei fortgeschrittener Erkrankung verbessert werden soll. Auch Sauer et al. [48] berichten über eine Tendenz zu einer geringen Verbesserung der Überlebensraten nach kombinierter Radio/Chemotherapie verglichen mit einer alleinigen Strahlentherapie. Kirschner et al. [25] sehen in der simultanen Anwendung von Bestrahlung und Chemotherapie im Vergleich zu Radiotherapie allein keinen gesicherten Vorteil. Zur Wahl der Zytostatika gibt es nach Meinung von Hansen [18] bisher keine Standards, wohl aber die Feststellung, daß die Verwendung von Platinderivaten (evtl. auch Etoposid oder 5-FU) überwiegt. 73 Das Ziel der kombinierten Radio/Chemotherapie sollte nicht nur eine Verlängerung der Überlebenszeit darstellen, sondern eine Verbesserung des sogenannten therapeutischen Index, der das Verhältnis der Wahrscheinlichkeit einer von Strahlen- bzw. Chemotherapie induzierten Tumorkontrolle zur Wahrscheinlichkeit einer therapiebedingten Akut- und Spätmorbidität im Normalgewebe beschreibt. [4, 38] Aus diesem Grunde ist neben dem Nachweis der Wirksamkeit immer auch der Nutzen für den Patienten zu bedenken. Dies gilt insbesondere für kombinierte Radio/Chemotherapien bei multimorbiden Patienten. Wir hatten erwartet, daß unsere Behandlungsergebnisse nach Kombination mit einer radiosensibilisierenden Chemotherapie noch weiter verbessert werden können. In der multivarianten Analyse unseres Kollektivs stellte sich jedoch heraus, daß die Variable Chemotherapie k e i n e statistische Signifikanz hinsichtlich des Überlebens und auch des rezidivfreien Überlebens darstellte. Dieses ist am ehesten aus der Negativselektion lokal fortgeschrittener Tumorstadien, Patienten mit Fernmetastasen und tendenziell mehr niedrig differenzierten Tumoren zu erklären. Zusätzlich mag es daran liegen, daß die Patientenzahl mit 34 Patienten relativ klein war und möglicherweise die Chemotherapie unselektioniert verabreicht wurde. Hier könnten wir eine Indikationsstellung, wie sie bei der Behandlung von bekannten Kopf-Hals-Tumoren durchgeführt wird, versuchen. Bei primär inoperablen Patienten ist eine Chemotherapie innerhalb eines neoadjuvanten Behandlungskonzeptes mit Strahlentherapie und nachfolgender Operation denkbar. Es bleibt aber zu bedenken, daß eine Verzögerung des Behandlungsbeginns nicht unbedingt vorteilhaft ist. In den Untersuchungen von Colletier et al. und Klop et al. [6, 26] wird der verzögerte Therapiebeginn als negativ bestätigt, jedoch ohne statistische Signifikanz. Für das CUP-Syndrom mit zervikaler Lymphknotenmetastasierung neoadjuvanten Therapiekonzepten jedoch keine Untersuchungen vor. liegen zu 74 5.3.3 Relevanz der Operation der Lymphabflußwege Der Stellenwert der Operation innerhalb eines kombinierten Behandlungskonzeptes (Neck Dissektion und postoperative Strahlentherapie) ist unumstritten. Unter kurativer Intention muß eine komplette Excision der Lymphknotenmetastasen immer angestrebt werden. Dunst et al. [7] beschrieben allerdings nur einen fraglichen Vorteil einer radikalen Halslymphknotenausräumung gegenüber einer einfachen Lymphknotenexstirpation bei anschließend hochdosierter postoperativer Strahlentherapie. Christiansen et al. [5] dagegen konnten nach radikaler Lymphknotendissektion versus Biopsie signifikant bessere lokoregionäre Kontrollraten (p=0,008) sowie Überlebensraten (p=0,008) nachweisen. Für Patienten mit günstigen prognostischen Faktoren kann möglicherweise eine alleinige Operation ausreichend sein. Jedoch ist nach Grau et al. zu bemerken, daß dann die mediane Rezidivrate bei 34% liegt, und daß sich der Primärtumor in ca. 25% der Fälle im Verlauf manifestiert. [13] In der Analyse der prognostischen Relevanz verschiedener Zielkriterien haben wir das Merkmal Neck Dissektion nicht untersucht, da die Fallzahl in dem Kollektiv zu gering war und aus diesem Grunde keine Aussage zu erwarten war. 5.3.4 Relevanz der Tonsillektomie In den bisher vorliegenden Arbeiten wird regelmäßig eine umfangreiche prätherapeutische Diagnostik inklusive Tonsillektomie empfohlen, im Ergebnisteil fehlen jedoch leider detaillierte Angaben darüber, wie konsequent im untersuchten Patientengut Tonsillektomien und auch umfassende Pharynxbiopsien wirklich durchgeführt wurden. [17] Dies bedeutet wohl, daß die Tonsillektomie nicht systematisch bei allen Patienten erfolgte. [58] Anhand der Literatur [27, 29] ist zu belegen, daß bereits eine ipsilaterale Tonsillektomie in bis zu 23-26 % der Fälle zur Entdeckung eines unbekannten Primärtumors führt und deshalb im Rahmen der Routine des operativen Stagings angestrebt wird. 75 Im Grunde ist aber eine möglichst bilaterale Tonsillektomie als Teil der diagnostischen Aufarbeitung bei Patienten mit zervikalem CUP-Syndrom zu fordern [34], da einerseits die Tonsillen neben dem Nasopharynx und dem Zungengrund der häufigste Sitz unentdeckter Primärtumoren sind und andererseits sogar bei 10% der Patienten auf der contralateralen Seite ein Tonsillenkarzinom gefunden wird [27, 37]. In unserem Patientenkollektiv erhielten 40 Patienten eine TE, 44 Patienten keine TE (s. Tabelle 4). Viele Patienten waren bereits in ihrer Vorgeschichte tonsillektomiert worden. Die Behandlungsergebnisse, also die Zielkriterien Überleben (p < 0,001) und rezidivfreies Überleben ( p <0,003) sind in unserem Patientenkollektiv nach Tonsillektomie signifikant besser (s. Abbildung 8 und 9). Patienten, bei denen durch die Tonsillektomie ein vorher klinisch inapparenter Tumor entdeckt wurde, befinden sich definitionsgemäß nicht im zu untersuchenden Patientengut. Es ist denkbar, daß Patienten, die im Vorfeld der Tumorsuche nur kleine bis mäßig vergrößerte Lymphknoten-Metastasen hatten, obligatorisch die Tonsillektomie zur Primärtumorsuche erhielten, während bei Patienten mit ausgedehntem Lymphknotenbefund auf eine Tonsillektomie verzichtet wurde. Stattdessen erfolgte bei nicht durchgeführter Tonsillektomie (TE) eine kombinierte Radio/Chemotherapie bzw. eine primäre Strahlentherapie. Ein weiterer Erklärungsversuch für die fehlende Operations-Indikation ist, daß bei der Entstehung von Kopf-Halstumoren - somit auch beim CUP-Syndrom – die Noxen Tabak und Alkohol bekanntermaßen zu den wichtigsten ätiologischen Faktoren gehören. Es resultiert daraus häufig eine relevante Multimorbidität mit stark eingeschränkter Operabilität. Ein anderer Gesichtspunkt hinsichtlich des besseren Abschneidens der Patienten mit TE ist die Frage, ob eine ausreichend exakte histologische Aufarbeitung des TE-Materials erfolgte. Es scheint erforderlich zu sein, das Untersuchungsmaterial nicht nur anhand repräsentativer Schnitte zu erfassen, sondern die gesamte Tonsille eng lamelliert zu untersuchen. In bis zu 8% können sich Tumoren in klinisch absolut unauffälligen ipsilateralen Tonsillen befinden. [17] Diese Forderung ist jedoch nur mit erhöhtem Zeit- und Kostenaufwand zu erfüllen. Theoretisch könnten Tonsillentumoren in mikroskopischer Ausbreitung der Diagnose entgangen sein. 76 Ungeachtet der zuvor genannten Gesichtspunkte reduziert sich durch eine Tonsillektomie die Anzahl der Patienten, die unter der Diagnose eines „echten“ CUP-Syndroms mit Halslymphknotenmetastasen geführt wurden, zugunsten einer Erkrankung mit bekanntem Ursprungstumor. Der Nachweis eines okkulten, potentiell kurativ behandelbarenTumors ermöglicht in dem Fall dann eine gezieltere Behandlung der Tumorkrankheit. Bei den in dieser Arbeit untersuchten Patienten fand sich unter den 6 im Verlauf aufgedeckten Primärtumoren in einem Fall ein Tonsillenkarzinom. Hier wäre eine routinemäßige Tonsillektomie indiziert gewesen. 5.4 Die Gesamtprognose Im Rahmen der in unserer Abteilung durchgeführten Untersuchung konnten insgesamt 84 Patientenakten ausgewertet werden. Zum Ende der Auswertung im März 2006 lebten noch 48 Patienten (57,14%) in Vollremission. Unter Berücksichtigung der Gesamtüberlebenskurven (Abb. 3, 4, 5) läßt sich eine 5-Jahres-Überlebensrate von 48%, darauf bezogen ein rezidivfreies 5-Jahres-Überleben von 65% und ein metastasenfreies 5-Jahres-Überleben von 89% ablesen. Insgesamt verstarben 36 Patienten innerhalb der Nachbeobachtungszeit, das ergibt einen prozentualen Wert von 42,86%. Die Ergebnisse sind durchaus vergleichbar mit anderen retrospektiven kleineren Studien [5, 7, 25, 52]. Durch unsere Behandlung konnte also das Tumorleiden in vielen Fällen beherrscht werden, was bestätigt, daß der anzunehmende Primärtumor im Kopf-Hals-Bereich lokalisiert sein mußte. Die Gefahr einer Generalisation der Erkrankung im Sinne einer Fernmetastasierung war relativ gering (s. das hohe metastasenfreie Überleben!), wie es bei Kopf-Hals-Tumoren allgemein bekannt ist. Insgesamt sind unsere Ergebnisse gleichrangig zu denen früherer Untersuchungen, jedoch ist ein direkter Vergleich schwierig wegen der Heterogenität der Patientenauswahl und der Therapiemodalitäten. 77 In Anbetracht der Seltenheit der Erkrankung wäre es wünschenswert, Patientendaten mit zervikaler Lymphknotenmetastasierung bei CUP-Syndrom national im Rahmen einer einheitlichen prospektiven Erhebung zu erfassen. Die oben genannte prospektive randomisierte Studie der EORTC (“Intergroup Study EORTC 24001-22005, „Randomised phase III study on the selection of the target volume in postoperative radiotherapy for cervical lymph node metastases of squamous cell carcinoma from an unknown primary [CUP] “) ist zumindest zur Datenerhebung des therapeutischen Vorgehens konzipiert. 5.5 Nebenwirkungen und Akzeptanz der Therapie Immer häufiger wird in onkologischen Behandlungsstudien die Lebensqualität, d.h. die subjektive Befindlichkeit, in die Erfolgs- bzw. Mißerfolgsbeurteilung einbezogen. Dies kann den Vergleich und auch die Auswahl verfügbarer Therapiepläne für bestimmte Indikationen und Patienten erleichtern. Wir haben in unserer Untersuchung diese Kriterien zwar erfragt, jedoch nicht statistisch erfaßt und ausgewertet. In den Gesprächen mit den Überlebenden kam immer eine hohe Akzeptanz der Behandlung, wie sie die Patienten in unserer Klinik erhalten hatten, zum Ausdruck, wenngleich fast alle Patienten sich an eine nicht immer unproblematische Therapiezeit erinnerten. In den meisten Fällen verblieben eine deutliche Xerostomie und auch Geschmacksveränderungen als Spätfolge der Strahlentherapie. Die Patienten hatten aber Wege und Mittel gefunden, mit diesen Langzeitnebenwirkungen zurecht zu kommen. Letztendlich überwog doch die Freude, die Tumorkrankheit bei guter Lebensqualität überwunden zu haben. 78 Tabelle 6: Literaturstudien zur Behandlung des CUP-Syndroms mit zervikalen LK-Metastasen Autor, Jahr der Publikation Christiansen et al. 2005 Patienten (n) 28 Therapie 5-JÜL (%) (n) RT CT 28 5 40,1 Rezi- Primariusdiv nachweis (%) (n) // (%) 21 0 // 0 Weber et al. 2001 75 56 - 14,7 21 NB // 44 Grau et al. 2000 237 250 - 36 48 66 // 19 Dunst et al. 1988 Kirschner et al. 1997 32 20 - 52 36 2 // 6 64 52 12 39 39 9 // 14 Colletier et al. 1998 136 120 - 60 27 14 // 8 Fernandez et al. 1998 67 52 - 22 NB 19 // 27 Strojan et al. 1998 Klop et al. 2000 v.d. Planken et al. 1997 56 56 - 52 18 5 // 9 39 39 - 52 34 NB // 5 44 33 2 50 2 Reddy et al. 1997 71 52 - 40 18 NB // 19 2 Haas et al. 2002 50 28 1 56 18 10 // 29 NB Iganej et al. 2002 106 72 - 53 54 19 // 18 81 Tong et al. 2002 Weir et al. 1995 45 36 8 69 57 3 // 11 48 144 144 - 41 49 17 // 12 51 Erkal et al.2001 126 123 3 47 10 NB // 13 78 Eigene Arbeit 2006 84 84 36 48 28 6 // 7 65 5 // 11 Tumor Untersuchte KonPrognosefaktoren trolle (%) 72,9 Hb, Kapseldurchbruch, OP (ND, TE) NB Oto-rhinolaryngeale Primärtumorsuche 51 Hb, Geschlecht, NStatus,Therapiezeit, Feldgröße,Therapiemodalität 32 Histologie, Primarius 68 Histologie, NStatus, LK-Lokalisation, Operabilität 74 Dosis, Rezidive, Therapiebeginn/ zeit,Kapseldurchbruch 66 N-Status, Grading Primarius 88 Feldgröße, Kapseldurchbruch NB Therapiebeginn Signifikante Prognosefaktoren 48 Histologie, Therapieziel, Kapseldurchbruch, Histologie, Therapieziel, Kapseldurchbruch, Therapieabbrüche, OP(ND,TE) Bestrahlungs,Behandlungsarten Primariussuche N-Status, Kapseldurchbruch Primariussuche, Nebenwirkungen N-Status, Histologie Behandlungsart, Feldgröße, NStatus, Tumorausdehnung nach Biopsie N-Status, N-Größe, ND,RT-Dosis, Kapseldurchbruch , LK-Level, Histo.Differenzierung,Therapiezeit Alter, Geschlecht, TE,N-Status, Gesamtdosis Simultane CT Tumorvolumen RND, Kapseldurchbruch NB N-Status, Hb, Therapiezeit, Geschlecht,Behanlungsmodalität NB Operabilität N-Status, Kapseldurchbruch N-Status, Grading, Primarius, Feldgröße, Kapseldurchbruch NB ND, Bestrahlungsart NB N-Status, Kapseldurchbruch, Primarius N-Status, Histologie, Behandlungsart N-Status, Gesamtdosis N-Status, N-Größe, Kapseldurchbruch, RT-Dosis Tumorvolumen Alter NB=nicht berichtet RT=Radiotherapie CT=Chemotherapie N=Nodus 5JÜL=5 Jahresüberleben ND=Neck Dissektion RND=Radikale ND Hb=Hämoglobinkonzentration TE=Tonsillektomie 79 6 Zusammenfassung In der vorliegenden Arbeit werden die Therapieergebnisse von 84 hauptsächlich aus der Universitäts-HNO-Klinik des St. Elisabeth-Hospitals Bochum zugewiesenen Patienten dargestellt, die in der Zeit von 1990 - 2006 in der Radiologischen Klinik, Abteilung Strahlentherapie des St. Josef-Hospitals Bochum bestrahlt wurden wegen einer zervikalen Lymphknotenmetastasierung bei unbekanntem Primärtumor (CUP-Syndrom). Nach histologischer Sicherung der Diagnose und der Situation angepaßter unterschiedlicher Ausweitung der weiteren operativen Maßnahmen erfolgte in der Regel unter kurativem Aspekt eine Bestrahlung mit Einbeziehung sämtlicher Pharynxetagen und sämtlicher zervikaler Lymphknotenstationen in das Zielvolumen. Die Fraktionierung betrug 1 x 1,8 Gy / Tag, 5 Fraktionen / Woche bis zu einer angestrebten Gesamtdosis von 59,4 Gy. 34 Patienten (40,47%) erhielten zusätzlich eine Chemotherapie mit Carboplatin oder Cisplatin. Die mediane Nachbeobachtungszeit der lebenden Patienten betrug 32 Monate (2-128 Monate). Die Patientendaten wurden analysiert hinsichtlich der epidemiologischen Patientendaten, Histologie, Tumorstadium, Grading und der Risikofaktoren Hb, BMI und Tumorvolumen, sowie der Therapiedaten Operation, Strahlentherapie und Chemotherapie. Es wurden Überlebensanalysen (Gesamtüberleben, rezidivfreies Überleben, metastasenfreies Überleben) in Bezug auf diese Daten durchgeführt und die prognostische Relevanz der verschiedenen Kriterien untersucht. Das 5-Jahres-Gesamtüberleben betrug 48%. Darauf beziehen sich ein Metastasenfreies 5-Jahres-Überleben von 89% und ein Lokalrezidivfreies 5-Jahres-Überleben von 65%. Diese Zahlen verdeutlichen die geringe Gefahr einer Fernmetastasierung bei dieser Erkrankung. 80 Bei multivarianter Betrachtung für das Zielkriterium Gesamtüberleben erwiesen sich die Merkmale Tonsillektomie bzw. Operation ja/nein, das Tumorvolumen und grenzwertig auch das Alter als relevant. Für den Endpunkt rezidivfreies Überleben waren nur die Merkmale Tonsillektomie und Tumorvolumen relevant. Somit zeigte sich statistisch signifikant, daß die Tumorprognose besser war, wenn das Tumorvolumen kleiner oder gleich dem ermittelten Median war und daß eine zusätzlich zu sonstigen operativen Maßnahmen erfolgte Tonsillektomie ebenfalls das Geamtüberleben und rezidivfreie Überleben verbesserte. Ein statistisch signifikanter Einfluß der zusätzlich zur Bestrahlung durchgeführten Chemotherapie auf das Überleben fand sich nicht. Zusammengefaßt schließen wir aus unseren Ergebnissen verglichen mit denen der Literatur folgendes: 1. Bei Patienten mit CUP-Syndrom und zervikalen Lymphknotenmetastasen ist eine intensive initale Primärtumorsuche mittels Bildgebung und HNO-fachärztlicher Untersuchungen inclusive systematischer Biopsien, Neck Dissektionen und Tonsillektomien angezeigt. 2. Die Behandlung der CUP-Syndrome mit zervikaler Lymphknotenmetastasierung beschränkt sich derzeit mangels anderer Optionen auf eine Therapie im Sinne von Operationen sowie Strahlentherapie der angenommenen Primärtumorregion und der Lymphabflusswege - eventuell mit radiosensibilisierender Chemotherapie 3. Geschlecht, Chemotherapie und Hämoglobinkonzentration blieben in unserer Untersuchung ohne statistischen Einfluß. 4. Als weitere Risikofaktoren sind das Alter und (allerdings unter Vorbehalt) die Noxen Nikotin und Alkohol zu werten. 81 5. Nach Tonsillektomie verbessern sich die Überlebenszeiten und auch das rezidivfreie Überleben. 6. Als ein unabhängiger Prognosefaktor konnte das Tumorvolumen der Lymphknotenmetastasen als statistisch relevant erfaßt werden. Es hat eine Auswirkung auf die Prognose (Überlebenszeiten und Rezidivbildung) - je kleiner desto günstiger, je größer desto ungünstiger - und kann somit zur Individualisierung der Therapie herangezogen werden. 82 7 Literaturverzeichnis [1] Berger D.P., Scheele J., Engelhard R. (2002). Charakterisierung klinisch eingesetzter Zytostatika.In: Berger DP, Engelhard R, Mertelsmann R, Das Rote Buch: Hämatologie und Internistische Onkologie, 2. überarbeite und erweiterte Auflage, Ecomed Verlagsgesellschaft Landsberg/Lech. Kapitel 2.2.1, 52-109. [2] Bönninghaus H.G., Lenarz T.H. (2001). Hals-Nasen-Ohrenheilkunde für Studierende der Medizin, 11. überarbeitete Auflage, Springer Verlag Berlin, Heidelberg, New York. Kapitel VI 6.2. Untersuchungsmethoden 504-508, Kapitel VI 6.3.3. Tumoren 517-22. [3] Bortz J., Lienert G.A. (Hrsg) (1998). Kurzgefasste Statistik für die klinische Forschung. Ein praktischer Leitfaden für die Analyse kleiner Stichproben, Springer Verlag. Berlin, Heidelberg, New York. 209-13. [4] Budach V., Böhmer D. (2004). Rachen In: Bamberg M, Molls M, Sack H. Radioonkologie, Klinik, Band II, Zuckerschwerdt Verlag Muenchen. 413-445. [5] Christiansen H., Hermann R.M., Martin A., Nitsche M., Schmidberger H., Pradier O.(2005). Neck lymph Node Metastases from an Unknown Primary Tumor. Retrospective Study and Review of Literature. Strahlenthera. Onkol. 355-62. [6] Colletier P.J., Garden A.S., Morrison W.H. (1998). Postoperative radiation for squamous cell carcinoma metastatic to cervical lymph nodes from an unknown primary site: outcomes and patterns of failure. Head Neck 20, 674-81. [7] Dunst J., Sauer R., Weidenbecher M. (1988). Halslymphknotenmetastasen bei unbekanntem Primärtumor. Strahlentherapie und Onkologie. 164, 129-35(Nr.3). [8] Erkal H.S., Mendenhall W.M., Amdur R.J., Villaret D.B., Stringer S.P. (2001). Squamous cell carinomas metastatic to cervical lymph nodes from an unknown head and neck mucosal site treated with radiation therapy alone or in combination with neck dissection. Radiotherapy and Int. J. Oncology Biol. Phys. Vol. 50, No.1, 55-63. [9] Esposito E.D., Motta S., Cassiano B., Motta G. (2001). Occult lymph node metastases in supraglottic cancers of the larynx. Otolaryngol Head Neck Surg Mar 124(3),253-7. [10] Fernandez J.A., Suarez C., Martinez J.A. (1998) Metastatic squamous cell carcinoma in cervical lymph nodes from an unknown primary tumor; prognostic factors. Clin Otolaryngol. 23,158-35. [11] Gatter K.C., Mason D.Y. (1982). The use of monoclonal antibodies for histopathologic diagnosis of human malignacy Semin Oncol. 9,517-525. 83 [12] Gillison M.L., Koch W.M., Capone R.B. (2000). Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J Natl Cancer Inst. 92,709-20. [13] Grau C., Johansen L.V., Jakobsen J. (2000). Cervical lymph note metastases from unknown primary tumors. Results from a national survey by the Danish Society for Head and Neck Oncology. Radiother Oncol. 55,212-9. [14] Greco A., Burris H.A., Erland J.B., Gray J.R., Kalman K.A., Schreeder M.T., Hainsworth J.D. (2000). Carcinoma of Unknown Primary Site. Long Term Follow-UP after Treatment with Paclitaxel, Carboplatin, and Etoposide. CANCER, Volume 89/Number 12,2655-2660. [15] Gregoire V., Choche E., Cosnard G., Hamoir M., Reychler H. (2000). Selection and delineation of lymph node target volumes in head and neck conformal radiotherapy. Proposal for standardizing terminology and procedure based on the surgical experience. Radiother Oncol. 56,135-50. [16] Grosu A.L., Nuesslin F., Stuschke M. (2003). Bildgebung und Bildverarbeitung. In: Bamberg M, Molls M, Sack H. Radioonkologie, Grundlagen, Band I, Zuckerschwerdt Verlag München. 145-156. [17] Haas I., Hoffmann T.K., Engers R., Ganzer U. (2002). Diagnostic strategies in cervical carcinoma of an unknown primary CUP. Eur Arch Otorhinolaryngol. 259(6), 325-33. [18] Hansen H.H., Daugaard G. (2001). Management of carcinoma of unknown primary site (CUP), any changes? Annals of Onkology. 12,431-32. [19] Harms V. (1998). Biomathematik, Statistik und Dokumentation. Harms Verlag. 7. Auflage, Kapitel 2, 14-37. Kapitel 7, 186-221. [20] Hossfeld D.K., Wittekind C.H. (2005). Metastasen bei unbekanntem Primaertumor. Das CUP-Syndrom. Dtsch Ärztebl. 102, A904-79 [Heft 13]. [21] Iganej S., Kagan R., Anderson P., Rao A., Tome M., Wang R, Dowlatshani M., Cosmatos H., Morgan T. (2002). Metastatic squamous cell carcinoma of the neck from an unknown primary: Management options and patterns of relapse. Head & Neck 236-246. [22] Issing W.J., Tauber S.T., Siefert A. (2003). Halslymphknotenmetastasen bei unbekanntem Primaertumor. In : Manual Kopf-Hals-Malignome Tumorzentrum München, Spezieller Teil 2. Auflage, Zuckerschwerdt Verlag München, 258-61. [23] Jenicke L., Bohuslavizki K.H., Sonnemann U. (2001) FDG-PET in der Bildgebung des CUP-Syndroms. Der Onkologe 7, 491-497. [24] Karsell P.R., Sheedy P.F., O’Connell M.J. (1982). Computed tomography in search of cancer of unknown origin. J. Amer. Med. Ass. 248, 340-43. 84 [25] Kirschner M.J., Fietkau R., Waldfahrer F. (1997). Zur Therapie von zervikalen Lymphknotenmetastasen ohne bekannten Primärtumor. Strahlenther Onkol. 39, 291-6. [26] Klop W.M., Balm A.J., Hilgers F.J., Tan I.B. (2000). Diagnosis and Treatment of 39 patients with cervical lymph node metastases of squamous cell carcinoma of unknown primary origin, referred to Netherlands Cancer Institute/Antoni van Leeuwenhoek Hospital 1979-98. Ned. Tijdschr. Geneeskd. 144 (28), 1355-60. [27] Koch W.M., Bhatti N., Williams M.F., Eisele D.W. (2001). Oncologic rationale for bilateral tonsillectomy in head and neck squamous cell carcinoma of unknown primary source. Otolaryngol Head Neck Surg. 124(3), 331-3. [28] Lamerz R. (1989). Klinische Relevanz von Tumormarkern. Wien Klin Wochenschrift. 101, 464-72. [29] Lapeyre M., Malissard L., Pfeiffert D. (1997). Cervical lymph node metastasis from an unknown primay: is tonsillectomy necessary. In J Radiat Oncol Biol Phys. 39, 291-6. [30] Lee W.Y., Hsiao J.R., Jin Y.T. (2000). Epstein-Barr virus detection in neck metastases by in-situ hybridization in fine-needle aspiration cytologic studies: An aid differentiating the primary site. Head Neck. 22, 336-40. [31] Lindberg, R. (1972). Distribution of cervical lymph node metastases from squamous cell carcinoma of the upper respiratory and distestive tracts. Cancer, 29, 1446-1449. [32] Lissner J., Fink U. (1992). Pysikalische und technische Grundlagen spezieller Untersuchungsverfahren. In :Lissner J, Fink U. Radiologie Grundlagen Band 1. Ferdinand Enke Verlag Stuttgart. Kapitel 4, 90-104. [33] Medina J.E. (1989). A rational classification of neck dissections. Otolayngol Head Neck Surg. 100, 169-76. [34] McQuone S.J., Eisele D.W., Lee D.J. (1998). Occult tonsillar carcinoma in the unknown primay. Laryngoscope. 108, 1605-10. [35] Molls M., Würschmitt F. (2003). Verstaerkung der Strahlenwirkung: Zytostatika und Sensitizer, biologische Substanzen und Gentherapie In: Bamberg M, Molls M, Sack H. Radioonkologie, Grundlagen, Band I, Zuckerschwerdt Verlag München. 274-292. [36] Nieder C., Gregoire V., Ang K.K. (1997). Cervical lymph node metastasis from an unknown primary tumor, with a review of the literature. Strahlenther Onkol. 173, 163-69. 85 [37] Nieder C., Gregoire V., Ang K.K. (2001). Cervical lymph node metastasis from occult squamous cell carcinoma: Cut down a tree to get an apple? Int J Radiation Oncology Biol Phys Vol. 50. N0.3, 727-33. [38] Ott O.J., Grabenbauer G.G. (2000). Die Toxizität häufig verwendeter Chemotherapeutika allein und in Kombination mit simultaner Radiotherapie. In: Dörr W, Zimmermann JS, Seegenschmiedt MH, Nebenwirkungen in der Radioonkologie. Klinisches Kompendium. Urban und Vogel München (Medizin und Wissen) Münchener Medizinische Taschenbcher. 241-50. [39] Pintos J., Franco E.L., Black M.J. (1999). Human papillomavirus and prognoses of patients with cancers of the upper aerodigestive tract. Cancer 8, 1903-1909. [40] Reddy S.P., Marks J.E. (1997). Metastatic carcinoma in the cervical lymph nodes from an unknown primary site: Results of bilateral neck plus mucosal irridiation vs. ipsilateral neck irridiation. Int J Radiat Oncol Biol Phys. 37, 797-802. [41] Riede U.N., Wiestler O.D., Müller H.J. (1995). Störungen des Zellwachstums, Riede UN, Costabel U,: Respiratorisches System, Riede UN, Schaefer HE, Krekeler GR: Digestorisches System. In: Riede UN, Schaefer HE, Allgemeine und spezielle Pathologie. 4. Auflage, Georg Thieme Verlag Stuttgart, New York. Kapitel 7, 330-391, Kapitel 11, 590-656, Kapitel 12, 660-739. [42] Robbins K.T. (1999). Integrating radiological criteria into the classifikation of cervical lymph node disease. Arch Otolaryngol Head Neck Surg. 125, 385-387. [43] Robbins K.T., Medina J.E.,Wolfe G.T., Levine P.A., Sessions R.B., Pruet C.W. (1991). Standardizing neck dissection terminology: official report of the Academy’s Committee for head and neck surgery and oncology. Arch Otolaryngol Head Neck surg. 117, 601-605. [44] Robert N.J., Garnick M.B., Frei E. (1982). Cancers of unknown origin: Current approaches and future perspectives. Semin.Oncol. 9, 526-31. [45] Rogers C. (2003). Analyse von 136 Patienten mit einem CUP-Syndrom in Bezug auf klinische Charakteristika, diagnostische und therapeutische Strategien sowie prognostische Faktoren. Hamburg, Dissertation. [46] Rübe C.H. (2004). Halslymphknoten bei unbekanntem Primärtumor. In: Bamberg M, Molls M, Sack H. Radioonkologie, Klinik, Band II, Zuckerschwerdt Verlag München. 497-501. [47] Rouviére H. (1932). Anatomie des lymphatiques de l´homme. Paris, Masson. 86 [48] Sauer R., Geiger C., Wey W. (1987). Perkutane Strahlentherapie der Oropharynx- und Hypopharynxkarzinome. In: Sauer R, Schwab W (Hrsg.): Kombinationstherapie der Oropharynx- und Hypopharynxkarzinome. Urban & Schwarzenberg, München, Wien, Baltimore, 32-43. [49] Shah J.P., Strong E., Spiro R.h., Vikram B. (1981) Neck dissection: Current status and future possibilities Clin bull 11, 25-33. [50] Som P.M. (1987). Lymph nodes of the neck. Radiology.165, 593-600. [51] Spiessl B., Beahrs O.H., Hermanek P., Hutter R.V.P., Scheibe O., Sobin L.H., Wagner G. ( 1993). Kopf-und Halstumoren. In: UICC International Union Against Caner; Union Internationals Contre le Cancer. TNM-Atlas. Illustrierter Leitfaden zur TNM/pTNM-Klassifikation maligner Tumoren, 3. Auflage, Springer Verlag Berlin, Heidelberg, New York. Abbildung 1-6, 3-10. [52] Strojan P., Anicin A. (1998). Combined surgery and postoperative radiotherapy for cervical lymph node metastases from an unknown primary tumor. Radiother Oncol 1949, 33-40. [53] Suárez O. (1963) El problema de las metástasis linfáticas y alejadas del cáncer de laringe e hipofaringe. Rev Otorrhinolaryngol 23, 83-99. [54] Suen J.Y., Stern S.J. (1996). Cancer of the Neck. In: Myers E.N., Suen J.Y., Cancer of the Head and Neck. Third Edition. WB Saunders Company, A Division of Harcourt Brace & Company. Philadelphia, London, Toronto, Montral, Sydney, Tokyo. Kapitel 23, 462-84. [55] Suen J.Y., Goepfert H. (1987). Standardization of neck dissection nomeclature. Head Neck. 10, 75-77. [56] Tong C.C., Luk M.Y., Chow S.M., Ngan K.C., Lau W.H. (2002). Cervical nodal metastases from occult primary versus squamous cell carcinoma. Head & Neck. 236-246. [57] Van den Planken H.J., Tiwari R.M., Karim A.B. (1997). Treatment of cervical lymph node metastasis from an unknown primary tumor, with a review of the literature. Strahlenther Onkol. 173, 163-69. [58] Weber A., Schmorz S., Bootz F. (2001). CUP (Carcinoma of unknown primary) syndrome in head and neck: Clinic, diagnostic and therapy. Onkologie. 24, 38-43. [59] Weir L., Keane T., Cummings B., Goodman P., O`Sullivan B., Payne B., Warde P. (1995). Radiation treatment of cervical lymph node metastases from an unknown primary: An analysis of outcome by treatment volume and other prognostic factors. Radiotherapy and Oncology. 35, 206-211. 87 [60] Werner J.A. (2001). Historical outline for the Nomenclature of the Lymph Nodes of the Neck as Basis for Neck Dissection Classification. Laryngo-Rhino-Otol. 80,400-9. [61] Werner J.A., Dünne A.A. (2001). Value of neck dissection in patients with squamous cell carcinoma of unknown primary. Onkologie. 24(1), 16-20. [62] Werner J.A., Dünne A.A., Brandt D., Ramaswamy A., Külkens C., Lippert B.M., Folz B.J., Joseph K., Moll R. (1999). Untersuchungen zum Stellenwert der Sentinel Lymphonodektomie bei Karzinomen des Pharynx und Larynx. Laryngo-Rhino-Otol. 12, 663-70. [63] Wittekind C.H., Meyer H.J., Bootz F. (2002). TNM Classification of malignant tumors, Springer Verlag Berlin, Heidelberg, New York. 6. Auflage. [64] Wittekind C.H., Klimpfinger M., Sobin L.H. (2005). TNM-Atlas Illustrierter Leitfaden zur TNM/pTNM-Klassifikation maligner Tumoren, Springer Verlag Berlin, Heidelberg, New York. 5. Auflage. Danksagung Für die Überlassung der interessanten Themenstellung und die freundliche Unterstützung bei der Ausführung der Arbeit danke ich Frau Dr. med. Maria Kißler, der ehemaligen Leiterin der Abt. Strahlentherapie am St. Josef-Hospital Bochum. Des weiteren danke ich der Universitäts-HNO-Klinik am St. Elisabeth-Hospital unter der Leitung von Herrn Prof. Dr. Stefan Dazert für die freundliche Überlassung der Patientenakten zur Einsichtnahme. Zuletzt gilt mein Dank meinem Ehemann, meiner Mutter und meiner Familie, die mich oft bei meiner Arbeit unterstützt haben und ohne deren Hilfe ich diese Hürde nicht gemeistert hätte. Lebenslauf Name: Martina Stillger, geb. Askamp Geburtsdatum: 23.12.1957 Geburtsort: Castrop-Rauxel Familienstand: verheiratet, keine Kinder Staatsangehörigkeit: deutsch Religion: römisch-katholisch Schulausbildung, Berufsausbildung, Berufstätigkeit: Grund/Hauptschule Dortmund-Bövinghausen Abschluß 1964-1973 Mittlere Reife Bénédict School Dortmund Abschluß in Englisch und Spanisch 1973-1976 Krankenpflegepraktikum Städtische Kliniken Dortmund 1976-1977 Krankenpflegeschule Städtische Kliniken Dortmund Abschluß 1977-1980 Fremdsprachenkorrespondentin Krankenpflegeexamen Tätigkeit als OP-Schwester Unfallchirurgische Klinik der Städtischen Kliniken Dortmund 1980-1989 Abendgymnasium der Stadt Dortmund Abschluß 1982-1985 Mitarbeit in der Facharztpraxis des Ehemannes 1989-1990 Abitur Studium: Westfälische Wilhelms Universität Münster Nur Sommersemester 1990 Ruhr Universität Bochum Ab Wintersemester 1990 Prüfungen: Ärztliche Vorprüfung September 1994 Erstes Staatsexamen der Medizin Zweites Staatsexamen der Medizin Drittes Staatsexamen der Medizin September 1995 September 1997 November 1998 AiP-Tätigkeit: St. Josef Hospital Bochum Abteilung für Strahlentherapie Radiologische Klinik 1.12.1998-31.5.1999 1.06.1999-31.5.2000 Ärtztliche Tätigkeit: St. Josef Hospital Bochum Abteilung für Strahlentherapie Ab 1.6.2000 Anerkennung Gebietsbezeichnung Fachärztin für Strahlentherapie 8.5.2004 Fachkunde im Strahlenschutz Strahlenbehandlung-Gesamtgebiet 8.5.2004 Fachkunde im Strahlenschutz Anwendung von Röntgenstrahlen mit Therapiesimulator einschließlich Bestrahlungsplanung mittels CT, Bereich Strahlentherapie 9.10.2006 Veröffentlichungen: Poster Präsentation: Deutsche Gesellschaft für Radioonkologie (DEGRO), 12. Jahreskongreß, Dresden 25. -28. Mai 2006 Poster Präsentation: American Society for Therapeutic Radiology & Oncology (ASTRO), 48th Annual Meeting, Philadelphia, Pennsylvania, USA. 4. -11. November 2006