5_Halogenalkane
Werbung

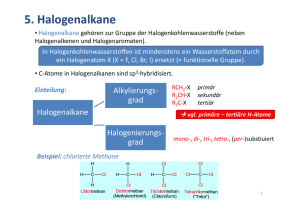
5. Halogenalkane • Halogenalkane gehören zur Gruppe der Halogenkohlenwasserstoffe (neben Halogenalkenen und Halogenaromaten). In Halogenkohlenwasserstoffen ist mindenstens ein Wasserstoffatom durch ein Halogenatom X (X = F, Cl, Br, I) ersetzt (= funktionelle Gruppe). • C‐Atome in Halogenalkanen sind sp3‐hybridisiert. Einteilung: Alkylierungs‐ grad RCH2‐X R2CH‐X R3C‐X Halogenalkane primär sekundär tertiär vgl. primäre – tertiäre H‐Atome Halogenierungs‐ grad mono‐, di‐, tri‐, tetra‐, (per‐)substiuiert Beispiel: chlorierte Methane OC I Lehramt ‐ F. H. Schacher 1 Allgemeines Bindung und physikalisch‐chemische Eigenschaften • Aufgrund der polaren C‐X‐Bindung unterscheiden sich Alkane und Halogenalkane beträchtlich in ihren chemischen und physikalischen Eigenschaften. • C‐X‐Bindung: • C‐X‐Bindungsstärke nimmt mit zunehmender Größe von X ab. Größere (diffusere) Orbitale führen zu geringerer Überlappung der Atomorbitale schwächere Bindung! Wdh. Elektronegativität • X – höhere Elektronegativität zieht stärker am gemeinsamen Bindungs‐ elektronenpaar polare Atombindung Dipol (resultierendes Dipolmoment) δ+ δ‐ Bindung Bindungslänge [pm] Bindungsstärke [kJ/mol] Dipolmoment [D] C-F 138.5 460 1.51 C-Cl 178.4 356 1.56 C-Br 192.9 297 1.48 C-I 213.9 239 1.29 C-C 154 346 - OC I Lehramt ‐ F. H. Schacher 2 Allgemeines – Atomradien [pm] OC I Lehramt ‐ F. H. Schacher 3 Allgemeines – Siedepunkte • Konsequenzen – physikalische Eigenschaften: • Siedepunkte liegen höher als die der entsprechenden Alkane. Dipol‐Dipol‐WW in flüssiger Phase! • Siedepunkte steigen mit zunehmender Halogengröße! Größere molare Masse und stärkere LONDON‐WW (VAN‐DER‐WAALS‐WW) (höhere Polarisierbarkeit). δ+ δ+ δ‐ δ‐ •••••• X= R H F Cl Br I CH3 -161,7 -78,4 -24,2 3,6 42,4 CH3CH2 -88,8 -37,7 12,3 38,4 72,3 CH3(CH2)2 -42,1 -2,5 46,6 71,0 102,5 CH3(CH2)3 -0,5 32,5 78,4 101,6 130,5 CH3(CH2)4 36,1 62,8 107,8 129,6 157,0 CH3(CH2)7 125,7 142,0 182,0 200,3 225,5 OC I Lehramt ‐ F. H. Schacher 4 Allgemeines – Eigenschaften • Konsequenzen – chemische Eigenschaften: • Positiv polarisiertes Kohlenstoffatom kann durch Anionen oder elektronenreiche Spezies angegriffen werden. • Negativ polarisiertes Halogenatom kann durch Kationen oder elektronenarme Teilchen angegriffen werden. Nucleophile Substitution Zusammenfassung des Einflusses der Halogengröße: In der Reihe F, Cl, Br, I (zunehmend diffusere Orbitale) gilt: 1) Stärke der C‐X‐Bindung nimmt ab. 2) Länge der C‐X‐Bindung nimmt zu. 3) Für gleiche Reste R steigen die Siedepunkte. 4) LONDON‐WW gewinnen an Bedeutung. 5) Polarisierbarkeit des Moleküls nimmt zu. OC I Lehramt ‐ F. H. Schacher 5 Nomenklatur • Halogenalkane werden als R‐X abgekürzt (vgl. R‐H für Alkane) IUPAC: Halogenatome werden wie Alkylgruppen (Substituenten des Alkangerüstes) behandelt! • Regeln: 1) Längste Alkylkette so nummerieren, dass Substituenten möglichst niedrige Nummern erhalten. 2) Substituenten werden alphabetisch geordnet. • Verbreitete (alte) Bezeichnung als Alkylhalogenide! F CH3 H3C C Br CH3 CH3I Iodmethan Methyliodid Fluorcyclohexan Cyclohexylfluorid H2 CH3 I C C CH3 H 2-Brom-2-methylpropan 1-Iod-2-methylpropan tert-Butylbromid I C CH3 H (1-Iodethyl)cyclooctan • Trivialnamen für viele halogenhaltige Lösungsmittel: • Methylenchlorid, Chloroform, Tetrachlorkohlenstoff, ... OC I Lehramt ‐ F. H. Schacher 6 Wichtige Synthesen • Wichtige Synthesemethoden sind: a) Radikalische Halogenierung von Alkanen b) Addition von Halogenwasserstoff an Alkene OC I Lehramt ‐ F. H. Schacher 7 c) Addition von Halogenen an Alkene d) Dehydrohalogenierung OC I Lehramt ‐ F. H. Schacher 8 e) Radikalische Bromierung in Allylstellung OC I Lehramt ‐ F. H. Schacher 9 Halogenierung von Alkanen Herstellung von Fluor‐ und Iodalkanen: • Keine direkte Herstellung durch radikalische Halogenierung von Alkanen! • Reaktion mit F2 ist stark exotherm! • F2 ist extrem korrodierend und reaktiv. • Fluorierung mittels anorganischer Fluorverbindungen: CoF3 CnF2n+2 CnH2n+2 - HF, CoF2 • perfluoriert bei Überschuss an Fluorierungsmittel (s. Teflon) Halogenaustausch: • Iodierungen mit I2 sind endotherm. • Einführung von Iod durch Reaktion von Halogenalkanen mit Alkalimetalliodid: FINKELSTEIN‐Reaktion: OC I Lehramt ‐ F. H. Schacher 10 Weitere Reaktionen GRIGNARD‐Reaktion • Halogenalkane und ‐aromaten können mit Magnesium eine metallorganische Verbindung eingehen GRIGNARD‐Verbindung. • Bei dieser Metallierung erfolgt eine UMPOLUNG des elektrophilen Kohlenstoffes in einen nucleophilen Kohlenstoff. 2 R X + 2 Mg 2 R Mg X R Mg R F. A. V. GRIGNARD 1871 – 1935 Nobelpreis 1912 + MgX2 SCHLENK‐Gleichgewicht • Vielfältige Folgechemie, besonders C‐C‐Bindungsknüpfungen! • Kopplung eines elektrophilen und eines nucleophilen Kohlenstoffs: siehe auch: WURTZ‐Reaktion Beispiel: OC I Lehramt ‐ F. H. Schacher 11 Verwendung und Umwelt • Lösungsmittel besonders: CH2Cl2, CHCl3, ClCH2‐CH2Cl, Cl2CH‐CH2Cl) • In der Industrie als Fett‐ und Harzlöser; im Labor als (nichtbrennbares) Reaktionsmedium. • Kältemittel FCKWs, FKWs, ClKWs mittlerweile weitgehend verboten • Feuerlöschmittel Halone, z.B. Halon 1301 = CBrF3 (Flugzeuge und Militär) • Brandschutzmittel BrKWs • PVC (Polyvinylchlorid) Fenster, Bodenbeläge, Rohre, Kabelisolierungen, Schallplatten • Teflon (Polytetrafluorethen) Beschichtungen (beständig gegen aggressive Chemikalien und Hitze) • Pestizide ClKWs DDT (Dichlordiphenyltrichlorethan) (verboten). • Treibgas CCl3F, CCl2F2 • Ausgangsstoff für viele Verbindungen (organische Synthesechemie). Umweltproblematik: • Sehr langsame Zersetzung vieler Halogenkohlenwasserstoffe. • Halogenkohlenwasserstoffe, besonders FCKWs zerstören die Ozonschicht. • Halogenierte Lösungsmittel sind bei dauerhafter Exposition gesundheitsschädlich. • Beim Verbrennen von PVC entseht HCl, bei Kabelbränden können hochgiftige, carcinogene polykondensierte Aromaten entstehen. • DDT ist krebserregend. • ... OC I Lehramt ‐ F. H. Schacher 12 Nukleophile Substitution Zwei Mechanismen: • SN1 (nucleophile Substitution erster Ordnung) • SN2 (nucleophile Substitution zweiter Ordnung) OC I Lehramt ‐ F. H. Schacher 13 Nukleophile Substitution Wichtige Einflussfaktoren: • Abgangsgruppe • Lösungsmittel • Struktur des Substrats • Nucleophilie Nucleophilie hängt von verschiedenen Faktoren ab: • Ladung • Basizität • Lösungsmittel • Polarisierbarkeit • Substituenten ? Läuft eine nucleophile Substitution nach einem Mechanismus erster oder zweiter Ordnung ab? OC I Lehramt ‐ F. H. Schacher 14 Verschiedene Nukleophile Nucleophil (Nu‐) Formel Name Formel Name HO‐ Hydroxid R‐OH Alkohol RO‐ Alkoxid R‐OR Ether HOH Wasser R‐OH2 + → R‐OH + H R‐OH Alkohol R‐OHR + → R‐OR + H NH3 Ammoniak R‐NH3 + → R‐NH2 + H R‐NH2 primäres Amin ‐ ‐ Sauerstoff Stickstoff Schwefel + Alkyloxoniumion + Dialkyloxoniumion + Alkylammonium‐ion R‐NH2R + → R‐NHR + H + Dialkylammonium‐ ion Hydrogensulfidion R‐SH Thiol Mercaptidion R‐S‐R Thioether (Sulfid) I‐ Iodid R‐I Alkyliodid CN Cyanid R‐CN Nitril ‐R Carbanion R‐R‘ Alkan HS R‐S Halogen Kohlenstoff Produkt (R‐Nu) ‐ OC I Lehramt ‐ F. H. Schacher 15 Mechanismus SN2 OC I Lehramt ‐ F. H. Schacher 16 Mechanismus SN2 Energieprofil des SN2‐Mechanismus sp2‐hybridisiertes C‐Atom sp3‐hybridisiertes C‐Atom sp3‐hybridisiertes C‐Atom SN2 = konzertierter, einstufiger Prozess OC I Lehramt ‐ F. H. Schacher 17 SN2 – Sterische Aspekte • Alkylierungsgrad des elektrophilen Kohlenstoffs: Relative SN2‐Reaktitvität: CH3 > Cprimär schnell > Substrateinfluss Csekundär langsam sehr langsam >> Ctertiär keine Reaktion hier: Halogenmethan > prim. Halogenalkan > sek. Halogenalkan >> tert. Halogenalkan OC I Lehramt ‐ F. H. Schacher 18 SN2 – Sterische Aspekte • Verzweigungsgrad des benachbarten Kohlenstoffs: Substrateinfluss Relative SN2‐Reaktitvität des substituierten Kohlenstoffs: Ethyl > Isopropyl > tert‐Butyl schnell langsam OC I Lehramt ‐ F. H. Schacher sehr langsam 19 SN2 – Stereochemie RÜCKSEITENANGRIFF! Inversion der Konfiguration am stereogenen Kohlenstoff! „Walden‐Umkehr“ OC I Lehramt ‐ F. H. Schacher 20 Mechanismus SN1 OC I Lehramt ‐ F. H. Schacher 21 Mechanismus SN1 Energieprofil des SN1‐Mechanismus geschwindigkeitsbestimmend produktbestimmend SN1 = zweistufiger Prozess OC I Lehramt ‐ F. H. Schacher 22 SN1 ‐ Stereochemie Nucleophil kann von beiden Seiten angreifen RACEMISIERUNG! OC I Lehramt ‐ F. H. Schacher 23 SN1 vs. SN2 R R‐X + Nu‐ → R‐Nu + X‐ SN 1 SN 2 CH3 in Lösung nicht beobachtet häufig: rasche Reaktion mit guten Nucleophilen in aprotischen Lösungsmitteln und guten Abgangsgruppen primär in Lösung nicht beobachtet häufig: rasche Reaktion mit guten Nucleophilen und guten Abgangsgruppen: langsam, wenn Verzweigung an C‐2 von R vorhanden sekundär relativ langsam: am besten in polaren, protischen Medien mit guten Abgangsgruppen und sperrigen Substituenten relativ langsam: am besten mit guten Nucleophilen in aprotischen Medien tertiär häufig: besonders rasch in polaren protischen Lösungsmitteln und bei sterisch gehinderten R mit guten Abgangsgruppen extrem langsam Nucleophilie Lösungsmittel Reaktionsgeschwindigkeit unabhängig von der Nucleophilkonzentration; Mechanismus für neutrale Nucleophile wahrscheinlicher Reaktionsgeschwindigkeit abhängig von der Nucleophilkonzentration; anionische Nucleophile begünstigen den Mechanismus Da die Zwischenstufen Ionen sind, wird die Reaktion durch polare protische Lösungsmittel beschleunigt Reaktion wird durch polare protische Lösungsmittel verzögert und durch polare aprotische Lösungsmittel beschleunigt OC I Lehramt ‐ F. H. Schacher 24 Nukleophile II Beurteilung der relativen Stärke oder Schwäche von Nucleophilen • Anionen sind nucleophiler (bessere Elektronendonoren) als die zugehörigen neutralen Moleküle HO‐ > H2O, RS‐ > RSH; RO‐ > ROH • Weiter unten im Periodensystem stehende Elemente neigen zu stärkerer Nucleophilie als die in der gleichen Gruppe darüber befindlichen Elemente HS‐ > HO‐; I‐ > Br‐ > Cl‐ > F‐ • Elemente derselben Periode sind in der Regel um so schwächer nucleophil, je elektro‐ negativer sie sind R3C‐ > R2N‐ > RO‐ > F‐; H3N > H2O > HF MERKE: Die Nucleophilie wird vom Lösungsmittel (protisch polar oder aprotisch polar) beeinflusst! Einfluss der Abgangsgruppen • Gruppen mit gutem Austrittsvermögen (= gute Stabilisierung der negativen Ladung) reagieren schneller I‐ > Br‐ > Cl‐ > F‐ (SN2). • Das Austrittsvermögen korreliert mit der Basenstärke: • Je schwächer X‐ basisch ist, desto besser fungiert es als Abgangsgruppe! OC I Lehramt ‐ F. H. Schacher 25