1. Das Mikroskop [7, 9,10]
Werbung
![1. Das Mikroskop [7, 9,10]](http://s1.studylibde.com/store/data/002675807_1-34a6a9d5bbd8aaf14e3c52664a255ae8-768x994.png)
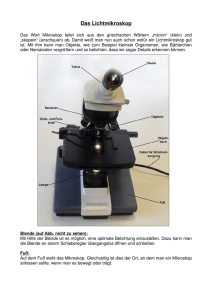
MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL 1. Das Mikroskop [7, 9,10] Das Mikroskop (mikros : klein, skopein : blicken) ist ein Gerät zum vergrößerten Betrachten sehr kleiner Objekte. Der für ein modernes Durchlichtmikroskop typische Aufbau wird in der Abbildung 1 gezeigt und beruht auf der bewährten Grundlage eines Baukastensystems. Das Durchlichtmikroskop besteht aus folgenden Elementen: Mechanischer Teil Optischer Teil Fuß- und Bodenplatte Abbildungssystem: Stativoberteil Objektiv Objekttisch (Kreuztisch-2 Ebenen) Okular Grob-, Feintrieb Beleuchtungseinrichtung: Objektivrevolver mit Bohrungen Lichtquelle Tubus (Verbindung zwischen Okular und Objektiv) Kondensor Irisblende Abb. 1: Mikroskop 3 03mikroskop.doc by gnagl 5 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL Gravierung der Objektive Jedes Mikroskop-Objektiv hat eine Gravierung der optischen Daten (Abb. 2), die die Leistungsfähigkeit des Objektivs kennzeichnen. Als Beispiel sollen die optischen Daten des abgebildeten Objektivs dienen: Abb. 2: Gravierung eines Mikroskop-Objektivs 1 160 mechanische Tubuslänge Die mechanische Tubuslänge ist der Abstand zwischen Objektivanschraubfläche und Okularauflage und beträgt nach DIN 160mm. Objektive neuerer Bauart sind für diese Tubuslänge berechnet. 2 0,17 Deckglasdicke Dieses Objektiv ist für die Verwendung von Präparaten mit einem Deckglas von 0,17mm ±0,01 mm Dicke berechnet. Anstatt 0,17 kann auch stehen: /- : Das Objektiv ist gegen größere Abweichungen der Deckglasdicke unempfindlich. Anstatt 0,17 kann auch stehen: /o : Das Objektiv ist korrigiert für eine "Deckglasdicke 0", d.h. für die Verwendung von Präparaten ohne Deckglas (unbedeckte Präparate). 3 40 Maßstabzahl des Objektivs Die Maßstabzahl bzw. der Vergrößerungsfaktor des Objektivs ist eine wichtige Größe zur Berechnung der Gesamtvergrößerung des Mikroskops. Multipliziert man die Maßstabzahl des Objektivs mit dem Vergrößerungsfaktor des Okulars, so ergibt das Produkt die Gesamtvergrößerung des Mikroskops (unter Berücksichtigung des Tubusfaktors). 4 0,65 numerische Apertur Die numerische Apertur (Abk.: n.A.) ist ein Maß für das Auflösungsvermögens des Objektivs. Unter Auflösungsvermögen versteht man die Leistung eines Mikroskop-Objektivs, zwei eng zusammen liegende Objekteinzelheiten deutlich als zwei getrennte Gebilde wiederzugeben, z.B. zwei nebeneinander liegende Bakteriengeisseln dürfen nicht als Einheit, sondern gerade noch als zwei getrennte Elemente im Bild erscheinen. Bei einigen Objektiven höherer Apertur wird der 3 03mikroskop.doc by gnagl 6 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL Zusatz "Oel" hinzugefügt. Dieses bedeutet, daß es sich um ein ÖlimmersionsObjektiv handelt. Ölimmersions-Objektive sind Objektive höherer Apertur, bei denen sich zwischen Objektivfrontlinse und Deckglas nicht Luft, sondern Öl befindet und dadurch ein Gewinn von numerischer Apertur erzielt wird. Immersionsöl hat den gleichen Berechnungsindex wie Glas (1,515). Die Bildeinstellung Der Grob- und Feintrieb, der auf den Objekttisch wirkt und der Schärfeneinstellung dient, ermöglicht ein schnelles und sicheres Einstellen des mikroskopischen Bildes bei allen Vergrößerungsstufen. Das Präparat wird auf dem Objekttisch mit Hilfe des seitlich ausschwenkbaren Objekthalters so bewegt, daß das Objekt in den Strahlengang gelangt. Eine wichtige Regel für die mikroskopische Beobachtung sagt, daß für die erste Einstellung ein Objektiv mit niedrigem Abbildungsmaßstab, z.B. 10:1 (Übersichtsobjektive) benutzt werden sollte. Diese Objektive haben einen großen Arbeitsabstand (Abstand Objektivfrontlinse bis Präparat), eine große Schärfentiefe und ermöglichen in Verbindung mit ihrem großen Sehfeld eine bessere Orientierung über das Präparat. Es empfiehlt sich, zunächst mit dem Grobtrieb etwas über die Scharfeinstellung des Bildes hinauszugehen, also das Bild wieder leicht unscharf werden zu lassen, um dann mit dem Feintrieb die beste Schärfe einzustellen. Dadurch bleibt auch beim Übergang zu Objektiven mit einem größeren Abbildungsmaßstab genügend Spielraum für ein Nachstellen mit der Feineinstellung, ohne daß diese ihre Anschläge erreicht. Für die erste Einstellung wähle man ein kontrastreiches Präparat. Das Objekt auf dem Objekttisch wird mit Hilfe des Grobtriebes dem Objektiv etwas mehr genähert als es dem freien Arbeitsabstand entspricht. Die Blende des Kondensors ist voll zu öffnen, und die Blende der Mikroskopbeleuchtung (Leuchtfeldblende) ist so auszurichten, daß das ganze Präparat beleuchtet wird. Durch langsames Senken des Objekttisches mit dem Feintrieb wird das mikroskopische Bild scharf gestellt. Die Objektive sind am Revolver umschaltbar, um den Übergang zu den Objektiven mit größerem Abbildungsmaßstab zu gewährleisten. Nach dem Einschalten eines anderen Objektives in den Strahlengang durch Drehen des Objektivrevolvers, ist die Schärfe geringfügig mit der Feineinstellung zu korrigieren. Ein integrierter Bestandteil des Kondensors ist die Aperturblende. Auflösung, Kontrast und Tiefenschärfe werden durch die Aperturblende beeinflußt, zur Regelung der Lichthelligkeit darf sie jedoch nicht benutzt werden. Durch Schließen der Blende wird die Tiefenschärfe erhöht, d.h. die scharf abgebildete Objektschicht wird in der Tiefe größer. Allerdings verringert sich mit zunehmender Tiefenschärfe die Auflösung (Detailerkennbarkeit) des Präparates. 3 03mikroskop.doc by gnagl 7 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL Arbeiten mit Immersions-Objektiven Stärkere Vergrößerungen werden mit Objektiven höherer Apertur, den Immsersions-Objektiven, erreicht. Das Immersionsöl stellt einen homogenen optischen Kontakt zwischen Objekt und Objektivfrontlinse her. Es soll ein Immersionsöl auf synthetischer Basis und Deckgläser in der Stärke 0,17mm verwendet werden, da hierfür die optischen Systeme berechnet sind. Zunächst sucht man mit einem Trockenobjektiv (z.B. 40:1) die zu untersuchende Präparatstelle aus. Dann ist der Objektivrevolver auf den Zwischenraum vor dem Immersions-Objektiv zu drehen. Aus der Tropfflasche wird ein Tropfen Immersionsöl auf die zu untersuchende Stelle des Präparates gegeben. Danach wird durch Drehen des Objektivrevolvers das Immersions-Objektiv in den Strahlengang gebracht, bis es einrastet; der Kontakt zwischen Frontlinse und Öl ist somit hergestellt. Mit dem Feintrieb wird die Bildschärfe exakt eingestellt. Luftblasen im Immersionsöl beeinträchtigen die Bildschärfe. Diese lassen sich leicht entfernen, indem das Objekt auf dem Objekttisch hin- und herbewegt wird. Das Immersionsöl sollte immer tropfenweise gebraucht werden. Nach Beendigung der Arbeiten wischt man es mit einem trockenen Tuch von den Linsen ab und entfernt den restlichen Ölfilm mit einem Xylolbefeuchteten Lappen. 3 03mikroskop.doc by gnagl 8 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL 2. Färben von Mikroorganismen [7, 9,10] Zweck der Färbung: • Mikroorganismen werden dadurch leichter erkennbar • Darstellen von gewissen Inhaltsstoffen wie, Strukturen, Geißeln, Sporen, Kapseln, Zellkerne... • Erreichen einer diagnostischen Differenzierung z.B. Gram-Färbung • Unterscheidung zwischen lebenden und toten Zellen z.B. Vitalfärbung 2.1 METHYLENBLAU-FÄRBUNG • Vor dem mb. Arbeiten den Tisch mit 70%igen Spiritus abwischen (Wattebausch) • Objektträger in Alkohol tauchen und abflammen (Cornetpinzette) • Impföse ausglühen und auskühlen lassen • Röhrchen mit Ringerlösung abflambieren – Tropfen Ringerlösung entnehmen • Röhrchen mit Ringerlösung abflambieren und verschließen • Sterile Ringerlösung mit der Öse auf den Objektträger auftragen • Impföse ausglühen und auskühlen lassen • Probe öffnen Eprouvettenrand abflambieren Probe entnehmen Eprouvettenrand abflambieren und Röhrchen verschließen • Probe am Objektträger mit Ringerlösung verdünnen • Objektträger lufttrocknen lassen oder überm Bunsenbrenner vorsichtig trocknen (Handrücken-Wärmetest) • Hitzefixieren - Objektträger 3x durch Flamme ziehen (um ein Haftenbleiben der MO am Objektträger und ein Abtöten der MO ohne große Strukturveränderungen zu gewährleisten; die Wirkung beruht auf einer Eiweißfällung) • Einige Tropfen Methylenblau auf Probe am Objektträger geben und 2 min warten • Präparat auf der Rückseite des Objektträgers mit dest. Wasser abspülen • Der Objektträger wird vorsichtig mit Filterpapier getrocknet und anschließend noch an der Luft fertiggetrocknet. • Mikroskopieren mit Ölimmersion 3 03mikroskop.doc by gnagl 9 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL 2.2 UNTERSCHEIDUNG VERSCHIEDENER BAKTERIENGRUPPEN Gram pos. Gramfärbung Aminopeptidasetest Kalilaugentest Gram neg. 2.2.1 GRAM-FÄRBUNG Gewisse Bakterien geben einen aufgenommen Farbstoff selbst bei Behandlung mit Alkohol nicht mehr ab. Eine Unterscheidung von grampositiven und gramnegativen Bakterien ist für diagnostische Zwecke oft schon im mikroskopischen Bild durch die festere Zellwand der Grampositiven möglich. Grampositiv (blau) sind die meisten Kokken, die Milchsäurebakterien, Sarcinen, die Sporenbildner, ferner Actinomyceten, Hefen und die meisten Schimmelpilze. Gramnegativ (rot) sind die meisten nichtsporenbildenden Stäbchen (coliforme Bakterien, Pseudomonaden, Achromobacterarten usw.) und einige pathogene Kokken. Bakterien, deren Verhalten sich im Laufe der Entwicklung ändert, die sich teils grampositiv und teils gramnegativ verhalten, bezeichnet man als gram-labil oder gramvariabel. Der Vorteil von Color Gram 2 im Vergleich zur klassischen Färbung liegt in der Verwendung einer gebrauchsfertigen Lugol'schen Lösung, bestehend aus dem LugolPolyvinylpyrrolidon (P.V.P.)-Komplex. Dieser P.V.P.-Komplex bewirkt eine Stabilisierung der Lugol-Lösung und dadurch eine beträchtliche Verringerung des Jodverlustes bei der Lagerung des Reagenzes. Darüberhinaus setzt es die Risiken einer schlechten Färbung grampositiver Keime auf ein Minimum herab. Prinzip Die Keime färben sich mit der phenolischen Kristallviolett-Lösung (R1) violett an. Die Lugol-P.V.P.-Beize (R2) setzt Jod frei, welches oben genanntes Färbemittel bindet. Während der Entfärbung durch Aceton-Alkohol (R3) löst sich der entstandene JodKristallviolett-Komplex bei gramnegativen Keimen auf. Safranin (R4) wird als Kontrastfärbemittel benötigt: gramnegative Keime erscheinen rosa, grampositive Keime, die nicht entfärbt wurden, bleiben violett. Gramnegative Keime erscheinen rosa, grampositive Keime, die nicht entfärbt wurden, bleiben violett. 3 03mikroskop.doc by gnagl 10 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL REAGENZIEN Aufbewahren bei 18-25°C bis zum angegebenen Verfallsdatum. Zusammensetzung der gebrauchsfertigen Reagenzien: R1 R2 R3 R4 Kristallviolett-Oxalat-Lösung (Hucker) 2-Liter- Kristallviolett . . . . . . . . . . . . . . . . . . . . . Äthylalkohol . . . . . . . . . . . . . . . . . . . . . . Ammoniumoxalat . . . . . . . . . . . . . . . . . 2% 20% 0,8% Lugol-PVP-Komplex, stabilisiert Jod . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Kaliumjodid . . . . . . . . . . . . . . . . . . . . . . PVP (Polyvinyl-Pyrrolydon) . . . . . . . . . . 1,3% Kompleter Kit: 2% 10% Entfärber Alkohol 95% . . . . . . . . . .. . . . . . . . . . . . . Aceton . . . . . . . . . . . . . . . . . . . . . . . .. ENTZÜNDLICHES REAGENZ Safranin-Lösung Safranin . . . . . . . . . . . . . . . . . . . . . . . . . 0,25% Alkohol 95% . . . . . . . . . . . . . . . . . . . . . . 50% 50% Flasche 240 mlFlaschen mit Gießvorrichtung 2-LiterFlasche 2-LiterFlasche 2-LiterFlasche 10% * Die Flaschen nach Gebrauch stehend lagern. ARBEITSANLEITUNG Herstellung und Fixierung von Ausstrichen: Sehr saubere Objektträger benutzen. Einen Ausstrich von den angezüchteten Keimen oder dem pathologischen Untersuchungsmaterial anfertigen. An der Luft trocknen lassen. Mit Hitze (auf einer Heizplatte oder rasch durch die Flamme ziehen) oder mit Alkohol fixieren. Färbung: - Präparat mit R1 (Kristallviolett) überschichten 1 Minute warten; mit Aqua dest. vorsichtig abspülen - Präparat mit R2 (Lugol) überschichten 1 Minute warten; mit Aqua dest. vorsichtig abspülen - mit R3 (Alkohol-Aceton) entfärben; mit Aqua dest. spülen - Präparat mit R4 (Safranin) überschichten 1 Minute warten; mit Aqua dest. vorsichtig spülen; trocknen - mit dem Immersionsobjektiv betrachten Anmerkungen: Die Gramfärbung muß mit frisch hergestellten Kulturen (24-48 Stunden) durchgeführt werden, zu alte Kulturen werden hinsichtlich der Entfärbung empfindlicher. Einige Antibiotika können grampositive Keime für die Entfärbung empfindlicher machen. Die Fixierung der Ausstriche durch Hitze ist unbedingt erforderlich. 3 03mikroskop.doc by gnagl 11 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL 2.2.2 SCHNELLTESTS AMINOPEPTIDASE – TEST eine Alternative zur Gram-Färbung Auch der L-Alanin-Aminopeptidase-Test basiert auf Unterschieden in der Zusammensetzung der Zellhülle von Bakterien: Untersuchungen an einer großen Reihe von Bakterien zeigten, daß die weitaus meisten gramnegativen Bakterien das Enzym LAlanin-Aminopeptidase in relevanter Menge enthalten, während praktisch alle grampositiven oder gram-variablen Bakterien keine oder höchstens eine schwache Enzym-Aktivität zeigten. Dies bedeutet, daß durch den Alanin-Aminopeptidase-Test nahezu alle in der Praxis interessierenden Bakterien sich umgekehrt analog zur GramReaktion verhalten: grampositiv = Aminopeptidase-negativ = farblos gramnegativ = Aminopeptidase-positiv = gelb Testprinzip: Die L-Alanin-Aminopeptidase spaltet die Aminosäure L-Alanin aus unterschiedlichen Substraten ab. Bei den vorliegenden Teststäbchen wird das Substrat L-Alanin-4nitroanilid bei Anwesenheit von Alanin-Aminopeptidase in 4-Nitroanilin und die Aminosäure L-Alanin gespalten. Aufgrund der Gelbfärbung durch das 4-Nitroanilin wird die Anwesenheit der L-Alanin-Aminopeptidase nachgewiesen. Anwendung: Eine gut gewachsene Einzelkolonie (ca. 2 mm ∅) wird in 0,3 ml Ringerlösung zu einer deutlichen Opaleszenz suspendiert. Das Teststreifchen wird nun eingehängt, und das Röhrchen 20-30 Minuten bei 37° C bebrütet. Hinweis: Für den Aminopeptidase-Test sollten vor allem von indikator- oder farbstoffreien Nährböden abgenommene Kolonien verwendet werden. Von einer Durchführung des Tests mit Kolonien mit starker Eigenpigmentierung wird abgeraten. Diese Methode ist nur für Reinkulturen anzuwenden. KALILAUGEN - TEST Dieser Test dient zur raschen Unterscheidung grampositiver und gramnegativer Bakterien, durch die Auflösung von Zellwand und zytoplasmatischer Membran gramnegativer Bakterien mittels 3 %iger Kalilauge (KOH). Es wird eine Kolonie auf einen sauberen Objekträger gegeben und mit einem Tropfen 3 %iger KOH-Lösung versetzt. Kommt es zur Bildung einer zähflüssigen, fadenziehenden Masse liefert dies einen Hinweis auf das Vorliegen gramnegativer Organismen. Im Zweifelsfalle kann eine Färbung nach Gram angeschlossen werden. 3 03mikroskop.doc by gnagl 12 MILA 4 MIKROSKOP UND FÄRBETECHNIKEN DR. NAGL 2.3 Sporenfärbung nach BARTHOLOMEW und MITTWER Bakterien der Genera Bacillus, Alicyclobacillus, Clostridium, Desulfotomaculum, Sporolactobacillus und Sporosarcina bilden Sporen, die bei der Methylenblau und Gramfärbung nur als helle ovale oder runde Zellen zu erkennen sind. Vielfach ist bei isoliert vorliegenden Sporen nur die Sporenhülle schwach angefärbt. Bei der Sporenfärbung sind die Sporen grün und die vegetativen Zellen rot. Durchführung: Luftgetrockneter Objektträgerausstrich wird intensiv hitzefixiert, ca. 20 mal durch die Bunsenbrennerflamme ziehen – Objektträger mit gesättigter Malachitgrünlösung bedecken und 10 min einwirken lassen – mit dest. Wasser abwaschen – Gegenfärbung mit einer 0,25%igen Safraninlösung für 10 s – Vorsichtig mit Leitungswasser abwaschen und trocknen – 3 03mikroskop.doc by gnagl 13