Beschreibung der Studie - Universitätsklinikum Tübingen
Werbung
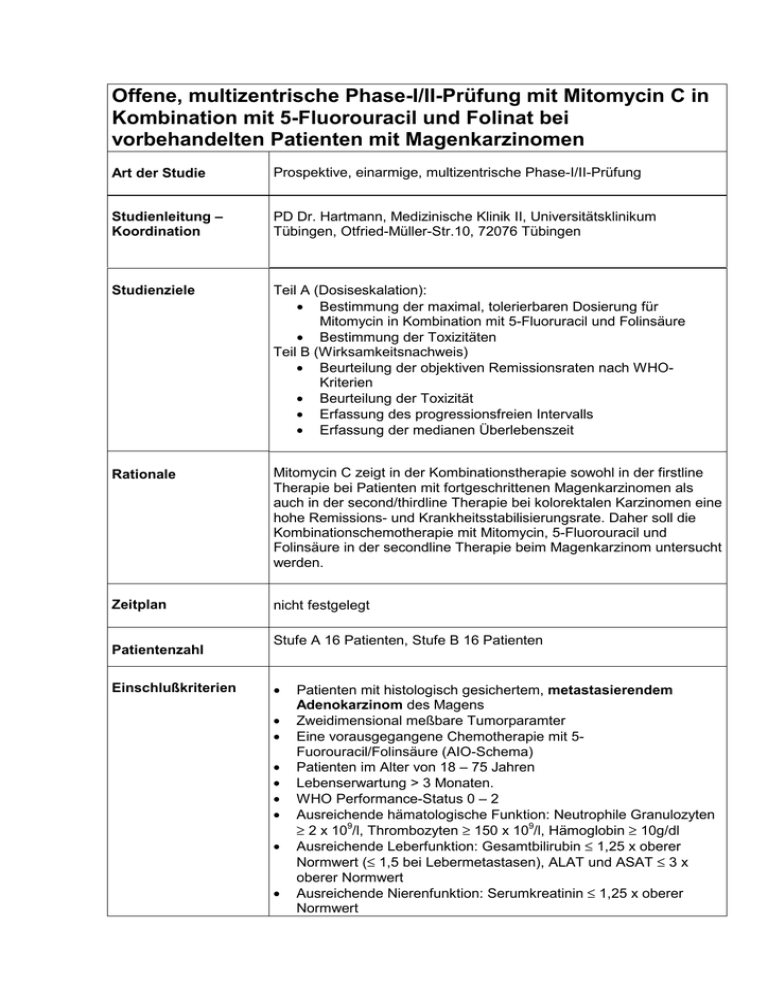
Offene, multizentrische Phase-I/II-Prüfung mit Mitomycin C in Kombination mit 5-Fluorouracil und Folinat bei vorbehandelten Patienten mit Magenkarzinomen Art der Studie Prospektive, einarmige, multizentrische Phase-I/II-Prüfung Studienleitung – Koordination PD Dr. Hartmann, Medizinische Klinik II, Universitätsklinikum Tübingen, Otfried-Müller-Str.10, 72076 Tübingen Studienziele Teil A (Dosiseskalation): • Bestimmung der maximal, tolerierbaren Dosierung für Mitomycin in Kombination mit 5-Fluoruracil und Folinsäure • Bestimmung der Toxizitäten Teil B (Wirksamkeitsnachweis) • Beurteilung der objektiven Remissionsraten nach WHOKriterien • Beurteilung der Toxizität • Erfassung des progressionsfreien Intervalls • Erfassung der medianen Überlebenszeit Rationale Mitomycin C zeigt in der Kombinationstherapie sowohl in der firstline Therapie bei Patienten mit fortgeschrittenen Magenkarzinomen als auch in der second/thirdline Therapie bei kolorektalen Karzinomen eine hohe Remissions- und Krankheitsstabilisierungsrate. Daher soll die Kombinationschemotherapie mit Mitomycin, 5-Fluorouracil und Folinsäure in der secondline Therapie beim Magenkarzinom untersucht werden. Zeitplan nicht festgelegt Patientenzahl Einschlußkriterien Stufe A 16 Patienten, Stufe B 16 Patienten • • • • • • • • • Patienten mit histologisch gesichertem, metastasierendem Adenokarzinom des Magens Zweidimensional meßbare Tumorparamter Eine vorausgegangene Chemotherapie mit 5Fuorouracil/Folinsäure (AIO-Schema) Patienten im Alter von 18 – 75 Jahren Lebenserwartung > 3 Monaten. WHO Performance-Status 0 – 2 Ausreichende hämatologische Funktion: Neutrophile Granulozyten ≥ 2 x 109/l, Thrombozyten ≥ 150 x 109/l, Hämoglobin ≥ 10g/dl Ausreichende Leberfunktion: Gesamtbilirubin ≤ 1,25 x oberer Normwert (≤ 1,5 bei Lebermetastasen), ALAT und ASAT ≤ 3 x oberer Normwert Ausreichende Nierenfunktion: Serumkreatinin ≤ 1,25 x oberer Normwert Ausschlußkriterien: • • Schriftliches Einverständnis des Patienten nach Aufklärung. Zu erwartende Kooperationsbereitschaft des Patienten bei Behandlung und Folgeuntersuchungen • • Vorausgegangene Therapie mit Mitomycin Kontraindikation gegenüber 5-Fluorouracil (z.B. Angstzustände, Mykardinfarkt innerhalb der letzten 6 Monate, schwerwiegende Toxizitäten während der vorangegangenen 5-Fluoruracil-Therapie) Floride Infektion Ileus oder Subileus, Morbus Crohn oder Colitis ulcerosa Bestehende chronische Diarrhoe Anderweitige, schwerwiegende internistische Begleiterkrankungen, die eine zytostatische Therapie ausschließen Zweitneoplasien, außer Carcinoma in situ der Cervix, Spinaliom oder Basaliom. Cerebrale Metastasen oder karzinomatöse Leptomeningitis Schwangerschaft oder Stillzeit Kein sicherer Kontrazeptionsschutz Begleittherapie mit anderen antineoplastischen Substanzen Teilnahme an einer anderen Therapiestudie innerhalb der letzten 4 Wochen vor Studieneinschluss Patient steht für Follow-up-Erhebungen nicht zur Verfügung • • • • • • • • • • • Therapie: • • Teil A: Dosiseskalation Mitomycin 6 bis 10 mg/m2, Folinsäure 500 mg/ m2, 5-FU 2600 mg/ m2 Teil B: Wirksamkeitsnachweis auf dem ermittelten Dosislevel