Urocin® 20 mg - APOGEPHA Arzneimittel GmbH
Werbung

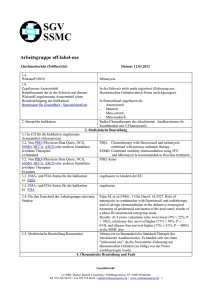
Gebrauchsinformation: Information für den Anwender Urocin® 20 mg, Pulver zur Her­stellung einer Injektions- bzw. Infusions­lösung oder einer Lösung zur intravesi­kalen Anwendung. Wirkstoff: Mitomycin Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwen­ dung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen. < Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. < Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker oder das medizinische Fachpersonal. < Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie. < Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4. Was in dieser Packungsbeilage steht 1. Was ist Urocin® 20 mg und wofür wird es angewendet? 2. Was sollten Sie vor der Anwendung von Urocin® 20 mg beachten? 3. Wie ist Urocin® 20 mg anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Urocin® 20 mg aufzubewahren? 6. Inhalt der Packung und weitere Informationen 7. Informationen für Ärzte und medizinisches Fachpersonal 1. Was ist Urocin® 20 mg und wofür wird es angewendet? Das Antibiotikum Mitomycin ist ein Zytostatikum, d. h. ein Arzneistoff, der die Zellteilung funktionell aktiver Zellen durch unterschiedliche Beeinflussung ihres Stoffwechsels verhindert oder erheblich verzögert. Die therapeutische Anwendung von Zytostatika in der Tumortherapie basiert darauf, dass Tumorzellen sich von normalen Körperzellen unter anderem durch eine der Wachstumskontrolle entzogene gesteigerte Zellteilungsrate unterscheiden. Mitomycin wird in der palliativen Tumortherapie (The­ rapie zur Linderung der Beschwerden) eingesetzt. Bei intravenöser Gabe ist es in der Monochemo­ thera­pie, d. h. der Behandlung mit nur einem Wirk­ stoff, oder in kombinierter zytostatischer Chemo­ thera­pie, bei folgenden metastasierenden (Tochter­ geschwulst-bildenden) Tumoren wirksam: < nicht-kleinzelliger Lungenkrebs (Bronchialkarzinom) < fortgeschrittener Darmkrebs (kolorektales Karzinom) < fortgeschrittener Leberkrebs (Leberzellkarzinom) < fortgeschrittener Magenkrebs (Magenkarzinom) < Brustkrebs (Mammakarzinom) < fortgeschrittener Speiseröhrenkrebs (Ösophagus­ karzi­nom) < fortgeschrittener Bauchspeicheldrüsenkrebs (Pankreaskarzinom) < fortgeschrittener Gebärmutterhalskrebs (Zervix­ karzinom). Intravesikale Anwendung (Anwendung in der Harn­ blase) zur Rezidivprophylaxe bei oberflächlichem Harnblasenkarzinom nach transurethraler Resektion (Abtragung von Gewebe durch die Harnröhre). 2. Was sollten Sie vor der Anwendung von Urocin® 20 mg beachten? Folgende Kontrolluntersuchungen und Sicherheits­ maßnahmen werden bei intravenöser Anwendung empfohlen: Vor Therapiebeginn Kompletter Blutstatus < Lungenfunktionsprüfung bei Verdacht auf eine vor­ bestehende Lungenfunktionsstörung < Nierenfunktionsprüfung zum Ausschluss einer Niereninsuffizienz (verminderte Funktionsfähigkeit der Nieren) < Leberfunktionsprüfung zum Ausschluss einer Leberinsuffizienz (verminderte Funktionsfähigkeit der Leber) Während der Therapie < regelmäßige Überprüfung des Blutstatus < engmaschige Überwachung der Nierenfunktion Die Anwendung von Mitomycin darf nur bei strenger Indikationsstellung, unter laufender Kontrolle der Blutwerte und von in dieser Therapie erfahrenen Ärzten erfolgen. < Urocin® 20 mg darf nicht angewendet werden, wenn Sie überempfindlich (allergisch) gegen Mitomycin oder einen der in Abschnitt 6. genannten sonstigen Bestandteile von Urocin® 20 mg sind < im Falle einer starken Verminderung der Blutzellen aller Systeme (Panzytopenie) oder einer isolierten Verminderung der Zahl der weißen Blutkörperchen (Leukopenie) oder der Blutplättchen (Thrombo­ zytopenie) < wenn Sie zu Blutungen neigen (hämorrhagische Diathese) < bei akuten Infekten < im Rahmen einer intravesikalen Therapie (Anwen­ dung in der Harnblase) bei Vorliegen einer Blasen­ wandperforation Mitomycin ist als Immunsuppresivum (Arzneistoff, der Reaktionen des Immunsystems unterdrückt bzw. abschwächt) nicht geeignet. < Warnhinweise und Vorsichtsmaßnahmen Im Folgenden wird beschrieben, wann Urocin® 20 mg nur unter bestimmten Bedingungen und nur mit besonderer Vorsicht angewendet werden darf. Dies gilt auch, wenn die Angaben früher einmal zutrafen. Zu den Gegenanzeigen siehe Abschnitt 2 „Urocin® 20 mg darf nicht angewendet werden“. Besondere Vorsicht bei der Anwendung von Urocin® 20 mg ist erforderlich, < falls Sie sich in einem schlechten Allgemeinzustand befinden, < falls bei Ihnen Lungen-, Nieren- oder Leberfunk­ tionsstörungen vorliegen, < wenn Sie im zeitlichen Zusammenhang mit der Mito­mycin-Behandlung eine Strahlentherapie oder Therapie mit anderen Zytostatika erhalten, da Mitomycin eine schädigende Wirkung auf das Knochenmark zeigt, < im Rahmen einer intravesikalen Therapie (Anwen­ dung in der Harnblase) bei Vorliegen einer Harn­ blasenentzündung. Eine längerfristige Therapie kann zu einer verstärkten Knochenmarkschädigung führen. Wegen der knochenmarkschädigenden Wirkung von Mitomycin müssen andere knochenmarkschädigen­ de Therapiemöglichkeiten (insbesondere andere Zytostatika, Bestrahlung) mit besonderer Vorsicht gehandhabt werden, um eine additive Unterdrückung der Funktion des Knochenmarks in Grenzen zu halten. Bei Krankheitszeichen der Lunge, die nicht auf die Grundkrankheit zurückgeführt werden können, ist die Therapie sofort abzubrechen, ebenso bei Anzei­ chen des Abbaus der roten Blutkörperchen (Hämo­ lyse) oder Anzeichen einer Nierenfunktionsstörung. Mitomycin ist eine Substanz, die erbliche Verände­run­ gen des genetischen Materials auslösen kann, sowie auch beim Menschen krebserregend wirken kann. Haut- und Schleimhautkontakte sind zu vermeiden. Anwendung von Urocin® 20 mg zusammen mit anderen Arzneimitteln Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben oder beabsichtigen, andere Arzneimittel anzuwenden. Chemotherapeutika und Bestrahlung (Radiotherapie) Eine Verstärkung der knochenmarkschädlichen Wirkung (Myelotoxizität) durch gleichzeitige Anwen­ dung anderer knochenmarkschädlicher Behand­ lungsmethoden (insbesondere Behandlung mit anderen Zytostatika oder Bestrahlung) ist möglich. Die schädigende Wirkung auf das Herz von Doxo­ rubicin kann durch Mitomycin verstärkt werden. Eine Kombination mit Vinca-Alkaloiden oder Bleo­ mycin (Arzneistoffe aus der Gruppe der Zytostatika) kann die schädigende Wirkung auf die Lunge verstärken. Vitamine Die gleichzeitige Gabe von Pyridoxinhydrochlorid (Vitamin B6) führte im Tierversuch zum Wirkungs­ verlust von Mitomycin. Impfstoffe Im Zusammenhang mit einer Mitomycin-Behandlung sollten keine Impfungen mit Lebend-Impfstoffen erfolgen. Beachten Sie bitte, dass diese Angaben auch für vor kurzem angewendete Arzneimittel gelten können. Schwangerschaft, Stillzeit und Zeugungs-/ Gebährfähigkeit Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Mitomycin wirkt erbgutschädigend und kann die Entwicklung eines Embryos beeinträchtigen. Mitomycin sollte nicht während der Schwangerschaft angewendet werden. Bei lebensnotwendiger Indika­ tion zur Behandlung einer schwangeren Patientin sollte eine medizinische Beratung über das mit der Behandlung verbundene Risiko von schädigenden Wirkungen für das Kind erfolgen. Mitomycin geht in die Muttermilch über. Während der Behandlung darf nicht gestillt werden. Frauen dürfen während einer Behandlung mit Mito­ mycin nicht schwanger werden. Tritt während der Behandlung eine Schwangerschaft ein, so ist die Möglichkeit einer genetischen Beratung zu nutzen. Patientinnen im geschlechtsreifen Alter sollten wäh­ rend und bis zu 6 Monate nach Beendigung der Chemotherapie empfängnisverhütende Maßnahmen ergreifen bzw. sexuelle Abstinenz einhalten. Mitomycin wirkt erbgutschädigend. Männern, die mit Mitomycin behandelt werden, wird daher empfohlen, während der Behandlung und bis zu 6 Monate danach kein Kind zu zeugen und sich vor Therapiebeginn wegen der Möglichkeit einer irreversiblen Infertilität durch die Therapie mit Mitomycin über eine Sperma­ konservierung beraten zu lassen. Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen Dieses Arzneimittel kann auch bei bestimmungsge­ mäßem Gebrauch durch Auslösen von Übelkeit und Erbrechen das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßen­ verkehr oder zum Bedienen von Maschinen beein­ trächtigt wird. Dies gilt in verstärktem Maße im Zusammenhang mit Alkohol. 3. Wie ist Urocin® 20 mg anzuwenden? Mitomycin darf nur von in dieser Therapie erfahre­nen Ärzten angewendet werden bei strenger Indi­kations­ stellung und unter laufender Kontrolle der Blutwerte (hämatologischen Parameter). Urocin® 20 mg ist bestimmt zur intravenösen Injek­tion oder Infusion oder zur intravesikalen Instil­lation nach Auflösen des Pulvers. Die Injektion muss streng intravasal (in ein Gefäß) erfolgen. Bei paravasaler Injektion (Injektion in das umliegende Gewebe) treten im betroffenen Bereich ausgedehnte schwere Schädigungen des Gewebes (Nekrosen) auf. Haut- und Schleimhautkontakte sind zu vermeiden. Soweit nicht anders verordnet, wird Mitomycin wie folgt dosiert: Intravenöse Anwendung In der zytostatischen Monochemotherapie wird Mitomycin zumeist als Bolusinjektion intravenös ver­ abreicht. Als Dosierung können 10-20 mg/m2 KOF alle 6-8 Wochen oder 8-12 mg/m2 KOF alle 3-4 Wochen empfohlen werden. In der Kombinationschemotherapie ist die Dosierung deutlich geringer. Wegen der Gefahr der additiven (zusätzlichen) schädigenden Wirkung auf das Kno­ chenmark darf von erprobten Therapieprotokollen ohne besonderen Grund nicht abgewichen werden. Bei Patienten mit ausgiebiger zytostatischer Vorbe­ handlung und bei älteren Patienten muss die Dosis reduziert werden. Mitomycin darf nicht intraarteriell verabreicht werden. Intravesikale Anwendung (Anwendung in der Harnblase) Zur intravesikalen Instillation werden zur Therapie jeweils 20-40 mg Mitomycin (entsprechend 1-2 Durch­stechflaschen Urocin® 20 mg), gelöst in 20-40 ml Was­ser für Injektionszwecke oder in 20-40 ml 0,9%iger isotonischer Natriumchloridlösung, verabreicht. Bei der intravesikalen Anwendung sollte der Urin-pH höher als pH 6 sein. Zubereitung der Lösungen Zur Herstellung und Entnahme sollten Kanülen von maximal 0,8 mm Durchmesser verwendet werden. Lösung für die intravenöse Anwendung Zur Zubereitung der Stammlösung (0,5 mg Mito­ mycin/ml) wird der Inhalt einer Durchstechflasche in 40 ml Wasser für Injektionszwecke durch Umschwen­ ken gelöst. Der Inhalt der Durchstechflasche muss sich innerhalb von 5 Minuten klar lösen. Zur Zubereitung der Infusionslösung kann isotonische Natriumchloridlösung verwendet werden. Die gebrauchsfertige Lösung sollte nicht mehr als 0,5 mg Mitomycin pro ml enthalten. Lösung zur intravesikalen Anwendung Zur Zubereitung einer Lösung zur intravesikalen Anwendung kann 1 Durchstechflasche Urocin® 20 mg, entsprechend 20 mg Mitomycin, in 20 ml 0,9%iger isotonischer Natriumchloridlösung gelöst werden. Die gebrauchsfertige Lösung sollte nicht mehr als 1 mg Mitomycin pro ml enthalten. Hinweise Es dürfen nur klare Lösungen verwendet werden. Zur Dauer der Haltbarkeit der Lösungen siehe Abschnitt 5 „Wie ist Urocin® 20 mg aufzubewahren“. Der Inhalt der Durchstechflasche ist zur einmaligen Entnahme bestimmt. Nicht verbrauchte Lösung ist zu verwerfen. Urocin® 20 mg darf nicht in Mischspritzen verwendet werden. Andere Injektions- bzw. Infusionslösungen müssen getrennt verabreicht werden. Zur Vermeidung von Nekrosen sollte nur in möglichst große Gefäße gespritzt werden (siehe Abschnitt 4 "Allgemeine Erkrankungen und Beschwerden am Verabreichungsort“). Dauer der Anwendung Über die Dauer der Anwendung entscheidet der Arzt. Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Urocin® 20 mg zu stark oder zu schwach ist. Wenn Sie weitere Fragen zur Anwendung des Arznei­ mittels haben, fragen Sie Ihren Arzt oder Apotheker. 4. Welche Nebenwirkungen sind möglich? Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: Sehr häufig: mehr als 1 Behandelter von 10 Häufig: 1 bis 10 Behandelte von 100 Gelegentlich: 1 bis 10 Behandelte von 1.000 Selten: 1 bis 10 Behandelte von 10.000 Sehr selten: weniger als 1 Behandelter von 10.000 Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar Die häufigsten Nebenwirkungen von Mitomycin bei systemischer Verabreichung bestehen in gastrointestinalen Beschwerden, wie Übelkeit und Erbrechen sowie in einer Unterdrückung der Knochenmark­ funktion (Knochenmarksuppression) mit einer Ver­ minderung der weißen Blutkörperchen (Leukopenie) und zumeist dominanter Verminderung der Blutplätt­ chen (Thrombopenie). Diese Knochenmarksuppres­ sion tritt bei bis zu 65 % der Patienten auf. Da sie bei längerer Anwendung stärker wird (kumulativ), ist sie häufig dosislimitierend. Erkrankungen des Blutes und des Lymphsystems Sehr häufig Unterdrückung der Knochenmarkfunktion (Knochenmarksuppression), Verminderung der weißen Blutkörperchen (Leukopenie), Verminderung der Blutplättchen (Thrombopenie) Selten Lebensbedrohliche Infektion, Blutvergiftung (Sepsis), Blutarmut durch Abbau roter Blutkörperchen (hämolytische Anämie) Erkrankungen des Immunsystems Sehr selten, einschließlich gemeldeter Einzelfälle Schwere allergische Reaktion Herzerkrankungen Selten Herzversagen (Herzinsuffizienz) nach vorausgegangener Anthrazyklintherapie Erkrankungen der Atemwege, des Brustraums und Mediastinums Häufig Entzündung des Bindegewebes der Lunge (Interstitielle Pneumonie), Atemnot, Husten, Kurzatmigkeit Selten Erhöhung des Blutdrucks im Lungenkreislauf (Pulmonaler Hypertonus), Lun­gen­ venenverschlußkrankheit (venookklusive Erkrankung der Lunge [PVOD]) Erkrankungen des Gastrointestinaltrakts Sehr häufig Übelkeit, Erbrechen Gelegentlich Schleimhautentzündung (Mukositis), Entzündung der Mundschleimhaut (Stomatitis), Durchfall (Diarrhoe) Leber- und Gallenerkrankungen Selten Leberfunktionsstörung, Transaminasenerhöhung, Gelbsucht (Ikterus), Lebervenenverschlußkrankheit (venookklusive Erkrankung der Leber [VOD]) Erkrankungen der Haut und des Unterhautzell­gewebes Häufig Umschriebener Hautausschlag (lokale Exantheme), allergischer Hautausschlag, Hautreaktion durch Kontakt mit Mitomycin (Kontaktdermatitis), Hand-FußSyndrom (Palmar-Plantar-Erythem) Gelegentlich Haarausfall (Alopezie) Selten Ausschlag am gesamten Körper (Generalisierte Exantheme) Erkrankungen der Nieren und Harnwege Häufig Nierenfunktionsstörung, Anstieg des Serumkreatinins, Veränderungen der Nierenglomerula (Glomerulopathie) Bei intravesikaler Anwendung: Harndrang, Blasenentzündung (Zystitis), Beschwerden beim Wasserlassen (Dysurie), vermehrtes nächtliches Wasser­ lassen (Nykturie), häufige Entleerung kleiner Harnmengen (Pollakisurie), Blut im Urin (Hämaturie), umschriebene Reizung der Blasenwand (lokale Blasen­ wandirritation) Selten Spezielle Form des Nierenversagens (Hämolytisch-Urämisches Syndrom [HUS]), spezielle Form der Blutarmut (mikroangiopathische hämolytische Anämie [MAHA-Syndrom]) Sehr selten, einschließlich gemeldeter Einzelfälle Bei intravesikaler Anwendung: Blasenentzündung mit Schädigung des Blasen­ gewebes (nekrotisierende Zystitis), allergische (eosinophile) Blasenentzündung (Zystitis), Stenosen der ableitenden Harnwege, Einschränkung der Blasen­ kapazität Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig Bei Injektion oder Übertritt von Mitomycin aus dem Gefäß in umliegendes Gewebe (Paravasation): Gewebsentzündung (Zellulitis), Gewebeschäden (Gewebsnekrosen) Gelegentlich Fieber, Appetitlosigkeit (Anorexie) Nähere Erläuterungen zu den Nebenwirkungen Erkrankungen des Blutes und des Lymph­systems Bei systemischer Therapie tritt regelmäßig eine Unter­ drückung der Knochenmarkfunktion (Knochenmark­ suppression), eine Verminderung der weißen Blut­ körperchen (Leukopenie) und zumeist dominante Verminderung der Blutplättchen (Thrombopenie) auf. Sie kann sich erst verzögert mit maximaler Ausprä­ gung nach 4-6 Wochen manifestieren und nach längerer Anwendung stärker werden. Dies erfordert häufig eine individuelle Dosisanpassung (siehe auch Abschnitt 2 “Was sollten Sie vor der Anwendung von Urocin® 20 mg beachten“). Mit der Unterdrückung der Knochenmarkfunktion kann eine lebensbedrohliche Infektion bzw. Blut­ vergiftung (Sepsis) mit potentiell tödlichem Ausgang einhergehen. Bei ersten Anzeichen einer Auflösung der roten Blut­ körperchen (Hämolyse) muss die Therapie sofort abgebrochen werden. Organtoxizität Bei bis zu 10 % der Patienten muss mit einer schwerwiegenden Schädigung der Lunge (interstitiellen Pneumonitis) oder der Niere (Nephrotoxizität) gerechnet werden. In diesem Fall muss die Therapie unterbrochen werden (Siehe auch Abschnitt 2 “Was sollten Sie vor der Anwendung von Urocin® 20 mg beachten“). Erkrankungen der Atemwege, des Brustraums und Mediastinums Eine Schädigung der Lunge führt häufig zu zunehmender Atemnot und nicht-produktivem Husten, kann sich jedoch auch in plötzlich einsetzender Kurzatmigkeit manifestieren. Die Schädigung der Lunge ist mit Steroiden (Korti­ son-artige Substanzen) gut behandelbar. Erkrankungen der Niere und Harnwege Wenn Nephrotoxizität auftritt, muss die The­ rapie unterbrochen werden (siehe auch Abschnitt 2 “Was sollten Sie vor der Anwendung von Urocin® 20 mg beachten“). Die Nierentoxizität von Mitomycin kann zu raschprogressiv oder chronisch-progressiv verlaufenden Nierenfunktionsstörungen (Anstieg des Serumkrea­ tinins, Glomerulopathie) führen. Bei Auftreten eines Hämolytischen-Urämischen Syndroms (HUS): spezielle Form des Nierenversagens mit mikroangiopathischer hämolytischer Anämie [MAHA-Syndrom: spezielle Form der Blutarmut] und Verminderung der Blutplättchen (Thrombozytopenie) sind tödliche Verläufe häufig. In diesem Fall wird Ihnen Ihr Arzt, wenn nötig, einen Therapieversuch zur Entfernung von Immunkom­ plexen, die eine wesentliche Rolle bei der Manifesta­ tion der Symptome zu spielen scheinen, mittels Sta­ phylococcus-Protein A empfehlen. Das MAHA-Syndrom wurde bisher bei Dosen von >30 mg Mitomycin/m2 KOF beobachtet und scheint dosisabhängig zu sein. Eine engmaschige Überwachung der Nierenfunktion wird empfohlen. Bei der intravesikalen Therapie können eine Blasen­ entzündung (Zystitis), unter Umständen blutiger Natur, Harndrang, Beschwerden beim Wasserlassen (Dysurie), vermehrtes nächtliches Wasserlassen (Nykturie), häufige Entleerung kleiner Harnmengen (Pollakisurie), Blut im Urin (Hämaturie) sowie eine umschriebene Reizung der Blasenwand (lokale Blasenwandirritation) auftreten. Sollte bei Ihnen eine Blasenentzündung (Zystitis) auftreten, wird Ihr Arzt diese symptomatisch durch lokale entzündungshemmende (antiphlogistische) und schmerzlindernde (analgetische) Maßnahmen behandeln. In Einzelfällen ist eine allergische (eosinophile) Zystitis beschrieben worden, die zum Therapieab­ bruch zwang. Verengungen (Stenosen) der ableitenden Harnwege aufgrund einer schädigenden Wirkung von Mitomycin auf das Urothel (Epithel, das die gesamten ableiten­ den Harnwege zwischen Nierenbecken und der äußeren Harnröhrenmündung innen auskleidet) sind als seltene Komplikationen nicht auszuschließen. Erkrankungen der Haut und des Unterhaut­zell­ gewebes Gelegentlich kann Haarausfall auftreten. Eine kom­ plette Alopezie tritt nach Monochemo­therapie mit Mitomycin nur selten auf. Vor allem bei der intravesikalen Therapie können allergische Hautreaktionen in Form lokaler Hautaus­ schläge (z. B. Kontaktdermatitis, auch in Form von flächigen Rötungen der Handinnenseiten und Fuß­ sohlen (Palmar- und Plantarerythemen)) und gene­ ralisierte Hautausschläge auftreten. Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Paravasate: Bei nicht sachgerechter Injektion oder beim Übertritt aus dem Gefäß in umliegendes Gewebe kommt es häufig zu Gewebsentzündungen (Zellulitis) mit schwe­ ren Schädigungen des Gewebes (Nekrosen). In diesem Fall wird Ihr Arzt, wenn nötig, eine lokale Behandlung mit Dimethylsulfoxid (DMSO 99 %) sowie mit trockener Kälte durchführen. Ein (plastischer) Chirurg sollte frühzeitig (innerhalb von 72 Stunden) hinzugezogen werden. Meldung von Nebenwirkungen Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker oder das medizini­ sche Fachpersonal. Dies gilt auch für Nebenwirkun­ gen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. 5. Wie ist Urocin® 20 mg aufzubewahren? Bewahren Sie dieses Arzneimittel für Kinder unzu­ gänglich auf. Sie dürfen das Arzneimittel nach dem auf dem Umkarton nach Verwendbar bis: Monat/Jahr angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats. Aufbewahrungsbedingungen: Durchstechflasche: Nicht über 25 °C lagern. Applikationssystem: Nicht unter 2 °C und nicht über 25 °C lagern. Katheter: Nicht unter 5 °C und nicht über 25 °C lagern. In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen. Hinweis auf Haltbarkeit nach Zubereitung Haltbarkeit der Stammlösung bzw. der gebrauchsfertigen Zubereitung: Aus mikrobiologischer Sicht sollte die Stammlösung bzw. die gebrauchsfertige Zubereitung sofort verwendet werden. Wenn die Stammlösung oder die gebrauchsfertige Lösung nicht sofort verwendet wird, ist der Anwen­ der für die Dauer und die Bedingungen der Aufbe­ wahrung verantwortlich. Entsorgen Sie das Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei. Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Hand­ habung. Die Entsorgungsvorschriften für Zytostatika sind zu beachten. 6. Inhalt der Packung und weitere Infor­ mationen Was Urocin® 20 mg enthält: Der Wirkstoff ist: Mitomycin Die sonstigen Bestandteile sind: Mannitol, Salzsäure 1 Durchstechflasche mit 260 mg Pulver zur Herstel­ lung einer Injektions- bzw. Infusionslösung oder einer Lösung zur intravesikalen Anwendung enthält 20 mg Mitomycin. Wie Urocin® 20 mg aussieht und Inhalt der Packung Pulver zur Herstellung einer Injektions- bzw. Infusions­ lösung oder einer Lösung zur intravesikalen Anwen­ dung in einer Durchstechflasche. OP mit 1 Durchstechflasche (N1) mit 20 mg Mitomycin (mit Applikationssystem zur intravesikalen Instillation) OP mit 4 Durchstechflaschen mit jeweils 20 mg Mitomycin (mit Applikationssystem zur intravesikalen Instillation) OP mit 6 Durchstechflaschen (N2) mit jeweils 20 mg Mitomycin (mit Applikationssystem zur intravesikalen Instillation) Klinikpackungen mit 5 und mit 10 Durchstech­fla­ schen mit jeweils 20 mg Mitomycin (ohne Applika­ tionssystem). Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht. Jede Durchstechflasche ist mit einer Folie zur Siche­ rung gegen Glassplitterung und Kontamination ummantelt. Pharmazeutischer Unternehmer und Hersteller APOGEPHA Arzneimittel GmbH Kyffhäuserstraße 27, 01309 Dresden Telefon: 0351 3363-3, Telefax: 0351 3363-440 [email protected], www.apogepha.de Diese Packungsbeilage wurde zuletzt über­ arbeitet im Mai 2015. _________________________________________ Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt: 7. Informationen für Ärzte und medizini­ sches Fach­personal Vorsichtsmaßnahmen bei der Handhabung von Urocin® 20 mg Beim Umgang mit Mitomycin sollten die Inhalation des Pulvers sowie Haut- und Schleimhautkontakte vermieden werden (Handschuhe tragen!). Die Zubereitung sollte durch geschultes Personal in Sicherheitswerkbänken mit Laminar flow erfolgen. Schwangeres Personal ist vom Umgang mit Zyto­ statika auszuschließen. Kontaminierte Körperstellen sollen umgehend sorg­ fältig mit Wasser und Seife gereinigt werden. Eine einwandfreie Injektionstechnik ist wichtig für die Vermeidung von Nekrosen und Verschorfungen, die immer dann entstehen, wenn Mitomycin aus dem Blutgefäß in das umliegende Gewebe austritt. Nekrosen können auch verzögert und vom Injek­ tionsort entfernt auftreten. Zu Gegenmaßnahmen bei Auftreten von Paravasaten siehe Abschnitt 4. „Allgemeine Erkrankungen und Beschwerden am Verabreichungsort“. Das Merkblatt "Sichere Handhabung von Zytostatika" der Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege ist zu beachten. Inkompatibilitäten Inkompatibilitäten treten mit stark sauren oder alkalischen Substanzen auf. Mitomycin ist kompatibel mit isotonischer Natrium­ chloridlösung. Urocin® 20 mg darf, außer mit den unter Abschnitt 3. „Zubereitung der Lösungen“ aufgeführten, nicht mit anderen Arzneimitteln gemischt werden. Der optimale pH-Wert der gebrauchsfertigen Mito­ mycin-Stammlösung in Wasser für Injektionszwecke beträgt 7,0. Überdosierung Symptome der Intoxikation Bei Überdosierung muss mit schwerwiegender Myelotoxizität bis hin zu Myelophthise (Anämie durch Knochenmarkschwund) gerechnet werden, die erst nach etwa 2 Wochen klinisch manifest wird. Der Zeitraum bis zum Absinken der Leukozyten auf den tiefsten Wert kann bis zu 4 Wochen betragen. Auch bei Verdacht auf Überdosierung muss das Blut­bild längerfristig engmaschig überwacht werden. Therapie bei Intoxikation Wirksame Gegenmittel sind nicht bekannt. Die myelosuppressive Wirkung von Mitomycin kann u. U. durch posttherapeutische Applikation von Vitamin B6 (200 mg /10 mg Mitomycin) gemildert werden. Anleitung SICS-Applikations­aus­stattung zur intravesikalen Instillation Die 0,9%ige Natriumchlorid-Lösung und der Kathe­ ter der SICS-Applikationsausstattung sind ausschlie­ß­ lich zur intravesikalen Instillation geeignet und sind nur zum einmaligen Gebrauch bestimmt und können nach dem Gebrauch zusammen mit Urocin® 20 mg im beiliegenden Entsor­gungsbeutel entsorgt werden. Die Entsorgungs­vorschriften für Zytostatika sind zu beachten. Die Medizinprodukte dürfen nach Ablauf der aufgedruckten Verwendbarkeitsdaten nicht mehr verwendet werden. Bitte beachten Sie auch die beiliegenden Infor­­ma­ tionen zu den einzelnen Medizinpro­duk­ten. Rekonstitution und intravesikale Instil­lation von Urocin® 20 mg Der Inhalt einer Durchstechflasche Urocin® 20 mg kann mit der beiliegenden 0,9%igen isotonischen Natriumchloridlösung zu einem Gesamtvolumen von 20 ml rekonstituiert werden. 1. Aluverpackung an der Einkerbung öffnen und Beutel mit 0,9%iger Natriumchlorid­lösung aus der Aluverpackung entnehmen. Bitte beachten Sie zu deren korrekter Anwendung und für weitere Informationen die jeweilig beiliegenden Informationen der Hersteller sowie die unten beschriebene Anleitung zur Verwendung der SICSApplikationsausstattung zur intravesikalen Instillation. 5 4 Applikationssystem 5. Roten Knickverschluss an der Sollbruch­stelle aufbrechen und den gesamten Inhalt der NaClLösung durch Zusammendrü­cken des Beutels in die Urocin® 20 mg Durch­stech­flasche pumpen. Applikationssystem mit der Urocin® 20 mg Durch­ stechflasche nach oben drehen. 8 7 9 6 1 Aluverpackung 2. Klarsicht-Sterilverpackung an der oberen Kante aufreißen und die 0,9 %ige Natrium­chlorid­lö­sung entnehmen. 2 Applikationssystem gedreht 6. Mitomycin-Lösung vollständig in den NaCl-Beu­tel zurückpumpen und Clip zur Urocin® 20 mg Durch­ stechflasche schließen. 7. Blaue Steril-Schutzkappe am Katheteran­schluss entfernen und Spitze des Kathe­ter­anschlusses abbrechen. 8. Den Beutel an den in der Harnröhre positio­nierten kompatiblen Katheter anschlie­ßen (koni­sche Auf­ steckverbindung). Information zur Applikationsausstattung Dem Arzneimittel liegen als Applikationshilfen aus­ schließlich zur intravesikalen Instillation die folgenden Medizinprodukte als SICS-Applikationsausstattung bei: < Katheter SafetyCat® Active Sicherheits­k atheter mit Gleimittelbeschichtung [Ch. 12, 40 cm]: CE 0124 < 0,9%ige isoton. Natriumchloridlösung, Medizin­ produkt zur intravesikalen Instillation nach Rekon­stitution von kompatiblen Arzneimitteln: CE 0428 < Sowie ein Entsorgungsbeutel mit Zip-Verschluss (Entsorgungsvorschriften für Zytostatika beachten) 3 Klarsicht-Sterilverpackung 3. Clips sind durch die Klemmverschlüsse auf beiden Seiten zu schließen. 4. Deckel-Kappe von der Urocin® 20 mg Durch­ stechflasche entfernen und den Anstechdorn durch den Gummistopfen der auf festem Unter­ grund stehenden Urocin® 20 mg Durch­stech­ flasche kräftig mit vertikalem Druck einstechen. Der Klemm-Bügel ist dabei unter dem Alurand der Urocin® 20 mg Durch­stechflasche fixiert. 9. Clip öffnen und die gesamte Lösung (20 ml) durch Zusammendrücken des NaCl-Beutels via Katheter in die Harnblase instillieren. NaCl-Beutel zusammengedrückt lassen und das gesamte Applikationssystem zusammen mit dem Katheter im beiliegenden verschließ­baren Entsor­ gungsbeutel gemäß den Vor­schrif­ten zur Entsor­ gung von Zytostatika ent­sorgen. Für die Anwendung des Katheters beachten Sie bitte die beiliegenden Infor­mationen. 13450 / v014de-1 APOGEPHA Arzneimittel GmbH Kyffhäuserstraße 27, 01309 Dresden Tel. 0351 3363-3, Fax 0351 3363-440 [email protected]