medac Mitomycin - Bronchialkarzinom Aktuell
Werbung

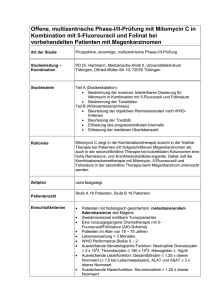
Fachinformation medac 1. Bezeichnung der Arzneimittel Mitomycin 2 medac Mitomycin medac Wirkstoff: Mitomycin 2. Verschreibungsstatus/ Apothekenpflicht Verschreibungspflichtig 3. Zusammensetzung der Arzneimittel 3.1 Stoff- oder Indikationsgruppe Das Antibiotikum Mitomycin ist ein Zytostatikum aus der Gruppe der Alkylantien. 3.2 Bestandteile nach der Art und arzneilich wirksame Bestandteile nach Art und Menge – arzneilich wirksame Bestandteile Eine Durchstechflasche Mitomycin 2 medac mit 50 mg Trockensubstanz enthält 2 mg Mitomycin. Eine Durchstechflasche Mitomycin medac mit 250 (375) mg Trockensubstanz enthält 10 (15) mg Mitomycin. – andere Bestandteile Natriumchlorid. 4. Anwendungsgebiete Blasentumoren, Magen-, Bronchial-, Pankreas-, Kolon-, Rektum-, Mamma-, Leberzell-, Zervix-, Ösophaguskarzinom, Karzinome im Kopf-Halsbereich, chronisch-myeloische Leukämie, Osteosarkom. 5. Gegenanzeigen Verminderte Knochenmarkfunktionen (Leukopenie, Thrombopenie), Blutungsneigung (hämorrhagische Diathese), Leber-, Lungenund Nierenschäden, schlechter Allgemeinzustand, bekannte Überempfindlichkeit gegen Mitomycin, bestehende Blasenentzündungen vor einer intravesikalen Anwendung, Schwangerschaft, Laktation. Patienten im geschlechtsreifen Alter sollten während und bis zu 3 Monate nach Beendigung der Chemotherapie kontrazeptive Maßnahmen ergreifen bzw. sexuelle Abstinenz einhalten. Verwendung bei Schwangerschaft und Laktation: Aufgrund seiner nachgewiesenen mutagenen, teratogenen und karzinogenen Wirkung darf Mitomycin in der Schwangerschaft und während der Laktation nicht gegeben werden. 6. Nebenwirkungen Mai 1994 Bei systemischer Therapie tritt regelmäßig eine Knochenmarksuppression mit Leukound zumeist dominanter Thrombopenie auf. Sie kann sich erst verzögert mit maximaler Ausprägung nach 4 – 6 Wochen manifestieren; nach längerer Anwendung kumulieren und erfordert deshalb häufig eine individuelle Dosisanpassung. Leberschäden treten selten auf, ebenso Übelkeit, Erbrechen und Appetitlosigkeit, gelegentlich Haarschwund sowie Schleimhautschäden (Stomatitis, Durchfall). 1360-m752 -- Mitomycin -- Mitomycin Bei bis zu 10 % der Patienten muß mit einer schwerwiegenden Organtoxizität in Form einer interstitiellen Pneumonitis oder einer Nephrotoxizität gerechnet werden. In diesem Fall muß die Therapie unterbrochen werden. Bei einer präventiven Gabe von Steroiden wird das Auftreten von Lungentoxizität sehr selten beobachtet. Steroide eignen sich zur Behandlung bereits bestehender Lungentoxizität. Die Nierentoxizität äußert sich als Hämolytisch-Urämisches Syndrom (HUS). Die klinischen Hauptsymptome sind: Thrombopenie, MAHA (mikroangiopathischhämoloytische Anämie) und Niereninsuffizienz. Neue Erkenntnisse lassen einen Therapieversuch zur Entfernung von Immunkomplexen, die eine wesentliche Rolle bei der Manifestation der Symptome zu spielen scheinen, mittels Staphylococcus-Protein A evtl. angezeigt erscheinen. Seltene Nebenwirkungen sind die Manifestation einer Herzinsuffizienz nach vorausgegangener Anthrazyklintherapie sowie eine venookklusive Erkrankung der Leber. Bei ungenauer Injektion oder beim Übertritt aus dem Gefäß in umliegendes Gewebe verursacht Mitomycin schwere Schädigungen des Gewebes (Nekrosen); deshalb sollte nur in möglichst große Gefäße injiziert werden. Vor allem nach intravesikaler Anwendung kann Mitomycin allergische Erscheinungen hervorrufen. In den meisten Fällen handelt es sich dabei um eine Kontaktdermatitis, auch in Form von Palmar- und Plantarerythemen; es können jedoch auch generalisierte Exantheme auftreten. Ebenfalls kann eine Zystitis auftreten, die symptomatisch durch lokale antiphlogistische und analgetische Maßnahmen behandelt werden soll. In Einzelfällen wurde von schweren Unverträglichkeitsreaktionen (nekrotisierende Zystitis) berichtet. Stenosen aufgrund einer direkt toxischen Wirkung von Mitomycin auf das Urothel sind als seltene Komplikationen nicht auszuschließen. 7. Wechselwirkungen mit anderen Mitteln Myelotoxische Interaktionen mit anderen knochenmarktoxischen Therapiemodalitäten (insbesondere anderen Zytostatika, Bestrahlung) sind möglich. Eine Kombination mit Vinca-Alkaloiden oder Bleomycin kann die pulmonale Toxizität verstärken. Pyridoxinhydrochlorid (Vitamin B6) führte in Tierversuchen zu einem Wirkungsverlust des Mitomycin. Im Zusammenhang mit einer MitomycinBehandlung sollten keine Impfungen mit Lebendvakzinen erfolgen. Die Kardiotoxizität von Adriamycin (Doxorubicin) kann durch Mitomycin verstärkt werden. 8. Warnhinweise entfällt 9. Wichtigste Inkompatibilitäten Nicht bekannt. Mitomycin ist kompatibel mit Kochsalzlösung 0,9 % und Natriumlaktatlösung. In Glucoselösung 5 % ist Mitomycin über eine Dauer von 3 Stunden stabil. Nach 24 Stunden haben sich bereits 20 % des Wirkstoffs zersetzt. 10. Dosierung mit Einzel- und Tagesgaben Soweit nicht anders verordnet, wird Mitomycin wie folgt dosiert: In der zytostatischen Monochemotherapie wird Mitomycin zumeist als Bolusinjektion intravenös verabreicht. Als Dosierung können 10 – 20 mg/qm KOF alle 6 – 8 Wochen oder 8 – 12 mg/qm KOF alle 3 – 4 Wochen empfohlen werden. In der Kombinationschemotherapie ist die Dosierung deutlich geringer. Wegen der Gefahr der additiven Myelotoxizität darf von erprobten Therapieprotokollen ohne besonderen Grund nicht abgewichen werden. Zur intravesikalen Instillation werden zur Therapie jeweils 20 – 40 mg Mitomycin, gelöst in 20 – 40 ml Wasser für Injektionszwecke, instilliert, im Durchschnitt 20 Instillationen. Zur Rezidivprophylaxe, z. B. nach transurethaler Resektion, werden jeweils 20 mg Mitomycin, gelöst in 20 ml Wasser für Injektionszwecke instilliert; im Durchschnitt 20 Instillationen im Abstand von jeweils 14 Tagen. Bei Patienten mit ausgiebiger zytostatischer Vortherapie und bei älteren Patienten muß eine Dosisreduktion erfolgen. 11. Art und Dauer der Anwendung Mitomycin darf nur von erfahrenen Onkologen angewendet werden. Zur intravenösen oder intraartiellen Injektionen bzw. Infusion oder zur intravesikalen Instillation nach vorgeschriebener Lösung. Der Inhalt einer Durchstechflasche Mitomycin 2 medac mit 50 mg Trockensubstanz (entsprechend 2 mg Mitomycin) wird mit 2 ml Wasser für Injektionszwecke in Lösung gebracht. Der Inhalt einer Durchstechflasche Mitomycin medac mit 250 (375) mg Trockensubstanz (entsprechend 10 (15) mg Mitomycin) wird mit 10 (15) ml Wasser für Injektionszwecke in Lösung gebracht. Die gebrauchsfertige Lösung sollte sofort verbraucht werden. 12. Notfallmaßnahmen, Symptome und Gegenmittel Bei Überdosierung muß mit einer schweren Myelotoxizität bis zur Myelophthise gerechnet werden, die erst nach etwa 2 Wochen klinisch voll in Erscheinung tritt. Der Zeitraum bis zum Absinken der Leukozyten auf den tiefsten Wert kann 4 Wochen betragen. Auch bei Verdacht auf Überdosierung muß daher eine längere engmaschige, hämatologische Kontrolle erfolgen. Da effektive Gegenmittel nicht verfügbar sind, ist bei jeder Applikation 1 Fachinformation Mitomycin größte Vorsicht zu üben. Die myelosuppressive Wirkung von Mitomycin kann u. U. durch posttherapeutische Applikation von Vitamin B6 (200 mg/10 mg Mitomycin) gemildert werden. 13. Pharmakologische und toxikologische Eigenschaften, Pharmakokinetik und Bioverfügbarkeit, soweit diese Angaben für die therapeutische Verwendung erforderlich sind 13.1 Pharmakologische Eigenschaften Das Antibiotikum Mitomycin entfaltet seine zytostatischen Eigenschaften nach Metabolisierung. Nach Reduktion des vorliegenden Chinons zu einem Hydrochinon wird die Methoxygruppe abgespalten, der Aziridinring geöffnet und die Urethanseitenkette abgespalten. Es entsteht dabei ein bifunktionelles Alkylans, das auch in der Lage ist, die komplementären DNS-Stränge quer zu vernetzen. Eine weitere alkylierende Gruppe kann an der Aminogruppe des Hydrochinonringes entstehen. Mitomycin wirkt in der späten G1-, in der S- und in der G2-Phase des Zellzyklus. 13.2 Toxikologische Eigenschaften entfällt 13.3 Pharmakokinetik Nach der i.v. oder i.a. Applikation ist Mitomycin in allen Geweben außer dem Gehirn, der Milz und der Haut nachweisbar. In der Leber wird Mitomycin auf anaerobe Weise hauptsächlich im mikrosomalen Bereich metabolisiert. Durch unterschiedliche Leberfunktionen erklärt man sich z. Zt. Schwankungen in der Plasmahalbwertszeit, die für t1/2α bei 4 – 8 Minuten, für t1/2β bei 30 – 70 Minuten liegen. Während der Eliminationsphase werden höhere Mitomycinkonzentrationen in der Gallenflüssigkeit als im Plasma gemessen, so daß ein enterohepatischer Kreislauf für Mitomycin diskutiert wird. Teile des Medikamentes werden renal durch glomeruläre Filtration eliminiert. 13.4 Bioverfügbarkeit entfällt 14. Sonstige Hinweise Eine einwandfreie Injektionstechnik ist wichtig für die Vermeidung von Nekrosen und Verschorfungen, die immer dann entstehen, wenn Mitomycin aus dem Blutgefäß in das umliegende Gewebe austritt. Nekrosen können auch verzögert und vom Injektionsort entfernt auftreten. Als erste Maßnahme bei paravenöser Injektion ist mit der liegenden Kanüle möglichst viel vom Zytostatikum zu entfernen. Mit einer dünnen Nadel wird versucht, den Erguß zu aspirieren. Eine großflächige Unterspritzung des Paravasats mit 5000 Einheiten Heparin in 5 ml physiologischer Kochsalzlösung kann durchgeführt werden. Eine äußerliche Anwendung von Dimethylsulfoxyd (DMSO) kann Ulcerationen nach paravasaler Injektion vermeiden: Das betroffene Areal und seine Umgebung werden alle 6 Stunden mit einem DMSO-getränkten Watteträger betupft. Die Behandlung sollte 2 medac einige Tage durchgeführt werden. Diese Behandlung kann ebenfalls bei verzögert auftretenden Nekrosen, die vom Injektionsort entfernt liegen, versucht werden. Mitomycin kann durch Auslösung von Übelkeit und Erbrechen indirekt zu einer Beeinträchtigung der Fahrtüchtigkeit oder der Bedienbarkeit von Maschinen führen. Eine längerfristige Therapie kann zu einer kumulativen Knochenmarktoxizität führen. Mitomycin ist eine mutagene, potentiell auch beim Menschen karzinogene Substanz. Haut- und Schleimhautkontakte sind zu meiden. Bei pulmonaler Symptomatik, die nicht auf die Grundkrankheit zurückgeführt werden kann, ist die Therapie sofort abzubrechen, ebenso bei Hämolysezeichen oder Anzeichen einer Nierenfunktionsstörung. 15. Dauer der Haltbarkeit Bei ordnungsgemäßer Lagerung ist Mitomycin medac 4 Jahre haltbar. Nach Ablauf des Verfalldatums soll das Arzneimittel nicht mehr verwendet werden. 16. Besondere Lagerund Aufbewahrungshinweise Flascheninhalt vor direktem Sonnenlicht schützen. 17. Darreichungsformen und Packungsgrößen Mitomycin 2 medac OP mit 10 Durchstechflaschen à 2 mg Mitomycin medac OP mit 1 Durchstechflasche OP mit 5 (1 W 5) Durchstechflaschen OP mit 5 (5 W 1) Durchstechflaschen Anstaltspackungen à 10 mg OP mit 1 Durchstechflasche OP mit 5 (1 W 5) Durchstechflaschen OP mit 5 (5 W 1) Durchstechflaschen Anstaltspackungen à 15 mg à 10 mg à 10 mg à 15 mg à 15 mg 18. Stand der Information Mai 1994 19. Name oder Firma und Anschrift des pharmazeutischen Unternehmers medac Gesellschaft für klinische Spezialpräparate mbH Fehlandtstraße 3 20354 Hamburg Telefon: (0 40) 35 09 02-0 Zentrale Anforderung an: Bundesverband der Pharmazeutischen Industrie e. V. Fachinfo-Service Postfach 12 55 88322 Aulendorf 1360-m752 -- Mitomycin --