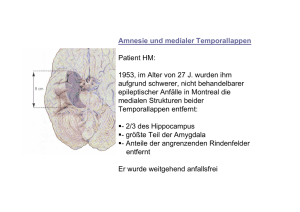
Dokument_11.
Werbung

Aus der Psychiatrischen und Psychotherapeutischen Klinik der Friedrich-Alexander-Universität Erlangen-Nürnberg Direktor: Prof. Dr. med. J. Kornhuber Jung, gesund und doch vergesslich? Wie die Polymorphismen BDNF Val66Met und APO E die mnestischen Leistungen junger gesunder Probanden beeinflussen Inaugural-Dissertation zur Erlangung der Doktorwürde der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg vorgelegt von Tanja Richter-Schmidinger aus Trostberg Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Prof. Dr. med. Dr. h.c. J. Schüttler Referent: Prof. Dr. med. J. Kornhuber Korreferent: PD Dr. med. J. M. Maler Prof. Dr. S. Engel Tag der mündlichen Prüfung: 09.12.2010 Inhaltsverzeichnis 1 Zusammenfassung 1 2 Gedächtnis, BDNF und APOE 5 2.1 2.1.1 Gedächtnis Taxonomien des Gedächtnisses 6 6 2.1.1.1 2.1.1.2 2.1.1.3 Zeitliche Dimensionen des Gedächtnisses Inhaltliche Dimensionen des Gedächtnisses Stufen der Verarbeitung von Gedächtnisinhalten 6 8 11 2.1.2 2.1.3 Neuroanamtomie des Gedächtnisses Diagnostik von Gedächtnisstörungen 13 15 2.2 2.2.1 2.2.2 Brain-derived neurotrophic factor (BDNF) Der Val66Met Polymorphismus des BDNF-Gens Effekte des Polymorphismus Val66Met auf die Neurophysiologie und cerebrale Morphologie Klinische Effekte des Polymorphismus Val66Met 17 20 20 22 23 24 2.3.3 Apolipoprotein E (ApoE) Polymorphismus des APOE-Gens Effekte des Polymorphismus APOE-ε4 auf die Neurophysiologie und cerebrale Morphologie Klinische Effekte des Polymorphismus APOE-ε4 2.4 Zielsetzungen 28 3 Methodik 29 3.1 Studiendesign 29 3.2 3.2.1 3.2.2 3.2.3 Messmethoden Inventar zur Gedächtnisdiagnostik (IGD) Genotypisierung des BDNF Genotypisierung des APOE 30 30 33 33 3.3 Beschreibung der Stichprobe 33 4 Ergebnisse 37 4.1 4.1.1 4.1.2 4.1.3 Deskriptive Statistik Mnestische Leistungen und BNDF Val66Met Mnestische Leistungen und APOE Zusammenfassung der deskriptiven Statistik 37 37 39 41 4.2 4.2.1 4.2.2 Analytische Statistik Der Einfluss demographischer Variablen Mnestische Unterschiede zwischen den BDNF-Genotypen 42 43 47 4.2.2.1 4.2.2.2 4.2.2.3 4.2.2.4 Val-Val versus Val-Met Val-Val versus Met-Met Val-Met versus Met-Met Kein Met versus Met 47 48 50 51 2.2.3 2.3 2.3.1 2.3.2 21 26 4.2.3 4.2.4 Mnestische Unterschiede zwischen den APOE-Genotypen Zusammenhänge mit demographischen Variablen und der Einfluss des Lebensalters 52 54 4.2.4.1 Zusammenhänge der Phänotypen von BDNF Val66Met und APOE-ε4 mit den demographischen Variablen Die Abhängigkeit der Phänotypen der Polymorphismen BDNF Val66Met und APOE-ε4 vom Alter 54 4.2.4.2 55 4.2.5 Zusammenfassung der analytischen Statistik 64 5 Diskussion 66 5.1 5.1.1 5.1.2 5.1.3 5.1.4 BDNF Val66Met und Gedächtnis Normativer Vergleich: Val-Val liegt vorne Demographische Einflüsse: epistatische Hinweise in der Val-Val Gruppe BDNF-Met Träger sind in mnestischer Hinsicht benachteiligt Mit dem Alter gleichen sich die Gruppen „kein Met“ und „Met“ an 66 66 66 67 69 5.2 5.2.1 5.2.2 5.2.3 70 70 71 72 5.2.4 APOE-εε4 und Gedächtnis Normativer Vergleich: APOE-E2 liegt vorne Demographische Einflüsse: BDNF-Met mindert den Erfolg von APOE-E2 APOE-Varianten verursachen keinen signifikanten Unterschied in den mnestischen Leistungen Mit dem Alter gleichen sich die Gruppen „kein ε4“ und „ε4“ an 5.3 Ausblick 74 6 Literaturverzeichnis 77 7 Vorveröffentlichung 89 8 Abkürzungsverzeichnis 90 9 Tabellenverzeichnis 92 10 Abbildungsverzeichnis 94 11 Anhang 95 12 Danksagung 73 106 -1- 1 Zusammenfassung Hintergrund und Ziele Seit der Sequenzierung des menschlichen Genoms versuchen Forscher unter den im zentralen Nervensystem exprimierten Genen diejenigen zu identifizieren, die nachweisbar die Kognition des Menschen beeinflussen. Eine in diesem Kontext häufig gestellte Frage ist die nach dem Zusammenhang zwischen den individuell differierenden Gedächtnisleistungen und den Polymorphismen BDNF Val66Met und APOE ε4. Sowohl die Varianten des brain-derived neurotrophic factors (BDNF) als auch die Isoformen des Apolipoproteins E (APOE) werden mit Lern- und Gedächtnisprozessen, aber auch mit mnestischen Defiziten und Amnesie im Rahmen einer dementiellen Erkrankung in Verbindung gebracht. Dementsprechend wurden diese Geno-PhänotypAssoziationen überwiegend bei Probanden bzw. Patienten im höheren Lebensalter geprüft. Inwieweit isolierte und interagierende Effekte der Polymorphismen Val66Met und APOE-ε4 unter Berücksichtigung demographischer Einflussvariablen auch auf die mnestischen Leistungen junger gesunder Probanden vorliegen, soll im Folgenden explorativ untersucht werden. Methoden Im Rahmen des GENES-Projektes (Erforschung der Beziehung ausgewählter Genotypen zu hirnmorphologischen Normabweichungen und deren neuropsychologische Messbarkeit; Psychiatrische und Psychotherapeutische Klinik des Universitätsklinikums Erlangen, Arbeitgsruppe: Prof. Dr. med. J. Kornhuber) wurden 140 gesunde europide Studenten (46 Männer, 94 Frauen) mit einem durchschnittlichen Alter von 24,6 (± 3,3) Jahren und einer mittleren Ausbildungsdauer von 16,9 (± 2,2) Jahren rekrutiert. Nach einer Genotypisierung der funktionalen Varianten von BDNF (Val66Met) und APOE (APOE-ε4) wurden die Teilnehmer einer umfangreichen neuropsychologischen Testung mit dem Inventar zur Gedächtnisdiagnostik (IGD) unterzogen. Jenes erfasst die in den etablierten Modellen beschriebenen zeitlichen und inhaltlichen Dimensionen sowie verarbeitungsspezifischen Prozesse des Gedächtnisses und ermöglicht so eine differenzierte Betrachtung der interessierenden GenoPhänotyp-Assoziationen. -2- Ergebnisse Nach einer deskriptiven Datenanalyse wurden die IGD-Testprofile auf phänotypische Unterschiede geprüft. Auch wurde der Einfluss von Alter, Geschlecht, Bildung und Epistase (BDNF*APOE) faktoriell analysiert. Um den Zusammenhang zwischen den einzelnen Phänotypen untereinander und mit den demographischen Variablen beschreiben zu können, wurden bivariate Korrelationen berechnet. Schließlich wurde mittels linearer Regressionsanalysen der altersabhängige Verlauf der mnestischen Leistungen für BDNF Val66Met und APOE-ε4 prognostiziert. Als primäre Ergebnisse sind festzuhalten: (1) die BDNF Methionin-Träger unterliegen signifikant den Val-Val Trägern bzgl. des Kurzzeit-/Arbeitsgedächtnisses (insbesondere der Zahlenspanne und Exekutiven Kontrolle), des Primings und des Gesamtscores als globales Gedächtnismaß; keinen signifikanten Leistungsunterschied gibt es hinsichtlich des Vorkommens bzw. Fehlens der APOE ε4-Variante. (2) Epistatische Hinweise liegen für die Val-Val Gruppe (schlechtere Ergebnisse im visuellen Arbeits-/Gedächtnis bei gleichzeitigem Vorkommen von ε4) und die Nicht-ε4 Träger (negativer Effekt von Methionin auf Zahlenspanne, Exekutive Kontrolle, Priming, Gesamtscore, Kurzzeit/Arbeitsgedächtnis und verbales Gedächtnis) vor. (3) Bezüglich des Gesamtscores, Kurzzeit-/Arbeitsgedächtnisses und des verbalen Gedächtnisses nähern sich die „überlegenen“ Val-Val Träger den „benachteiligten“ Met-Trägern mit den Jahren an und sind diesen im weiteren Lebensverlauf möglicherweise sogar unterlegen. Ein ähnliches Phänomen ist für die APOE-Varianten zu beobachten. Praktische Schlussfolgerungen Die Ergebnisse lassen eine Assoziation zwischen BDNF Val66Met und den mnestischen Leistungen junger, gesunder Probanden vermuten. Die funktionalen Varianten des APOE hingegen scheinen nur im Falle des gemeinsamen Vorkommens mit BDNFMet eine signifikante Rolle zu spielen. Beide Polymorphismen modulieren den altersbedingten Verlauf einzelner Gedächtnisfunktionen. -3- Summary Background and objectives Since the sequencing of the human genome, researchers have attempted to identify the genes expressed in the central nervous system that can be proven to influence human cognition. A question often posed in this context refers to the correlation between the memory performance that varies individually and the BDNF Val66Met and APOE ε4 polymorphisms. Both the variants of the brain-derived neurotrophic factors (BDNF) and the isoforms of apolipoprotein E (APOE) are believed to be associated with learning and memory processes, as well as with memory deficits and amnesia related to dementia. Thus, these geno-phenotype associations have been primarily tested on elderly subjects or patients. This study aims to explore the extent to which isolated and interacting effects of the polymorphisms Val66met and APOE ε4 on the memory performance of young, healthy adults exist, while taking demographic influence variables into account. Method As part of the GENES Project (research on the relationship of selected genotypes and morphologic brain deviation and their neuropsychological measurability; Erlangen University Hospital Department of Psychiatry and Psychotherapy; group headed by Prof. J. Kornhuber, MD), 140 healthy Caucasian students (46 men, 94 women) with an average age of 24.6 (± 3.3) years and an average of 16.9 (± 2.2) years of education were recruited. After genotyping the functional variants of the BDNF (Val66Met) and APOE (APOE ε4), participants underwent comprehensive neuropsychological testing with the inventory for memory diagnostics (IMD). This inventory records the temporal and content-related dimensions as well as memory processes specific to information processing and thus allowes a differentiated examination of the geno-phenotype associations of interest. Results After descriptive data analysis, the IMD test profiles were examined for phenotypical differences. In addition, factor analysis was used to determine the impact of age, sex, education and epistasis (BDNF*APOE). Bivariant correlations were calculated in order to describe the interrelation between individual phenotypes and the demographic -4- variables. Finally, the age-dependent course of memory performance for BDNF Val66Met and APOE ε4 was predicted using linear regression analyses. The primary results are as follows: (1) The BDNF methionine carriers (Met carriers) are significantly inferior to Val-Val carriers with respect to short term memory/working memory (particularly digit span and executive control), as well as priming and overall score as a global measure of memory; there was no significant performance difference regarding the presence or absence of the APOE ε4 variant. (2) There are indications of epistasis for the Val-Val group (worse results for the visual working memory with the simultaneous occurrence of ε4) and the non-ε4 carriers (negative effect of methionine on the digit span, executive control, priming, overall score, short term memory/working memory and verbal memory). (3) The “disadvantaged” Met carriers seem to approach the “advantaged“ Val-Val carriers in terms of the overall score, short term memory/working memory and verbal memory over the years and over time possibly might be at an advantage over these carriers later on in life. A similar phenomenon can be observed for the APOE variants. Practical conclusions The results suggest an association between BDNF Val66Met and the memory performance of young, healthy participants. The functional variants of APOE, however, only seem to play a significant role in the case of simultaneous occurrence with BDNFMet. Both polymorphisms modulate the age-related course of individual memory functions. -5- 2 Gedächtnis, BDNF und APOE Seit der Sequenzierung des menschlichen Genoms im Jahre 2003 versuchen Forscher unter den im zentralen Nervensystem (ZNS) exprimierten Genen diejenigen zu identifizieren, die nachweislich die Kognition des Menschen beeinflussen. Dies ist ein spannendes, aber auch komplexes Unterfangen, denn von den etwa 35 000 Genen sind wahrscheinlich mehr als 20 000 essentiell an der Entwicklung, Plastizität und Aufrechterhaltung des ZNS beteiligt. Viele davon spielen auch in anderen Organsystemen eine wichtige Rolle (Goldberg & Weinberger, 2004). Außerdem ist möglicherweise nur ein kleiner Anteil der ca. sechs Millionen, für die genetische Variation in der Weltbevölkerung verantwortlichen single nucleotide polymorphism (SNP) tatsächlich funktional, was heisst, dass vielleicht weniger als fünf Einzelbasenaustausche pro Gen mit einer Modifikation in der Genexpression oder Veränderung auf Proteinebene in Zusammenhang gebracht werden können (a.a.O.). Wieviele dieser zahlreichen Genvariationen letztendlich die kognitiven Prozesse messbar beeinflussen, ist noch nicht abzuschätzen. In Assoziationsstudien wird untersucht, wie stark die Varianten eines spezifischen Kandidatengens mit den Phänotypen zusammenhängen. Falls eine bestimmte Sequenzvariante häufig in einer Population mit einem charakteristischen kategorialen Phänotyp (z.B. klinische Diagnose) vorkommt oder mit den Varianten eines qualitativen Phänotyps (z.B. psychometrisches Profil) statistisch korreliert, dann wird dieses Allel als mit dem Phänotyp assoziiert gesehen (Plomin et al., 1994). Eine in der Literatur häufig untersuchte Geno-Phänotyp-Assoziation ist die Beeinflussung der Mnestik durch die Polymorphismen der Gene HUM-BDNF und APOE. Sowohl die Varianten des brain-derived neurotrophic factors (BDNF) als auch die Isoformen des Apolipoproteins E (APOE) werden mit Lern- und Gedächtnisprozessen, aber auch mit mnestischen Defiziten und Amnesie im Rahmen einer dementiellen Erkrankung in Verbindung gebracht. Dementsprechend wurden diese Geno-Phänotyp-Assoziationen überwiegend bei Probanden bzw. Patienten im höheren Lebensalter geprüft. Inwieweit isolierte und interagierende Effekte der Polymorphismen Val66Met und APOE-ε4 unter Berücksichtigung demographischer Einflussvariablen breits auf die mnestischen Leistungen junger gesunder Probanden vorliegen, soll im Folgenden explorativ untersucht werden. -6- Zunächst werden die theoretischen Grundlagen des Gedächtnisses mit den Taxonomien der zeitlichen und inhaltlichen Dimensionen dargestellt (Kapitel 2.1.1, S. 6-11), die Verarbeitungsstufen mnestischer Prozesse veranschaulicht (Kapitel 2.1.1.3, S.11-13), die neuroanatomischen Korrelate des Gedächtnisses konkretisiert (Kapitel 2.1.2, S. 13-15) und die allgemeinen Richtlinien zur Diagnostik von Gedächtnisstörungen angeführt (Kapitel 2.1.3, S.15-17). Anschließend werden in Kapitel 2.2 und 2.3 der brain-derived neurotrophic factor (BDNF, S. 17-23) und das Apolipoprotein E (ApoE; S. 23-28) jeweils in ihrer Funktion beschrieben, ihre kognitiv relevanten Polymorphismen Val66Met und ε4 aufgezeigt und die daraus resultierenden neurophysiologischen, cerebral-morphologischen und klinischen Wechselbeziehungen überblicksartig zusammengefasst. Basierend auf diesen Erkenntnissen wird in Kapitel 2.4 (S.28f) die Zielsetzung der vorliegenden Arbeit definiert. 2.1 Gedächtnis Unter Lernen und Gedächtnis sind allgemein die Prozesse des Aneignens, Behaltens und Erinnerns von Informationen zu verstehen. Dabei wird das Gedächtnis als lernabhängige Speicherung ontogenetisch erworbener Informationen gesehen, die sich in phylogenetischen, neuronalen Strukturen selektiv artgemäß einfügt und zu beliebigen Zeitpunkten abgerufen werden kann (Sinz, 1979). Anders ausgedrückt: beim Gedächtnis handelt es sich um konditionierte Veränderungen der Übertragungseigenschaften der neuronalen Strukturen, welche Lernen im Sinne eines situationsangepassten Verhaltens ermöglichen. 2.1.1 Taxonomien des Gedächtnisses Moderneren Theorien zufolge lässt sich das Gedächtnis in zeitliche und inhaltliche Dimensionen unterteilen. Eine weitere Beschreibung kann über Verarbeitungsprozesse, die an den mnestischen Leistungen beteiligt sind, vorgenommen werden. 2.1.1.1 Zeitliche Dimensionen des Gedächtnisses Zur chronologischen Klassifikation wird häufig das modifizierte Modell von Atkinson & Shiffrin (1968) herangezogen, in dem das Gedächtnis in ein Ultrakurzzeit-, Kurzzeitund ein Langzeitgedächtnis untergliedert ist (vgl. Abbildung 1, S.7). -7- Umweltreiz e Ultrakurzzeitgedäch tn is (sensorischer Register) visuell auditiv olfaktorisch gustatorisch haptisch Kurz zeit-Gedächtnis Arbeitsgedächtnis L angzeitgedächtnis Ab ruf, Informationswiedergabe Abbildung 1: vereinfachte Darstellung der zeitlichen Einteilung des Gedächtnisses und der beteiligten Speicher (modifiziert nach Baller et al., 2006, S.7) Die Informationsaufnahme erfolgt über die Sinnesorgane und wird als flüchtige Wahrnehmungserfahrung für wenige Millisekunden im Ultrakurzzeitgedächtnis (auch sensorisches Gedächtnis genannt) gehalten und verarbeitet. Hier findet ein komplexer Selektionsprozess statt, der unbewusst abläuft, und in dem nur die als relevant bewerteten Reize in das Kurzzeitgedächtnis weitergeleitet werden. Im Kurzzeitgedächtnis, das nach der klassischen Arbeit von Miller (1956) in seiner Aufnahmekapazität auf 7 ± 2 Einheiten begrenzt ist, können Informationen für einige Sekunden bis zu einer Minute bewusst gehalten und abgerufen werden (vgl. Merkspanne). Finden weiterverarbeitende Prozesse statt (elaboriertes Memorieren wie etwa strukturieren oder an bekannte Speicherinhalte anknüpfen), werden die Informationen in das Langzeitgedächtnis übertragen, in welchem sie Minuten bis zu Jahrzehnten gespeichert sind. Das Arbeitsgedächtnis stellt nach einer Modellvorstellung von Baddeley & Hitch (1974) die Schnittstelle zwischen dem Kurz- und dem Langzeitgedächtnis dar, und setzt sich aus einer zentralen Kontrollinstanz (Zentrale Exekutive) und spezialisierten Subsystemen zusammen. In jenen Subsystemen werden Neuinformationen aus dem Kurzzeitgedächtnis bereit gehalten und aktiv verarbeitet, sowie bereits gespeicherte Inhalte aus dem Langzeitgedächtnis zum Abruf zur Verfügung gestellt. Die zwei bislang am besten belegten Subsysteme sind die phonologische Schleife und der visuell-räumliche Notizblock, wobei in ersterer verbale bzw. auditive Informationen und im zweiten visuell-räumliche Informationen verarbeitet werden. Die Zentrale Exekutive kontrolliert -8- die Aufmerksamkeit, die für die genannten Subprozesse notwendig ist, und steuert die Übertragung der Informationen in das Langzeitgedächtnis. In einer Erweiterung des Arbeitsgedächtnis-Modells beschreibt Baddeley (2000) die Funktion eines episodischen Zwischenspeichers, in dem neue Informationen kontextuell in bereits bekannte Inhalte integriert und zu einer kurzfristigen einheitlichen Episode miteinander verknüpft werden. Das Langzeitgedächtnis hat im Vergleich zum Kurzzeitgedächtnis eine weitgehend unbegrenzte Aufnahmekapazität, und seine Inhalte sind normalerweise zeitlich stabil. Es werden vorwiegend solche Informationen darin fixiert, die entweder einen besonderen personalen Bezug aufweisen, oder denen ein hohes Maß an Aufmerksamkeit zuteil wird (z.B. durch bewusstes, willentliches Lernen). Der Übertragungsvorgang vom Kurz- über das Arbeits- bis in das Langzeitgedächtnis und die Bildung einer beständigen Gedächtnisspur wird als Konsolidierung bezeichnet (Hartje & Poeck, 1997). Mit Enkodierung ist die Übersetzung eintreffender Reize in einen neuralen Code, den das Gehirn weiterverarbeiten kann, gemeint (Zimbardo, 1995). Unter Abruf (retrieval) ist das Wiederauffinden der gespeicherten Information zu einem späteren Zeitpunkt zu verstehen (a.a.O.). Für die Diagnostik (s. Kapitel 2.1.3, S.15ff) und Behandlung von Gedächtnisstörungen ist eine weitere chronologische Einteilung relevant, die sich auf den Schädigungsrespektive Erkrankungszeitpunkt bezieht (Baller et al., 2006): Informationen, die vor einem kritischen Ereignis (z.B. einem psychischen Trauma) gespeichert wurden, werden als Altgedächtnis bezeichnet. Dementsprechend bezieht sich das Neugedächtnis auf Konsolidierungsprozesse, die nach einem kritischen Ereignis vollzogen wurden. Ist der Abruf bereits gelernter Informationen beeinträchtigt, spricht man von einer retrograden Amnesie; die Unfähigkeit neue Inhalte zu lernen, wird als anterograde Amnesie bezeichnet. 2.1.1.2 Inhaltliche Dimensionen des Gedächtnisses In der Taxonomie nach Tulving (1995; Tulving & Schacter, 1990) werden vier hierarchisch angeordnete Hauptsysteme postuliert, die sich nach den Inhalten der gespeicherten Informationen unterscheiden: das episodische Gedächtnis, das Wissens- und Faktensystem, das prozedurale Gedächtnis und das Priming-System (s. Abbildung 2, -9- S.9). Die Informationsverarbeitung zwischen dem Einspeichern und dem Abrufen erfolgt nach dem SPI-Modell (a.a.O.), wobei S für „serial“, P für „parallel“ und I für „independent“ steht. Demnach werden Informationen seriell enkodiert (d.h. die Konsolidierung höherer Systeme basiert auf dem Output niedrigerer Systeme), im Weiteren parallel gespeichert und später speicherunabhängig abgerufen. GEDÄCHTNISSYSTEME episodisches Gedächtnis WissensSystem perzeptuelles Gedächtnis Priming („Bahnung“) prozedurales Gedächtnis ? ? mein erstes Auto ? ? N = Stickstoff, letzte Woche im Zoo Venedig ist eine Stadt in Italien Ein Strauß !!! Abbildung 2: inhaltliche Unterteilungen des Langzeitgedächtnisses (modifiziert nach Pritzel et al., 2003) Das oberste und phylogenetisch jüngste hierarchische System stellt das episodische Gedächtnis dar, dessen Inhalte mit dem zeitlichen und räumlichen Kontext der Lernoder Aufnahmesituation assoziiert sind. Dazu gehören einerseits individuelle Erfahrungen der eigenen Lebensgeschichte (autobiographische Ereignisse), die ein Gefühl der Identität vermitteln und meist emotional gefärbt sind. Bestimmte Vorlieben oder Abneigungen, die durch Lernprozesse entstanden sind, können dadurch ebenso erklärt werden wie Entscheidungen und Pläne für die Zukunft, welche vor dem Hintergrund der persönlichen emotionalen und rationalen Erfahrungen gefasst werden. Zum episodischen Gedächtnis gehören andererseits auch nicht-personenbezogene Inhalte, die in einem bestimmten räumlich-zeitlichen Bezugsrahmen enkodiert werden, wie etwa das Erlernen von Wortlisten. Auf der nächsten Hierarchieebene findet sich das semantische Gedächtnis, das häufig auch als „Wissenssystem“ bezeichnet wird. Es beinhaltet Fakten, die kontextfrei gespeichert und abgerufen werden wie beispielsweise schulisches Wissen oder Sprachkenntnisse. Ebenfalls zum semantischen Gedächtnis gehören autobiographische Gegebenheiten, die ohne zeitlichen und räumlichen Bezug enkodiert wurden (z.B. - 10 - das eigene Geburtsdatum). Die Annahme, dass semantische Informationen zunächst episodisch gespeichert und erst dann, wenn die kontextuelle Information verloren geht, in das semantische Gedächtnis übernommen werden (Cermak, 1984), ist umstritten. Eher ist nach Tulving & Markowitsch (1989) davon auszugehen, dass das episodische Gedächtnis auf semantische Gedächtnisinhalte angewiesen ist. Unter den auf der nächsten Ebene zu findenden Primingleistungen ist das Phänomen zu verstehen, dass eine Stimulusexposition die nachfolgende Verarbeitung eben dieser Reize (oder Teilen davon) beeinflusst. So verbessert Priming das Erkennen von Objekten, denen man zuvor unbewusst begegnet ist, selbst wenn sie fragmentiert dargeboten werden. Beim Priming sind zwei Formen zu unterscheiden: das perzeptuelle Priming, bei dem sich die Fähigkeit zur Objektidentifikation erhöht, wenn das Objekt und der vorherige Reiz identisch sind; und das konzeptuelle Priming, bei dem der vorausgehende Stimulus (z.B. „Rose“) dem gleichen Konzept (z.B. „Blumen“) des zu identifizierenden Objekts (z.B. „Tulpe“) zugehörig sein muss (Markowitsch, 2002). Auf der untersten Hierarchieebene ist das prozedurale Gedächtnis angesiedelt. Dieses gilt phylogenetisch wie ontogenetisch als das älteste Gedächtnissystem und beinhaltet motorische Fertigkeiten und kombinierte sensorisch-motorische (nicht-kognitive) Fähigkeiten wie z.B. Fahrradfahren oder das Zubinden von Schnürsenkeln. Charakteristisch für diese Prozesse sind hochgradig automatisierte Handlungsabläufe, die keiner bewussten Verarbeitung mehr bedürfen. In einer Erweiterung des SPI-Modells (vgl. S. 9) führen Tulving und Markowitsch (1998) das perzeptuelle Gedächtnis ein, das hierarchisch zwischen dem Wissenssystem und dem Priming steht und dem Erkennen von Gegenständen oder anderen Objekten dient. Basierend auf Bekanntheit oder Familiarität ermöglicht es das Beurteilen der Vertrautheit, ohne dass hierfür eine semantische Einordnung oder ein Benennen notwendig ist. Eine weitere alltagsrelevante Gedächtnisfunktion stellt das prospektive Gedächtnis dar, das Erinnerungen an zukünftige, intendierte Handlungen umfasst. Sollen jene durchgeführt werden, müssen „prospektive“ und „retrospektive“ Komponenten der Absicht realisiert werden (McDaniel & Einstein, 1992): das Erinnern an den situativen und/oder zeitlichen Bezug, in der die beabsichtigte Handlung vollzogen werden soll (prospektive Komponente); und die Erinnerung, welche Handlung in diesem Kontext initiiert werden soll (retrospektive Komponente). Aufgrund dieser kontextuellen Assoziationen ist das - 11 - prospektive Gedächtnis modelltheoretisch dem episodischen Gedächtnis zuzuordnen (Roediger, 1996). Die genannten inhaltlichen Dimensionen des Gedächtnisses fasst Squire (1987) zusammen und formuliert folgende dichotome Taxonomie: alle Informationen, die bewusst abgerufen werden, sprich die semantischen und episodischen Inhalte, gehören dem deklarativen Gedächtnis an; alle Informationen, die ohne bewussten Abruf das Erleben und Verhalten beeinflussen, wie das prozedurale Lernen, das Priming oder auch Konditionierungen, zählen zum nicht-deklarativen Gedächtnis. Tulving (1995) ergänzt diesen Ansatz um zusätzliche Terminologien, die sich auf den Bewusstseinsgrad beim Enkodieren und Abrufen beziehen. So sind beim Einspeichern inzidentelle (beiläufige) von intentionalen (bewussten) Prozessen zu unterscheiden. Das heißt, der Abruf kann ohne Bewusstmachen des eigentlichen Inhaltes und seiner Bedeutung sprich implizit erfolgen, oder explizit mit dem raum-zeitlichen Bezug zum Erwerb der Information. 2.1.1.3 Stufen der Verarbeitung von Gedächtnisinhalten Gedächtnisprozesse umfassen die Aufnahme und kognitive Manipulation von Informationen, die Einspeicherung und den Abruf aus dem Kurz- oder Langzeitspeicher (s. auch Kapitel 2.1.1.1, S. 6ff). Ankommende Informationen werden über die Sinnesorgane an das UltrakurzzeitGedächtnis, auch sensorisches Register genannt, weitergeleitet, das seinerseits modalitätsspezifisch (auditorisch, visuell, haptisch, gustatorisch, olfaktorisch) arbeitet (Atkinson & Shiffrin, 1968). Nach einem ersten Bewertungsprozess werden die relevanten Stimuli selektiert und an das Kurzzeit-Gedächtnis weitergeleitet (ebd.). Durch Verarbeitungsprozesse wie Wiederholung oder Chunking bleiben die Informationen kurzfristig verfügbar (Zimbardo, 1995). Sollen sie dauerhaft in das LangzeitGedächtnis übernommen werden, wird eine Konsolidierungs-Phase zwischengeschaltet (Baller et al., 2006). Diese erfordert eine tiefergehende Verarbeitung (elaboriertes Memorieren), welche zu einer Integration der neuen Information in das bestehende neuronale Netzwerk führt. Auf zellulärer Ebene finden sich eine verstärkte Verknüpfung von Synapsen und das Ausbilden von neuronalen Netzwerken (Lehrner & BrennerWalter, 2006). Die Dauer dieser Konsolidierungs-Phase ist umstritten. In der Literatur - 12 - finden sich Angaben von wenigen Minuten bis Stunden, aber auch von Zeitrahmen, die sich über Tage, Wochen und Jahre erstrecken (Baller et al., 2006). Der Abruf einer Information erfolgt entweder direkt aus dem Kurzzeit- bzw. dem Arbeitsgedächtnis, wo Informationen vorübergehend bereitgehalten werden, oder aus dem Langzeitgedächtnis. In letzterem Fall werden die Inhalte zunächst in den Arbeitsspeicher zurückgeführt und dort verfügbar gemacht. Jeder Abruf aus dem Langzeitgedächtnis bedingt ein erneutes Einspeichern der Information (Re-Enkodierung) und damit eine Verfestigung und Veränderung der Gedächtnisspur (Buckner et al., 2001). äußerer Reiz sensori sche s Register Speicherung: direkte Repräsentation Kapazität: groß Dauer: kurz (visuell 0,5s, auditiv bis zu 2s) Verlust aufgrund von: Verstreichen der Zeit, Verdrängung durch neues Material [Herausfiltern von Merkmalen] [Mustererkennung] [Aufmerksamkeit] Kurzzeitgedächtnis Arbeitsgedächtni s bewusste Verarbeitungsprozesse Chunking Langzeitgedächtnis [erhaltendes Wiederholen] [elaborierendes Wiederholen] Reaktion Speicherung: akustisch, visuell, semantisch Kapazität: gering (7±2 Chunks), Erweiterung nicht möglich, aber Vergrößerung des Umfangs der Chunks Dauer: vorübergehend (bis zu 20s) ohne Wiederholen Verlust aufgrund von: Interferenz, fehlendes Wiederholen, Verstreichen der Zeit Wissensstrukturen prozedurale Fertigkeiten deklarativ (Fakten) episodi sch innere Reize (Gedanken) semantisch Speicherung: semantische Netzwerke (organisiert, bedeutungstragend) Kapazität: theoretisch unbegrenzt Dauer: möglicherweise die gesamte Lebensspanne Verlust aufgrund von: unangemessener Enkodierung, Verstreichen der Zeit, Interferenz, fehlende Konsolidierung motiviertes Vergessen, Misslingen des Abrufs Abbildung 3: Flussdiagramm zur zeitlichen Einteilung des Gedächtnisses mit beteiligten Speichern und Prozessen der Informationsverarbeitung (nach Zimbardo, 1995) Aus Abbildung 3 ist ersichtlich, dass das Gedächtnis als ein dynamischer Prozess mit plastischen und konstruktiven Anteilen zu verstehen ist. Gedächtnisinhalte können aber auch unzureichend abgespeichert oder vergessen werden, können variabel verfügbar sein, der falschen Quelle zugeordnet werden, erfunden werden, umgeformt werden und unterliegen Veränderungen in der Zeit. Schacter (2005) hat diese Phänomene mnestischer Fehlleistungen systematisch erfasst (s. Tabelle 1, S. 13). - 13 - Phänomen Beschreibung Beispiel Transienz verringerte Verfügbarkeit von Gedächtnisinhalten über die Zeit einfaches Vergessen von länger zurückliegenden Ereignissen Geistesabwesenheit Aufmerksamkeitsstörungen führen Vergessen, wo die Autoschlüssel abgelegt wurden zu Gedächtnisschwäche Blockierung Information ist vorhanden, aber temporär nicht verfügbar „Der Name liegt mir auf der Zunge“ Fehlattribuierung Erinnerungen werden einer falschen Quelle zugeordnet Verwechseln eines Traums mit einer Erinnerung Suggestibilität Erinnerungen an Ereignisse, die nie passiert sind Suggestivfragen führen zu falschen Erinnerungen Verzerrung aktuelles Wissen verzerrt das Gedächtnis für Ereignisse aus der Vergangenheit Zeugenaussagen nach Bekanntwerden des Tathergangs Persistenz Erinnerungen an Ereignisse, die nicht vergessen werden können traumatische Kriegserinnerungen Tabelle 1: Übersicht über die verschiedenen Fehlleistungen des Gedächtnisses (nach Schacter, 2005) Ergänzend zur Auflistung der mnestischen Fehlleistungen nach Schacter (2005) ist die Interferenz hinzuzufügen, die sowohl das erstmalige Erlernen von Informationen, als auch das Behalten neuen Materials beeinflusst. Dabei ist die proaktive Interferenz (früher Erlerntes stört später zu Lernendes) von der retroaktiven (später Erlerntes stört früher Gelerntes) zu unterscheiden. Nach Zimbardo (1995) lautet die offensichtlichste Prognose der Interferenz-Theorie, dass eine Information, die nicht durch neues Material gestört wird, am besten erinnert wird. Weiterhin scheint das Kurzzeitgedächtnis am anfälligsten gegenüber Interferenzen zu sein. Hingegen sind die im Langzeitgedächtnis konsolidierten Informationen retroaktiven Interferenzen am wenigsten unterworfen. 2.1.2 Neuroanatomie des Gedächtnisses Für die Übertragung von Informationen aus dem Kurzzeit- in das Langzeitgedächtnis sind Strukturen des limbischen Systems mit zwei unterschiedlichen Schaltkreisen von großer Bedeutung: zum einen der Papez’ sche Schaltkreis, der aus limbischen und diencephalen Strukturen besteht wie der hippocampalen Formation, dem Fornix der Mamillarkörper, den anterioren Kernen des Thalamus, den cingulären Gyrus sowie den mamillothalamischen Trakt und den thalamocorticaken Pedunkeln als verbindende - 14 - Faserstrukturen (Lehrner & Brenner-Walter, 2006); zum anderen ist der basolaterallimbische Schaltkreis wichtig, der im Wesentlichen die Amygdala, den mediodorsalen Kern des Thalamus, die Area subcallosa des basalen Vorderhirns und Faserverbindungen umfasst (Baller et al., 2006). Der Papez’sche Schaltkreis ist für die Einspeicherung (teils auch für den Abruf) episodischer und semantischer Inhalte zuständig, der basolateral-limbische Schaltkreis für emotional bedeutsame Inhalte (ebd.). Darüber hinaus sind weitere Hirnregionen an Enkodierungsprozessen beteiligt wie beispielsweise der präfrontale Cortex, der das zu lernende Material strukturiert und organisiert (z.B. Fletcher & Henson, 2001). Dabei wird der dorsolaterale präfrontale Cortex eng mit Arbeitsgedächtnisleistungen assoziiert, die ebenfalls bei der Auswahl und Einspeicherung von Informationen eine große Rolle spielen (Markowitsch, 2000). Die Verarbeitungsstufen einschließlich der Enkodierungsprozesse des perzeptuellen Gedächtnisses und der Primingleistungen sind in den uni- und polymodalen Assoziationscortices lokalisiert (Baller et al., 2006). Für das prozedurale Gedächtnis sind vorwiegend die Basalganglien, das Cerebellum und die prämotorische Region des cerebralen Cortex wichtig, für das Priming die neocorticalen Assoziationsgebiete (Hartje & Poeck, 1997). Uneinheitlich sind bislang die Befunde zu den an der Konsolidierung beteiligten Hirnarealen. Nach Markowitsch (2000) gilt es als gesichert, dass ebenfalls limbische Strukturen, insbesondere die hippocampale Formation und die Amygdala (letztere vorrangig für Inhalte mit emotionaler Konnotation) bei der Konsolidierung mitwirken. Bei der Langzeitspeicherung geht man davon aus, dass die Informationen in weiten Teilen der cerebralen Assoziationscortices repräsentiert sind (Baller et al., 2006). Für den Abruf von Gedächtnisinhalten werden bezüglich episodischer und semantischer Informationen unterschiedliche neuronale Korrelate angenommen. So sind nach dem H(emispheric)E(ncoding)R(etrieval)A(symmetry)-Modell von Tulving et al. (1994) für episodische Inhalte eher temporo-frontale Regionen der rechten Hemisphäre relevant, für semantische Inhalte mehr die temporo-frontalen Regionen der linken Hirnhälfte. Allerdings hängt die funktionale Lateralisierung des präfrontalen Cortex auch von weiteren Faktoren ab wie zum Beispiel dem Grad der Aufmerksamkeit oder die Verbalisierbarkeit (Baller et al., 2006). Wie Studien mit bildgebenden Verfahren zeigen, sind beim Abruf episodischer Gedächtnisinhalte zudem limbische Strukturen mit einer Dominanz der rechten Hemisphäre beteiligt (Brand & Markowitsch, 2003). - 15 - 2.1.3 Diagnostik von Gedächtnisstörungen Je nach Ort, Ausmaß und Ursache der Schädigung gedächtnisrelevanter Hirnstrukturen (s. Kapitel 2.1.2, S.13fff) variieren Gedächtnisstörungen hinsichtlich ihres Musters, Schweregrades und Verlaufes (Schuri, 1993). Die Spannbreite reicht von mnestischen Beeinträchtigungen im Rahmen eines allgemeinen und schleichend progredienten intellektuellen Leistungsverlustes (vgl. Demenzen), über umgrenzte verbale und/oder figurale Neu- bzw. Altgedächtnisstörungen infolge fokaler Hirnschädigungen bis hin zu psychisch bedingten Erinnerungslücken im Rahmen der funktionellen oder dissoziativen Amnesie (Leitlinien der Deutschen Gesellschaft für Neurologie, 2008). Auch können verschiedene internistische und psychiatrische Krankheiten mit mnestischen Defiziten einhergehen. Eine detaillierte Aufzählung aller mit Gedächtnisstörungen assoziierter Erkrankungen würde allerdings den Rahmen dieser Arbeit sprengen, weshalb auf die einschlägige Literatur verwiesen wird (siehe z. B. Markowitsch, 2002). Wegen der Vielfalt an Gedächtnisstörungen und ihres Konfundierens mit anderen kognitiven Defiziten wie etwa den Aufmerksamkeitsleistungen, sind für die Befundung differenzialdiagnostische Abgrenzungen notwendig. Screening-Verfahren reichen hierfür allerdings nicht aus. Vielmehr ist der Einsatz spezifischer und sensibler Testverfahren unabdingbar. Nach Schuri (1993) muss eine differenzierte Gedächtnisdiagnostik sowohl Prozesse der Informationsaufnahme bzw. Enkodierung (Einprägen, Lernen), des Behaltens neuer Informationen (kurz-, längerfristig) als auch des Abrufs (retrieval) neuer und alter Gedächtnisinhalte in den Modalitäten „freier Abruf“, „Abruf mit Hilfen“ und „Wiedererkennen“ berücksichtigen. Für ein besseres qualitatives Verständnis der Gedächtnisstörung ist zudem zu beachten, inwieweit das Lernen eines Materials die anschließende Aufnahme anderer Informationen stört (proaktive Interferenz) bzw. ob durch erneutes Lernen das Speichern des zuvor Aufgenommenen beeinträchtigt wird (retroaktive Interferenz), und wie die Lernkurve verläuft. Als Material sollten sowohl verbale als auch figurale Stimuli Verwendung finden. Berücksichtigt werden sollten außerdem neben dem bewussten expliziten Gedächtnis auch unbewusste, implizite Gedächtnisleistungen. Wo immer möglich, sollten zusätzlich zur „reinen“ Gedächtnisleistung auch die Vorgehensweise der Patienten und die spontan eingesetzten internen und externen Gedächtnishilfen Beachtung finden (Thöne-Otto & Markowitsch, 2004). - 16 - Nach den Leitlinien zur Diagnostik und Therapie in der Neurologie (2008) sind zur eingehenden neuropsychologischen Diagnostik die in Tabelle 2 abgebildeten Gedächtnisteilfunktionen zu untersuchen. unverzichtbar (Empfehlungsstärke A) Teilfunktion Untersucher Setting gemessene Leistung Orientierung Arzt bzw. Psychologe Anamnesegespräch Angaben zur örtlich-geographischen, zeitlich-kalendarischen, situativen und personalen Orientierung Kurzzeit- und Psychologe Arbeitsgedächtnis Testung kurzfristiges Halten und mentales Manipulieren verbaler und figuraler Informationen (z.B. Zahlenspanne) Neugedächtnis Psychologe Testung unmittelbare Reproduktion expliziter verbaler und figuraler Informationen, die im Umfang die Aufnahmekapazität des Kurzzeitgedächtnisses übersteigen (z.B. Wiedergabe von Texten); verzögerte Reproduktion des Gelernten nach 20 bis 30 Minuten; Durchführung eines Lernparadigmas (z.B. Lernzuwachs durch Wiederholung); Überprüfung unterschiedlicher Abrufmodalitäten (freier Abruf, Abruf mit Hinweisen, Wiedererkennen) Altgedächtnis Arzt bzw. Psychologe Anamnesegespräch Wiedergabe von autobiographischen und öffentlichen semantischen und episodischen Informationen aus verschiedenen Lebensepochen; subjektiv relevantes domänen-spezifisches Wissen (z.B. berufliche Fachkenntnisse) ergänzend (Empfehlungsstärke A) Teilfunktion Untersucher Setting gemessene Leistung prospektives Gedächtnis keine Angabe keine Angabe zeit- oder situationsgerechte Erinnerung an zu erledigende Aufgaben inzidentelles Lernen keine Angabe keine Angabe Abfrage von Informationen, zu denen es vorher keine Lerninstruktion gegeben hat nichtdeklaratives Gedächtnis keine Angabe keine Angabe keine Angabe Tabelle 2: Empfehlungen zur neuropsychologischen Diagnostik von Gedächtnisstörungen (modifiziert nach Leitlinien der Deutschen Gesellschaft für Neurologie, 2008) Um die erhobenen Gedächtnisleistungen angemessen interpretieren zu können, sind darüber hinaus folgende Aspekte einzubeziehen (Leitlinien der Deutschen Gesellschaft für Neurologie, 2008): (1) relevante weitere kognitive Defizite wie z. B. Wahrnehmung, Sprache, Aufmerksamkeit, Exekutivfunktionen, (2) affektive oder Verhaltensstörungen - 17 - wie Depression, Antriebsminderung, perseveratorisches Verhalten, Konfabulationen, (3) Einsichtsfähigkeit in die Störung durch den Patienten (awareness) und seine subjektive Prioritätensetzung, (4) alltagspraktische Anforderungen und Leistungen des Patienten zur Abschätzung der funktionellen Relevanz der Störung, (5) vorhandene Ressourcen, sozialer Hintergrund (berufliche Situation, sozialrechtlicher Status, familiäre Einbettung) und (6) bisher eingesetzte Kompensationsstrategien und die Erfahrungen damit. Zur Messung der verschiedenen Gedächtnisaspekte steht eine Vielzahl an Untersuchungsverfahren zur Verfügung, so dass an dieser Stelle auf explizite Testvorschläge verzichtet wird. Einen Überblick über die im deutschen Sprachraum erhältlichen Instrumente geben Schellig et al. (2008). Die Auswahl der Testverfahren orientiert sich allgemein an den Gütekriterien und an einer hinreichend vorhandenen Normstichprobe im jeweiligen Sprachraum (Leitlinien der Deutschen Gesellschaft für Neurologie, 2008). Für eine systematische Verhaltensbeobachtung und eine qualitative Abschätzung der Leistung können auch experimentelle oder vorläufige Testversionen eingesetzt werden. Ergänzend kann mit Fragebögen die funktionelle Relevanz der Gedächtnisstörung im Alltag erfasst werden. 2.2 Brain-derived neurotrophic factor (BDNF) Der brain-derived neurotrophic factor (BDNF) gehört zur Familie der PolypeptidWachstums-Faktoren (Neurotrophine) bei Vertebraten, zu der auch der Nervenwachstumsfaktor (nerve growth factor, NGF), das Neurotrophin-3 (NT-3) und das Neurotrophin-4 (NT-4) zählen (Bath & Lee, 2006). Neurotrophine stimulieren die Proliferation, die Kollateralisierung, das Axonwachstum und die dendritische Arborisation der Neurone, wodurch ihr Überleben gesichert wird (Barde et al., 1982, Leibrock et al., 1989). Außerdem greifen sie in die verschiedenen Synthesevorgänge von Peptiden, Transmittern (Green & Tischler, 1976) und kalziumbindenden Proteinen ein (Cheng & Mattson, 1994). Ursprünglich wurden Neurotrophine als Signalmoleküle identifiziert, die kritisch für die embryonale Entwicklung des Nervensystems sind (Bath & Lee, 2006). Aufgrund ihres evolutionär gesehenen jungen Alters scheinen sie insbesondere für die Reifung und das Funktionieren eines komplexeren Nervensystems notwendig zu sein (Beck et al., - 18 - 2004, Chao, 2000). Aus Studien mit transgenen knockout-Tieren ist zudem bekannt, dass Neurotrophine für die Effektivität zentralnervöser Prozesse im postpartalen und adulten Gehirn entscheidend sind (Bath & Lee, 2006). BDNF ist v.a. im Cortex, Hippocampus, Cerebellum, Bulbus olfactorius und in den limbischen Strukturen vorzufinden (Huang & Reichardt, 2001). Dort gewährleistet er das Überleben verschiedenster Neurone wie etwa der dopaminergen Neuronen des Mesencephalons (Knüsel et al., 1991), der cholinergen Neurone des Septums (Nonner et al., 1996) und der GABAergen Neurone des Striatums (Ventimiglia et al., 1995). Wie effektiv Neurotrophine sind, hängt von ihrer Verfügbarkeit, adäquaten Speicherung und Ausschüttung wie auch ihrer Bindungsaffinität an transmembranen Rezeptoren ab (Bath & Lee, 2006). Alle neurotrophen Faktoren werden von einem Vorläuferprotein (bekannt als ProNeurotrophin) synthetisiert, das mit hoher Affinität an den p75-Neurotrophin-Rezeptor (p75NT-Rezeptor) bindet (Teng et al., 2005). Die pro-Region des Vorläuferproteins für BDNF (proBDNF) enthält eine Differenzierungssequenz und ist für die zielgenaue Sortierung von BDNF verantwortlich (a.a.O.). ProBDNF wird aktivitätsabhängig ausgeschüttet (Mowla et al., 2001) und bindet überwiegend an den niedrigaffinen p75NTRezeptor, während BDNF an den hochaffinen Tyrosin-Kinase-B-Rezeptor (TrkBRezeptor) bindet (Lee et al., 2001). Die durch die Bindung von BDNF an seinen TrkBRezeptor ausgelöste Dimerisierung führt zunächst zur intrazellulären Signaltransduktion und Aktivierung der Tyrosinkinase-Aktivität (Chao, 2003). Durch die ligandenvermittelte Aggregation der Rezeptoren kommt es dann zur Autophosphorylierung der intrazellulären Domänen (Bath & Lee, 2006). Die weitere Signalkaskade beeinflusst schließlich die zelluläre Gentranskription und Proteinsynthese (Greene & Kaplan, 1995, Li et al., 1998). Während dieser Mechanismus der Neurotrophinwirkung Stunden bis Tage andauern kann, sind auch Neurotrophinwirkungen bekannt, die innerhalb von Minuten auftreten und sich nur kurz anhaltend auf die synaptische Transmission auswirken (Levine et al., 1996). Es ist anzunehmen, dass es in diesem Fall nicht zu Änderungen in der Genexpression kommt (Henneberger et al., 2002). Es wurde gezeigt, dass Pro-Neurotrophine nach ihrer Bindung an den p75NT-Rezeptor im peripheren Nervensystem Apoptose auslösen können (Lee et al., 2001, Teng et al., 2005). Dies widerspricht der antiapoptotischen und differenzierenden Eigenschaft der Neurotrophine. Allerdings besitzen viele Neurone Bindungsstellen beider Rezeptorklassen (TrkB und p75NT), weshalb angenommen wird, dass Pro-Neurotrophine und reife - 19 - Neurotrophine über unterschiedliche Signalkaskaden gegensätzliche Signalantworten auslösen können (ebd.). Neurotrophe Faktoren spielen eine wichtige Rolle für die synaptische Plastizität im reifenden und erwachsenen Gehirn. Der Großteil der Erkenntnisse hierzu wurde über die etablierte in vitro Methode der hippocampalen slice-Präparation gewonnen. Werden hippocampale slice-Präparate exogenen BDNF ausgesetzt, wird die Induktion einer schnellen und langanhaltenden Erhöhung der synaptischen Stärke sprich die Langzeitpotenzierung (LTP) gefördert (Kang & Schuman, 1995, Levine et al., 1995). Hingegen ist die Langzeitpotenzierung, welche als Voraussetzung für die Konsolidierung gesehen wird, bei genetisch veränderten Mäusen mit ausgeschaltetem BDNF-Gen oder inaktivem TrkB-Rezeptor stark eingeschränkt (Korte, 2004). Diese Reduktion der LTP ist durch die Gabe von BDNF reversibel (Patterson et al., 1996). Demnach scheinen Signale, die durch den TrkB-Rezeptor vermittelt werden, ein wichtiges Verbindungsglied zwischen der neuronalen Aktivität und der Regulation der Proteinexpression im Zusammenhang mit Plastizitätsphänomenen wie der Langzeitpotenzierung zu sein (Lu & Gottschalk, 2000, Woo et al., 2005). Neben seiner Rolle in der Modulation der synaptischen Transmission hat BDNF auch einen bedeutsamen Einfluss auf die neuronale Konnektivität, was insbesondere für den Erhalt anatomischer Strukturen wichtig ist. In transgenen Mäusen, die ein postnatales Defizit von BDNF oder TrkB aufweisen, sind die corticalen und hippocampalen Volumina reduziert (Bath & Lee, 2006). Der Grund hierfür liegt nicht in einer verminderten Neuronenzahl, sondern in einer bedeutsamen Veränderung in der Zellmorphologie, nämlich einer Reduktion der Größe des Zellsomas und der Dendritenkomplexität (Baquet et al., 2004, Gorski et al., 2003). Ein weiterer Beweis für die neuroplastische Wirkung von BDNF ist die Beobachtung, dass nach dem Untergang neuronaler Zellen eine vermehrte Expression von BDNF und TrkB-Rezeptoren in den betroffenen Gebieten stattfindet. So konnte bei Ratten gezeigt werden, dass nach künstlich induzierten Krämpfen im Hippocampus und nach zerebraler Ischämie bzw. hypoglykämischem Koma im Gyrus dendatus die TrkBmRNA und das TrkB-Protein vermehrt vorkommen (Merlio et al., 1993). Gleichzeitig konnte eine Erhöhung der BDNF-mRNA in diesen Hirnregionen gemessen werden. Wurde nach fokaler ischämischer Hirnläsion BDNF lokal appliziert, reduzierte sich die reaktive Astrogliose, und es verbesserte sich das funktionelle Outcome (Schäbitz et al., 2004). - 20 - 2.2.1 Der Val66Met-Polymorphismus des BDNF-Gens Das Gen für BDNF liegt auf dem Chromosom 11p13 und bildet als Translationsprodukt das BDNF-Protein. Auf dem neunten Exon im BDNF-Gen kann ein Einzelbasenaustausch (single-nucleotide polymorphism, SNP) rs6265 auftreten (Huang et al., 2001). Diese Sequenzvariation zwischen den Basen Guanin und Adenin führt zu einem Aminosäurenaustausch auf Position 66 (Val66Met). Aus dem genetischen Polymorphismus (G/G, G/A, A/A) ergeben sich zwei homozygote (Val-Val, Met-Met) und ein heterozygoter (Val-Met) Phänotyp. Ungefähr 20 bis 50 Prozent der Menschen weltweit weisen einen heterozygoten (ValMet) oder homozygoten (Met-Met) Methionin-Austausch auf (Shimizu et al., 2004). Diese Prozentangaben variieren in Abhängigkeit von der Region und Ethnizität. So sind 43,2% der Italiener und 27,1% der amerikanischen Bevölkerung, von denen die meisten indo-europäischer Abstammung sind, Träger der Val-Met Variante, in Japan hingegen sind 50,3% der Bevölkerung betroffen (Schimizu et al., 2004). Wenig Informationen gibt es zu homozygoten Met-Allel Trägern, da dieser Genotyp nur selten in der Allgemeinbevölkerung vorkommt (vgl. 8,1% in Italien, 4,5% in den Vereinigten Staaten und 15,9% in Japan; a.a.O.). Die Variante Val-Val hingegen ist mit 68,4% in den USA, 48,7% in Italien und 33,8% in Japan am häufigsten vertreten (Schimizu et al., 2004). Unklar bleibt, was solche Erkenntnisse für die Allgemeinbevölkerung bedeuten. Nordeuropäer scheinen von kognitiven bzw. Verhaltensänderungen, die mit dem BDNFGenotyp einhergehen, stärker betroffen zu sein als die asiatische Bevölkerung, obwohl ein größerer Anteil der asiatischen Bevölkerung Träger dieses Allels ist. Es scheint ethnische Kompensationsmechanismen zu geben, welche die Effekte der Met-Mutation ausgleichen oder eliminieren (Bath & Lee, 2006). 2.2.2 Effekte des Polymorphismus Val66Met auf die Neurophysiologie und Morphologie Die molekularen Auswirkungen des Val66Met wurden ursprünglich mit Zellkulturen in vitro untersucht. So haben Studien mit primären Hippocampusneuronen gezeigt, dass der Val66Met Polymorphismus zu drei Veränderungen im intrazellulären Transportmechanismus führt: (1) zu einer verminderten BDNF-Varianten-Verteilung in den - 21 - neuronalen Dendriten, (2) zu einer reduzierten Einlagerung von BDNF in den sekretorischen Vesikeln und (3) zu einer beeinträchtigten aktivitätsabhängigen Sekretion von BDNF aus den Vesikeln, was zu einer verminderten Langzeitpotentierung führt (Chen et al., 2004, Egan et al., 2003). Eine häufig replizierte Beobachtung bei den Val-Met Trägern ist ein Unterschied in der hippocampalen Morphologie. So weisen in Untersuchungen mit strukturierten MRTScans Val-Met Träger wiederholt ein kleineres hippocampales Volumen als die Kontrollgruppe mit homozygoten Val-Allel auf (Pezawas et al., 2004, Szeszko et al., 2005). Der Grund für die differierenden Hippocampusvolumina ist letztendlich nicht geklärt. Denkbar ist eine Kombination aus verschiedenen Veränderungen wie eine verminderte Dendriten-Komplexität, ein Mangel an neuronalen und Stützzellen, ein vermehrter Zelltod oder eine verminderte Neurogenese in der embryonalen Entwicklung bzw. über die Lebensspanne hinweg. BDNF und seine TrkB-Rezeptoren sind für die Vermittlung all dieser Prozesse wichtig (Huang & Reichardt, 2001, Lu et al., 2005). Neben den morphologischen Veränderungen des Hippocampus haben Studien gezeigt, dass bei heterozygoten Met-Allel Trägern auch das Volumen im dorsolateralen präfrontalen Cortex, einem Areal, das mit Planen und höheren corticalen Funktionen assoziiert ist, wie auch das Volumen in subcorticalen Regionen (z.B. Nucleus caudatus), vermindert ist (Pezawas et al., 2004). 2.2.3 Klinische Effekte des Polymorphismus Val66Met Bislang ist es nicht gelungen, eine genetische Assoziation zwischen neurotrophen Genen und kognitiven Funktionen des Menschen zu sichern. Jedoch konnte der SNP Val66Met mit Gedächtnisbeeinträchtigungen und einer erhöhten Vulnerabilität für neuropsychiatrische Störungen wie die Alzheimer-Krankheit (Ventriglia et al., 2002), Parkinson’sche Krankheit (Momose et al., 2002), Depression (Sen et al., 2003), Essstörung (Ribases et al., 2003) und bipolare Störung (Neves-Pereira et al., 2002) in Verbindung gebracht werden. Ein allgemeines klinisches Symptom dieses Basenaustausches ist ein variierender Grad an Beeinträchtigung höherer kognitiver Fähigkeiten. In erster Linie sind davon das Lernen und das Gedächtnis betroffen, was sich durch den hohen Expressionslevel von BDNF und TrkB in hippocampalen Strukturen des erwachsenen ZNS (Yan et al., - 22 - 1997) und ihrer kritischen Rolle in der Aufrechterhaltung synaptischer Verbindungen (Huang & Reichardt, 2001), synaptischen Plastizität (McAllister et al., 1995) und Neurotransmission (Poo, 2001) in diesen Regionen erklären lässt. So hat sich beispielsweise gezeigt, dass unter Einsatz neuropsychologischer Testbatterien die Träger des Met-Allels (Val-Met, Met-Met) schlecht in Aufgaben abschneiden, bei denen Plätze und Ereignisse erinnert werden müssen, sich aber nicht von den Val-Val Trägern in Tests unterscheiden, die klassischerweise weniger vom Hippocampus abhängen, wie etwa das Erlernen von Wörtern oder Planungsaufgaben (Egan et al., 2003, Hariri et al., 2003). Solche Studien legen nahe, dass bei Met-Allel Trägern das Hippocampus-abhängige Gedächtnis selektiv gestört ist. Interessanterweise stimmen viele der reproduzierbaren Phänotypen, die bei menschlichen Met-Allel Trägern beobachtet wurden, mit denen transgener Tiere überein, deren BDNF- oder TrkB-Level reduziert ist. Diese transgenen Tiere haben Schwierigkeiten beim Lernen, zeigen Verhaltensänderungen und haben ein vermindertes Hippocampusvolumen (Chen et al., 2008). Allgemein bleibt es in Studien, in denen Gene mit Pathologien oder Verhaltensänderungen assoziiert werden, oft unklar, wie sich die Variation des Genotyps auf den Phänotyp auswirkt. Dies ist insbesondere dann schwierig wenn versucht wird, eine Genotypveränderung mit einer diskreten Modifikation im kognitiven Funktionieren zu verbinden. Es ist möglich, dass die identifizierte Genvariante direkt die Kognition beeinflusst, aber es ist auch plausibel, dass die genetische Variation den Effekt durch nachgelagerte funktionale Veränderungen oder durch die Regulation anderer Gene vermittelt (Yamada et al., 2001). Dieser Umstand muss bei der Interpretation und Verallgemeinerung derartiger Studienresultate Berücksichtigung finden. 2.3 Apolipoprotein E (ApoE) Das Apolipoprotein E (ApoE) ist ein Glycoprotein, das in den Transport von Cholesterol und Lipiden involviert ist. Auch außerhalb des Lipidstoffwechsels nimmt das ApoE zahlreiche Aufgaben wahr wie die Modulation der zellulären Immunantwort, die Hemmung der Thrombozytenaggregation und die Regulation der Steroidsynthese (Hoe et al., 2005). Im peripheren und zentralen Nervensystem beeinflusst ApoE das Wachstum und die Differenzierung von Neuronen (Lemaitre et al., 2005). Aus diesem Grund und wegen seiner Interaktion mit den neurotoxischen Amyloid-Peptiden und Plaque- - 23 - Komplexen wird dem ApoE eine Rolle in der Pathogenese der Demenz vom Alzheimer Typ (DAT) zugeschrieben (Saunders et al., 1993, Strittmatter et al., 1993). 2.3.1 Polymorphismen des APOE-Gens Das menschliche APOE-Gen liegt auf Chromosom 19 (19q13.2; Pericak-Vance et al., 1991) und kommt in den drei allelen Formen ε2, ε3 und ε4 vor. Der Wildtyp ε3 (Cystein112, Arginin158) unterscheidet sich von den beiden anderen Allel-Formen ε2 (Cystein112, Cystein158) und ε4 (Arginin112, Arginin158) jeweils nur in einer Aminosäure, was jedoch erhebliche pathobiochemische Konsequenzen hat (Price et al., 1998; vgl. Kapitel 2.3.2, S. 24ff). Aus dem genetischen Polymorphismus ergeben sich drei homozygote (E2/E2, E3/E3, E4/E4) und drei heterozygote (E2/E3, E2/E4, E3/E4) Phänotypen (Beffert et al., 1998, Lahiri et al., 2004). In Westeuropa tritt das ε3-Allel bei 75 %, das ε4-Allel bei 15% und das ε2-Allel bei 8% der Bevölkerung auf (Utermann et al., 1980). Der dominierende Phänotyp ist deshalb E3/E3 (50%), gefolgt von den Phänotypen E3/E4 (25%), E2/E3 (15%), E2/E4 (2%), E4/E4 (2%) und E2/E2 (1%; Hill et al., 2007). Verglichen mit ApoE3 besitzt ApoE4 eine höhere und ApoE2 eine sehr viel niedrigere Affinität zum LDL-Rezeptor (low density lipoprotein receptor). Demzufolge werden die Lipoproteine bei ε4-Trägern wesentlich schneller aus dem Plasma entfernt. Dies bewirkt eine Herunterregulation des hepatischen LDL-Rezeptors, woraus ein Anstieg des Plasma-LDL-Cholesterins resultieren kann (Moriarty et al., 2010). ApoE4 ist somit potentiell atherogen, während ApoE2 eher einen kardioprotektiven Effekt ausübt. Allerdings ist auch bekannt, dass die seltene Hyperlipoproteinämie Fredrickson Typ III, die mit einem sehr hohen koronaren Risiko einhergeht, kausal mit der ApoE2-Homozygotie zusammenhängt. Für ihre Manifestation sind jedoch weitere Störungen des Fettstoffwechsels wie etwa Diabetes mellitus, Hypothyreose und Fehlernährung oder auch exogene Risikofaktoren notwendig (Riesen et al., 1995, Siest et al., 1995, Feussner et al., 1998). - 24 - 2.3.2 Effekte des APOE-Polymorphismus auf die Neurophysiologie und cerebrale Morphologie Von den funktionellen Allelen des APOE-Gens ist auf das ZNS bezogen die ε4-Variante von großer Bedeutung. Zwar ist der pathologische Mechanismus, der hinter der ε4Isoform steckt, noch weitgehend unbekannt, jedoch kristallisieren sich drei maßgebende Hypothesen heraus: so wurde postuliert, dass E4 aufgrund seiner starken Bindung an das Beta-Amyloidpeptid einen stabilen Komplex bildet, der die Entstehung von Plaques erleichtert (Strittmatter et al., 1993). Zahlreiche Studien hierzu haben gezeigt, dass die Dichte der senilen Plaques mit dem ApoE-Genotyp in der Rangfolge ε4/ε4 >> ε3/ε4 >> ε3/ε3 korreliert (Beffert et al., 1998). Gearing et al. (1996) haben zudem herausgefunden, dass die erhöhte Plaque-Dichte, die bei ε4-Allel Trägern beobachtet wird, auf einen Anstieg der Aβ1-40-positiven Plaques rückführbar ist, während die Aβ 1-42positiven Plaques bei allen ApoE-Genotypen in etwa gleich häufig sind. In der zweiten Hypothese wird ein Zusammenhang zwischen dem ApoE-Genotyp und den neurofibrillären Bündeln (neurofibrillary tangles, NFT) angenommen (Polvikoski et al., 1995). Diese Aussage beruht auf der Beobachtung, dass die E2- und E3-Isoformen des APOEs viel effizienter als das E4 an das Mikrotubuli-assoziierte Tauprotein binden, was im Falle des letzteren die Phosphorylierung von Tau erhöht (a.a.O.). Hierzu haben beispielsweise Ghebremedhin et al. (1998) nachgewiesen, dass bei ε4-Trägern in einem Alter zwischen 22 und 46 Jahren neurofibrilläre Bündel im entorhinalen Cortex häufiger auftreten als bei den Nichtträgern dieses Allels. Basierend auf Querschnittsdaten schätzen Ohm et al. (1995), dass diese histopathologischen Merkmale dem Beginn einer Alzheimer-Krankheit um bis zu 50 Jahre vorausgehen. Neben den zahlreichen Bestätigungen dieser Hypothese gibt es allerdings auch kontroverse Befunde, in denen kein Zusammenhang zwischen der E4 und den NFTs gefunden wurde (z.B. Landen et al., 1996). Der dritte Ansatz geht davon aus, dass ApoE als Reaktion auf die zelluläre Schädigung bzw. Degeneration zwar prinzipiell den Neuritenwachstum fördert (Fagan et al., 1996), das E4 jedoch verzögernd auf die neuronale Wiederherstellung wirkt und sogar mit der normalerweise protektiven Funktion von E3 interferiert (Buttini et al., 2000). Die dadurch entstehende zeitliche Verschiebung des Dendritenwachstums führt zu einem Verlust synaptischer Verbindungen und zu damit assoziierten kognitiven Einbußen (Turic et al., 2001). Diese Annahme wurde durch eine Vielzahl an Studien gestützt. Beispielsweise haben Jordan und Kollegen (1997) bei Profiboxern mit chronischen traumatischen Hirnschädigungen festgestellt, dass die Kombination aus zahlreichen - 25 - Kämpfen und der Anwesenheit eines ε4-Allels mit einer größeren kognitiven Beeinträchtigung einhergeht. Kutner et al. (2000) haben gezeigt, dass ältere Footballspieler mit einem ε4-Allel schlechter in kognitiven Aufgaben abschneiden als ihre Teamkollegen, die kein ε4-Allel aufweisen oder auch jüngere Spieler mit einem ε4Allel. Und Arendt et al. (1997) haben beschrieben, dass Alzheimer-Patienten mit homooder heterozygotem ε4-Allel schwerwiegendere neuronale Degeneration und signifikant weniger neuronale Plastizität aufweisen als Patienten ohne ε4-Allel. Vergleichbare Ergebnisse haben Untersuchungen mit transgenen Mäusen erbracht, in denen das E4 zu einem geringeren Dendritenwachstum (Ji et al., 2003), einer gestörten hippocampalen Plastizität (Levi et al., 2003) und in vitro zu einer erhöhten Neurotoxizität geführt hat (Qiu et al., 2003). Das durch E4 bedingte verminderte Neuritenwachstum ist auch in der strukturellen und neuroradiologischen Bildgebung nachweisbar. So fallen die Hippocampus-Volumina von Alzheimer-Patienten mit dem ε4/ε4 Genotyp kleiner als die von Erkrankten ohne ε4-Allel aus (Lehtorvirta et al., 1995). Daraus ist zu schließen, dass homozygote ε4Allel Träger bereits früh im Krankheitsverlauf eine größere hippocampale Schädigung erleiden und sich darin signifikant von den Nicht-ε4 Trägern unterscheiden (Lehtorvirta et al., 1996). Auch bei den gesunden älteren Personen besteht eine Korrelation zwischen dem ε4-Allel und einem reduzierten Hippocampusvolumen (May et al., 1998). Reiman et al. (2004) haben mittels Positronen-Emissions-Tomographie (PET) zudem entdeckt, dass kognitiv leistungsfähige ε4-Allel Träger bereits im Alter von 20 bis 39 Jahren einen abnormen Glukosemetabolismus im posteriorem Cingulum wie auch im parietalen, temporalen und präfrontalen Cortex aufweisen – eben in den Hirnregionen, die auch bei Verwandten von Patienten mit einer autosomal dominanten Form der Alzheimer-Krankheit auffällig sind. Und Small et al. (1995) haben herausgefunden, dass das ε4-Allel mit einem reduzierten cerebro-parietalen Metabolismus und einer erhöhten Asymmetrie bei nicht-dementen Familienangehörigen einhergeht, die ein erhöhtes Risiko für die Alzheimer Krankheit haben. All diese Daten verdeutlichen die hohe Vulnerabilität des ε4-Allels für das Auftreten der Alzheimer Krankheit. Doch obwohl das E4 in der Bildung von neurofibrillären Bündeln und Plaques involviert ist und das Neuritenwachstum hemmt, ist seine exakte Rolle bei der DAT noch nicht gänzlich geklärt. Tatsache ist, dass ein Drittel bis die Hälfte der - 26 - Patienten mit spätem Erkrankungsalter kein ε4-Allel besitzt, so dass auch andere Faktoren in der Pathogenese beteiligt sein müssen (Beffert et al., 1998). 2.3.4 klinische Effekte des Polymorphismus APOE-εε4 Das APOE ε4-Allel wurde unter anderem mit kardiovaskulären Erkrankungen (Menzel et al., 1983), diätischer Hypercholesterinämie (Laakso et al., 1991) und LewyKörperchen-Demenzen wie der senilen Form (Benjamin et al., 1995), der AD-Variante (Galasko et al., 1994) und des diffusen Typs (Kawanishi et al., 1996), mit der vaskulären Demenz, dem Morbus Parkinson, der Frontotemporalen Demenz und dem Down Syndrom (letztere nachzulesen bei Helisalmi et al., 1996) in Verbindung gebracht. Am besten untersucht ist jedoch seine Assoziation mit der Demenz vom Alzheimer Typ. Epidemiologische Studien (Farrer et al., 1997) haben aufgedeckt, dass in Europa das Risiko für eine Alzheimer Demenz mit der Anzahl der ε4-Allele ansteigt und zwar mit den odd ratios (OR) von 2.6, 3.2 und 14.9 für die ApoE-Genotypen ε2/ε4, ε3/4 und ε4/ε4 jeweils bezogen auf ε3/ε3. Bei Afro-Amerikanern und Hispanics ist der ε4 Genotyp-Effekt geringer. In der japanischen Bevölkerung hingegen ist die E4-DATAssoziation stärker als bei den Europäern ausgeprägt. Der ε2/ε3 Genotyp scheint für alle ethnischen Gruppen protektiv zu sein (OR = 0.6 relativ zu ε3/ε3). Diese Angaben bekräftigen, dass das ε4-Allel des APOEs für alle ethnischen Gruppen einen Hauptrisikofaktor für die Entwicklung einer Alzheimer Krankheit darstellt. Weiterhin wurde postuliert, dass jedes zusätzliche ε4-Allel das Erkrankungsalter nach unten verschiebt - im Schnitt vom 84. auf das 68. Lebensjahr (Corder et al., 1993). Wenn die ε4-Isoform also ein gravierender Risikofaktor für die DAT ist, dann müsste die Prävalenz dieses Allels in der hochbetagten Bevölkerung sehr niedrig ausfallen. Tatsächlich befinden sich 40% aller Demenz-Patienten mit einem ε4/ε4 Genotyp im 55. Lebensjahr, wohingegen weniger als 5% älter als 91 Jahre sind (Sauners et al., 1993). Nach Dartigues & Letenneur (2000) scheint bei Personen jenseits des 75. Lebensjahres das durch das ε4-Allel erhöhte Erkrankungsrisiko abzunehmen und sich dem Erkrankungsrisiko der Nicht-ε4-Allel Träger anzugleichen. Der beschriebene Zusammenhang zwischen E4 und dem Gedächtnis spiegelt sich auch in neuropsychologischen Untersuchungen wider. So fanden Henderson et al. - 27 - (1995) heraus, dass das ε4-Allel mit einer schlechteren Leistung in Tests wie dem MMST oder Aufgaben zum episodischen Gedächtnis assoziiert ist, aber nicht mit Messungen der prämorbiden Gedächtnisleistung. Folglich scheint das ε4-Allel zu kognitiven Einbußen zu prädisponieren, aber keinen Effekt auf die Kognition vor der Erkrankung zu haben. Auch Bunce et al. (2004) stellen fest, dass das Vorkommen eines ε4-Allels weder die kognitiven Defizite von präklinischen DAT-Fällen beeinflusst, noch die von gesunden Erwachsenen. Wenn genetische APOE-Variationen für Differenzen bezüglich des Gedächtnisses und der Kognition in der Bevölkerung verantwortlich sein sollen, dann müsste das ε4-Allel auch im Kindes- und Jugendalter Unterschiede bedingen (Parasuraman et al., 2002). Deary et al. (2003) verfolgte längsschnittlich eine Kohorte von Kindern, bei denen erstmals 1932 die Intelligenz gemessen wurde. Sie stellten fest, dass sich der ε4-Allel Effekt weder mit elf Jahren, noch im 77. Lebensjahr zeigt. Es muss allerdings festgehalten werden, dass in dieser und ähnlichen Studien Intelligenztests und keine expliziten Aufgaben zum Gedächtnis durchgeführt werden, was eine „echte“ PhänotypAssoziation eventuell verschleiert. Anzumerken ist, dass die meisten neuropsychologischen Studien mit älteren Probanden durchgeführt werden. Dies erschwert die abschließende Bewertung, ob APOEVarianten generell zum interindividuellen Unterschied in der kognitiven Leistung beitragen, weil ε4 Träger, die sich im Prodromalstadium einer Alzheimer Krankheit befinden, eventuell für die gefundenen Geno-Phänotyp-Korrelationen verantwortlich sind (Savitz et al., 2006). Jede zufällig ausgewählte Gruppe Erwachsener in einem Alter von über 65 Jahren schließt wahrscheinlich Fälle mit frühem Alzheimer ein (Sliwinski et al., 1996) und das Problem aggraviert durch die Tatsache, dass viele der untersuchten gesunden Probanden einen nahen Angehörigen mit Alzheimer-Krankheit haben (Savitz et al., 2006). - 28 - 2.4 Zielsetzungen Ziel der vorliegenden Studie ist es, den Effekt der Genotypen von BDNF und APOE auf die mnestischen Leistungen junger, gesunder Probanden zu messen. Dabei sollen folgende zwei ungerichtete Haupthypothesen geprüft werden (1) unterscheiden sich die Probanden unter Berücksichtigung des Polymorphismus BDNF Val66Met hinsichtlich der zeitlichen und inhaltlichen Dimensionen sowie verarbeitungsspezifischen Prozesse ihres Gedächtnisses? (2) unterscheiden sich die Probanden unter Berücksichtigung der Varianten des APOE-Gens hinsichtlich der zeitlichen und inhaltlichen Dimensionen sowie verarbeitungsspezifischen Prozesse ihres Gedächtnisses? Darüber hinaus sollen die nachfolgenden Fragen beantwortet werden: (3) Wie schneiden die Probanden mit den Polymorphismen BDNF Val66Met und APOE-ε4 im normativen Vergleich ab? (4) Werden die mnestischen Leistungen in den genotypischen Subgruppen BDNF „kein Met“ und „Met“ bzw. APOE „kein ε4“ und „ε4“ durch das Alter, das Geschlecht oder die Ausbildungsdauer beeinflusst? Gibt es epistatische Hinweise (BDNF*APOE)? (5) Bestehen Zusammenhänge zwischen den Phänotypen der Polymorphismen BDNF Val66Met und APOE-ε4 und den demographischen Variablen einschließlich der Gen-Wechselwirkung? (6) Wie entwickeln sich die Gedächtnisleistungen der BDNF Val-Val und MetTräger bzw. die der APOE ε4-(Nicht-)Träger in Abhängigkeit vom Lebensalter? - 29 - 3 Methodik Die vorliegende Studie ist eine explorative, deskriptive und vergleichende Querschnittsuntersuchung. Sie stellt einen Teil des Projektes GENES dar, das von Februar 2007 bis Oktober 2008 in der Psychiatrischen und Psychotherapeutischen Klinik des Universitätsklinikums Erlangen (Arbeitsgruppe Prof. Dr. J. Kornhuber) durchgeführt wurde. Mit dem Projekt GENES soll die Beziehung ausgewählter Genotypen zu hirnmorphologischen Normabweichungen und deren neuropsychologische Messbarkeit untersucht werden. Von besonderem Interesse ist hierbei, inwieweit die Polymorphismen der Gene HUM-BDNF und APOE, welche für die Varianten des Wachstumsfaktors BDNF (brain-derived neurotrophic factor) bzw. des Apolipoproteins E (ApoE) kodieren, einen Einfluss auf die Hippocampus- und Gesamthirnvolumina wie auch auf die mnestischen und intellektuellen Leistungen junger gesunder Probanden haben. Im Folgenden wird das Studiendesign vorgestellt (Kapitel 3.1, S. 29f), das Messinstrument wie auch die Genotypisierung von BDNF und APOE beschrieben (Kapitel 3.2, S. 30-33) und die Stichprobe charakterisiert (Kapitel 3.3, S.33-37). 3.1 Studiendesign Das Studienprotokoll wurde von der Ethikkommission des Fachbereichs Medizin der Friedrich-Alexander-Universität Erlangen-Nürnberg genehmigt und im Einklang mit der Deklaration von Helsinki (2008) durchgeführt. Um eine möglichst homogene Stichprobe zu erhalten, wurde um 18- bis maximal 35jährige Studenten der Medizinischen Fakultät über den Verteiler der Fachschaft und Mundpropaganda in den an der Klinik abgehaltenen Praktika geworben. Als Ausschlusskriterien wurden somatische Vorerkrankungen, welche potentiell die Gehirnfunktion beeinträchtigen (u.a. Hypo-/Hyperthyreose), gegenwärtige oder anamnestisch bekannte psychische Störungen (z.B. Depression, Persönlichkeitsstörung), eine regelmäßige Einnahme von Medikamenten (mit Ausnahme hormoneller Kontrazeptiva), ein Konsum bzw. Missbrauch von bewusstseinsverändernden Substanzen (einschließlich Alkohol) und Schwangerschaft formuliert. Alle Probanden unterzeichneten vor der aktiven Studienteilnahme das Aufklärungsprotokoll, die Einwilligungserklärung und den Verzicht auf die Mitteilung der genotypischen Untersuchungsergebnisse. Für die Teilnahme an allen drei Untersuchungsarmen (MRT, Gedächtnis, Intelligenz, einschließlich - 30 - Blutentnahme für Routinelabor und Genotypisierung) wurden jedem Probanden 50 Euro entrichtet. Diese und die Finanzierung der weiteren Messungen wurden aus intramuralen Finanzierungsquellen getragen. Zur Gewährleistung des Datenschutzes wurden sämtliche Messwerte noch vor der Auswertung pseudonymisiert. Die Qualität der Daten wurde statistisch und durch stichprobenartige Quelldatenverifikation kontrolliert. Zu den Aufgaben des Autors gehörten (1) die Auswahl eines für die Fragestellung geeigneten Gedächtnistests, (2) die Terminierung der psychometrischen Untersuchungen, (3) deren Durchführung in Form von Gruppentestungen mit maximal zehn Teilnehmern, (4) die Auswertung und Erstellung der Testprofile, (5) die Eingabe der Daten in die SPSS-Datenbank, (6) die Qualitätssicherung der Daten, (7) die Verwaltung bzw. Pflege der gesamten GENES-Datenbank, (8) die Verteilung der Probandengelder und (9) das Versenden der Testprofile (einschließlich einer allgemein verständlichen Interpretation der Ergebnisse) an die Studienteilnehmer. 3.2 Messmethoden 3.2.1 Inventar zur Gedächtnisdiagnostik (IGD) Das Inventar zur Gedächtnisdiagnostik (IGD; Baller et al., 2006) ist eine umfangreiche Testbatterie, mit welcher die in den etablierten Modellen (s. Kapitel 2.1.1, S.6ff) beschriebenen zeitlichen und inhaltlichen Dimensionen sowie verarbeitungsspezifischen Prozesse des Gedächtnisses gemessen werden können. In Einzel- oder Gruppensettings ist es im leistungsdiagnostischen und klinischen Bereich wie auch in der neurowissenschaftlichen und psychologischen Forschung einsetzbar. Das IGD besteht aus drei Testmodulen, mittels derer Neu- und Altgedächtnisleistungen untersucht werden: das Modul A, welches die Lern- und Merkfähigkeit neuer Informationen im mittleren bis höheren mnestischen Leistungsbereich überprüft, und die Testmodule B (semantisches Gedächtnis) und C (autobiographisches Gedächtnis), die beide Altgedächtnisleistungen im niedrigen bis mittleren Leistungsspektrum erfassen. Die einzelnen Module A, B und C können unabhängig voneinander durchgeführt und interpretiert werden. Bestehen Zweifel, ob das Testmodul A aufgrund seines hohen Schwierigkeitsgrades im Individualfall anwendbar ist, sollte laut der Autoren vor seiner Durchführung das beiliegende Screening eingesetzt werden. Mit diesem kann - 31 - innerhalb von wenigen Minuten die Testvoraussetzung hinsichtlich des Instruktionsverständnisses, der basalen Lern- und Merkfähigkeit sowie der Aufmerksamkeit bzw. Vigilanz (Wachheit) überprüft werden. In der vorliegenden Studie kam allein das Testmodul A zum Einsatz, für dessen Durchführung etwa 50 Minuten einzurechnen sind und eine Stoppuhr, die Testordner (Aufgabenordner mit einem Satz Antwortbögen, die vor der Testdurchführung vom Testleiter eingelegt werden), Bleistifte und das Manual benötigt werden. Mittels der zwölf Untertests des IGD (s. Anhang A1, S.96ff) werden prospektive Gedächtnisleistungen, Priming, Arbeitsgedächtnis sowie Lern- und Merkfähigkeit für neue visuelle und verbale Stimuli gemessen. Ein Subtest erfasst sprachliche (semantische/phonematische) Verarbeitungsprozesse des Einspeicherns, ein weiterer überprüft das inzidentelle Lernen. Das Paarassoziationslernen ist so konzipiert, dass die Lernleistung unabhängig von materialspezifischen Verarbeitungsprozessen erfasst werden kann. Der Abruf des gelernten Materials erfolgt unmittelbar und nach kurzer bis mittelfristiger zeitlicher Verzögerung in den Paradigmen der freien oder gestützten Reproduktion und der Rekognition aus Distraktoren. Die Testdurchführung ist vollständig standardisiert, indem die Instruktionen vom Testleiter wortwörtlich vorgelesen werden und den Probanden im gleichen Wortlaut schriftlich vorliegen (s. Anhang A2, S.98ff). Bedeutsame Versuchsleitereffekte sind demnach auszuschließen (vgl. sehr zufriedenstellende Objektivität bzw. Interrater-Reliabilität mit Werten zwischen 0,97 und 1,0 auf Untertestebene und 0,99 für den Gesamtscore; Baller et al., 2006, S.27). Zu jedem Subtest wird ein Beispiel vorgegeben. Bei Verständnisproblemen bezüglich der Aufgabeninstruktion wird diese durch den Testleiter anhand des Beispiels nochmals erklärt. Die Lern- und Abrufzeiten sind festgelegt und werden mit der Stoppuhr gemessen. Die Reihenfolge der Untertests darf nicht variiert werden. In der Auswertung werden zunächst mit Hilfe von Protokollbögen und Ergebnisprofilen die Rohwerte der Untertests berechnet und nach einer Gewichtung zu Skalen zusammengefasst. Aus der Summe der derart erhaltenen Skalen ergibt sich der Gesamtscore. Für die Interpretation des Gesamtscores und der Skalen stehen alterskorrigierte Normwerte (Prozentränge PR und T-Werte für 18- bis über 65-Jährige) zur Verfügung. In Abbildung 4 (S. 32) ist das Modul A des IGD schematisch dargestellt. - 32 - Kurzzeit-/ ArbeitsGedächtnis Zahlenspanne visuelles/verbales Arbeits-Gedächtnis Exekutive Kontrolle Lernen verbales Lernen visuelles Lernen Paarassoziationslernen verzögerter Abruf verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text verzögerte Rekognition: Figuren verbales Gedächtnis verbales Arbeits-Gedächtnis verbales Lernen verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text visuelles Gedächtnis visuelles Arbeits-Gedächtnis visuelles Lernen verzögerte Rekognition: Figuren Priming Gesamtscore: allgemeines Gedächtnis Abbildung 4: Übersicht über die Subtests, Skalen und den Gesamtscore des IGDModuls A Das IGD wurde theoriegeleitet entwickelt und überprüft wesentliche Verarbeitungskomponenten neuropsychologischer Modellvorstellungen. Daher ist von einer guten Inhaltsvalidität auszugehen (Baller et al., 2006). Für die Konstruktvalidierung wurden etablierte Gedächtnistest wie beispielsweise die deutsche Fassung der Wechsler Memory Scale - R von Härting et al. (2000) herangezogen. Auch hier liegen zufriedenstellende bis gute Werte vor (z.B. Korrelation für den IGD-Gesamtscore Modul A und der WMSR: r = 0,83; Baller et al., 2006, S.28). Ebenfalls als gut zu werten ist die RetestReliabilität (Gesamtscore: r = 0,84, Skalen: r = 0,74 bis 0,87; a.a.O.), sofern ein Abstand von mindestens sechs Monaten zwischen den Messzeitpunkten eingehalten wird. - 33 - 3.2.2 Genotypisierung des BDNF Aus dem peripheren Blut der Studienteilnehmer wurde die Leukozyten-DNA mit Hilfe des Qiagen Isolations-Kits (Qiagen, Hilden, Deutschland) nach Anleitung der Hersteller isoliert. Die BDNF-Genotypisierung erfolgte nach Büller et al. (2006). Es wurde zunächst ein 274 bp großes Basenpaarfregment durch eine Polymerase- Kettenreaktion (PCR) unter Verwendung der Oligonukleotide Val66Met 5'-AAAGAAGC AAACATCCGAGGACAAG-3 ' (vorwärts) und Val66Met 5'-ATTCCTCCAGCAGAAAGA GAAGAGG-3' (rückwärts) amplifiziert. Die Amplifikationsprodukte wurden dann mit Hsp92II (Promega, Madison, Wisconsin, USA) verdaut und auf einem zweiprozentigen Agarosegel mit Ethidiumbromid (Roth, Karlsruhe, Deutschland) analysiert. Im Falle eines G-Allels (BDNF-Val66) produziert die Hsp92II-Verdauung zwei Produkte (57 und 217 bp), beim A-Allel (BDNF-Met66) drei (57, 77 und 140 bp ). 3.2.3 Genotypisierung des APOE Wiederum wurde aus dem peripheren Blut der Studienteilnehmer die Leukozyten-DNA mit Hilfe des Qiagen Isolations-Kits (Qiagen, Hilden, Deutschland) nach Anleitung der Hersteller isoliert. Die APOE-Genotypisierung wurde nach der Methode von Hixson und Vernier durchgeführt (1990). Dabei kam folgender Primer zum Einsatz: 5'-ACAG AATTCGCCCCGGCCTGGTACAC-3' (vorwärts) und 5'-TAAGCTTGGCACGGCTGT CCAAGGA-3' (rückwärts). Nach der Amplifizierung erfolgte die Verdauung des Amplifikationsproduktes mit Hilfe des Enzyms Hha I (New England Biolabs, Frankfurt am Main, Deutschland) bei 40 Grad Celsius über sechs Stunden. Schließlich wurden die Proben auf einem dreiprozentigen Agarosegel aufgetrennt und mit SYBR Gold Nucleic Acid Gel Stain® (Invitrogen, Karlsruhe, Germany) visualisiert. 3.3 Beschreibung der Stichprobe Am Projekt GENES (s. Kapitel 3, S.29) nahmen insgesamt 156 Probanden europäischer Abstammung und beiderlei Geschlechts teil. Fünf Teilnehmer mussten aufgrund einer durch das Routinelabor festgestellten Hyperthyreose (n = 3) und eines Diabetes mellitus (n = 1) wie auch einer in der Bildgebung nachgewiesenen Läsion rechts frontal (n = 1) ausgeschlossen werden. Diese Probanden wurden über die Zufallsbefunde und Therapiemöglichkeiten aufgeklärt. - 34 - Von den verbliebenen 151 Studienteilnehmern verweigert elf die Messung ihrer Gedächtnisleistungen, so dass letztendlich die Daten von 140 Probanden für die vorliegende Arbeit zur Verfügung stehen. Anzumerken ist, dass der besseren Lesbarkeit wegen allein die männliche Schreibweise (z.B. Studienteilnehmer, Proband) verwendet wird. Es sind aber ausdrücklich immer beide Geschlechter gemeint. In Tabelle 3 sind die soziodemographischen Variablen und die Häufigkeiten der Polymorphismen von BDNF und APOE überblicksartig zusammengestellt. N=140 n n% n%Literatur MW (s) Geschlecht männlich weiblich 46 94 32,9 67,1 - - Alter in Jahren - - - 24,6 (3,3) Bildung in Jahren - - - 16,9 (2,2) 68,4 27,1 † 4,5 - ‡ 1,0 15,0 ‡ 2,0 ‡ 50,0 ‡ 25,0 ‡ 2,0 - - - BDNF Val-Val Val-Met Met-Met 89 39 12 63,6 27,9 8,6 APOE ε2/2 ε2/3 ε2/4 ε3/3 ε3/4 ε4/4 2 15 2 104 13 4 1,4 10,7 1,4 74,3 9,3 2,9 positive Familienanamnese keine Demenz Schizophrenie Depression bipolare Störung keine Angabe 126 4 2 5 1 2 90,0 2,9 1,4 3,6 0,7 1,4 † † ‡ Tabelle 3: Beschreibung der Stichprobe mit absoluten (n) und relativen (n%) Häufigkeiten, Mittelwerten (MW) und Standardabweichungen (s); † nach Egan et al. (2003), ‡ nach Hill et al. (2007) In Tabelle 3 ist zunächst ein Dominieren der weiblichen Probanden festzustellen (vgl. 94 Frauen gegenüber 46 Männer), was im Hinblick auf mögliche geschlechtsspezifische Effekte in den weiteren Berechnungen (Kapitel 4.2, S. 42ff) berücksichtigt werden muss. Auch beim Lebensalter ist nicht von einer gleichmäßigen Besetzung der Altersklassen 18 bis 35 Jahren auszugehen (vgl. Kolmogorv-Smirnov-Test: p = ,042), wohingegen die Ausbildungsjahre normeilverteilt sind (Kolmogorov-Smirnov-Test: p = - 35 - ,229). Die Häufigkeitsverteilungen des Alters und der Ausbildungsjahre sind in Abbildung 5 dargestellt. Abbildung 5: Histogramme mit Normalverteilungskurven für das Alter (links) und der Ausbildungsjahre (rechts) Weiterhin ist aus Tabelle 3 (S. 34) ersichtlich, dass die (relativen) Häufigkeiten der Genvarianten von BDNF und APOE teilweise sehr gering ausfallen wie etwa bei den APOE-Isoformen ε2/ε2 (n = 2), ε2/ε4 (n = 2) und ε4/ε4 (n = 4). Dies muss in der analytischen Statistik entsprechend berücksichtigt werden, da sonst die Generalisierbarkeit der Ergebnissen nicht gewährleistet werden kann. Allerdings ist auch festzuhalten, dass die Häufigkeitsverteilungen in der Studienpopulation mit nur geringen Abweichungen den verfügbaren epidemiologischen Angaben entsprechen (vgl. BDNF: ValValDifferenz = 4,8%, Val-MetDifferenz = 0,8%, Met-MetDifferenz = 4,1%; APOE: ε2/ε2Differenz = 0,4%, ε2/ε3Differenz = -5,7%, ε2/ε4Differenz = 0,6%, ε3/ε3Differenz = 24,3%, ε3/ε4Differenz = 15,7%, ε4/ε4Differenz. = 0,9%). Die Verteilung der Genotypen von BDNF und APOE nach den Geschlechtern ist in Tabelle 4 (S. 36) dargestellt. - 36 - Geschlecht männlich ApoE ε2/ε2 ε2/ε3 ε2/ε4 ε3/ε3 ε3/ε4 ε4/ε4 Val-Val 0 3 1 23 1 2 30 BDNF Val-Met 0 1 0 6 2 1 10 ε2/ε2 ε2/ε3 ε2/ε4 ε3/ε3 ε3/ε4 ε4/ε4 2 6 1 44 5 1 59 0 4 0 22 3 0 29 gesamt weiblich ApoE gesamt Met-Met 0 1 0 4 1 0 6 gesamt 0 5 1 33 4 3 46 0 0 0 5 1 0 6 2 10 1 71 9 1 94 Tabelle 4: Kreuztabelle ApoE * BDNF * Geschlecht (N=140); farblich hervorgehoben sind die potentiell kritischen Allel-Kombinationen mit jeweils mindestens einem BDNFMet und einem APOE ε4 Weder bei den männlichen, noch bei den weiblichen Studienteilnehmern liegt die potentiell kritische Allel-Kombination „Met-Met und ε4/ε4“ vor (s. Tabelle 4). Ein gleichzeitiges Auftreten eventuell kognitiv nachteiliger heterozygoter Varianten findet sich in acht Fällen (vgl. Männer: nε3/ε4 und Met-Met=1, nε3/ε4 und Val-Met=2, nε4/ε4 und Val-Met=1; Frauen: nε3/ε4 und Met-Met=1, nε3/ε4 und Val-Met=3). Diese interessante Subgruppe ist jedoch zu klein, um weiterführende statistische Analysen durchführen zu können. Die Frage nach psychiatrischen und/oder neurodegenerativen Erkrankungen in der eigenen Familie bejahen 8,6%, wobei in erster Linie Depressionen (n = 5) und Demenzen (n = 4) genannt werden (s. Tabelle 3, S. 34). In der überwiegenden Mehrheit (zu 90%) ist keine familiäre Vorbelastung bekannt, so dass von einer mit dem Studienvorhaben konfundierenden genetischen Disposition weitestgehend abzusehen ist. - 37 - 4 Ergebnisse Die Datenanalyse erfolgt gemäß der in Kapitel 2.4 (S.29) aufgeführten Fragestellungen und ist in zwei Teile untergliedert: einer deskriptiven Statistik (Kapitel 4.1, S. 37-42), in welcher die Gedächtnisleistungen getrennt nach den Varianten der Gene HUM-BDNF und APOE anhand von Verteilungsparametern und im Vergleich zur Normstichprobe beschrieben werden; und einer analytischen Statistik (Kapitel 4.2, S. 42-66), in welcher Einflüsse des Geschlechts, Alters, der Ausbildungsdauer und der BDNF-APOEInteraktion geprüft, mnestische Unterschiede zwischen den Genotypen aufgedeckt, relevante Zusammenhänge mit demographischen Variablen berechnet und prognostisch bedeutsame Indikatoren für das Gedächtnis identifiziert werden. Die hierfür notwendigen statistischen Berechnungen wurden mit dem Programm PASW Statistics 18.0 für Windows (SPSS, Chicago IL) durchgeführt. 4.1 Deskriptive Statistik Zur Beschreibung des Datensatzes werden die in der Testung mit dem IGD (Inventar zur Gedächtnisdiagnostik) erzielten Ergebnisse bzw. deren Interpretation unterteilt nach den Genotypen von BDNF und APOE graphisch dargestellt und erläutert. Die Mittelwerte und Standardabweichungen wie auch die Leistungen aus den Subtests werden an den entsprechenden Stellen in der analytischen Statistik besprochen (Kapitel 4.2, S.42ff). 4.1.1 Mnestische Leistungen und BDNF Val66Met Wie in Kapitel 3.2.1 (S. 31) beschrieben, wurden die Rohwerte der Untertests manualgeleitet berechnet, gewichtet und zu den Skalen Kurzzeitgedächtnis, Lernen, verzögerter Abruf, verbales Gedächtnis und visuelles Gedächtnis zusammengefasst, welche durch Addition den Gesamtscore ergeben. Für die Interpretation wurden die alterskorrigierten Normwerte (Prozentränge, PR) herangezogen. Deren Häufigkeitsverteilung wird unter Berücksichtigung der Genvarianten von BDNF in Abbildung 6 (S. 38) gezeigt. - 38 - Gesamtscore unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 57,3 Kurzzeitgedächtnis unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 43,8 37,1 30,3 61,5 53,8 19,1 30,8 12,4 25,6 12,8 50,0 50,0 15,4 Lernen unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 69,7 41,7 33,3 25,0 verzögerter Abruf unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 60,7 36,0 66,7 28,1 56,4 35,9 30,8 75,0 66,7 25,0 2,2 3,4 33,3 7,7 2,6 71,9 verbales Gedächtnis unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) visuelles Gedächtnis unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 52,8 41,6 76,9 43,6 21,3 46,2 58,3 5,6 10,3 17,9 6,7 33,3 8,3 5,1 58,3 25,0 16,7 Abbildung 6: Darstellung der absoluten und relativen Häufigkeiten der auf den IGDSkalen erzielten Ergebnisse unterteilt nach den BDNF-Phänotypen (N=140, nVal-Val=89, nVal-Met=39, nMet-Met=12). Ein Prozentrang (PR) zwischen 0 und 24 gilt als „unterdurchschnittlich“, zwischen 25 und 75 als „durchschnittlich“ und zwischen 76 und 100 als „überdurchschnittlich“. - 39 - Von den homozygoten Valin-Trägern (n = 89) werden mit Ausnahme der Resultate in den Skalen verzögerter Abruf und verbales Gedächtnis, welche als Teilleistungsstärken zu interpretieren sind, überwiegend altersentsprechende Ergebnisse erzielt. So fällt auch der Gesamtscore, der als globales Gedächtnismaß gilt, in 57% der Fälle durchschnittlich aus; knapp ein Drittel liegt über dem Durchschnitt, und 12% darunter. Auf alle Skalen bezogen ist der Anteil unterdurchschnittlicher Leistungen gering, wobei die größten Schwierigkeiten in den Aufgaben zum Kurzzeit- und Arbeitsgedächtnis auftreten. Ein vergleichbares Profil zeigen die Val-Met Träger (n = 39) mit zumeist regelrechten Leistungen, einer relativen Stärke im Bereich des verzögerten Abrufs wie auch des verbalen Gedächtnisses und einer Schwäche bezüglich des Arbeits- und Kurzzeitgedächtnisses. Beim Gesamtscore unterscheiden sich 62% nicht vom Durchschnittswert der Normpopulation, 13% liegen darüber und etwas mehr als ein Viertel darunter. Die homozygoten Met-Träger (n = 12) heben sich von den Trägern der beiden anderen BDNF Genvarianten dadurch ab, dass sie in den Aufgaben zum Arbeits- und Kurzzeitgedächtnis überwiegend Defizite zeigen (vgl. 42% unter, 33% im und 25% über dem Durchschnitt), auf den Skalen Lernen und verzögerter Abruf jeweils durchwegs regelrechte bis überdurchschnittliche Ergebnisse erzielen, und der Gesamtscore zu gleichen Anteilen entweder unterdurchschnittlich oder altersentsprechend ausfällt. Die besten Resultate erreichen sie jedoch in Einklang mit den Va-Val und Val-Met Trägern auf den Skalen verzögerter Abruf und verbales Gedächtnis. 4.1.2 Mnestische Leistungen und APOE Analog dem Vorgehen aus Kapitel 4.1.1 (S. 37ff) wurden die absoluten und relativen Häufigkeiten zu den interpretierten Skalenwerten berechnet und graphisch dargestellt (s. Abbildung 7, S. 40). Die herausragendsten Leistungen erzielen die ε2/ε2- und die ε2/ε4-Träger (jeweils n = 2) mit auf die Skalen und dem Gesamtscore bezogen ausnahmslos durchschnittlichen bis überdurchschnittlichen Ergebnissen. Probanden mit homozygoten ε4-Allel (n = 4) schneiden abgesehen von einigen Beeinträchtigungen bzgl. des Arbeits- und Kurzzeitgedächtnisses (vgl. 50% unter-, 50% durchschnittlich) vergleichbar gut ab. - 40 - Kurzzeitgedächtnis unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) Gesamtscore unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 55,8 48,1 28,8 23,1 22,1 22,1 60,0 20,0 61,5 30,8 20,0 50,0 50,0 100,0 7,7 50,0 50,0 46,2 33,3 33,3 33,3 50,0 50,0 Lernen unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 69,2 30,8 50,0 50,0 23,1 100,0 verzögerter Abruf unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 57,7 36,5 28,8 73,3 66,7 61,5 33,3 100,0 50,0 50,0 5,8 30,8 1,9 7,7 51,0 46,2 53,8 100,0 26,7 100,0 50,0 50,0 50,0 50,0 verbales Gedächtnis unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) visuelles Gedächtnis unterdurchschnittlich (PR 0-24) durchschnittlich (PR 25-75) überdurchschnittlich (PR 76-100) 70,2 40,4 22,1 8,7 60,0 40,0 73,3 7,7 38,5 75,0 50,0 50,0 84,6 61,5 50,0 50,0 25,0 50,0 50,0 13,3 13,3 100,0 75,0 7,7 7,7 25,0 Abbildung 7: Darstellung der absoluten und relativen Häufigkeiten der auf den IGDSkalen erzielten Ergebnisse unterteilt nach den APOE-Phänotypen (N=140, nε2/ε2=2, nε2/ε3=15, nε2/ε4=2, nε3/3=104, nε3/4=13, nε4/4=4). Ein Prozentrang (PR) zwischen 0 und 24 gilt als „unterdurchschnittlich“, zwischen 25 und 75 als „durchschnittlich“ und zwischen 76 und 100 als „überdurchschnittlich“. - 41 - Auch die ε2/ε3- und ε3/ε4-Träger (n = 15 und n = 13) ähneln sich, wobei letztere höhere Werte im Gesamtscore erbringen (vgl. ε3/ε4: 30,8% überdurchschnittlich, 7,7% unter dem Durchschnitt, ε2/ε3: jeweils 20% unter- und überdurchschnittlich). Die umfangstärkste Gruppe der ε3/ε3-Träger (n = 104) zeichnet sich v.a. im verzögerten Abruf, verbalen Gedächtnis und Lernen aus. Unterdurchschnittliche Ergebnisse werden auf alle Skalen bezogen am häufigsten in den Aufgaben zum Kurzzeit-/ArbeitsGedächtnis erbracht (vgl. 23,1%). Insgesamt ist ihre Gedächtnisleistung zumeist als durchschnittlich einzustufen. 4.1.3 Zusammenfassung der deskriptiven Statistik Die zu den sechs Skalen verrechneten Gedächtnisleistungen der Sudienteilnehmer sind im Vergleich zur Normpopulation zumeist als durchschnittlich zu werten. In der Betrachtung der BDNF-Phänotypen (s. Abbildung 6, S. 38) fällt auf, dass die besten Ergebnissen auf der Skala verzögerter Abruf erbracht werden, welche sich aus der verzögerten Rekognition einer Wortliste, der verzögerten Reproduktion eines Textes und des verzögerten Abrufes von Figuren zusammensetzt. Die vergleichsweise schlechtesten Ergebnisse werden hinsichtlich des Kurzzeit-/Arbeitsgedächtnisses vorgelegt, zu dem die Zahlenspanne, das visuelle/verbale Arbeitsgedächtnis und die Exekutive Kontrolle zählen. Dabei scheint sich die Anwesenheit von BDNF-Met negativ auf das Leistungsniveau auszuwirken (vgl. Erfolg: Val-Val > Val-Met > Met-Met). Stehen die Phänotypen des APOE im Vordergrund (s. Abbildung 7, S. 40) zeigt sich eine ähnliche Verteilung der Stärken (verzögerter Abruf, verbales Gedächtnis) und Schwächen (Kurzzeit-/Arbeitsgedächtnis). Das Vorkommen eines ε4 Allels wirkt sich leistungsbezogen aber nicht so deutlich aus wie das von Methionin bei den BDNFVarianten. Zusammenfassend ist festzustellen, dass sich die Probanden durch die Fähigkeit, Gelerntes nach einer zeitlichen Verzögerung wieder abzurufen, auszeichnen. Das Kurzzeit-/ Arbeitsgedächtnis hingegen ist relativ gesehen als Schwäche zu werten. - 42 - 4.2 Analytische Statistik In Abhängigkeit vom Skalenniveau und den Ergebnissen des Kolmogorov-SmirnovTests (s. Anhang A3, S. 101) werden die Leistungsunterschiede zwischen den Genotypen des BDNF und APOE für intervallskalierte und normalverteilte Werte mit dem t-Test für unabhängige Gruppen (unter Berücksichtigung des Levene-Tests), für die intervallskalierten und nicht-normalverteilten mit dem Mann-Whitney-U-Test und für die nominalen Werte mit dem Pearson’schen Chi-Quadrat-Test berechnet. Obwohl es sich bei diesem Vorgehen um ein multiples Testen handelt, wird auf eine αAdjustierung verzichtet. Der Grund hierfür ist, dass wegen des explorativen Charakters dieser Studie die interessierenden Variablen als primäre anzusehen sind, die alle für die Beschreibung möglicher Unterschiede zwischen den Untersuchungsgruppen (sprich möglicher unterschiedlicher Gedächtnisleistungen bzgl. der Genotypen von BDNF und APOE) notwendig sind. Demzufolge muss jede Nullhypothese bezüglich jeder einzelnen Variable auf dem gleichen Signifikanz-Niveau zurückgewiesen werden. Oder anders ausgedrückt: die einzelnen Fehler erster Art werden mit dem Gesamtfehler erster Art α gleichgestellt. In solchen Fällen gibt es nach EMEA (2002) keine Tendenz oder Chance, das günstigste Ergebnis zu selektieren. Allerdings erhöht dieses Vorgehen den Fehler zweiter Art (falsches Akzeptieren, dass mindestens eine Nullhypothese wahr ist), was im schlimmsten Fall ein Aufsummieren aller β-Fehler, die mit den einzelnen Hypothesen in Verbindung gebracht werden, bedeutet. Diese Erhöhung des Fehlers zweiter Art wird in Kauf genommen. Werden in einer Untersuchung sehr viele Unterschiede bzw. Zusammenhänge getestet, so muss – auch wenn tatsächlich immer die Nullhypothese gilt – durch Zufallsfehler der eine oder andere signifikant erscheinen. Allerdings trifft dieser Einwand nur dann zu, wenn es sich um eine Vielzahl unabhängiger voneinander zufällig gemessener Zusammenhänge oder Unterschiede handelt (Janssen & Laatz, 2007, S. 344). Zumeist bestehen zwischen den Messvariablen aber systematische Beziehungen, so dass man davon ausgehen kann, dass nicht bei jeder Variablen ein unabhängiger Zufallsfehler auftritt, sondern der einmal aufgetretene Zufallsfehler sämtliche Daten durchzieht (ebd.). Dies berücksichtigend wird vor dem Durchführen der oben beschriebenen Testung auf Gruppenunterschiede geprüft, ob sich die Träger der interessierenden Allele bezüglich des Alters, des Geschlechts, der Ausbildungsjahre oder des Genotyps (bei Betrachtung des BDNF: gleichzeitiges Vorliegen/Fehlen von ε4, bei APOE: gleichzeitiges Vorliegen/Fehlen von Methionin) unterscheiden. Zudem wird - 43 - mittels Kovarianzanalysen und einfaktoriellen Varianzanalysen untersucht, ob die erbrachten Leistungen demographischen Einflüssen (Alter, Geschlecht, Bildung, Genotyp) unterliegen, und ob Interaktionen auftreten. Sofern signifikante phänotypische Unterschiede vorliegen, werden für diese jeweils die praktische Bedeutsamkeit über die Effektstärke d berechnet. Weitestgehend von der Stichprobengröße n unbeeinflusst (Bortz & Döring, 2006, S. 605f) ist die Effektstärke nach Cohen, (1969) ein dimensionsloses Maß. Mit der Formel d= µ A − µB σ (µA: Mittelwert der Gruppe A, µB: Mittelwert der Gruppe B, σ: gemeinsame Streuung) normiert sie im einfachsten Fall die Unterschiede zwischen den unabhängigen Experimentalgruppen auf die Streuung der Testwerte. Die gemeinsame Streuung aus beiden Gruppen berechnet sich nach Bortz & Döring (2006) mit der Formel σ= s A2 + s B2 2 (sA: Streuung in Gruppe A, sB: Streuung in Gruppe B). Allgemein werden Effektstärken von größer 0,50 als „groß“, von 0,50 bis 0,30 als „moderat“, von 0,30 bis 0,10 als „klein“ und kleiner als 0,10 als „trivial“ interpretiert (Bortz & Döring, 2006). Für die Skalen des IGD werden weiterhin bivariate Korrelationen (nach Pearson für normalverteilte) oder Spearman (für nicht-normalverteilte) mit den demographischen Variablen Alter, Geschlecht, Bildung und den Genotypen HUM-BDNF (kein Met, Met) und APOE (kein ε4, ε4) berechnet. Um bei signifikanten Zusammenhängen Kausalitätsaussagen treffen zu können, werden anschließend lineare Regressionsanalysen durchgeführt. Angesichts der ungerichteten Hypothesen wird zweiseitig getestet. Das zugrunde liegende Signifikanz-Niveau beträgt α = ,05. 4.2.1 Der Einfluss demographischer Variablen Um weitestgehend von phänotypischen Effekten sprechen zu können, werden zunächst mittels nichtorthogonaler faktorieller Designs diejenigen mnestischen Unterschiede zwischen den Untersuchungsgruppen aufgespürt, die auf den Einfluss demographischer Variablen rückführbar sind. Hierfür werden unter Beachtung des Levene- - 44 - Tests für die Allelvarianten von BDNF und APOE die kategorialen Variablen „Geschlecht“ und „Genotyp“ (bei BDNF: gleichzeitiges Vorliegen/Fehlen von ε4, bei APOE: gleichzeitiges Vorliegen/Fehlen von Methionin) als feste Faktoren, das „Alter“ wie auch die „Ausbildungsdauer“ als Kovariaten in die Analysen aufgenommen. Da es sich bei den Kovariaten um metrische Variablen handelt, die unweigerlich zu Mehrfachvergleichen führen, werden im Falle signifikanter Unterschiede post hoc Tests nach Bonferroni durchgeführt. Hierfür wird eine α-Adjustierung nach der Formel α’ = α/k (mit k = Anzahl der Gruppen) vorgenommen. Um die Erklärungskraft der einzelnen Faktoren und Kovariaten abschätzen zu können, werden für alle signifikanten Ergebnisse die Effektgrößen eta2 berechnet. Dabei gilt ein Wert von 0,10 als „kleine“, von 0,25 als „mittlere“ und von 0,40 als „große“ Wirkung (Bortz & Döring, 2006, S. 606). Ist eine Interaktion signifikant, so werden alle F-Tests der Haupteffekte verworfen, da das Berechnungsmodell für die Haupteffekte dann nicht mehr zutrifft (Janssen & Laatz, 2007). In Tabelle 5 (S. 45) sind die signifikanten Mittelwertsdifferenzen dargstellt. Val-Val (BDNF, n = 89): in der Gruppe der Val-Val Träger zeigen sich signifikante Geschlechtsunterschiede bezüglich der Untertests Paarassoziationslernen und Priming dahingehend, dass die männlichen Probanden beim intentionalen Lernen visuellverbaler Stimuli und in deren expliziten Reproduktion besser abschneiden als die weiblichen Teilnehmer (Paarassoziationslernen: Männer (n = 30): MW = 7,00, s = 0.64; Frauen (n = 59): MW=6,75, s=0,73; eta2 = 0,01). Die weiblichen Probanden hingegen sind den männlichen im impliziten Abruf zuvor gelernten verbalen Materials überlegen (Priming: Frauen (n = 59): MW = 3,95, s = 1,94; Männer (n = 30): MW = 3,07, s = 1,66; eta2 = 0,03). Des Weiteren ergibt sich in den Aufgaben zum visuellen Arbeitsgedächtnis und der Skala visuelles Gedächtnis ein signifikanter Unterschied zwischen den Val-Val Trägern, die zusätzlich mindestens ein ε4 Allel besitzen, und denen, die keines aufweisen. In beiden Fällen erbringen die Probanden ohne ε4 Allel bessere Leistungen, d.h. sie könne visuell-räumliche Informationen besser halten, gleichzeitig kognitiv manipulieren und frei reproduzieren (visuelles Arbeitsgedächtnis: kein ε4 (n = 78): MW = 16,74, s = 3,34; ε4 (n = 11): MW = 13,73, s = 4,63; eta2 = 0,13; visuelles Gedächtnis: kein ε4 (n = 78): MW = 52,90, s = 5,16; ε4 (n = 11) MW = 50,09, s = 5,01; eta2 = 0,08). Die signifikanten Alterseffekte bezüglich der Skalen Gesamtscore, Kurzzeit-/Arbeitsgedächtnis und des Unterstests Exekutive Kontrolle halten der Bonferroni-Korrektur nicht stand (vgl. α’ = ,003). - 45 - IGD Faktor/Kovariate Levene Statistik Signifikanz BDNF Val-Val Gesamtscore Kurzzeit-/Arbeitsgedächtnis visuelles Gedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle Paarassoziationslernen Priming Alter Alter Vorkommen ε4 Vorkommen ε4 Alter Geschlecht Geschlecht p=,117 F=1,86 p=,261 F=2,30 p=,100 F=4,91 p=,310 F= 7,13 p=,839 F=2,07 p=,000 U=765,00 p=,293 F=4,51 p=,046 p=,012 p=,031 p=,009 p=,025 p=,036 p=,037 Val-Met visuelles Arbeitsgedächtnis Alter p=,147 F=2,41 p=,035 Met-Met verzögerte Rekognition Geschlecht p=1,00 F=6,62 p=,028 Vorkommen Met Alter Vorkommen Met Alter Geschlecht*Met Vorkommen Met Vorkommen Met Vorkommen Met Alter Geschlecht*Met Alter Geschlecht Vorkommen Met Bildung p=,197 p=,197 p=,095 p=,095 p=,141 p=,928 p=,493 p=,824 p=,824 p=,094 p=,293 p=,053 p=,053 p=,053 F=17,44 F=2,25 F=11,38 F=2,76 F=4,74 F=5,27 F=7,20 F=7,58 F=2,42 F=6,98 F=1,91 F=7,40 F=6,73 F=2,63 p=,000 p=,011 p=,001 p=,002 p=,032 p=,024 p=,009 p=,007 p=,006 p=,010 p=,035 p=,008 p=,011 p=,010 Bildung Bildung Bildung p=,534 p=,497 p=,199 F=5,74 F=3,76 F=3,37 p=,005 p=,025 p=,035 APOE 2 kein ε4 Gesamtscore Kurzzeitgedächtnis Lernen verbales Gedächtnis Zahlenspanne Exekutive Kontrolle visuelles Lernen verz. Reproduktion Text Priming 3 ε4 1 verzögerter Abruf verbales Gedächtnis verz. Reproduktion Text 2 3 Met: Val-Met und Met-Met, kein ε4: ε2/ε2, ε2/ε3, ε3/ε3; ε4: ε2/ε4, ε3/ε4, ε4/ε4 Tabelle 5: Darstellung der mit der Kovarianzanalyse bzw. univariaten Varianzanalyse aufgedeckten signifikanten Unterschiede in den einzelnen Gedächtnisleistungen infolge demographischer Einflüsse unter Berücksichtigung des Levene-Tests (aufgeteilt nach den Genotypen von BDNF und APOE) Val-Met (BDNF, n = 39): auch der altersbedingte Unterschied hinsichtlich des visuellen Arbeitsgedächtnisses in der Val-Met Gruppe muss aufgrund des post hoc Tests verworfen werden (vgl. α’ = ,005). Met-Met (BDNF, n = 12): unter den Met-Met Trägern erbringen die Frauen in der Aufgabe zur verzögerten Rekognition der Wortliste bessere Resultate als die männlichen Teilnehmer (verzögerte Rekognition: Frauen (n = 6): MW = 14,67, s = 1,51; Männer (n = 6): MW = 12,33, s = 1,63; eta2 = 0,01), was bedeutet, dass die weiblichen - 46 - Probanden im Wiedererkennen zuvor gelernter verbaler Reize aus einer Menge von Distraktoren besser sind als ihre männlichen Mitstreiter. kein ε4 (εε2/εε2, ε2/εε3, ε3/εε3; APOE, n = 121): in dieser Gruppe sind zunächst Hinweise auf epistatische Effekte auffällig und zwar in der Form, dass sich das Vorkommen von BDNF-Met negativ auf die Leistung in den Aufgaben zur Zahlenspanne, Exekutiven Kontrolle und Priming wie auch bei den Skalen Gesamtscore, Kurzzeit-/Arbeitsgedächtnis und verbales Gedächtnis auswirkt. Dementsprechend sind Probanden, die weder ein ε4 Allel noch BDNF-Met vorweisen, beim kurzfristigen Behalten von Zahlenreihen zunehmender Komplexität (Zahlenspanne: kein Met (n = 78): MW = 9,13, s = 1,92; Met (n = 43): MW = 8,28, s = 1,82; eta2 = 0,07), beim Halten, kognitiven Manipulieren und freien Reproduzieren von visuell-verbalen Reizen (Exekutive Kontrolle: kein Met (n = 78): MW = 20,78, s = 5,11; Met (n = 43): MW = 19,14, s = 4,22; eta2 = 0,08) und auch beim Identifizieren von Fragmenten zuvor gelernter Wörter (Priming: kein Met (n = 78): MW = 3,55, s = 1,91; Met (n = 43): MW = 2,79, s = 1,57; eta2 = 0,07) den Probanden ohne ε4 Allel aber mit BDNF-Met überlegen. Dieser genotypische Vorteil setzt sich auch in den Skalen Gesamtscore, Kurzzeit-/Arbeitsgedächtnis und verbales Gedächtnis fort (Gesamtscore: kein Met (n = 78): MW = 188,70, s = 16,73; Met (n = 43): MW = 179,63, s = 16,23; eta2 = 0,16; Kurzzeit-/Arbeitsgedächtnis: kein Met (n = 78): MW = 56,12, s = 8,67; Met (n = 43): MW = 52,35, s = 7,57; eta2 = 0,11; verbales Gedächtnis: kein Met (n = 78): MW = 63,03, s = 6,51; Met (n = 43): MW = 60,95, s = 6,78; eta2 = 0,06). Geschlechtsspezifische Unterschiede zeigen sich in der Aufgabe zum Priming, in der die Frauen beim impliziten Abruf zuvor gelernten verbalen Materials besser als die Männer abschneiden (Priming: Frauen (n = 83): MW = 3,54, s = 1,90; Männer (n = 38): MW = 2,71, s = 1,51; eta2 = 0,08). Ein mittelgroßer Alterseffekt (eta2 = 0,30; s. Anhang 4, S. 104) liegt beim Kurz-/Arbeitsgedächtnis vor, wohingegen die altersbedingten signifikanten Unterschiede hinsichtlich des Gesamtscores, der Exekutiven Kontrolle und der verzögerten Preproduktion des Textes aufgrund der αAdjustierung verworfen werden (vgl. α’ = ,003). Auch der Bildungseffekt beim Priming hält der Bonferroni-Korrektur nicht stand (vgl. α’ = ,005). Da beim Untertest visuelles Lernen (eta2 = 0,07) und der Skala Lernen (eta2 = 0,05) signifikante Interaktionen zwischen dem Geschlecht und dem Vorkommen von BDNF-Met auftreten, werden die F-Tests der Haupteffekte verworfen. - 47 - ε4 (εε3/εε4, ε4/εε4; APOE, n = 19): bei den ε4-Allel Trägern sind von der Ausbildungsdauer abhängige Unterschiede bezüglich des verzögerten freien Reproduzierens eines Textes und der Skalen verbales Gedächtnis und verzögerter Abruf signifikant, wobei aber nur letzterer nach der α-Adjustierung bestehen bleibt (vgl. α’ = ,006; s. Anhang A4, S. 104). 4.2.2 Mnestische Unterschiede zwischen den BDNF-Genotypen Nach dem in Kapitel 4.2 (s. 42f) erläuterten Vorgehen werden zunächst die Gruppen „Val-Val vs. Val-Met“, „Val-Met vs. Met-Met“ und „Val-Val vs. Met-Met“ auf signifikante Unterschiede in ihren Gedächtnisleistungen geprüft. 4.2.2.1 Val-Val vs. Val-Met Die Gruppen Val-Val und Val-Met unterscheiden sich nicht bezüglich ihres Alters, des Geschlechts, der Ausbildungsdauer und des Vorkommens eines APOE ε4 Allels, so dass von einer Homogenität der Gruppen ausgegangen werden kann (s. Tabelle 6, S. 48). Bezüglich der Gedächtnisleistungen zeigen sich signifikante Mittelwertsdifferenzen in den Aufgaben zum Kurzzeit-/Arbeitsgedächtnis, zur Zahlenspanne und im Gesamtscore. Demnach sind die Val-Val Träger den Val-Met Trägern eindeutig (1) im kurzfristigen Behalten und Manipulieren von Informationen (t = 1,99, p = ,048), (2) insbesondere im kurzfristigen Behalten und Reproduzieren von Zahlenreihen zunehmender Komplexität (t = 2,23, p = ,027) und (3) im Gedächtnis als globales Konstrukt überlegen. Die praktische Bedeutung bzw. Relevanz der aufgedeckten Unterschiede ist mit dGesamtscore = 0,59, dKurzzeitgedächtnis = 0,55 und dZahlenspanne = 0,61 als groß zu interpretieren. - 48 - N=140 Demographie Alter [Jahren] Geschlecht* Bildung [Jahren] ε4-Allel IGD: Skalen Gesamtscore Kurzzeit-/Arbeitsgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis IGD: Subtests prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text verzögerte Reproduktion: Figuren Priming Val-Val n =89 MW (s) 25,0 (3,7) 16,9 (2,3) - Val-Met n =39 MW (s) Statistik 23,9 (2,4) U=1508,50 p=,237 2 χ =0,82 p=,365 17,0 (2,0) t=-,211 p=,833 2 χ =,215 p=,643 - 188,8 (16,2) 182,0 (16,4) t=2,18 p=,031 d=0,59 56,1 (8,4) 53,0 (7,5) t=1,99 p=,048 d=0,55 53,9 (3,5) 54,0 (3,5) U=1694,50 p=,829 48,0 (4,9) 47,1 (5,6) U=1533,00 p=,293 62,7 (6,4) 61,5 (7,0) t=0,94 p=,348 52,6 (5,2) 52,6 (4,5) t=-,07 p=,946 5,0 (1,4) 9,2 (1,9) 17,4 (2,5) 16,4 (3,6) 20,9 (4,8) 8,4 (1,0) 8,4 (1,2) 6,8 (0,6) 13,9 (2,8) 14,7 (3,1) 9,7 (0,7) 3,7 (1,9) 4,7 (1,3) 8,4 (1,8) 17,5 (2,1) 16,4 (3,7) 19,3 (4,2) 8,3 (1,2) 8,3 (1,0) 7,0 (0,2) 12,9 (4,1) 14,5 (3,1) 9,8 (0,5) 3,0 (1,6) U=1496,50 t=2,23 t=-0.36 U=1712,50 t=1,81 U=1659,00 U=1576,00 U=1621,50 U=1500,50 t=0,29 U=1678,00 U=1399,00 p=,184 p=,027 d=0,61 p=,716 p=,905 p=,072 p=,680 p=,344 p=,138 p=,218 p=,775 p=,630 p=,076 Tabelle 6: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Val und Val-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen ChiQuadrat-Test; d ist die Effektstärke nach Cohen (1969) mit Modifikation der Streuung nach Bortz & Döring (2006)) 4.2.2.2 Val-Val vs. Met-Met Die Gruppen Val-Val und Met-Met sind homogen bezüglich des Alters, des Geschlechts, der Ausbildungsdauer und des Vorkommens eines APOE ε4 Allels (s. Tabelle 7, S. 49). - 49 - N=140 Demographie Alter [Jahren] Geschlecht* Bildung [Jahren] ε4-Allel IGD: Skalen Gesamtscore Kurzzeit-/Arbeitsgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis IGD: Subtests prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text verzögerte Reproduktion: Figuren Priming Val-Val n =89 MW (s) 25,0 (3,7) 16,9 (2,3) - Met-Met n =12 MW (s) 16,4 (2,3) - U=442,00 2 χ =1,22 t=0,72 2 χ =,175 p=,331 p=,269 p=,471 p=,676 188,8 (16,2) 177,5 (15,0) 56,1 (8,4) 51,7 (7,5) 53,9 (3,5) 53,4 (3,8) 48,0 (4,9) 46,4 (4,4) 62,7 (6,4) 60,8 (5,3) 52,6 (5,2) 50,0 (5,7) t=2,30 t=1,72 U=493,00 U=409,50 t=0,94 t=1,58 p=,024 d=1,02 p=,088 p=,661 p=,190 p=,350 p=,118 - U=420,50 t=0,55 t=1,20 U=434,00 t=1,83 U=502,00 U=406,00 U=528,00 U=443,00 t=0,79 U=485,50 U=330,00 p=,197 p=,585 p=,235 p=,292 p=,071 p=,724 p=,122 p=,899 p=,333 p=,431 p=,434 p=,030 d=1,13 5,0 (1,4) 9,2 (1,9) 17,4 (2,5) 16,4 (3,6) 20,9 (4,8) 8,4 (1,0) 8,4 (1,2) 6,8 (0,6) 13,9 (2,8) 14,7 (3,1) 9,7 (0,7) 3,7 (1,9) 23,8 (2,3) Statistik 4,7 (1,1) 8,8 (2,0) 16,4 (3,2) 15,3 (3,9) 18,2 (5,1) 8,5 (0,8) 7,8 (1,4) 6,9 (0,3) 13,5 (1,9) 13,9 (3,3) 9,5 (1,2) 2,4 (1,3) - Tabelle 7: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Val und Met-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen ChiQuadrat-Test; d ist die Effektstärke nach Cohen (1969) mit Modifikation der Streuung nach Bortz & Döring (2006)) Die Val-Val Träger und die Met-Met Träger differieren signifikant in den Aufgaben zum Priming (U= 330,00, p = ,030) und bezüglich des Gesamtscores (t = 2,30, p = ,024). Demzufolge sind die Val-Val Träger im längerfristigen Behalten geprimter Informationen und im Gedächtnis als Globalmaß den Met-Met Trägern deutlich überlegen. Da die Effektstärken bei dGesamtscore = 1,02 und dPriming = 1,13 liegen, ist von einer hohen praktischen Relevanz der Ergebnisse auszugehen. - 50 - 4.2.2.3 Val-Met vs. Met-Met Es kann von einer Homogenität der Gruppen Val-Met und Met-Met bezüglich des Alters, Geschlechts, der Ausbildungsdauer und des Vorkommens eines APOE ε4 Allels ausgegangen werden (s. Tabelle 8). N=140 Demographie Alter [Jahren] Geschlecht* Bildung [Jahren] ε4-Allel IGD: Skalen Gesamtscore Kurzzeit-/Arbeitsgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis IGD: Subtests prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text verzögerte Reproduktion: Figuren Priming Val-Met n =39 MW (s) 23,9 (2,4) 17,0 (2,0) - Met-Met n =12 MW (s) 16,4 (2,3) - t=0,19 χ =2,53 t=0,89 2 χ =,011 p=,849 p=,112 p=,377 p=,915 182,0 (16,4) 177,5 (15,0) 53,0 (7,5) 51,7 (7,5) 54,0 (3,5) 53,4 (3,8) 47,1 (5,6) 46,4 (4,4) 61,5 (7,0) 60,8 (5,3) 52,6 (4,5) 50,0 (5,7) t=0,85 t=0,51 t=0,49 t=0,36 t=0,23 t=1,66 p=,397 p=,611 p=,624 p=,719 p=,775 p=,104 t=0,19 t=-0,79 t=1,42 t=0,88 t=0,77 t=-0,64 U=196,00 U=220,50 U=219,50 t=0,57 U=205,00 t=1,18 p=,848 p=,434 p=,163 p=,383 p=,447 p=,523 p=,358 p=,373 p=,744 p=,571 p=,308 p=,246 4,7 (1,3) 8,4 (1,8) 17,5 (2,1) 16,4 (3,7) 19,3 (4,2) 8,3 (1,2) 8,3 (1,0) 7,0 (0,2) 12,9 (4,1) 14,5 (3,1) 9,8 (0,5) 3,0 (1,6) 23,8 (2,3) Statistik 2 4,7 (1,1) 8,8 (2,0) 16,4 (3,2) 15,3 (3,9) 18,2 (5,1) 8,5 (0,8) 7,8 (1,4) 6,9 (0,3) 13,5 (1,9) 13,9 (3,3) 9,5 (1,2) 2,4 (1,3) Tabelle 8: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Met und Met-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen ChiQuadrat-Test) Die Prüfung auf Unterschiede zwischen den Mittelwerten bzw. den zentralen Tendenzen der Verteilungen der Skalen und Untertests in den Gruppen Val-Met und Met-Met erbringt keine signifikanten Ergebnisse. Folglich gleichen sich diese beiden Phänotypen des Val66Met-Polymorphismus in ihrem Einfluss auf die mnestischen Leistungen. - 51 - 4.2.2.4 Val-Val vs. Val-Met/Met-Met Aufgrund zweier Überlegungen wird eine Subgruppenanalyse zum systematischen Erfassen des Methionin-Effekts auf die Gedächtnisleistungen durchgeführt: (1) die Daten zeigen zwar einen Unterschied zwischen Val-Val gegenüber Val-Met bzw. MetMet auf, aber keinen zwischen homo- und heterozygoten Met-Allel Trägern (Val-Met vs. Met-Met); und (2) die Gruppe der Met-Met Träger fällt mit n = 12 klein aus, was eine erhöhte Gefahr des Fehlers zweiter Art in sich birgt (vgl. das Risiko des β-Fehlers steigt mit fallender Stichprobengröße; Janssen & Laatz, 2007, S.344). Es ist daher empfehlenswert, "(...) die Daten kleinerer Stichproben zu demselben Gegenstand so lange zu kumulieren, bis die Fallzahl einen hinreichend sicheren Schluss zwischen H0 und H1 zulässt.“ (a.a.O.). Dies berücksichtigend wird die Stichprobe in Abhängigkeit des Vorhandenseins von BDNF-Met in die Gruppen “kein Met“ (Val-Val, n = 89) und „Met“ (Val-Met / Met-Met, n = 51) unterteilt. Auch diese Gruppen unterscheiden sich nicht signifikant bezüglich ihres Alters, des Geschlechts, der Ausbildungsdauer und des Vorkommens eines APOE ε4 Allels, so dass von Homogenität ausgegangen werden kann (s. Tabelle 9, S.52). Die Subgruppenanalyse deckt signifikante Unterschiede in den Aufgaben zur Zahlenspanne (t = 2,08, p = ,039) zur Exekutiven Kontrolle (t = 2,29, p 0 ,024), zum Priming (U = 1729,00, p = ,017), bezüglich der Skala Kurzzeit-/Arbeitsgedächtnis (t = 2,41, p = ,017) und des Gesamtscores (t = 2,78, p = ,006) auf. Demnach schneiden die Träger eines homo- und/oder heterozygoten Met-Allels deutlich schlechter als die Val-ValTräger ab, wenn (1) Zahlenreihen nach kurzfristigem Behalten frei reproduziert werden sollen, (2) wenn ein Aufmerksamkeitsshift zwischen zwei zu merkenden visuellen Reizmustern und bei deren Abruf eine Transkodierung in verbale Information erforderlich ist und (3) wenn geprimte verbale Information wieder abgerufen werden soll. Außerdem liegt ihr (4) Kurzzeit-/Arbeitsgedächtnis und (5) Gedächtnis als globales Konstrukt deutlich unter denen der Val-Val Träger. Die praktische Relevanz ist mit dGesamtscore = 0,69, dKurzzeitgedächtnis = 0,61, dZahlenspanne = 0,53, dExekutive dPriming = 0,66 jeweils als groß zu werten. Kontrolle = 0,58 und - 52 - N=140 Demographie Alter [Jahren] Geschlecht* Bildung [Jahren] ε4-Allel IGD: Skalen Gesamtscore Kurzzeit-/Arbeitsgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis IGD: Subtests prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text verzögerte Reproduktion: Figuren Priming kein Met n =89 MW (s) 25,0 (3,7) 16,9 (2,3) - Met n =51 MW (s) Statistik 23,9 (2,3) U=1950,50 p=,164 2 χ =0,08 p=,777 16,8 (2,0) t=0,12 p=,904 2 χ =,306 p=,580 - 188,8 (16,2) 180,9 (16,1) t=2,78 p=,006 d=0,69 56,1 (8,4) 52,7 (7,4) t=2,41 p=,017 d=0,61 53,9 (3,5) 53,9 (3,6) U=2269,50 p=1,00 48,0 (4,9) 46,9 (5,3) U=1942,50 p=,156 62,7 (6,4) 61,3 (6,6) t=1,18 p=,241 52,6 (5,2) 52,0 (4,9) t=0,62 p=,538 5,0 (1,4) 9,2 (1,9) 17,4 (2,5) 16,4 (3,6) 20,9 (4,8) 8,4 (1,0) 8,4 (1,2) 6,8 (0,6) 13,9 (2,8) 14,7 (3,1) 9,7 (0,7) 3,7 (1,9) 4,7 (1,2) 8,5 (1,8) 17,3 (2,4) 16,2 (3,7) 19,0 (4,4) 8,3 (1,1) 8,2 (1,1) 7,0 (0,2) 13,0 (3,7) 14,4 (3,1) 9,8 (0,7) 2,9 (1,5) U=1917,00 t=2,08 t=0,22 U=2192,50 t=2,29 U=2225,00 U=1982,00 U=2149,50 U=1943,50 t=0,57 U=2260,50 U=1729,00 p=,104 p=,039 d=0,53 p=,825 p=,737 p=,024 d=0,58 p=,841 p=,158 p=,244 p=,153 p=,571 p=,951 p=,017 d=0,66 Tabelle 9: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen „kein Met“ (Val-Val) und „Met“ (Val-Met/Met-Met) mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen Chi-Quadrat-Test; d ist die Effektstärke nach Cohen (1969) mit Modifikation der Streuung nach Bortz & Döring (2006) 4.2.3 Mnestische Unterschiede zwischen den APOE-Genotypen Wie in Kapitel 4.2.2.4 (S. 51) beschrieben ist es zur Vermeidung eines übermäßig ansteigenden β-Fehlers ratsam, kleinerer Stichproben zu demselben Gegenstand so lange zu kumulieren, bis die Fallzahl einen hinreichend sicheren Schluss zwischen H0 und H1 zulässt (Janssen & Laatz, 2007). Eben diese Maßnahme ist auch beim APOEDatensatz vor der Analyse von Mittelwertsdifferenzen und Unterschieden in den - 53 - Verteilungen durchzuführen, weil die Besetzung der Allel-Kombinationen mit Ausnahme des Wildtyps (nε3/ε3 = 104) sehr gering ausfällt (vgl. nε2/ε2 = 2, nε2/ε4 = 2, nε4/ε4 = 4, nε3/ε4 = 13 und nε2/ε3 = 13). Nach der Dichotomisierung in „kein ε4“ (ε2/ε2, ε2/ε3, ε3/3; n = 121) und „ε4“ (ε2/ε4, ε3/ε4, ε4/ε4; n = 19) werden die in Kapitel 4.2 (S. 42f) erläuterten statistischen Berechnungen durchgeführt. Die Gruppen „kein ε4“ und „ε4“ sind als homogen zu betrachten, da keine signifikanten Unterschiede bezüglich des Alters, des Geschlechts, der Ausbildungsdauer und des Vorkommens eines BDNF Met-Allels vorliegen (s. Tabelle 10). N=140 Demographie Alter [Jahren] Geschlecht* Bildung [Jahren] Met-Allel IGD: Skalen Gesamtscore Kurzzeit-/Arbeitsgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis IGD: Subtests prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition: Wortliste verzögerte Reproduktion: Text verzögerte Reproduktion: Figuren Priming kein ε4 n = 121 MW (s) ε4 n = 19 MW (s) Statistik 24,3 (3,8) 16,8 (2,0) - 24,6 (3,3) U=1000,00 p=,360 2 χ =0,85 p=,356 16,9 (2,2) t=0,17 p=,863 2 χ =,306 p=,580 188,9 (12,6) 55,2 (6,2) 53,7 (3,7) 47,2 (4,2) 61,4 (5,3) 51,4 (4,9) 185,5 (17,1) t=-0,84 p=,400 54,8 (8,5) t=-0,23 p=,822 53,9 (3,5) U=1148,50 p=,995 47,7 (5,2) U=1010,00 p=,395 62,3 (6,7) t=0,58 p=,566 52,5 (5,1) t=0,91 p=,366 5,3 (1,2) 9,4 (1,7) 17,4 (2,6) 14,7 (4,3) 20,3 (4,1) 8,2 (0,8) 8,5 (0,6) 6,8 (0,9) 13,6 (2,1) 14,0 (3,6) 9,8 (0,5) 3,9 (1,6) 4,8 (1,3) 8,8 (1,9) 17,3 (2,5) 16,5 (3,5) 20,2 (4,9) 8,4 (1,1) 8,3 (1,2) 6,9 (0,4) 13,6 (3,3) 14,7 (3,1) 9,7 (0,7) 3,3 (1,8) U=909,00 t=-1,24 U=1097,50 U=851,50 t=-0,10 U=985,00 U=1098,50 U=1129,00 U=1051,50 U=1025,50 U=1144,00 U=879,50 p=,119 p=,205 p=,749 p=,068 p=,921 p=,296 p=,725 p=,780 p=,546 p=,448 p=,958 p=,095 Tabelle 10: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den APOE-Gruppen „kein ε4“ (ε2/ε2, ε2/ε3, ε3/3) und „ε4“ (ε2/ε4, ε3/ε4, ε4/ε4; mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen Chi-Quadrat-Test - 54 - Die Prüfung auf Unterschiede zwischen den Mittelwerten bzw. den zentralen Tendenzen der Verteilungen der Skalen und Untertests in den Gruppen „kein ε4“ (ε2/ε2, ε2/ε3, ε3/3) und „ε4“ (ε2/ε4, ε3/ε4, ε4/ε4) erbringt keine signifikanten Ergebnisse. Demzufolge wirkt sich die Anwesenheit mindestens eines ε4-Allels weder positiv noch negativ auf die mnestischen Leistungen aus. 4.2.4 Zusammenhänge mit demographischne Variablen und der Einfluss des Lebensalters Neben den auf die Polymorphismen der Gene BDNF und APOE zurückführbaren Unterschieden in den Gedächtnisleistungen interessiert auch, inwieweit die mnestischen Funktionen mit den demographischen Variablen zusammenhängen. Hierfür werden bivariate Korrelationen unter Berücksichtigung des Skalenniveaus und der Normalverteilungsvoraussetzung (vgl. Pearson bei normalverteilten und intervallskalierten Variablen, sonst Spearman-Rho) berechnet. Außerdem wird in Einklang mit Cleff (2008) davon ausgegangen, dass die Korrelation nach Pearson auch für die Kombination einer dichotomen mit einer metrischen Variablen angewendet werden darf. Dies wird damit begründet, dass eine mit „0“ und „1“ kodierte Variable auch „metrisiert“ betrachtet werden kann (z.B. bei Geschlecht: „Nimmt die Ausprägung der Variablen Geschlecht den Wert eins an, desto weiblicher ist die Person. Nimmt die Ausprägung den Wert null an, umso männlicher ist der Befragte.“, a.a.O., S.125). Es wird wiederum zweiseitig auf einem Signifikanzniveau von α = 0,05 getestet. Zwei Anmerkungen sind dem hinzuzufügen: (1) auf eine korrelative Analyse der einzelnen Untertests wird verzichtet, da sich jene in den jeweiligen Skalen zusammengefasst abbilden; (2) die Tatsache, dass bei Korrelationen prinzipiell keine kausalen Schlüsse gezogen werden können, wird als gegeben vorausgesetzt und in der weiteren Ergebnisdarstellung nicht mehr explizit erwähnt. 4.2.4.1 Zusammenhänge der Phänotypen von BDNF Val66Met und APOE-εε4 mit den demographischen Variablen Der Datensatz wird separat für BDNF und APOE betrachtet und analog zu Kapitel 4.2.2.4 (S. 51) und Kapitel 4.2.3 (S. 52) jeweils nach der Anwesenheit der kritischen Genotypen (BDNF: Val-Val und Val-Met/Met-Met, APOE: kein ε4 und ε4) dichotomisiert. In die korrelativen Analysen gehen die IGD-Skalen, die dichotomisierten Genoty- - 55 - pen, das Lebensalter, das Geschlecht und die Anzahl der Ausbildungsjahre ein (Anhang A5, S. 105). Wie sich gezeigt hat, liegen signifikante Zusammenhänge ausschließlich zwischen den IGD-Skalen und dem Alter vor. Jene sind in Tabelle 11 abgebildet. N=140 IGD BDNF * Alter Gesamtscore ‡ Kurzzeitgedächtnis ‡ Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis Val-Val r=-,219 p=,039 r=-,247 p=,020 ‡ ‡ ‡ † r=-,004 p=,969 ‡ r=-,189 p=,076 † r=-,234 p=,027 ‡ Val-Met/Met-Met † r=-,062 p=,668 r=-,060 p=,578 † † APOE * Alter ‡ r=-,001 p=,992 ‡ r=-,187 p=,189 ‡ r=-,076 p=,594 ‡ r=-,076 p=,595 ‡ r=,-028 p=,843 ‡ kein ε4 r=-,160 p=,079 r=-,180 p=,048 r=-,131 p=,151 r=-,174 p=,057 r=-,212 p=,020 r=-,117 p=,200 † † ε4 r=-,002 p=,992 r=-,025 p=,918 † r=,318 p=,185 † r=-,031 p=,898 † r=-,014 p=,956 † r=,239 p=,325 Tabelle 11: bivariate Korrelationen zwischen den IGD-Skalen und dem Lebensalter gruppiert nach dem Auftreten der kritischen Genotypen von HUM-BDNF und APOE († Korrelation nach Pearson, ‡ Korrelation nach Spearman) Hinsichtlich des BDNF-Polymorphismus fällt auf, dass in der Gruppe der Va-Val Träger mit zunehmenden Alter das Kurzeit-/Arbeitsgedächtnis (r = -,274, p = ,020) das verbale Gedächtnis (r = -,234, p = ,027) wie auch das Gedächtnis als Gesamtkonstrukt gesehen (r = -,219, p = ,039) signifikant abnimmt. Hingegen liegen in der Gruppe der Val-Met/Met-Met Träger keinerlei signifikante Zusammenhänge zwischen den Gedächtnisleistungen und dem Lebensalter vor. Ähnlich verhält es sich in der Betrachtung der dichotomisierten APOE-Genotypen: während in Abwesenheit des ε4-Allels das Kurzzeit-/Arbeitsgedächtnis (r = -,180, p = ,048) und das verbale Gedächtnis (r = -,212, p = ,020) signifikant negativ mit dem Lebensalter interkorrelieren, finden sich keine signifikanten Zusammenhänge bei den ε4-Trägern. 4.2.4.2 Die Abhängigkeit der Phänotypen BDNF Val66Met und APOE-εε4 vom Alter Wie oben ausgeführt, bestehen signifikant negative Zusammenhänge zwischen einzelnen Skalen des IGD und dem Lebensalter. Auffällig ist, dass jene nur für die Varianten der Gene HUM-BDNF und APOE auftreten, die in der bisherigen Datenanalyse als unbeeinträchtigt gegolten haben (vgl. BDNF: Val-Val, APOE: ε2/ε2, ε2/ε3 und ε3/ε3). Die eigentlich als kritisch geltenden Allel-Konstellationen (BDNF: Val-Met und Met-Met, - 56 - APOE: ε4) weisen hingegen keinen signifikanten Zusammenhang zwischen den IGDSkalen und dem Lebensalter auf. Mittels einer linearen Regressionsanalyse soll nun der funktionale Zusammenhang und dessen Stärke zwischen den betreffenden IGD-Skalen (Kriteriumsvariablen) und dem Lebensalter (Prädiktorvariable) unter Berücksichtigung der interessierenden Genotypen untersucht werden. Trotz fehlender signifikinater Zusammenhänge zwischen den IGD-Skalen und den Variablen Geschlecht, Bildung und Vorkommen von Methionin bzw. ε4 wurden diese zum Ausschluss latenter Effekte in der Regressionsanalyse mit berücksichtigt. Zunächst wird der Zusammenhang zwischen der Skala Gesamtscore und dem Lebensalter für die Gruppen Val-Val und Val-Met/Met-Met dargelegt (s. Abbildung 8). Abbildung 8: Ergebnisse des IGD-Gesamtscores in Abhängigkeit vom Lebensalter und den Polymorphismen des Gens HUM-BDNF (Val-Val und Val-Met/Met-Met), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden - 57 - Das Streudiagramm verdeutlicht, dass (1) die Gesamtscores der Val-Val Träger über denen der Val-Met-/Met-Met Träger liegen, (2) bei den Val-Val Trägern die Gesamtscores in Abhängigkeit vom Alter abnehmen, während die Leistung bei den Val-Met/Met-Met Trägern relativ stabil bleibt, und (3) sich die Gesamtscores der beiden Subgruppen aller Wahrscheinlichkeit nach jenseits des 35. Lebensjahres annähern. Die für die Val-Val Gruppe berechnete Regressionsanalyse egibt für den Regressionskoeffizient Alter einen Ordinatenabschnitt von 216,63 (s = 11,38, p = ,000) und eine Steigung von -1,11 (s= 0,45, p = ,015). Demnach ist bei den homozygoten Val-Trägern eine Einbuße von etwa einem Punkt pro Lebensjahr auf der Skala Gesamtscore zu erwarten. Die ANOVA ist mit F = 6,11 und p = ,015 signifikant. Da es sich um eine einfache Regression handelt, fällt das Bestimmtheitsmaß R2 mit 0,07 klein aus. Die in die multiple lineare Regression aufgenommenen Prädiktorvariablen Geschlecht (Beta = ,089, p = ,418), Bildung (Beta = -,014, p = ,895) und Vorkommen von ε4 (Beta = ,024, p = ,823) haben keinen bedeutsamen Einfluss auf den Gesamtscore der ValVal Träger (vgl. F = ,249, p = ,861, R2 = 0,01). In der Regressionsanalyse für die Val-Met/Met-Met Träger ist die ANOVA mit F = 0,186 und p = ,668 nicht signifikant. Zwar ist tendenziell eine Abnahme des Gesamtscores von –0,43 Punkten (s = 0,99) pro Lebensjahr festzustellen, jedoch kann dieses Ergebnis nicht verallgemeinert werden (p = ,668). Ein ähnlicher funktionaler Zusammenhang zwischen dem Lebensalter und der Gedächtnisleistung findet sich bezüglich der Skala Kurzzeit-/Arbeitsgedächtnis. Wiederum liegen die von den Val-Val Trägern erbrachten Leistungen zunächst über denen der Val-Met-/Met-Met Gruppe, nehmen mit fortschreitendem Alter ab und nähern sich denen der Met-Träger an bzw. unterschreiten jene mit dem Beginn des dritten Lebensjahrzehnts (s. Abbildung 9, S. 58). - 58 - Abbildung 9: Ergebnisse der IGD-Skala Kurzzeit-/Arbeitsgedächtnis in Abhängigkeit vom Lebensalter und den Polymorphismen des Gens HUM-BDNF (Val-Val und ValMet/Met-Met), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Die Regressionsanalyse deckt bei den Val-Val Trägern einen jährlichen Abfall des Kurzzeit-/Arbeitsgedächtnis-Wertes von etwas mehr als einem halben Punkt auf (vgl. Regressionskoeffizient Alter mit einem Ordinatenabschnitt von 72,06, s = 5,82, p = ,000 und einer Steigung von -0,64, s = 0,23, p = ,007). Die ANOVA ist mit F = 7,70 und p = ,007 signifikant. Die Prädiktorvariablen Geschlecht (Beta = ,078, p = ,474), Bildung (Beta = -,047, p = ,666) und Vorkommen von ε4 (Beta = -,009, p = ,931) beeinflussen nicht die von den Val-Val Trägern erbrachten Leistungen (R2 = 0,10, F = 0,26, p = ,855). Bei den Val-Met/Met-Met Trägern ist die ANOVA mit F = 0,000 und p = ,992 allerdings nicht signifikant. Die tendenzielle Abnahme ihres Kurzzeit-/Arbeitsgedächtnisses von -0,01 Punkten (s = 0,46, p = ,992) pro Lebensjahr kann nicht verallgemeinert werden. - 59 - Bei der Skala verbales Gedächtnis tritt die mit dem Alter einhergehende Annhäherung bzw. Unterschreitung der von der Val-Val Gruppe im Vergleich zur Val-Met/Met-Met Gruppe erbrachten Leistungen etwa zur Mitte des dritten Lebensjahrzehnts auf (Abbildung 10). Abbildung 10: Ergebnisse der IGD-Skala verbales Gedächtnis in Abhängigkeit vom Lebensalter und den Polymorphismen des Gens HUM-BDNF (Val-Val und ValMet/Met-Met), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Mit jedem neuen Lebensjahr verlieren die Val-Val Träger knapp einen halben Punkt auf der Skala verbales Gedächtnis (vgl. Regressionskoeffizient Alter mit einem Ordinatenabschnitt von 73,77, s = 4,50, p = ,000 und einer Steigung von -0,45, s = 0,18, p = ,014; ANOVA: F = 6,23 und p = ,014; R2 = 0,07). Diese altersbedingte Abnahme des verbalen Gedächtnisses in der Val-Val Gruppe ist nicht auf den Einfluss des Geschlechts (Beta = ,069, p = ,519), der Bildung (Beta = -,142, p = ,187) oder das Vorkommen von ε4 (Beta = -,152, p = ,156) zurückzuführen (vgl. R2 = ,050, F = 1,47, p = ,230). - 60 - Bei den Val-Met-/Met-Met Trägern ist die tendenzielle jährliche Abnahme des verbalen Gedächtnisses von 0,22 Punkten (s = 0,40, p = ,595) nicht verallgemeinerbar (vgl. ANOVA: F = 0,29 und p = ,595; R2 = 0,08). Für die nach dem Vorhandensein eines homo-/heterozygoten ε4-Allels dichotomisierte Subgruppe ergibt sich beim Kurzzeit-/Arbeitsgedächtnis ein ähnliches Bild (s. Abbildung 11). Abbildung 11: Ergebnisse der IGD-Skala Kurzzeit-/Arbeitsgedächtnis in Abhängigkeit vom Lebensalter und den Polymorphismen des Gens APOE (kein ε4 und ε4), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Wie dem Streudiagramm zu entnehmen ist, liegen die Kurzzeit-/ArbeitsgedächtnisWerte der Probanden, die kein ε4 Allel aufweisen, über den Werten der Probanden, die mindestens eine ε4 Isoform besitzen. Während das Kurzzeit-/Arbeitsgedächtnis zweite- - 61 - rer realitv stabil zu bleiben scheint, fallen die Nicht-ε4 Träger in ihren Leistungen ab, was noch vor dem Erreichen des 30. Lebensjahres zu einer Angleichung der Gruppen bzw. einem Vorteil der ε4 Träger gegenüber den Nicht-Trägern führt. Probanden, die kein ε4 Allel aufweisen, verlieren pro Jahr etwa einen halben Punkt auf der Skala Kurzzeit-/Arbeitsgedächtnis (vgl. Regressionskoeffizient Alter: Steigung von 0,50, s = 0,23, p = ,033; Ordinatenabschnitt von 67,19, s = 5,80, p = ,000; ANOVA: F = 4,67, p = ,033; R2 = 0,04). Diese altersbedingte Abnahme des Kurzzeit-/Arbeitsgedächtnisses bei Probanden, die keine ε4 Variante aufweisen, ist nicht auf den Einfluss des Geschlechts (Beta = ,067, p = ,469) oder der Bildung (Beta = -,004, p = ,961) zurückzuführen (mit R2 = ,050, F = 1,47, p = ,230). Allerdings spielt das zusätzliche Vorkommen von BDNF-Met eine statistisch bedeutsame Rolle (Beta = -,203, p = ,028). Bei den ε4 Trägern ist die tendenzielle jährliche Abnahme des Kurzzeit-/Arbeitsgedächtnisses von 0,04 Punkten (s = 0,40, p = ,918) nicht verallgemeinerbar (vgl. ANOVA: F = 0,01 und p = ,918; R2 = 0,001). Auch noch vor dem 30. Lebensjahr tritt die altersbedingte Annhäherung bzw. Unterschreitung der von den Nicht-ε4 Trägern im Vergleich zur ε4-Allel Gruppe erbrachten Leistungen im verbalen Gedächtnis auf (Abbildung 12, S. 62). Pro Jahr verlieren die Nicht-ε4 Träger knapp einen halben Punkt auf der Skala verbales Gedächtnis (vgl. Regressionskoeffizient Alter mit einem Ordinatenabschnitt von 73,00, s = 4,54, p = ,000 und einer Steigung von -0,43, s = 0,18, p = ,019; ANOVA: F = 5,62 und p = ,019; R2 = 0,05). Diese altersbedingte Abnahme des verbalen Gedächtnisses in der Gruppe ohne ε4 Isoform ist nicht auf den Einfluss des Geschlechts (Beta = ,113, p = ,218), der Bildung (Beta = -,148, p = ,106) oder das Vorkommen von BDNF-Met (Beta = -,147, p = ,108) zurückzuführen (vgl. R2 = 0,06, F = 2,38, p = ,073). Bei den ε4 Trägern ist die tendenzielle jährliche Abnahme des verbalen Gedächtnisses von 0,02 Punkten (s = 0,34, p = ,956) nicht verallgemeinerbar (vgl. ANOVA: F = 0,003, p = ,956; R2 = 0,000). - 62 - Abbildung 12: Ergebnisse der IGD-Skala verbales Gedächtnis in Abhängigkeit vom Lebensalter und den Polymorphismen des Gens APOE (kein ε4 und ε4), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Einschränkend muss jedoch erwähnt werden, dass in der Gruppe der Met-Träger (BDNF: Val-Met/Met-Met) nur ein Proband das 30. Lebensjahr überschritten hat; im Vergleich dazu sind 14 Val-Val Träger älter als 30 Jahre. Und auch unter den ε4Trägern finden sich nur zwei im dritten Lebensjahrzehnt im Gegensatz zu 13 bei den Nicht-ε4 Trägern. Infolgedessen werden die funktionalen Zusammenhänge zwischen den Gedächtnisleistungen nochmals für die 19- bis 29-jährigen Probanden mit den interessierenden Genvarianten berechnet (s. Tabelle 12, S. 63). Weder bei den 19- bis 29-jährigen Val-Val Trägern, noch bei den ebenso alten MetTrägern ist der funktionale Zusammenhang zwischen dem Alter und dem Kurzzeit-/ Arbeitsgedächtnis, dem verbalen Gedächtnis oder dem Gedächtnis als Gesamtkonstrukt signifikant. Auch in der Gruppe der jüngeren Nicht-ε4 Träger gibt es keine signifikante altersbedingte Verschlechterung des Arbeits-/Kurzzeitgedächtnisses. - 63 - Allerdings übt das Alter einen signifikanten Einfluss auf ihr verbales Gedächtnis aus. Dieser Effekt liegt bei den ε4 Trägern nicht vor. IGD-Skala Steigung Signifikanz F* Signifikanz* R 2 BDNF Val-Val Gesamtscore Kurzzeit-/Arbeitsgedächtnis verbales Gedächtnis -0,88 -0,61 -0,40 p=,254 p=,084 p=,180 1,32 3,07 1,83 p=,254 p=,084 p=,180 Met Gesamtscore Kurzzeit-/Arbeitsgedächtnis verbales Gedächtnis -1,07 -0,08 -0,53 p=,332 p=,871 p=,240 0,96 0,03 1,42 p=,332 0,02 p=,871 0,001 p=,240 0,03 APOE kein ε4 Kurzzeit-/Arbeitsgedächtnis verbales Gedächtnis -0,56 -0,61 p=,087 p=,024 2,30 5,25 p=,087 p=,024 0,03 0,05 ε4 Kurzzeit-/Arbeitsgedächtnis verbales Gedächtnis 0,84 0,99 p=,272 p=,149 1,30 2,31 p=,272 p=,149 0,08 0,13 0,02 0,04 0,03 * ANOVA Tabelle 12: Ergebnisse der linearen Regression mit den IGD-Skalen als Kriteriumsvariablen und dem Lebensalter als Prädiktorvariable unter Berücksichtigung der Genotypen von HUM-BDNF und APOE Die altersbedingte Abnahme des verbalen Gedächtnisses in der Gruppe ohne ε4 Allel ist nicht auf den Einfluss des Geschlechts (Beta = ,152, p = ,115) oder der Bildung (Beta = -,562, p = ,072) zurückzuführen (R2 = 0,12, F = 4,05, p = ,009). Allerdings spielt das gleichzeitge Vorkommen von BDNF-Met eine bedeutsame Rolle, welches eine jährliche Einbuße von 2,8 Punkten bewirkt (s = 1,28, p = ,030; F = 4,82, p = ,030). Gemeinsam mit dem Lebensalter erklärt das Vorkommen von BDNF-Met 10 Prozent der durch die lineare Regression aufgeklärten Varianz (R2 = 0,10). Unter Berücksichtigung der vorausgegangenen Regressionsanalysen, die unter Einschluss der über 30-jährigen Probanden einen signifikanten Alterseffekt aufgedeckt haben, kann gemutmaßt werden, dass es erst ab dem dritten Lebensjahrzehnt zu einer Wecheslwirkung zwischen dem Altern und den genetischen Varianten Val-Val (BDNF) und ε4 (APOE) kommt. Unterstützt wird diese Annahme durch die zumeist negativen Steigungen der Regressionsgeraden bei den jüngeren Studienteilnehmern (s. Tabelle 12). - 64 - 4.2.5 Zusammenfassung der analytischen Statistik Demographische Einflüsse: mittels nichtorthogonaler faktorieller Designs konnte gezeigt werden, dass die innerhalb der interessierenden Genvarianten von HUM-BDNF und APOE gemessenen Gedächtnisleistungen teilweise von demographischen Einflüssen mitbestimmt werden. So gibt es geschlechtsspezifische Unterschiede in der Gruppe der homozygoten Valin-Träger hinsichtlich des Primings (Frauen besser als Männer) und des Paarassoziationslernens (Männer besser als Frauen) wie auch eine Genwechselwirkung mit dem ε4 Allel beim visuellen Arbeitsgedächtnis und dem visuellen Gedächtnis (beide Male erweist sich das Vorkommen mindestens eines ε4 Allels als nachteilig). In der Met-Met Gruppe wirkt sich das weibliche Geschlecht förderlich auf die verzögerte Rekognition einer zuvor gelernten Wortliste aus. Hingegen bleiben die von den Val-Met Trägern erbrachten Gedächtnisleistungen unbeeinflusst von den untersuchten demographischen Variablen. In der faktoriellen Analyse der APOE-Varianten finden sich epistatische Hinweise bei der Zahlenspanne, Exekutiven Kontrolle, beim Priming, Gesamtscore, Kurzzeit-/ Arbeitsgedächtnis und verbalen Gedächtnis dahingehend, dass die Nicht-ε4 AllelTräger mit mindestens einer BDNF-Met-Isoform schlechter abschneiden als Nicht-ε4 Allel Träger mit der BDNF-Variante Val-Val. Außerdem sind bei den Nicht-ε4 AllelTrägern die Frauen den Männern im Priming überlegen, und das Alter hat einen signifikanten Einfluss auf die Ergebnisse im Kurzzeit-/Arbeitsgedächtnis. Die ε4 Träger ihrerseits zeigen bildungsabhängige Leistungen im verzögerten Abruf verbaler und nonverbaler Stimuli. Die Erklärungskraft (eta2) der einzelnen Faktoren und Kovariaten ist zumeist (sehr) klein, was die Aufdeckung phänotypisch bedingter Unterschiede in den Mittelwertsvergleichen wahrscheinlicher macht. Unterschiede zwischen den Genvarianten von BDNF und APOE: die homozygoten Valin-Träger erbringen bessere Ergebnisse als die Val-Met Träger im Gesamtscore, beim Kurzzeit-/Arbeitsgedächtnis und in der Zahlenspanne. Auch sind sie den Met-Met Trägern im Priming und Gesamtscore überlegen. Keine signifikanten Unterschiede deckt der Vergleich von Val-Met mit Met-Met auf, weshalb der Datensatz in die Subgruppen „kein Met“ und „Met“ dichotomisert und nochmals auf Unterschiede geprüft wurde. Signifikante Differenzen ergeben sich bezüglich des Gesamtscores, des Kurzzeit-/Arbeitsgedächtnisses, der Zahlenspanne, der Exekutiven Kontrolle und des - 65 - Primings. Wiederum erweist sich die Anwesenheit von BDNF-Met als nachteilig. Dass die aufgedeckten signifikanten Differenzen auch von praktischer Bedeutsamkeit sind, zeigen die durchgehend als „groß“ zu interpretierenden Effektstärken. Der Vergleich von Nicht-ε4 Allel-Trägern mit ε4 Trägern erbringt keinerlei signifikante Unterschiede. Demzufolge wirkt sich die Anwesenheit mindestens eines APOE ε4 Allels weder positiv noch negativ auf die mnestischen Leistungen aus. Zusammenhänge und Prognosen: wie gezeigt werden konnte existieren signifikante Unterschiede innerhalb der untersuchten Genvarianten von BDNF und APOE, die durch demographische Einflüsse verursacht sind, und es gibt auch Unterschiede zwischen den BDNF- bzw. APOE-Genotypen, die eine genetische Disposition oder auch Vulnerabilität in Bezug auf die gemessenen mnestischen Leistungen widerspiegeln. Interessant erschienen deshalb die Zusammenhänge zwischen den phänotypischen Gedächtnisleistungen und den demographischen Variablen, die als Grundlage für prognostische Aussagen herangezogen werden können. Zunächst fällt auf, dass unter den demographischen Variablen allein das Alter und nur mit einzelnen Gedächtnisaspekten der Val-Val Träger und Nicht-ε4-Allel Träger interkorreliert. Die weiterführenden Analysen verdeutlichen, dass das Gedächtnis als Gesamtkonstrukt (Gesamtscore), das Kurzzeit-/Arbeitsgedächtnis und das verbale Gedächtnis bei den homozygoten Val-Trägern und das Kurzzeit-/Arbeitsgedächtnis mitsamt den verbalen Gedächtnis bei den Nicht-ε4 Allel-Trägern mit dem zunehmenden Lebensalter kontinuierlich abnimmt. Hingegen bleiben die genannten mnestischen Leistungen in den korrespondierenden Gruppen der Met- bzw. ε4-Träger relativ konstant. Die naheliegende Folgerung daraus ist, dass die als „erfolgreich“ geltenden Träger der BDNF-Variante „Val-Val“ und der APOE-Isoformen „ε2/ε2, ε2/ε3, ε3/ε3“ sich mit den Jahren den „benachteiligten“ Met- und ε4-Trägern annähern und diesen wahrscheinlich sogar im Laufe des Lebens unterlegen sind. Wie weiterführende Analysen gezeigt haben, scheint dieser funktionale Zusammenhang zwischen dem Lebensalter und den Varianten „Val-Val“ bzw. „kein ε4“ ab dem dritten Lebensjahrzehnt aufzutreten. Eine Ausnahme stellt die altersbedingte Verschlechterung des verbalen Gedächtnisses bei den Nicht-ε4 Trägern dar, welche bereits zwischen dem 19. und 29. Lebensjahr beginnt und mit dem gleichzeitigen Vorkommen von BDNF-Met zusammenhängt. - 66 - 5 Diskussion 5.1 BDNF und Gedächtnis 5.1.1 Normativer Vergleich: Val-Val liegt vorne Im normativen Vergleich erbringen die Probanden unabhängig von ihrem BDNFPhänotyp die besten Ergebnisse auf der Skala verzögerter Abruf, welche sich aus der verzögerten Rekognition einer Wortliste, der verzögerten Reproduktion eines Textes und des verzögerten Abrufes von Figuren zusammensetzt. Die vergleichsweise schlechtesten Ergebnisse liegen hinsichtlich des Kurzzeit-/Arbeitsgedächtnisses vor, zu dem die Zahlenspanne, das visuelle/verbale Arbeitsgedächtnis und die Exekutive Kontrolle zählen. Dabei scheint sich die Anwesenheit von Methionin negativ auf das Leistungsniveau auszuwirken (vgl. Kapitel 4.1.1, S. 37ff). Wenn auch eine Rangfolge in dem Sinne zu bestehen scheint, dass Probanden mit homozygoten Valin (n = 89; 30 Männer, 59 Frauen) mehr regelrechte bis überdurchschnittliche Testergebnisse erzielen als die Val-Met Träger (n = 39; 10 Männer, 29 Frauen), und diese wiederum mehr als die Teilnehmer mit homozygotem Methionin (n = 12; 6 Männer, 6 Frauen), zeichnet sich die gesamte Studienpopulation durch die Fähigkeit aus, Gelerntes nach zeitlicher Verzögerung wieder abzurufen. Das Kurzzeit-/ Arbeitsgedächtnis hingegen ist relativ gesehen als schwächste Leistung zu werten. Eventuell liegt bei Letzterem ein Artefakt durch den nachmittäglichen Messzeitpunkt (16:00-17:00 Uhr) vor. Da die Testungen aber immer zur selben Zeit durchgeführt worden sind, handelt es sich bei dem möglichen infradianen Leistungstief gewissermaßen um eine kontrollierte Störvariable. 5.1.2 Demographische Einflüsse: epistatische Hinweise in der Val-Val Gruppe Varianzanalytisch wurde untersucht, inwieweit mögliche mnestische Unterschiede zwischen den Genvarianten des BDNF durch demographische Variablen wie das Alter, die Ausbildungsdauer, das Geschlecht oder das Vorliegen bzw. Fehlen eines APOE ε4 Allels beeinflusst werden (s. Kapitel 4.2.4.1, S. 54f). Geschlechtsspezifische Effekte treten innerhalb der Val-Val Gruppe (Frauen sind im Priming besser als Männer, Männer sind den Frauen im Paarassoziationslernen überlegen) und bei den Met-Met Trägern (das weibliche Gechlecht wirkt sich förderlich auf die verzögerte Rekognition einer zuvor gelernten Wortliste aus) auf. Dass - 67 - Aufgaben zum verbalen Gedächtnis den stärksten Unterschied zugunsten des weiblichen Geschlechts ausmachen, ist in der Literatur hinlänglich bekannt (Bleeker et al., 1988, Kramer et al., 1988, Herlitz et al., 1997, Chipman & Kimura, 1998). Was bislang aber nicht berichtet wurde, ist eine bei den Val-Val Trägern auftretende Genwechselwirkung mit dem ε4 Allel in den Aufgaben zum visuellen Arbeitsgedächtnis und dem visuellen Gedächtnis. Beide Male erweist sich das Vorkommen mindestens eines ε4 Allels als nachteilig und verursacht so Leistungsunterschiede innerhalb der Val-Val Gruppe. Studien haben ergeben, dass das Arbeitsgedächtnis valide in der Messung leistungsbezogener Unterschiede zwischen ε4 und ε3 Trägern ist (Scarmeas et al., 2005, Wilson et al., 2002, Wisdom et al., 2009). Warum sich die E4 Isoform allerdings materialspezifisch auswirkt, bedarf weiterer Untersuchungen. Es wurde kein durch das Alter oder die Ausbildungsdauer verursachter signifikanter Einfluss auf die Mnestik festgestellt. Gänzlich von den untersuchten demographischen Variablen unbeeinflusst sind die von den Val-Met Trägern erbrachten Gedächtnisleistungen. Anzumerken ist, dass die Erklärungskraft der einzelnen Faktoren und Kovariaten zumeist (sehr) klein ist, so dass bei den nachfolgenden Leistungsdifferenzen zwischen den BDNF-Varianten eher von phänotypischen Unterschieden ausgegangen werden kann. 5.1.3 BDNF-Met Träger sind in mnestischer Hinsicht benachteiligt Im direkten Leistungsvergleich erbringen die homozygoten Valin-Träger signifikant bessere Ergebnisse als die Val-Met Träger bzgl. des Gesamtscores, des Kurzzeit-/ Arbeitsgedächtnisses und der Zahlenspanne. Auch sind die Val-Val Träger den homozygoten Met-Trägern im Priming und Gesamtscore überlegen. Keine signifikanten Unterschiede deckt der Vergleich von Val-Met mit Met-Met auf, weshalb der Datensatz in die Gruppen „kein Met“ (Val-Val) und „Met“ (Val-Met/Met-Met) dichotomisert und nochmals auf Unterschiede geprüft wurde. Im erneuten Vergleich ergeben sich signifikante Differenzen bezüglich des Gesamtscores, des Kurzzeit-/Arbeitsgedächtnisses, der Zahlenspanne, der Exekutiven Kontrolle und des Primings. Wiederum erweist sich die Anwesenheit von Methionin als nachteilig. Dass die aufgedeckten signifikanten Differenzen auch von praktischer Bedeutsamkeit sind, zeigen die durchgehend als „groß“ zu interpretierenden Effektstärken (s. Kapitel 4.2.2, S. 47ff). - 68 - In der Literatur finden sich zahlreiche Hinweise auf die relative Unterlegenheit der Methionin-Träger im Vergleich zur Val-Val Gruppe. Meist wird der Unterschied unter Verwendung „klassischer“ hippocampus-assoziierter Aufgaben zum episodischen oder verbalen Gedächtnis offensichtlich (vgl. Egan et al., 2003, Hariri et al., 2003, Laske & Eschweiler, 2006, Dempster et al., 2005, Goldberg et al., 2008, Ho et al., 2006, Miyajima et al., 2008, van Wingen et al., 2010). Selten werden diesbezüglich Negativbefunde berichtet (kein Val66Met-Effekt beim episodischen Gedächtnis: Karnik et al., 2010; oder beim logischen Gedächtnis: Harris et al., 2006). Auch das deklarative Gedächtnis scheint durch den Methionin-Effekt vermindert (Dempster et al., 2005, Echeverria et al., 2005, Hariri et al., 2003). Kontroverse Befunde gibt es in Untersuchungen zum Kurzzeit- und Arbeitsgedächtnis: während Gong et al. (2009), Echeverria et al. (2005) und Li et al. (2010) schlechtere Leistungen bei den MethioninTrägern im Vergleich zur homozygoten Val-Gruppe gemessen haben, finden Hansell et al. (2007) und Egan et al. (2003) keine signifikanten Unterschiede. Bildgebende Studien haben jedenfalls gezeigt, dass bei heterozygoten Met-Allel Trägern neben den morphologischen Veränderungen des Hippocampus auch das Volumen im dorsolateralen präfrontalen Cortex, dem neuronalen Korrelat des Arbeitsgedächtnisses, vermindert ist (Pezawas et al., 2004). Und Untersuchungen mit funktioneller Magnetresonanztomographie haben aufgedeckt, dass die Aktivität im dorsolateralen präfrontalen Cortex typischerweise mit einer verminderten Aktivität des Hippocampus einhergeht (Bath & Lee, 2006), und dass bei Met-Trägern diese hippocampale Aktivitäts-Unterdrückung in vergleichsweise geringerem Maße als bei Trägern der homozygoten Valin-Variante stattfindet (Chen et al., 2008, Egan et al., 2003). Keine Befunde wurden bislang zum Einfluss von BDNF Val66Met auf die Primingleistung publiziert, was wohl daran liegt, dass diese Gedächtnisfunktion des erleichterten Erkennens von selbst fragmentiert dargestellten Objekten, denen man zuvor unbewusst begegnet ist, nicht standardmäßig mit den geläufigen Gedächtnistests erhoben wird. In der vorliegenden Arbeit konnte jedoch gezeigt werden, dass sich BDNF-Met auch auf das implizite Lernen negativ auswirkt. Neben der generellen Problematik in der Vergleichbarkeit von Studien untereinander (vgl. insbesondere unterschiedliches Alter der Probanden, Stichprobengröße, Kontrolle von (latenten) psychiatrischen/neurologischen/systemischen Erkrankungen, differierender Bildungsgrad, eingetzte Testinstrumente mit unterschiedlichen Gütekriterien) ist bei - 69 - neuropsychlogischen Fragestellungen auch die unterschiedlich verwendete Terminologie von Nachteil. So wird oftmals von einem „deklarativen“ Gedächtnis gesprochen, ohne dass zwischen semantischen oder episodischen Inhalten unterschieden wird. Ähnlich verhält es sich in Bezug auf das Kurzzeit- und Arbeitsgedächntis. Was in der Zusammenschau die vorliegende Studie gegenüber den bereits veröffentlichten auszeichnet, sind neben der differenzierten Erfassung und Nomenklatur der Gedächtnisfunktionen (1) der Nachweis eines negativen Effekts von BDNF-Met auf das Kurzzeitgedächtnis (zu dem die Zahlenspanne zählt) und das Arbeitsgedächtnis (unter dem die Exekutive Kontrolle subsumiert ist) und (2) die im Vergleich zur homozygoten Valin-Gruppe erbrachten schlechteren Leistungen von Met-Trägern beim impliziten Lernen, das sich im Priming abbildet. Der Gesamtscore, der die Summation aller IGDSkalen darstellt und als globales Gedächtnismaß gilt, wird als allgemeiner Beleg für die Überlegenheit der homozygoten Valin-Variante gesehen. 5.1.4 Mit dem Alter gleichen sich die Gruppen „kein Met“ und „Met“ an Zum Messzeitpunkt der vorliegenden Studie liegen signifikante Unterschiede zwischen den homozygoten Valin-Trägern und der Gruppe mit Methionin bezüglich des Gesamtscores, des Kurzzeit- und Arbeitsgedächtnisses und des impliziten Lernens (Priming) vor. Wie verhält es sich aber mit diesem phänotypischen Effekt, wenn die Probanden weiterhin gesund bleiben aber altern? Um diese Frage beantworten zu können, wurden regressionsanalytische Modelle berechnet (s. Kapitel 4.2.4.2, S. 55ff). Es zeigte sich, dass bei den homozygoten ValTrägern das Gedächtnis als Gesamtkonstrukt (Gesamtscore), das Kurzzeit-/Arbeitsgedächtnis und das verbale Gedächtnis mit dem zunehmenden Lebensalter kontinuierlich abnimmt. Im Tiermodell konnten altersabhängige Veränderungen in der BDNFSekretion und auf TrkB-Rezeptorebene nachgewiesen werden (Croll et al., 1998, Karege et al., 2002), was sich letztendlich negativ auf die Langzeitpotenzierung und damit auf das Gedächtnis auswirkt (Lu & Gottschalk, 2000, Woo et al., 2005). Dass nun gerade die Einbußen im Kurzzeit-/Arbeitsgedächtnis auftreten, ist nicht verwunderlich, da die frühsten und schwerwiegendsten altersbedingten Veränderungen im Gehirn im präfrontalen Cortex stattfinden. Eine Abnahme der Kapazität des Kurzzeit-/Arbeitsgedächtnisses, die man klassischerweise mit der Zahlenspanne messen kann, ist somit das hervorstechendste Kennzeichen des normalen Alterungspro- - 70 - zesses (Wright, 1981, Light & Anderson, 1985, Craik & McDowd, 1987, Kirasic et al., 1996, Park et al., 1996). Was allerdings herauszustellen ist, ist die Beobachtung, dass die genannten mnestischen Leistungen bei den Met-Trägern relativ stabil bleiben. Die naheliegende Annahme ist, dass die als „erfolgreich“ geltenden Träger der BDNFVariante „Val-Val“ sich mit den Jahren den „benachteiligten“ Met-Trägern annähern und diesen gegebenenfalls sogar im Laufe des Lebens unterlegen sind. Die weiterführenden Analysen haben gezeigt, dass dieser funktionale Zusammenhang zwischen dem Alter und der Variante „Val-Val“ erst ab dem dritten Lebensjahrzehnt aufzutreten scheint. Ob jene altersabhängigen Veränderungen tatsächlich zukünftig zu signifikanten Leistungsunterschieden führen werden, kann mit dem vorliegenden Datensatz aufgrund der geringen Zahl an über-30-jährigen Probanden nicht geklärt werden. In der Literatur finden sich jedoch Hinweise für die Richtigkeit dieser Hypothese. So haben Harris et al. (2006) vermutet, dass BDNF-Val zwar mit besseren kognitiven Leistungen in jungen Jahren zusammenzuhängt, es aber mit dem fortschreitenden Alter zu kognitiver Beeinträchtigung prädisponiert. Und Egan et al. (2003) liefern die mögliche Erklärung, dass Probanden mit dem Val-Allel zwar zunächst bessere Gedächtnisleistungen zeigen, weil das Valin mit einer erhöhten aktivitätsabhängigen synaptischen BDNF-Ausschüttung einhergeht und ihre Synapsen quasi „plastischer“ sind (Laske & Eschweiler, 2006). Diese Synapsenkontakte seien aber auch instabiler, und es wäre eine zeitlich adaptierte Metaplastizität erforderlich, um die aktivitätsabhängige Verstärkung der synaptischen Übertragung nicht letztlich in einen gesättigten Zustand mit Informationsverlusten im neuronalen Netz oder gar einem „Status konvulsivus“ enden zu lassen (vgl. auch Bear, 2003, Garcia, 2002). 5.2 APOE und Gedächtnis 5.2.1 Normativer Vergleich: APOE-E2 liegt vorne In der deskriptiven Statistik wurden zunächst die von den 140 Probanden (46 Männer, 94 Frauen) erbrachten Leistungen im normativen Vergleich dargestellt. Es zeigte sich, dass unter den APOE-Varianten die ε2 Träger die besten und die ε4 Träger die relativ gesehen schlechtesten Ergebnisse in der Gedächtnistestung erzielt haben (s. Kapitel 4.1.2, S. 39ff). Die „Überlegenheit“ der ε2 Träger findet sich auch in der Literatur wieder. So haben beispielsweise Helkala et al. (1996) bei Gesunden gemessen, dass die ε2 Träger im - 71 - Lernen besser als die ε3 und ε4 Trägern abschneiden. Auch verschlechtern sich die ε2/ε2 und ε2/ε3 im Gegensatz zu den anderen Varianten nicht im Drei-Jahres-Verlauf (ebd.), bzw. weisen sie vergleichsweise geringere Einbußen bezüglich des epsiodischen Gedächtnisses auf (Wilson et al., 2002). Weitere „Vorteile“ des E2 Phänotyps zeigen sich in einer anzunehmenden protektiven Rolle hinsichtlich der Alzheimer Demenz, indem er das Erkrankungsrisiko mindert und das klinische Manifestationsalter erhöht (Farrer et al., 1997, Rubinzstein & Easton, 1999) und seiner wahrscheinlichen Verbindung zur Langlebigkeit (vgl. unter den Hundertjährigen ist das Vorkommen von ε2 höher als bei Jüngeren; Kervinen et al., 1994). Da die Fallzahlen in den einzelnen APOE-Gruppen der vorliegenden Studie klein sind, wurde für die weiteren Analysen eine in der Literatur übliche Dichotomisierung des Datensatzes in „kein ε4“ (n = 121) und „ε4“ (n = 19) vorgenommen. 5.2.2 Demographische Einflüsse: BDNF-Met mindert den Erfolg von APOE-E2 In der faktoriellen Analyse der APOE-Varianten finden sich epistatische Hinweise in den Aufgaben zur Zahlenspanne, Exekutiven Kontrolle, zum Priming, Gesamtscore, Kurzzeit-/Arbeitsgedächtnis und zum verbalen Gedächtnis dahingehend, dass die Nicht-ε4-Allel Träger mit mindestens einer BDNF-Met-Isoform schlechter abschneiden als Nicht-ε4-Allel Träger mit der BDNF-Variante Val-Val. Dies bedeutet, dass das zusätzliche Vorkommen von Methionin nur bei den Nicht-ε4-Allel Trägern das intentionale Lernen verbaler Informationen mit expliziten und impliziten Abruf nach einer kurzen, mittel- und längerfristigen Ablenkungsphase mindert. Auch wenn diese Effekte als klein zu interpretieren sind (s. Kapitel 4.2.1, S. 43ff), sind sie hervorzuheben, da in den bisherigen Studien keine APOE-BDNF-Interaktionen in den erbrachten Gedächtnisleistungen beschrieben wurden. Abgesehen von den epistatischen Hinweisen liegen bei den Nicht-ε4-Allel Trägern auch geschlechtsspezifische Einflüsse im Priming (Frauen sind besser als Männer) und ein signifikanter Einfluss des Alters auf das Kurzzeit-/Arbeitsgedächtnis vor. Die ε4 Träger zeigen bildungsabhängige Leistungen im verzögerten Abruf verbaler und nonverbaler Stimuli. - 72 - 5.2.3 APOE-Varianten verursachen keinen signifikanten Unterschied in den mnestischen Leistungen Werden die Gedächtnisleistungen der Gruppe „kein ε4“ mit denen der Gruppe „ε4“ verglichen, sind keinerlei statistisch signifikante Unterschiede feststellbar (s. Kapitel 4.2.3, S. 52ff). Folglich wirkt sich die Anwesenheit mindestens eines ε4 Allels weder positiv noch negativ auf die mnestischen Leistungen junger gesunder Probanden aus. Dies erscheint zunächst erstaunlich, da das APOE ε4 Allel wiederholt als prädisponierend für eine Demenz bei Alzheimer Krankheit mit dem Kardinalsymptom Gedächtnisstörung gegolten hat (Corder et al., 1993, Rebeck et al., 1994, Kuusisto et al., 1994, Smith et al., 1998), und in zahlreichen Studien gezeigt worden ist, dass APOE E4 mit einem stärkeren kognitiven Abbau im Alter einhergeht (Helkala et al., 1995, Fillenbaum et al., 2001, Wilson et al., 2002, Den Heijer et al., 2002, Hofer et al., 2002, Wisdom et al., 2009). Wenn also das APOE E4 nicht zu subtilen kognitiven Defiziten bereits in jüngeren Jahren führt, kann bei den in der Literatur beschriebenen spezifischen Unterschieden in der Gehirnfunktion auch nicht von einer Prädisposition für die Alzheimer Krankheit gesprochen werden. Denkbar ist vielmehr eine infolge verminderter Reparaturmechanismen einhergehende Vulnerabilität bei auftretenden Risikofaktoren wie etwa cerebralen Insulten oder kardiovaskulären Erkrankungen (Alexander et al., 2007). Diesen Ansatz bekräftigend sind Studien mit nicht-dementen Älteren anzuführen, die trotz ε4 Allel keine bedeutsam schlechteren Gedächtnisleistungen als die Nicht-Träger aufweisen (Smith et al., 1998, Small et al., 2000, Cohen et al., 2001, Klages & Fisk, 2002, Winnock et al., 2002, Marquis et al., 2002, Kim et al., 2002, Pendleton et al., 2002), und auch Arbeiten, in denen die E4 Isoform zwar einen signifikant nachteiligen Effekt auf die kognitive Leistungsfähigkeit von Personen mit kognitiven Beeinträchtigungen ausübt, aber nicht auf die von Gesunden (Small et al., 1998, Collie & Maruff, 2002). Außerdem haben einige Autoren die Möglichkeit in Betracht gezogen, dass in Studien, die APOE-assoziierte kognitive Einbußen in der gesunden älteren Bevölkerung aufdecken, möglicherweise ε4 Träger im Prodromalstadium einer AD für die relevanten Genotyp-Phänotyp Korrelationen verantwortlich sind (Pendleton et al., 2002, Kim et al., 2002, Hofer et al., 2002, Savitz et al., 2006). Wenige Arbeiten haben bislang den Einfluss der APOE Allele auf die Kognition im Kindes- und Jugendalter untersucht. Während in einigen Studien keine Effekte nachgewiesen wurden (Deary et al., 2002, Turic et al., 2001, Reiman et al., 2004, Scarmeas et al., 2005, Savitz et al., 2006), haben andere sogar eine bessere kognitive Leistungs- - 73 - fähigkeit bei den ε4 Trägern aufgedeckt (Yu et al., 2000, Puttonen et al., 2003, Hubacek et al., 2001, Wright et al., 2003, Oria et al., 2005, Mondadori et al., 2007). Eine abschließende Einordnung des Negativbefundes aus der vorliegenden Arbeit ist schwierig, da sich die in der Literatur verfügbaren Studien - wie in Kapitel 4.1.3 (S. 68) bereits angedeutet - bezüglich des Alters, Bildungsniveaus und der Ethnizität der Probanden, der eingesetzten Testverfahren (einschließlich deren divergierender Sensitivitäten), der Stichprobengröße und des Studiendesigns (Längs-/Querschnittsuntersuchungen) teilweise stark unterscheiden. Am ehesten ist das Fehlen eines APOEEffekts auf die mnestischen Leistungen in Einklang mit Jorm und Kollegen (2007) zu sehen, die in einer bevölkerungsrepräsentativen Stichprobe 6560 nach dem Alter stratifizierte (20-24, 40-44, 60-64 Jahre) Europide ausführlich neuropsychologisch getestet haben (vgl. episodisches Gedächtnis, Arbeitsgedächtnis, kognitive Geschwindigkeit, Reaktionszeit, Lesewortschatz). Als Ergebnis wurde festgehalten, dass die gemessenen kognitiven Fähigkeiten mit Ausnahme des Lesewortschatzes zwar einem altersbedingten Abbau unterliegen, jedoch in keiner Altersgruppe ein APO ε4 Effekt zu beobachten war. Folglich scheint APO E4 nicht präklinisch die Kognition und damit das Gedächtnis zu beeinflussen, sondern vielmehr als ein Beispiel für eine antagonistische Pleiotropie (Wright et al. 2003) zu fungieren mit einem Nettonutzen während des Kindes- und Erwachsenenalters (vgl. neuroprotektive Rolle des APOE z.B. bei Ohkubo et al., 2001, Zetterberg et al., 2002, Oria et al.,2005) und einer Krankheitsassoziation im höheren Alter. 5.2.4 Mit dem Alter gleichen sich die Gruppen „kein ε4“ und „ε4“ an Auch wenn die mnestischen Leistungen in den APOE-Gruppen „kein ε4“ und „ε4“ nicht signifikant differieren, so liegen erstere in der Betrachtung der erzielten Testwerte marginal vor den zweiten. Dieser kleine Unterschied scheint aber bezüglich einiger Gedächtnisfunktionen mit dem Alter zu schwinden. Denn wie sich gezeigt hat, nimmt das Kurzzeit-/Arbeitsgedächtnis und das verbale Gedächtnis bei den Nicht-ε4 AllelTrägern mit den Jahren kontinuierlich ab (s. Kapitel 4.2.4.2, S. 55ff). Dass die Einbußen gerade im Kurzzeit-Arbeitsgedächtnis nicht verwunderlich sind, wurde bereits in Kapitel 5.1.4 (S. 69f) erläutert. Was allerdings erstaunt ist die Tatsache, dass die genannten mnestischen Leistungen in den korrespondierenden Gruppen der ε4-Träger relativ konstant bleiben. Daraus kann gefolgert werden, dass - 74 - sich die „überlegenen“ Träger der APOE-Isoformen „ε2/ε2, ε2/ε3, ε3/ε3“ mit den Jahren den „benachteiligten“ ε4-Trägern annähern und diesen wahrscheinlich sogar im Laufe des Lebens mnestisch unterlegen sind. Wie weiterführende Analysen aufgedeckt haben, scheint dieser funktionale Zusammenhang zwischen dem Lebensalter und „kein ε4“ ab dem dritten Lebensjahrzehnt aufzutreten. Eine Ausnahme stellt die altersbedingte Verschlechterung des verbalen Gedächtnisses bei den Nicht-ε4 Trägern dar, welche bereits zwischen dem 19. und 29. Lebensjahr beginnt und mit dem gleichzeitigen Vorkommen von BDNF-Met zusammenzuhängen scheint. Ob jene altersabhängigen Veränderungen zukünftig auch zu signifikanten Leistungsunterschieden führen werden, kann mit dem vorliegenden Datensatz aufgrund der geringen Zahl an über-30-jährigen Probanden nicht geklärt werden. In der Literatur finden sich zu dieser Fragestellung zwei konträre Ansätze: (1) die Meta-Analysen von Farrer et al. (1997) und Small et al. (2004), die beide eine altersbedingte Abnahme der E4-Effekte auf die Kognition und damit eine Angleichung der ε4 und Nicht-ε4 Träger postulieren; aber auch (2) die Meta-Analyse von Wisdom et al. (2009), die einen verstärkt nachteiligen Effekt des E4 mit zunehmendem Alter vorgefunden haben. Spekulativ scheinen die vorliegenden Daten eher dem ersten Ansatz zu folgen, wobei sich hier nicht die E4-Effekte abschwächen, sondern die Nicht-ε4 Träger mit der Zeit in ihren mnestischen Leistungen nachlassen. 5.3 Ausblick Mit der vorliegenden Studie wurden erstmalig in der Literatur die isolierten und interagierenden Effekte der Polymorphismen Val66Met und APOE-ε4 auf die mnestischen Leistungen junger gesunder Probanden unter Berücksichtigung demographischer Einflussvariablen explorativ untersucht. Die bereits publizierte negative Wirkung des BDNF Methionins auf das Kurzzeit/Arbeitsgedächtnisses und das semantische Gedächtnis wie auch das Fehlen eines durch das APOE-ε4 verursachten Leistungsunterschiedes wurden repliziert. Als neue Befunde sind zu nennen: (1) ein signifikanter Nachteil der Methionin- gegenüber den homozygoten Valin-Trägern im impliziten Lernen (Priming), (2) epistatische Hinweise für die Val-Val Gruppe (schlechtere Ergebnisse im visuellen Arbeits-/Gedächtnis bei gleichzeitigem Vorkommen von ε4) und die Nicht-ε4 Träger (ungünstiger Effekt von BDNF-Met auf Zahlenspanne, Exekutive Kontrolle, Priming, Gesamtscore, Kurzzeit- - 75 - /Arbeitsgedächtnis und verbales Gedächtnis) und (3) eine altersbedingte Leistungsabnahme der „überlegenen“ Val-Val bzw. Nicht-ε4-Träger bezüglich des Kurzzeit-/Arbeitsgedächtnisses und des verbalen Gedächtnisses (bei ersteren zusätzlich noch bzgl. des Gesamtscores), so dass sie sich den „benachteiligten“ Metbzw. ε4-Trägern annähern und diesen im weiteren Lebensverlauf möglicherweise sogar unterlegen sind. Neben diesen neuen Erkenntnissen zeichnet sich die Studie durch ihr kontrolliertes Design aus: die Stichprobe ist in ihren gebildeten Subgruppen homogen hinsichtlich des Alters, des Geschlechts, der Ausbildungsdauer, der Ethnizität, der physischen / psychischen Gesundheit und der Verteilung der Genotypen (bei BDNF die Häufigkeit von ε4 / kein ε4, bei APOE die Häufigkeit von Met / kein Met). Beim eingesetzten Untersuchungsinstrument handelt es sich um ein theoriegeleitet entwickeltes Verfahren, das sensitiv, valide und reliabel die wesentlichen Verarbeitungskomponenten neuropsychologischer Gedächtnismodelle abbildet. Außerdem wurden der Testleiter, der Messzeitpunkt und –ort konstant gehalten und in der Durchführung wie auch Auswertung wurde strikt manualgeleitet vorgegangen. Der eindeutige Nachteil der vorliegenden Untersuchung ist die geringe Fallzahl von 140 Probanden, die eine weiterführende Analyse zum Beispiel der Phänotypen E2 oder E4/4 bzw. von Trägern mit kombinierten ε4/ε4- und Met-Met Genotypen nicht erlaubt. Nach Plomin et al. (2006) verlangen genetische Assoziationsstudien sogar generell Stichprobenumfänge von mehreren tausend Teilnehmern, um statistisch reliable Befunde produzieren zu können, da der Effekt eines einzigen genetischen Locus sehr klein ist mit einem OR von 1.1 bis 1.3 für kategoriale Outcomes und kleiner 0,5% der Varianz für quantitative Outcomes. Auch der zusätzliche Einsatz funktioneller Bildgebung könnte mehr oder stärkere Geno-Phänotyp-Assoziationen aufdecken, weil sie „näher“ an der ursächlichen Mutation sind. Denn Polymorphismen verursachen bekanntlicherweise zuerst Variationen auf Proteinebene, welche sich auf die neuronale Funktion auswirken, die ihrerseits vielleicht die cerebrale Morphologie verändert; diese Unterschiede in der Gehirnmorphologie können dann mit einem abweichenden Verhalten oder der Progressionen von Krankheiten in Verbindung gebracht werden (Hashimoto et al., 2009). Erschwerend kommt für die Interpretation beobachteter Effekte noch hinzu, dass ein einziges Gen multiple Prozesse beeinflussen kann, multiple Gene - 76 - einen einzelnen Prozess beeinflussen können und multiple kognitive Prozesse interkorrelieren (Goldberg & Weinberger, 2004). Trotz dieser Einschränkungen in der Generalisierbarkeit vorgefundener GenoPhänotyp-Assoziationen, kann abschließend festgehalten werden, dass die vorliegenden Ergebnisse eine Assoziation zwischen BDNF Val66Met und den mnestischen Leistungen junger, gesunder Probanden nahelegen. Die funktionalen Varianten des APOE hingegen scheinen nur im Falle des gemeinsamen Vorkommens mit BDNF-Met eine signifikante Rolle zu spielen. Es gibt einen durch beide Polymorphismen modulierten altersbedingten Verlauf einzelner Gedächtnisfunktionen, dessen Prüfung der Inhalt einer weiterführenden Studie sein könnte. - 77 - 6 Literaturverzeichnis 1 Alexander DM, Williams LM, Gatt JM, Dobson-Stone C, Kuan SA, Todd EG, Schofield PR, Cooper NJ, Gordon E. The contribution of apolipoprotein E allels on cognitive performance and dynamic neural activity over six decades. Biol Psychol, 75, 2007, 229-238 2 Arendt T, Schindler C, Bruckner MK, Eschrich K, Bigl V, Zedlick D, Marcova L. Plastic neuronal remodeling is impaired in patients with Alzheimer’s disease carrying apolipoprotein ε4 allele. J Neurosci, 17, 1997, 516-529 3 Atkinson RC, Shiffrin RM. Human memory: A proposed system and is control processes. In: Spence KW, Pence JT (Eds.). The psychology of Learning and Motivation. Advances in Research and Theory. Vol 2., Academic Press, New York, 1968, 89-195 4 Baddeley AD, Hitch GJ. Working memory. In: Bower GH (ED.). The Psychology of Learning and Motivation: Advances in Research and Theory. Vol. 8, Academic Press, New York, 1974 5 Baddeley AD. The episodic buffer: A new component of working memory? Trends Cog Sci, 4, 2000, 417-423 6 Baller G, Brand M, Kalbe E, Kessler J. IGD. Inventar zur Gedächtnisdiagnostik. Manual. Hogrefe Verlag GmbH & Co. KG, Bern, Toronto, Seattle, Oxford, Prag, 2006 7 Baquet ZC, Gorski, JA, Jones KR. Early striatal dendrite deficits followed by neuron loss with advanced age in the absence of anterograde cortical brainderived neurotrophic factor. J Neurosci, 24, 2004, 4250-4258 8 Barde YA, Edgar D, Thoenen H. Purification of a new neurotrophic factor from mammalian brain. EMBO Journal, 1, 1982, 549-553 9 Bath KG, Lee FS. Variant BDNF (Val66Met) impact on brain structure and function. Cogn Affect Behav Ne, 6(1), 2006, 79-85 10 Bear MF. Bidirectional synaptic plasticity: from theory to reality. Philos Trans R Soc Lond B Biol Sci, 358, 2003, 649-655 11 Beck G, Munno DW, Levy Z, Dissel HM, Van-Minnen J, Syed, NI, Fainzilber M. Neurotrophic activities of trk receptors conserved over 600 million years of evolution. J Neurobiol, 60, 2004, 12-20 12 Beffert U, Danik M, Krzywkowski P, Ramassamy FB, Poirier J. The neurobiology of apolipoproteins and their receptors in the CNS and Alzheimer’s disease. Brain Res Rev, 27, 1998, 119-142 13 Benjamin R, Leake A, Ince PG, Perry RH, McKeith IG, Edwardson JA, Morris CM. Effects of apolipoprotein E genotype on cortical neuropathology in senile dementia of the Lewy body and Alzheimer’s disease. Neurodegeneration, 4, 1995, 443-448 14 Bleeker ML, Bolla-Wilson K, Agnew J, Meyers DA. Age related sex differences in verbal memory. J Clin Psychol, 44, 1988, 403–411 15 Bortz J, Döring N. Forschungsmethoden und Evaluation für Human- und Sozialwissenschaftler. Springer, Berlin, Heidelberg, 2006 16 Brand M, Markowitsch HJ. Amnesia: Neuroanatomic and clinical issues. In: Feinberg T, Farrah T (Eds.). Behavioral Neurology ans Neuropsychology. McGrawHill, New York, 2003, 431-443 - 78 - 17 Buckner RL, Wheeler ME, Sheridan MA. Encoding processes during retrieval tasks. J Cognitive Neurosci, 13, 2001, 406-415 18 Büller JA, Aftab M, Sen S, Gomez-Hassan D, Burmeister M, Zubieta JK. BDNF Val66Met allel is associated with reduced hippocampal volume in healthy subjects. Biol Psychiatry, 59, 2006, 812-815 19 Bunce D, Fratiglioni L, Small BJ, Winblad B, Backman L. APOE and cognitive decline in preclinical Alzheimer disease and non-demented aging. Neurology, 63, 2004, 816-821 20 Buttini M, Akeefe H, Lin C, Mahley RW, Pitas RE, Wyss-Coray T, Mucke L. Dominant negative effects of apolipoprotein E4 revealed in transgenetic models of neurodegenerative disease. Neurosci, 97, 2000, 207-210 21 Cermak LS. The episodic-semantic distinction in amnesia. In: Squire LR, Butters N (Eds.). Neuropsychology of Memory. The Guilford Press, New York, 1984 22 Chao MV. Trophic factors: An evolutionary cul-de-sac or door into higher neuronal function? J Neurosci Res, 59, 2000, 353-355 23 Chao MV. Neurotrophins and their receptors: A convergence point for many signalling pathways. Nat Rev Neurosci, 4, 2003, 299-309 24 Cheng B, Mattson MP. NT3 and BDNF protect CNS neurons against metabolic/ excitotoxic insults. Brain Res, 640 (1-2), 1994, 56-67 25 Chen Z-Y, Patel PD, Sant G, Meng CX, Teng KK, Hempstead BL, Lee FS. Variant brain-derived neurotrophic factor (BDNF) (Met66) alters the intracellular trafficking and activity-dependent secretion of wild-type BDNF in neurosecretory cells and cortical neurons. J Neurosci, 24, 2004, 4401-4411 26 Chen Z-Y, Bath, K, McEwen B, Hempstead B, Lee F. Impact of genetic variant BDNF (Val66Met) on brain structure and function. Novart FDN Symp, 289, 2008, 180-195 27 Chipman K, Kimura D. An investigation of sex differences on incidental memory for verbal and pictorial material. Learn Individ Differ, 10, 1998, 259–272 28 Cleff T. Deskriptive Statistik und moderne Datenanalyse. Eine computergestützte Einführung mit Excel, SPSS und STATA. GWV Fachverlage GmbH, Wiesbaden, S.125f 29 Cohen J. Statistical power analysis for the behavioral sciences. Academic Press, New York, London, 1969 30 Cohen RM, Small C, Lalonde F, Fritz J, Sunderland T. Effect of apolipoprotein E genotype on hippocampal volume loss in aging healthy women. Neurology, 57, 2001, 2223-2228 31 Collie A, Maruff P. An analysis of systems to classifying mild cognitive impairment in older people. Aust NZ J Psychiat, 36, 2002, 133-140 32 Corder EH, Saunders AM, Strittmatter WJ, Schmechel DE, Gaskell PC, Small GW, Roses AD, Haines JL, Pericak-Vance MA. Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer’s disease in late onset families. Science, 261, 1993, 921-923 33 Craik FIM, McDowd JM. Age differences in recall and recognition. J Exp Psychol, 13, 1987, 747-749 34 Croll SD, Ip NY, Lindsay RM, Wiegand SJ. Expression of BDNF and trkN as function of age and cognitive performance. Brain Res, 812, 1998, 200-208 - 79 - 35 Dartigues JF, Letenneur L. Genetic epidemiology of Alzheimer’s disease. Curr Opin Neurol, 13(4), 2000, 385-389 36 Deary IJ, Whiteman MC, Pattie A, Starr JM, Hayward C, Wright AF, Carothers A, Whalley LJ. Cognitive change and the APOE epsilon 4 allele. Nature, 418, 2002, 932 37 Deary IJ, Whalley LJ, St Clair D, Breen G, Leaper S, Lemmon H, Hayward C, Starr JM. The influence of the ε4 allele of the apolipoprotein E gene on childhood IQ, nonverbal reasoning in old age, and lifetime corgnitive change. Intelligence, 31, 2003, 85-92 38 Dempster E, Toulopoulou T, McDonald C, Bramon E, Walshe M, Filbey F, Wickham H, Sham PC, Murray RM, Collier DA. Association between BDNF val66met genotype and episodic memory. Am J Genet B Neuropsychiatr Genet, 134, 2005, 73-75 39 Den Heijer T, Oudkerk M, Launer LJ, van Duijn CM, Hofman A, Breteler MM. Hippocampal, amygdalar, and global brain atrophy in different apolipoprotein E genotypes. Neurology, 59, 2002, 764-748 40 Echeverria D, Woods JS, Heyer NJ, Rohlman DS, Farin FM, Bittner ACJ, Li T, Garabedian C. Chronic low level mercury exposure, BDNF polymorphism, and associations with cognitive and metor function. Neurotoxicol Teratol, 27, 2005, 781-796 41 Egan MF, Kojiama M, Callicott JH, Goldberg TE, Kolachana BS, Weinberger DR. The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function. Cell, 112, 2003, 257-269 42 EMEA, The European Agency for Evaluation of Medicinal Products. Evaluation of Medicine for Human Use. Points to consider on multiplicity issues in clinical trials, 2002. [on-line] verfügbar unter http://www.ema.europa.eu/pdfs/human/ewp/090899 en.pdf 43 Fagan Am, Bu G, Sun Y, Daugherty A, Holtzman DM. Apolipoprotein E-containing high density lipoprotein promotes neurite outgrowth and is a ligand for the low density lipoprotein receptor related protein. J Biol Chem, 271, 1996, 30121-30125 44 Farrer LA, Cupples LA, Haines JL, Hyman B, Kukull WA, Mayeux R. Effects of age, sex, and ethicity on the association between apolipoprotein E genotype and Alzheimer disease. JAMA, 278, 1997, 1349-1356 45 Feussner G, Feussner V, Hoffmann MM, Lohrmann J, Wieland H, März W. Molecular basis of type III hyperlipoproteinemia in Germany. Hum Mutat 11, 1998, 417423 46 Fillenbaum GG, Landerman LR, Blazer DG, Saunders AM, Harris TB, Launer LJ. The relationship of APOE genotype to cognitve functioning in older African-American and Caucasian community residents. J Am Geriatr Soc, 49, 2001, 1148-1155 47 Fletcher PC, Henson RNA. Frontal lobes and human memory: Insights from functional neuroimaging. Brain, 124, 2001, 849-881 48 Galasko D, Saitoh T, Xia Y, Thal LJ, Katzman LR, Hill LR, Hansen L. The apolipoprotein E allele epsilon-4 is overexpressed in patients with Lewy body variant of Alzheimer’s disease. Neurology, 44, 1994, 1950-1951 49 Garcia R. Stress, metaplasticity, and antidepressants. Curr Mol Med, 2, 2002, 629638 50 Gearing M, Mori H, Mirra SS. A beta-peptide length and apolipoprotein E genotype in Alzheimer’s disease. Ann Neurol, 39, 1996, 395-399 - 80 - 51 Ghebremedin E, Schultz C, Braak E, Braak H. High frequency of apolopoprotein E ε4 alleles in young individuals with very mild Alzheimer’s disease-related neurofibrillary changes. Exp Neurol, 153, 1998, 152-155 52 Goldberg TE, Weinberger DR. Genes and the parsing of cognitive processes. Trends Cogn Sci, 8(7), 2004, 325-335 53 Goldberg TE, Iudicello J, Russo C, Elvevag B, Straub R, Egan MF, Weinberger DR. BDNF Val66Met polymorphism significantly affects d’ in verbal recognition memory at short and long deleays. Biol Psychol, 77, 2008, 20-24 54 Gong P, Zheng A, Chen D, Ge W, Lu C, Zhang K, Gao X, Zhang F. Effect of BDNF Val66Met polymorphism on digital working memory and spatial localization in a healthy Chinese Han population. J Mol Neurosci, 38, 2009, 250-256 55 Gorski JA, Zeiler SR, Tamowski S, Jones KR. Brain-derived neurotrophic factor is required for the maintenance of cortical dendrites. J Neurosci, 23, 2003, 6856-6865 56 Green LA, Tischler AS. Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor. Proc Natl Acad Sci USA, 1976, 73 (7), 2424-2428 57 Greene LA, Kaplan DR. Early events in neurotrophin signalling via Trk and p75 receptors. Curr Opin Neurobiol, 5 (5), 1995, 579-587 58 Hansell NK, James MR, Duffy DL, Birley AJ, Luciano M, Geffen GM, Wright MJ, Montgomery GW, Martin NG. Effect of the BDNF V66M polymorphism on working memory in healthy adolescents. Genes, Brain and Beh, 6, 2007, 260-268 59 Hariri AR, Goldberg TE, Mattay VS, Kolachana BS, Callicott JH, Egan MF, Weinberger DR. Brain-derived neurotrophic factor val66met polymorphism affects human memory-related hippocampal activity and predicts memory performance. J Neurosci, 32(17), 2003, 6690-6694 60 Harris SE, Fox H, Wright AF, Hayward C, Starr JM, Whalley LJ, Deary IJ. The brain-derived neurotrophic factor Val66Met polymorphism is associated with agerelated change in reasoning skills. Mol Psychiatry, 11, 2006, 505-513 61 Härting C, Markowitsch HJ, Neufeld H, Calabrese P, Deisinger K, Kessler J (Hrsg.). WMS-R: Wechsler Gedächtnistest – Deutsche Adaptation der revidierten Fassung der Wechsler Memory Scale. Verlag Hans Huber, Göttingen, 2000 62 Hartje W, Poeck K. Klinische Neuropsychologie. 3. Auflage, Georg Thieme Verlag: Stuttgart, 1997 63 Hashimoto R, Hirata Y, Asada T, Yamashita F, Nemoto K, Mori T, Moriguchi Y, Kunugi H, Arima K, Ohnishi T. Effect of the brain-derived neurotrophic factor and the apolipoprotein E polymorphism on disease progression in preclinical Alzheimer’s disease. Genes Brain Behav, 8, 2009, 43-52 64 Helisalmi S, Linnaranta K, Lehtovirta M, Mannermaa A, Heinonen O, Ryynänen M, Riekkinen P, Soininen H. Apolipoprotein E polymorphism in patients with different neurodegenerative disorders. Neurosci Lett, 205, 1996, 61-64 65 Helkala EL, Koivisto K, Hanninen T, Vanhanen M, Kervinen K, Kuusisto J, Mykkanen L, Kesaniemi YA, Laakso M, Riekkinen P. The association of apolipoprotein E polymorphism with memory: a population based study. Neurosci Lett, 191, 1995, 141-144 66 Helkala E-L, Koivisto K, Hänninen T, Vanhanen M, Kervinen K, Kuusisto J, Mykkänen L, Kesäniemie YA, Laakso M, Riekkinen P. Memory functions in human subjects with different apolipoprotein E phenotypes during a 3-Year populationbased follow-up study. Neurosci Lett, 204, 1996, 177-180 - 81 - 67 Henderson AS, Easteal S, Jorm AF, Mackinnon AJ, Korten AE, Christensen H, Croft L, Jacomb PA. Apolipoprotein E allele ε4, dementia, and cognitive decline in a population sample. Lancet, 346, 1995, 1387-1390 68 Henneberger C, Jüttner R, Rothe T, Grantyn R. Postsynaptic action of BDNF on GABAergic synaptic transmission in the superficial layers of the mouse superior colliculus. J Neurophysiol, 88(2), 2002, 595-603 69 Herlitz A, Nilsson LG, Bäckman L. Gender differences in episodic memory. Mem Cogn, 25, 1997, 801-811 70 Hill JM, Bhattacharjee PS, Neumann DM. Apolipoprotein E alleles can contribute to the pathogenesis of numerous clinical conditions including HSV-1 corneal disease. Exp Eye Res, 84 (5), 2007, 801-811 71 Hixson JE, Vernier DT. Restriction isotyping of human apolipoprotein E by gene amplification and cleavage with Hha I. J Lipid Res, 31, 1990, 545-548 72 Ho BC, Milev P, O’leary DS, Librant A, Andreasen NC, Wassink TH. Cognitive and magnetic resonance imaging brain morphometric correlates of brain-derived neurotrophic factor val66met gene polymorphism in patients with schizophrenia and healthy volunteers. Arch Gen Psychiat, 63, 2006, 731-740 73 Hoe HS, Wessner D, Beffert U, Becker AG, Matsuoka Y, Rebeck GW. F-spondin interaction with the apolipoprotein E receptor ApoEr2 affects processing of amyloid precursor protein. Mol Cell Biol, 25, 2005, 9259-9268 74 Hofer SM, Christensen H, Mackinnon AJ, Korten AE, Jorm AF, Henderson AS, Easteal S. Change in cognitive functioning associated with apoE genotype in a community sample of older adults. Psychol Aging, 17, 2002, 194-208 75 Huang E., Reichardt L. Neurotrophins: Roles in neuronal development and function. Annu Rev Neusosci, 24, 2001, 677-736 76 Hubacek JA, Pitha J, Skodova Z, Adamkova V, Lanska V, Poledne R. A possible role of apolipoprotein E polymorphism in predisposition to higher education. Neuropsychobiology, 43, 2001, 200-203 77 Janssen J, Laatz W. Statistische Datenanalyse mit SPSS für Windows. Eine anwendungsorientierte Einführung in das Basissystem und das Modul Exakte Tests. 6. Auflage, Springer-Verlag, Berlin, Heidelberg, New York, 2007, S. 344 78 Ji Y, Gong Y, Gan W, Beach T, Holtzman DM, Wisniewski T. Apolipoprotein E isoform-specific regulation of dendritic spine morphology in apolipoprotein E transgenic mice and Alzheimer’s disease patients. Neurosci, 122, 2003, 305-315 79 Jordan BD, Relkin NR, Ravdin RD, Jacobs AR, Bennett A, Gandy S. Apolipoprotein E ε4 associated with chronic traumatic brain injury in boxing. J Am Med Assoc, 278, 1997, 136-140 80 Jorm AF, Mather KA, Butterworth P, Anstey KJ, Christensen H, Easteal S. APOE Genotype and Cognitive Functioning in a Large Age-Stratified Population Sample. Neuropsychology, 21(1), 2007, 1-8 81 Kang H, Schuman EM. Long-lasting neurotrophin-induced enhancement of synaptic transmission in the adult hippocampus. Science, 267, 1995, 1658-1662 82 Karege F, Schwald M, Cisse M. Postnatal developmental profile of brain-derived neurotrophic factor in rat brain and platelets. Neurosci Lett, 328, 2002, 261-264 83 Karnik MS, Wang L, Barch DM, Morris JC, Csernansky JG. BDNF polymorphism rs6265 and hippocampal structure and memory performance in healthy control subjects. Psychiat Res, 178, 2010, 425-429 - 82 - 84 Kawanishi C, Suzuki K, Odawara T, Iseki E, Onishi H, Miyakawa T, Yamada Y, Kosaka K, Kondo N, Yamamoto T. Neuropathological evaluation and apolipoprotein E gene polymorphism analysis in diffuse Lewy body disease. J Neurol Sci, 136, 1996, 140-142 85 Kervinen K, Savolainen MJ, Salokannel J, Hynninen A, Heikkinen J, Enholm C, Koistinen MJ, Kesäniemi YA. Apolipoprotein E and B polymorphism: longevity factors assesed in nonagenarians. Atherosclerosis, 105, 1994, 89-95 86 Kim KW, Youn JC, Jhoo JH, Lee DY, Lee KU, Lee JH, Woo JI. Apolipoprotein E epsilon 4 allele is not associated with the cognitive impairment in communitydwelling normal elderly individuals. Int J Geriatr Psych, 17, 2002, 635-640 87 Kirasic KC, Allen GL, Dobson SH, Binder KS. Aging, cognitive resources, and declarative learning. Psychol Aging, 11, 1996, 658-670 88 Klages J, Fisk JD. The realtion between APOE status and neuropsychology memory test performance: an analysis of the Canadian Study of Health and Aging. Brain Cognition, 49, 2002, 201-204 89 Knüsel B, Winslow JW, Rosenthal A, Burton LE, Seid DP, Nikolics K, Hefti F. Promotion of central cholinergic and dopaminergic neuron differentation by brainderived neurotro-phic factor but not neurotrophin-3. PNAS, 88, 1991, 961-965 90 Korte M. Zelluläre Grundlangen von Lern- und Gedächtnisvorgängen, Tätigkeitsbericht 2004, MPI für Neurologie, Abteilung Zelluläre und Systemneurobiologie, 2004 91 Kramer JH, Delis DC, Daniel M. Sex differences in verbal learning. J Clin Psychol, 44, 1988, 907–915 92 Kutner KC, Erlanger DM, Tsai J, Jordan B, Relkin NR. Lower cognitive performance of older football players possessing apolipoprotein E ε4. Neurosurgery, 47, 2000, 651-657 93 Kuusisto J, Koivisto K, Kervinen K, Mykkanen L, Helkala EL, Vanhanen M, Hanninen T, Pyorala K, Kesaniemi YA, Riekkinen P. Association of apolipoprotein E phenotypes with late onset Alzheimer’s disease: population based study. Brit Med J, 309, 1994, 636-638 94 Laakso M, Kesäniemie A, Kervinen K, Jauhiainen M, Pyörälä K. Relation of coronary heart disease and apolipoprotein E phenotype in patients with noninsulin-dependent diabetes. Br Med J, 303, 1991, 1159-1162 95 Lahiri DK, Sambamurti K, Bennett DA. Apolipoprotein gene and its interaction with the environmentally driven risk factors: molecular, genetic and epidemiological studies of Alzheimer’s disease. Neurobiol Aging, 25, 2004, 651-660 96 Landen M, Thorsell A, Wallin A, Blennow K. The apolipoprotein E allel epsilon 4 does not correlate with the number of senile plaques or neurofibrillary tangles in patients with Alzheimer’s disease. J Neurol Neurosurg Psychiatry, 61, 1996, 352356 97 Laske C, Eschweiler G. Brain-derived neurotrophic factor. Vom Nervenwachstumsfaktor zum Plastizitätsmodulator bei kognitiven Prozessen und psychischen Erkrankungen. Nervenarzt, 77, 2006, 523-537 98 Lee R, Kermani P, Teng KK, Hempstead BL. Regulation of cell survival by secreted proneurotrophins. Science, 2001, 294 (5548), 1945-1948 99 Lehrner J, Brenner-Walter B. Gedächtnisstörungen. In: Lehrner J, Pusswald G, Fertl E, Strubreither W, Kryspin-Exner I. (Hrsg.). Klinische Neuropsychologie. Grundlagen – Diagnostik – Rehabilitation. Springer, Wien, New York, 2006, 455473 - 83 - 100 Lehtorvirta M, Laakso MP, Soininen H, Helisalmi S, Mannermaa A, Helkala EL, Partanen K, Ryynanen M, Vainio P, Hartikainen P, Riekkinen PJ. Volumes of hippocampus, amygdala and frontal lobe in Alzheimer patients with different apolipoprotein E genotypes. Neurosci, 67, 1995, 65-72 101 Lehtorvirta M, Soininen H, Laakso MP, Partanen K, Helisalmi S, Mannermaa A, Ryynanen M, Kuikka J, Hartikainen P, Riekkinen PJ. SPECT and MRI analysis in Alzheimer’s disease: relation to apolipoprotein E ε4 allele. J Neurol Neurosurg PS, 60, 1996, 644-649 102 Leibrock J,Lottspeich F, Hohn A, Hofer M, Hengerer B, Masiakowski P, Thoenen H, Barde YA. Molecular cloning and expression of brain-derived neurotrophic factor. Nature, 341, 1989, 149-152 103 Leitlinien der Deutschen Gesellschaft für Neurologie: Leitlinien für Diagnostik und Therapie in der Neurologie. Diagnostik und Therapie von Gedächtnisstörungen; 4. überarbeitete Auflage Georg Thieme Verlag, Stuttgart, 2008, S. 654 ff 104 Lemaitre H, Crivello F, Dufouil C, Grassiot B, Tzourio C, Alperovitch A, Mazoyer B. No epsilon4 gene dose effect on hippocampal atrophy in large MRI database of healthy elderly subjects. Neuroimag, 24, 2005, 1205-1213 105 Levi O, Jongen-Relo AL, Feldon J, Roses AD, Michaelson DM. ApoE4 impairs hippocampal plasticity isoform-specifically and blocks the environmental stimulation of synaptogenesis and memory. Neurobiol Dis, 13, 2003, 273-282 106 Levine ES, Dreyfus Cf, Black IB, Plummer MR. Brain-derived neurotrophic factor rapidly enhances synaptic transmission in hippocampal neurons via postsynaptic tyrosine kinase receptors. PNAS, 92, 1995, 804-8077 107 Levine ES, Dreyfus CF, Black IB, Plummer MR. Selective role for trkB neurotrophin receptors in rapid modulation of hippocampal synaptic transmission. Brain Res Mol Brain Res, 38(2), 1996, 300-303 108 Li YX, Xu Y, Ju D, Lester HA, Davidson N, Schuman EM. Expression of a dominant negative TrkB receptor, T1, reveals a requirement for presynaptic signaling in BDNF-induced synaptic potentiation in cultured hippocampal neurons. Proc Natl Acad Sci USA, 95(18), 1998, 10884-10889 109 Li SC, Chicherio C, Nyberg L, von Oertzen T, Nagel IE, Papenberg G, Sander T, Heekeren HR, Lindenberger U, Bäckman L. Ebbinghaus revistet: influence of the BDNF Val66Met polymoprhism on backward serial recall are modulatet by human aging. J Cogn Neurosci, 22(10), 2010, 2164-2173 110 Light LL, Anderson PA. Working memory capacity, age, and memory for discourse. J Gerontol, 40, 1985, 737-747 111 Lu B, Gottschalk W. Modulation of hippocampal synaptic transmission and plasticity by neurotrophins. Prog Brain Res, 128, 2000, 231-241 112 Lu B, Pang PT, Woo NH. The yin and yang of neurotrophin action. Nat Rev Neurosci, 6, 2005, 603-614 113 Markowitsch HJ. Memory and amnesia. In: Mesulam M-M (Ed.). Principles of behavioral and cognitive Neurology. Oxford University Press, New York, 2000, 257-293 114 Markowitsch HJ. Dem Gedächtnis auf der Spur. Vom Erinnern und Vergessen. Wissenschaftliche Buchgesellschaft und PRIMUS-Verlag, Darmstadt, 2002 115 Markowitsch HJ. Psychogenic amnesia. Neuro-Image, 20, 2003,132-138 - 84 - 116 Marquis S, Moore MM, Howieson DB, Sexton G, Payami H, Kaye JA, Camicioli R. Independent predictors of cognitive decline in healthy elderly persons. Arch Neurol, 59, 2002, 601-606 117 May PC, Lampert-Etchells M, Johnson SA, Poirier J, Masters JN, Finch CE. Dynamics of gene expression for a hippocampal glycoprotein elevated in Alzheimer’s disease and in response to experimental lesions in rat. Neuron, 5, 1990, 831-839 118 McAllister A, Lo D, Katz L. Neurotrophins regulate dentritic growth in developing visual cortex. Neuron, 15, 1995, 791-803 119 McDaniel MA, Einstein GO. Aging and prospective memory: Basic findings and practical applications. Adv Learn Behav Dis, 7, 1992, 87-105 120 Menzel HJ, Kladentzky RG, Assmann G. Apolipoprotein E Polymorphism and coronary heart diesease. Atherosclerosis, 3, 1983, 310-315 121 Merlio JP, Ernfors P, Kokaia Z, Middlemas DS, Bengzon J, Kokaia M, Smith ML, Siesjö BK, Hunter T, Lindvall O, et al. (1993) Increased production of the TrkB protein tyrosine kinase receptor after brain insults. Neuron, 10(2), 1993, 151-164 122 Miller GA. The magic number seven plus and minus two: Some limits on our capacity for processing information. Psychol Rev, 63, 1956, 81-97 123 Miyajima F, Ollier W, Mayes A, Jackson A, Thacker N, Rabbitt P, Pendleton N, Horan M, Payton A. Brain-derived neurotrophic factor polymorphism Val66Met influences cognitive abilities in the elderly. Genes Brain Behav, 7, 2008, 411-417 124 Momose Y, Murata M, Kobayashi K, Tachikawa M, Nakabayashi Y, Kanazawa I, Toda T. Association studies of multiple candidate genes for Parkinson’s disease using single nucleotide polymorphisms. Ann Neurol, 51, 2002, 133-136 125 Mondadori CRA, Quervain DJ-F, Buchmann A, Mustovic H, Wollmer MA, Schmidt CF, Boesiger P, Hock C, Nitsch RM, Papassotiropoulos A, Henke K. Better Memory and Neural Efficiency in Young Apolipoprotein E ε4 Carriers. Cereb Cortex, 17, 2007, 1934-1947 126 Moriarty PM, Luyendyk JP, Gibson CA, Backes JM. Apheresis on plasma levels of apolipoprotein e4. Am J Cardiol, 105(11), 2010, 1585-1587 127 Mowla SJ, Farhadi HF, Pareek S, Atwal JK, Morris SJ, Seidah NG, Murphy RA. Biosynthesis and post-translational processing of the precursor to brain-derived neurotrophic factor. J Biol Chem, 276(16), 2001, 12660-12666 128 Neves-Pereira M, Mundo E, Muglia P, King N, Macciardi F, Kennedy JL. The brainderived neurotrophic factor gene confers susceptibility to bipolar disorder: Evidence from a family-based association study. Am J Hum Genet, 71, 2002, 651655 129 Nonner D, Barrett EF, Barret JN. Neurotrophin effects on survival and expression of cholinergic properties in cultured rat septal neurons under normal and stress conditions. J Neurosci, 16, 1996, 6665-6675 130 Ohkubo N, Mitsuda N, Tamatani M, Yamaguchi S, Lee YD, Ogihara T, Vitek MP, Tohyama M. Apolipoprotein E4 stimulates cAMP response element-binding protein transcriptional activity through the etracellular signal-regulated kinase pathway. J Biol Chem, 276, 2001, 3046-3053 131 Ohm TG, Muller H, Braak H, Bohl J. Close-meshed prevalence rates of different stages as a tool to uncover the rate of Alzheimer's disease-related neurofibrillary changes. Neurosci, 64, 1995, 209-217 - 85 - 132 Oria RB, Patrick PD, Thang H, Lorntz B, Catsro Costa CM, Brito GA, Barrett LJ, Lima AA, Guerrant RL. APOE4 protects the cognitive development in children with heavy diarrhea burdens in Northeast Brazil. Pediatr Res, 57, 2005, 310-316 133 Parasuraman R, Greenwood PM, Sunderland T. The apolipoprotein E gene, attention, and brain function. Neuropsychology, 16, 2002, 254-274 134 Park DC, Smith AD, Lautenschlager G, Earles JL, Frieske D, Zwahr M. Mediators of long-term memory performance across the life-span. Psychol Aging, 11, 1996, 621-637 135 Patterson SL, Abel T, Deuel TA, Martin KC, Rose JC, Kandel ER. Recombinant BDNF rescues deficits in basal synaptic transmission and hippocampal LTP in BDNF knockout mice. Neuron, 16, 1996, 1137-1145 136 Pendleton N, Payton A, van den Boogerd EH, Holland F, Diggle P, Rabbitt PM, Horan MA, Worthington J, Ollier WE. Aplipoprotein E genotype does not predict decline in intelligence in healthy older adults. Neurosci Lett, 324, 2002, 74-76 137 Pericak-Vance MA, Bebout JL, Gaskell PC, Yamaoka LH, Hung WY, Alberts MJ, Walker AP, Bartlett RJ, Haynes CA, Welsch KA, Earl NL, Heyman A, Clark CM, Roses AD. Linkage studies in familial Alzheimer’s diesease: evidence for chromosome 19 linkage. Am J Hum Genet, 48, 1991, 1034-1050 138 Pezawas L,Verchinski BA, Mattay VS, Callicott JH, Kolachana BS, Straub RE. The brain-derived neurotrophic factor val66met polymorphism and variation in human cortical morphology. J Neurosci, 24, 2004, 10099-10102 139 Plomin R, Owen MJ, McGuffin P. The Genetic Basis of Complex Human Behaviours. Science, 264, 1994, 1733-1739 140 Plomin R, Kennedy JKJ, Craig IW. The quest of quantitative trait loci associated with intelligence. Intelligence, 34(6), 2006, 513-526 141 Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, Niinisto L, Halonen P, Kontula K. Apolipoprotein E, dementia, and cortical deposition of beta amyloid protein. N Engl J Med, 333, 1995, 1242-1247 142 Poo MM. Neurotrophins as synaptic modulators. Nat Rev Neurosci, 2, 2001, 24-31 143 Price DL, Sisodia SS, Borchelt DR. Alzheimer’s disease – when and why? Nat Genet, 1998, 19, 314-316 144 Pritzel M, Brand M, Markowitsch HJ. Gehirn und Verhalten. Ein Grundkurs der physiologischen Psychologie. Spektrum Akademischer Verlag, Heidelberg, 2003 145 Puttonen S, Elovainio M, Kivimaki M, Lehtimaki T, Keltikangas-Jarvinen L. The combined effects of apolipoprotein E polymorphism and low-density lipoprotein cholesterol on cognitive performance in young adults. Neuropsychobiology, 48, 2003, 35-40 146 Qiu Z, Crutcher KA, Hyman BT, Rebeck GW. ApoE isoforms affect neuronal Nmethyl-D-aspartate calcium responses and toxicity via receptor-mediated processses. Neurosci, 122, 2003, 291-303 147 Rebeck GW, Perls TT, West HL, Sodhi P, Lipsitz LA, Hyman BT. Reduced apolipoprotein epsilon 4 allele frequency in the oldest old Alzheimer’s patients and cognitively normal individuals. Neurology, 44, 1994, 1513-1516 148 Reiman EM, Uecker A, Caselli R, Lewis S, Bandy D, de Leon M. Hippocampal volumes in cognitively normal persons at genetic risk for Alzheimer’s disease. Ann Neurol, 44, 1998, 288-291 - 86 - 149 Reiman EM, Chen K, Alexander GE, Caselli RJ, Bandy D, Osborne D, Saunders AM, Hardy J. Functional brain abnormalities in young adults at genetic risk for lateonset Alzheimer’s dementia. P Natl Acad Sci, 101, 2004, 284-289 150 Ribases M, Gratacos M, Armengol, L, de Cid R, Basia A, Jimenez L. Met66 in the brain-derived neurotrophic factor (BDNF) precursor is associated with anorexia nervosa restrictive type. Mol Psychiatr, 8, 2003, 745-751 151 Riesen WF, Engler H. Clinical relevance of apolipoproteins. Clin. Lab., 42, 1996, 14 152 Roediger HL. Prospective memory and episodic memory. In Brandimonte M, Einstein GO, McDaniel MA (Eds.). Prospective memory: Theory and Application. Erlbaum, Mahwah, NJ, 1996, 149-155 153 Rubinzstein DC, Easton DF. Apolipoprotein E genetic variation and Alzheimer’s disease: A meta-analysis. Dement Geriatr Cogn, 10, 1999, 199-209 154 Saunders AM, Strittmatter WJ, Schmechel D, George-Hyslop PH, Perikac-Vance M, Joo S. Association of apolipoprotein E allele ε4 with late-onset familial and sporadic Alzheimer’s disease. Neurology, 43, 1993, 1467-1472 155 Savitz J, Solms M, Ramesar R. Apolipoprotein E variants and cognition in healthy individuals: A critical opinion. Brain Res Rev, 51, 2006, 125-135 156 Scarmeas N, Habeck CG, Hilton J, Anderson KE, Flynn J, Park A, Stern Y. APOE related alterations in cerebral activation even at college age. J Neurol Neurosur PS, 76, 2005, 1440-1444 157 Schäbitz WR, Berger C, Kollmar R, Seitz M, Tanay E, Kiessling M, Schwab S, Sommer C. Effect of brain-derived neurotrophic factor treatment and forced arm use on functional motor recovery after small cortical ischemia. Stroke, 35(4), 2004, 992-997 158 Schellig D, Drechsler R, Heinemann D, Sturm, W, Hrsg. Handbuch neuropsychologischer Testverfahren, Band 1. Hogrefe, Göttingen, 2008 159 Schimizu E, Hashimoto K, Iyo M. Ethnic difference of the BDNF 196G/A (val66met) polymorphism frequencies: The possibility to explain ethnic mental traits. Am J Med Genet B, 126, 2004, 123-123 160 Schuri U. Gedächtnis. In: von Cramon DY, Mai N, Ziegler W (Hrsg.). Neuropsychologische Diagnostik. VCH Verlagsgesellschaft mbH, Weinheim, 1993, 91-107 161 Sen S, Nesse RM, Stoltenberg SF, Li S, Gleiberman L, Chakravarti A. A BDNF coding variant is associated with the NEO personality inventory domain neuroticcism, a risk factor for depression. Neuropsychopharmacol, 28, 2003, 397-401 162 Shacter DL. Aussetzer – Wie wir vergessen uns zu erinnern. Lübbe, Bergisch Gladbach, 2005 163 Siest G, Pillot T, Régis-Bailly A, Leiniger-Muller B, Steinmetz J, Galteau MM, Visvikis S. Apolipoprotein E: an important gene and protein to follow in laboratory medicine. Clin. Chem., 41, 1995, 1068-1086 164 Sinz, R. Neurobiologie und Gedächtnis. Gustav Fischer Verlag, Stuttgart, 1979 165 Sliwinski M, Lipton RB, Buschke H, Stewart W. The effects of preclinical dementia on estimates of normal cognitive functioning in aging. J Gerontol B, 51, 1996, 217225 166 Small GW, Mazziotta JC, Collins MT, Baxter LR, Phelps ME, Mandelkern MA, Kaplan A, La Rue A, Adamson CF, Chang L, Guze BH, Corder EH, Saunders AM, Haines JL, Pericak-Vance MA. Roses AD. Apolipoprotein E type 4 allele and - 87 - cerebral glucose metabolism in relatives at risk for familial Alzheimer disease. JAMA, 1995, 273, 942-947 167 Small BJ, Basun H, Backman L. Three year-changes in cognitive performance as a function of apolipoprotein E genotype: evidence from very old adults without dementia. Psychol Aging, 13, 1998, 80-87 168 Small BJ, Graves AB, McEvoy CL, Crawford FC, Mullan M, Mortimer JA. Is APOEepsilon 4 a risk factor for cognitive impairment in normal aging? Neurology, 54, 2000, 2082-2088 169 Small BJ, Rosnick CB, Fratiglioni L, Backman L. Apolipoprotein E and cognitive performance: a meta-analysis. Psychol Aging, 19, 2004, 592-600 170 Smith GE, Bohac DL, Waring SC, Kokmen E, Tangalos EG, Ivnik RJ, Petersen RC. Apolipoprotein E genotype influences cognitive ‘phenotype’ in patients with Alzheimer’s disease but not in healthy control subjects. Neurology, 50, 1998, 355-362 171 Squire LR. Memory and brain. Oxford University Press, New York, 1987 172 Strittmatter WJ, Weisgraber KH, Huang DY, Dong LM, Salvesen GS, PericakVance M, Schmechel D, Saunders GS, Goldgaber D, Roses AD. Binding of human apolipoprotein E to synthetic amyloid beta peptide: isoform specific effects and implications for late-onset Alzheimer’s disease. Proc Natl Acad Sci, 90, 1993, 8098-8102 173 Szeszko PR, Lipsky R, Mentschel C; Robinson D, Gunduzbruce H, Sevy S. Brainderived neurotrophic factor val66met polymorphism and volume of the hippocampal formation. Mol Psychiatr, 10, 2005, 631-636 174 Teng HK, Teng KK, Lee R, Wright S, Tevar S, Almeida RD, Kermani P, Torkin R, Chen ZY, Lee FS, Kraemer RT, Nykjaer A, Hempstead BL. ProBDNF induces neuronal apoptosis via activation of a receptor complex of p75NTR and sortilin. J Neurosci, 25 (22), 2005, 5455-63 175 Thöne-Otto A, Markowitsch HJ. Gedächtnisstörungen nach Hirnschäden. In: Flor H, Gauggel S, Lautenbacher S, Niemann H, Thöne-Otto A (Hrsg.). Fortschritte der Neuropsychologie, Band 2., Hogrefe, Göttingen, 2004 176 Tulving E, Schacter DL. Priming and human memory systems. Science, 247, 1990, 301-306 177 Tulving E, Kapur S, Craik FIM, Moscovitsch M, Houle S. Hemispheric encoding/ retrieval asymmetry in episodic memory: Prositron emission tomography findings. PNAS, 91, 1994, 2016-2020 178 Tulving E. Organization of memory: Quo vadis? In Gazzaniga MS (Ed.). The cognitive neuroscience. MIT-Press, Cambridge, Massachisetts, 1995, 839-847 179 Tulving E., Markowitsch HJ. Episodic and declarative memory: a role of the hippocampus. Hippocampus, 8, 1998, 198-204 180 Turic D, Fisher PJ, Plomin R, Owen MJ. No association between apolipoprotein E polymorphism and general cognitive ability in children. Neurosci Lett, 299, 2001, 97-100 181 Utermann G, Langenbeck U, Beisiegel U, Weber W,. Genetics of the apolipoprotein E system in man. Am J Hum Genet, 32, 1980, 339-347 182 van Wingen G, Rijpkema M, Franke B, van Eijndhoven P, Tendolkar I, Verkes RJ, Buitelaar J, Fernández G. The brain-derived neurotrophic factor Val66Met polymerphism affects memory formation and retrieval of biologically salient stimuli. Neuroimage, 50(3), 2010, 1212-1218 - 88 - 183 Ventimiglia R, Mather PE, Jones BE, Lindsay RM. The neurotrophins BDNF, NT-3 and NT-4/5 promote survival and morphological and biochemical differentation of striatal neurons in vitro. Eu J Neurosci, 7, 1995, 213-222 184 Ventriglia M, Bocchio Chiavetto L, Benussi L, Binetti G, Zanetti O, Riva MA, Gennarelli M. Association between the BDNF 196 A/G polymorphism and sporadic Alzheimer’s disease. Mol Psychiatr, 7, 2002, 136-137 185 Wilson RS, Berry-Kravis E, Evans DA, Bennett DA. The apolipoprotein E epsilon 2 allele and decline in epsiodic memory. J Neurol Neurosur PS, 73, 2002, 672-677 186 Winnock M, Letenneur L, Jacqmin-Gadda H, Dallongeville J, Amouyel P, Dartigues JF. Longitudinal analysis of the effect of apolipoprotein E epsilon4 and education on cognitive performance in elderly subjects: the PAQUID study. J Neuro Neurosurg PS, 72, 2002, 794-797 187 Wisdom NM, Callahan JL, Hawkins KA. The effects of apolipoprotein E on nonimpaired cognitive functioning: A meta-analysis. Neurobiol Aging, 2009 188 Woo NH, Teng HK, Siao CJ, Chiaruttini C, Pang PT, Milner TA, Hempstead BL, Lu B. Activation of p75NTR by proBDNF facilitates hippocampal long-term depression. Nat Neurosci, 8(8), 2005, 1069-1077 189 Wright RE. Aging, devided attention, and processing capacity. J Gerontol, 5, 1981, 605-614 190 Wright RO, Hu H, Silverman EK, Tsaih SW, Schwartz J, Bellinger D, Palazuelos E, Weiss ST, Hernandez-Avila M. Apolipoprotein E genotype predicts 24-months bayley sclaes infant development score. Pediatr Res, 54, 2002, 819-825 191 Yamada K, Mizuno M, Nabeshima T. Role of brain-derived neurotrophic factor in learning and memory. Life Sci, 70, 2001, 735-744 192 Yan Q, Radeke MJ, Matheson CR, Talvenheimo J, Welcher AA, Feinstein SC. Immunocytochemical localization of TrkB in the central nervous system of the adult rat. J Comp Neurol, 378, 2007, 135-157 193 Yu YW, Lin CH, Chen SP, Hong CJ, Tsai SJ. Intelligence and event-related potentials for young female human volunteer apolipoprotein E epsilon4 and non-epsilon4 carriers. Neurosci Lett, 294, 2000, 179-181 194 Zetterberg H, Palmer M, Ricksten A, Poirier J, Palmqvist L, Rymo L, Zafiropoulos A, Arvantis DA, Spandidos DA, Blennow K. Influence of the apolipoprotein E epsilon4 allele on human embryonic development. Neurosci Lett, 324, 2002, 189192 195 Zimbardo PG. Psychologie. Deutsche Bearbeitung von Hoppe-Graf S, Keller B und Engel I. 6. Auflage, Springer, Berlin, Heidelberg, New York, 1995, S. 334 - 89 - 7 Vorveröffentlichungen Richter-Schmidinger T, Alexopoulos P, Horn M, Maus S, Reichel M, Rhein C, Lewczuk P, Sidiropoulos C, Kneib T, Perneczky R, Doerfler A, Kornhuber J. Influence of Brainderived neurotrophic-factor and Apolipoprotein E genetic variants on hippocampal volume and memory performance in young healthy adults. J Neural Transm, 2010, 1-9 - 90 - 8 Abkürzungsverzeichnis α Signifikanzniveau A Adenin a.a.O. am angegebenen Ort AD Alzheimer Demenz ANOVA Varianzanalyse APOE Gen des Apolipoproteins BDNF brain-derived neurotrophic factor Bp Basenpaare bzw. beziehungsweise d Effektstärke d.h. das heißt DAT Demenz vom Alzheimer Typ DNS Desoxyribonukleinsäure ebd. ebenda et al. et alii (und andere) f (ff) folgende (fortfolgende) G Guanin HUM-BDNF BDNF-Gen beim Menschen IGD Inventar zur Gedächtnisdiagnostik LDL Low Density Lipoprotein Met Methionin MMST Mini Mental Status Test mRNA messenger (Boten-) Ribonukleinsäure MW Mittelwert N Umfang der gesamten Stichprobe n (n%) absoluter (relativer) Umfang von Teilpopulationen NFT neurofibrillary tangles NGF nerve growth factor NT-3 Neurotrophin-3 NT-4 Neurotrophin-4 OR odd ratio p Signifikanz p75NT-Rezeptor p75-Neurotrophin-Rezeptor - 91 - PCR Polymerase-Kettenreaktion PR Prozentrang r Korrelations-/Regressionskoeffizient 2 R Bestimmtheitsmaß bei Regression s Standardabweichung S. Seite s. siehe SNP single nucleotide polymorphism SPSS Statistical Package for the Social Sciences TrkB-Rezeptor Tyrosin-Kinase-B-Rezeptor u.a. unter anderem Val Valin vgl. vergleiche WMS-R Wechsler Memory Scale - revised vs. versus z.B. zum Beispiel ZNS zentrales Nervensystem - 92 - 9 Tabellenverzeichnis Tabelle 1: Übersicht über die verschiedenen Fehlleistungen des Gedächtnisses (nach Schacter, 2005) Tabelle 2: Empfehlungen zur neuropsychologischen Diagnostik von Gedächtnisstörungen (modifiziert nach Leitlinien der Deutschen Gesellschaft für Neurologie, 2008) Tabelle 3: Beschreibung der Stichprobe mit absoluten (n) und relativen (n%) Häufigkeiten, Mittelwerten (MW) und Standardabweichungen (s); † nach Egan et al. (2003), ‡ nach Hill et al. (2007) Tabelle 4: Kreuztabelle ApoE * BDNF * Geschlecht (N=140); farblich hervorgehoben sind die potentiell kritischen Allel-Kombinationen mit jeweils mindestens einem BDNFMet und einem APOE ε4 Tabelle 5: Darstellung der mit der Kovarianzanalyse bzw. univariaten Varianzanalyse aufgedeckten signifikanten Unterschiede in den einzelnen Gedächtnisleistungen infolge demographischer Einflüsse unter Berücksichtigung des Levene-Tests (aufgeteilt nach den Genotypen von BDNF und APOE) Tabelle 6: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Val und Val-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen ChiQuadrat-Test; d ist die Effektstärke nach Cohen (1969) mit Modifikation der Streuung nach Bortz & Döring, 2006)) Tabelle 7: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Val und Met-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen ChiQuadrat-Test; d ist die Effektstärke nach Cohen (1969) mit Modifikation der Streuung nach Bortz & Döring, 2006)) Tabelle 8: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Met und Met-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen ChiQuadrat-Test) Tabelle 9: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den BDNF-Gruppen Val-Val und Val-Met/Met-Met (mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen Chi-Quadrat-Test; d ist die Effektstärke nach Cohen (1969) mit Modifikation der Streuung nach Bortz & Döring, 2006)) Tabelle 10: Prüfung auf signifikante demographische und mnestische Unterschiede zwischen den APOE-Gruppen „kein ε4“ (ε2/ε2, ε2/ε3, ε3/3) und „ε4“ (ε2/ε4, ε3/ε4, ε4/ε4; mit U, t, χ2 als Testgrößen des Mann-Whitney-U-Tests, t-Tests für unabhängige Stichproben und Pearson’schen Chi-Quadrat-Test) - 93 - Tabelle 11: bivariate Korrelationen zwischen den IGD-Skalen und dem Lebensalter gruppiert nach dem Auftreten der kritischen Genotypen von HUM-BDNF und APOE († Korrelation nach Pearson, ‡ Korrelation nach Spearman) Tabelle 12: Ergebnisse der linearen Regression mit den IGD-Skalen als Kriteriumsvariablen und dem Lebensalter als Prädiktorvariable unter Berücksichtigung der Genotypen von HUM-BDNF und APOE - 94 - 10 Abbildungsverzeichnis Abbildung 1: vereinfachte Darstellung der zeitlichen Einteilung des Gedächtnisses und der beteiligten Speicher (modifiziert nach Baller et al., 2006, S.7) Abbildung 2: inhaltliche Unterteilungen des Langzeitgedächtnisses (modifiziert nach Pritzel et al., 2003) Abbildung 3: Flussdiagramm zur zeitlichen Einteilung des Gedächtnisses mit beteiligten Speichern und Prozessen der Informationsverarbeitung (nach Zimbardo, 1995) Abbildung 4: Übersicht über die Subtests, Skalen und den Gesamtscore des IGDModuls A Abbildung 5: Histogramme mit Normalverteilungskurven für das Alter (links) und der Ausbildungsjahre (rechts) Abbildung 6: Darstellung der absoluten und relativen Häufigkeiten der auf den IGDSkalen erzielten Ergebnisse unterteilt nach den BDNF-Phänotypen (N=140, nVal-Val=89, nVal-Met=39, nMet-Met=12). Ein Prozentrang (PR) zwischen 0 und 24 gilt als „unterdurchschnittlich“, zwischen 25 und 75 als „durchschnittlich“ und zwischen 76 und 100 als „überdurchschnittlich“. Abbildung 7: Darstellung der absoluten und relativen Häufigkeiten auf den IGDSkalen erzielten Ergebnisse unterteilt nach den APOE-Phänotypen (N=140, nε2/ε2=2, nε2/ε3=15, nε2/ε4=2, nε3/3=104, nε3/4=13, nε4/4=4). Ein Prozentrang (PR) zwischen 0 und 24 gilt als „unterdurchschnittlich“, zwischen 25 und 75 als „durchschnittlich“ und zwischen 76 und 100 als „überdurchschnittlich“. Abbildung 8: Ergebnisse des IGD-Gesamtscores in Abhängigkeit vom Lebensalter und den Polymorphismen des Gens HUM-BDNF (Val-Val und Val-Met/Met-Met), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Abbildung 9: Ergebnisse der IGD-Skala Kurzzeit-/Arbeitsgedächtnis in Abhängigkeit vom Lebensalter und der Polymorphismen des Gens HUM-BDNF (Val-Val und ValMet/Met-Met), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Abbildung 10: Ergebnisse der IGD-Skala verbales Gedächtnis in Abhängigkeit vom Lebensalter und der Polymorphismen des Gens HUM-BDNF (Val-Val und Val-Met/MetMet), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Abbildung 11: Ergebnisse der IGD-Skala Kurzzeit-/Arbeitsgedächtnis in Abhängigkeit vom Lebensalter und der Polymorphismen des Gens APOE (kein ε4 und ε4), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden Abbildung 12: Ergebnisse der IGD-Skala verbales Gedächtnis in Abhängigkeit vom Lebensalter und der Polymorphismen des Gens APOE (kein ε4 und ε4), dargestellt in Form eines Streudiagramm einschließlich der Regressionsgeraden - 95 - 11 Anhang A1: Übersicht über die Subtests und die Skalen des IGD-Moduls A (Lern- und Merkfähigkeit; modifiziert nach Baller et al., 2006, S. 16f) A2: Übersicht über die Instruktionen und gemessenen mnestischen Leistungen der IGD-Subtests (nach Baller et al., 2006, S. 31-40) A3: Testung auf Normalverteilung innerhalb der interessierenden PolymorphismusSubgruppen; bei intervallskalierten Variablen mit Hilfe des Kolmogorov-Smirnov Tests für eine Stichprobe, bei nominalen mit Hilfe des Tests auf Binomialverteilung A4: Diagramme der gemittelten Gedächtnisleistungen in Abhängigkeit vom Lebensalter A5: bivariate Korrelationen nach Pearson† bzw. Spearman-Rho‡ zwischen den IGDSkalen und den demographischen Variablen Alter, Geschlecht und Bildung pro dichotomisierten Phänotyp (kein Met, Met und kein ε4, ε4) räumlichvisuell 4 Lage und Ausrichtung von Objekten und visuelles Arbeits- gleichzeitig die Position der Objekte auf der Gedächtnis Seite verarbeiten verbal mittelfristig mittelfristig Figurenrekognition aus ähnlichen Vorlagen und freier Abruf eines fehlenden Details 8 Form-Farb-Paare lernen, Abruf durch Vorgabe Paarassoziations der Form, Zuordnen der Farben lernen Rekognition von bewusst und unbewusst längerfristig gelernten Wörtern aus Untertest 3 aus einer Wortliste mit phonematischen und semantischen Distraktoren und neutralen Wörtern 7 visuelles Lernen 9 verzögerte Rekognition: Wortliste visuellverbal mittelfristig Wortrekognition aus einer Textvorlage mit semantisch ähnlichen Distraktoren 6 verbales Lernen visuell verbal kurzzeitig Aufmerksamkeitsshift zwischen zwei zu merkenden visuellen Reizmustern, für den Abruf Transkodierung in verbale Information erforderlich 5 Exekutive Kontrolle visuellverbal verbal 3 Wörter mit einem bestimmten Merkmal aus einer kurzzeitig verbales Arbeits- Wortliste selektieren und speichern Gedächtnis kurzzeitig verbal kurzzeitig kurzfristiges Behalten von Zahlenreihen zunehmender Komplexität 2 Zahlenspanne verbal Modalität zukunftsgerichtet zeitliche Dimension Instruktion einspeichern, bereit halten und in einem bestimmten zeitlichen und situativen Kontext abrufen Beschreibung 1 prospektives Gedächtnis Subtest - intentional intentional intentional intentional intentional intentional intentional intentional Speichern explizit explizit explizit explizit explizit explizit explizit explizit explizit Abruf rekognizieren lernen, zuordnen lernen, frei reproduzieren, rekognitizieren lernen, rekognizieren halten und manipulieren, frei reproduzieren halten und gleichzeitig verarbeiten, frei reproduzieren selektieren und halten, frei reproduzieren einspeichern und halten, frei reproduzieren bereit halten und zum bestimmten Zeitpunkt abrufen Funktion A1: Übersicht über die Subtests und die Skalen des IGD-Moduls A (Lern- und Merkfähigkeit; modifiziert nach Baller et al., 2006, S. 16f) - 96 - längerfristig längerfristig längerfristig freier Abruf von Textinformation aus Untertest 6 mit Hinweisreizen durch Fragen Rekognition der Figuren aus Untertest 7 aus ähnlichen und weniger ähnlichen Distraktoren Wortfragmente teilweise zuvor verarbeiteter Wörter aus Untertest 3 ergänzen 10 verzögerte Reproduktion: Text 11 verzögerte Rekognition: Figuren 12 Priming zeitliche Dimension Beschreibung Subtest (Fortsetzung A1) - 97 - verbal visuell verbal Modalität - - - Speichern implizit explizit explizit Abruf identifizieren rekognizieren gestütztes reproduzieren Funktion Prägen Sie sich bitte die Lage und Ausrichtung der Linien in den Kästchen ein. Merken Sie sich bitte außerdem die Position, also in welchem Kästchen auf der Seite welche Linie liegt. In der Abfrage werden Ihnen die leeren Kästchen vorgegeben, und Sie zeichnen bitte die passenden Linien ein. Diese Aufgabe wird Ihnen drei mal hintereinander vorgelegt. 4 visuelles Arbeitsgedächtnis 5 Zählen Sie bitte abwechselnd die punkte und die Dreiecke in den Kästchen 1 Exekutive Kontrolle bis 9. Sie beginnen im ersten Kästchen mit den Punkten, dann zählen Sie im zweiten Kästchen die Dreiecke, im nächsten Kästchen wieder die Punkte usw.. Bilden Sie aus diesen Zahlen eine Zahlenreihe und merken Sie sich diese. Anschließend schreiben Sie die Zahlenreihe bitte auf. Diese Aufgabe wird Ihnen drei mal hintereinander vorgelegt. Ich werde Ihnen jetzt eine Wortliste vorlesen. Prägen Sie sich bitte nur die Wörter ein, die ein „r“ enthalten. Wenn ich Ihnen also die Wörter Auto, Hase, Brot vorlese, sollen Sie hinterher nur das Wort Brot aufschreiben, weil nur dieses Wort ein „r“ enthält. Diese Wortliste wird drei mal vorgelesen und abgefragt. 3 verbales Arbeitsgedächtnis Ich werde Ihnen jetzt Zahlenreihen vorsprechen. Nach jeder Zahlenreihe Das Spannenmaß lässt sich aus der Anzahl der mache ich eine Pause. Schreiben Sie dann bitte die Zahlenreihe auf. richtig reproduzierten Ziffern ableiten Beginnen Sie erst dann mit dem Aufschreiben, wenn ich zu Ende gesprochen habe. 2 Zahlenspanne hohe Aufmerksamkeitsanforderung (v.a. zusätzlicher Shift zwischen den wechselnden relevanten Reizen); visuelle Information muss bei Einspeicherung verarbeitet und für den Abruf in eine verbale Information transkodiert werden Mehrfachanforderung hinsichtlich der räumlichvisuellen Verarbeitung: die einzuprägenden Linien müssen bezüglich ihrer Merkmale Ausrichtung und Lage frei reproduziert und zudem richtig im Raum positioniert werden Unterscheiden zwischen relevanten und irrelevanten Wörtern und gleichzeitiges Einspeichern der selektierten Wörter Halten von Handlungsanweisungen vom Zeitpunkt des Einspeicherns bis zu ihrer Ausführung zu einem festgelegten Zeitpunkt; Aufgabenschwierigkeit variiert durch Hinweisreize (in erster Aufgabe mit den Kästchen gegeben, in zweiter ist die Handlungsausführung zeitlich-situativ assoziiert) 1. Aufgabe: Immer wenn Sie unten rechts auf einer Seite Ihres Testheftes ein solches doppelt umrandetes Kästchen sehen, tragen Sie dort bitte ein X ein. 2. Aufgabe: Bitte beschreiben Sie nach der Testung auf der letzten Seite dieses Ordners kurz und stichwortartig, wie Sie den Test persönlich empfunden haben (z.B. interessant oder schwierig). Vergessen Sie diese Anweisungen bitte nicht. Sie werden nicht noch einmal daran erinnert. 1 prospektives Gedächtnis Information und mnestische Leistung Instruktion Subtest A2: Übersicht über die Instruktionen und gemessenen mnestischen Leistungen der IGD-Subtests (nach Baller et al., 2006, S. 31-40) - 98 - Instruktion Ich werde Ihnen einen kurzen Zeitungstext vorlesen. Sie können den Text in Ihrem Testheft mitlesen. Bitte prägen Sie sich den Inhalt und den Wortlaut ein. In einer späteren Aufgabe kommen wir auf den Inhalt zurück. In dieser Aufgabe wird nach dem Wortlaut gefragt. Dazu wird Ihnen der gleiche Text noch einmal vorgelegt – allerdings gibt es zu einigen Wörtern mehrere Wahlmöglichkeiten. Diese sind zur Kennzeichnung schräg gedruckt. Von diesen Wörtern sollen Sie jeweils das Wort unterstreichen, welches im Originaltext verwendet wurde. Bitte Prägen Sie sich die Figuren mit allen Einzelheiten ein. In der Abfrage wird Ihnen eine Auswahl von Figuren gezeigt, die diesen ähnlich sind. Allerdings fehlt immer ein Element. Bitte kreuzen Sie die Figur an, die der Originalfigur am ähnlichsten ist. Zeichnen Sie dann in diese Figur das fehlende Element ein, so dass wieder die Originalfigur entsteht. In der folgenden Aufgabe sind jeweils eine Form und eine Farbe einander zugeordnet. Bitte prägen Sie sich diese Form-Farb-Paare ein. In der Abfrage werden die Formen vorgegeben. Kreuzen Sie bitte die dazugehörige Farbe an. Erinnern Sie sich jetzt noch einmal an die Wortliste, die ich Ihnen mehrmals vorgelesen habe. Aus einer Vielzahl von Wörtern sollen Sie diejenigen heraussuchen, die in der Liste enthalten waren. Allerdings nicht nur die gelernten Wörter mit „r“, sondern auch die Wörter der Wortliste ohne „r“. Kreuzen Sie bitte die Antwort „Ja“ an, wenn Sie der Meinung sind, dass dieses Wort in der Liste enthalten war. Sonst kreuzen Sie „Nein“ an. Sie haben vor einigen Minuten den Text „Warnstreik“ gelesen. Bitte beantworten Sie zu diesem Text Fragen. Formulieren Sie Ihre Antwort kurz und so präzise wie möglich. Subtest 6 verbales Lernen 7 visuelles Lernen 8 Paarassoziationslernen 9 verzögerte Rekognition: Wortliste 10 verzögerte Reproduktion: Text (Fortsetzung A2) - 99 - durch Fragen gestützte Reproduktion des Textes expliziter Abruf der bewusst gelernten Wörter mit „r“; inzidenteller Abruf der Wörter ohne „r“ durch die gleichzeitige visuelle und verbale Darbietung der Items kann die Lernleistung materialunabhängig erfasst werden Rekognizieren der Figur und freie Reproduktion einer Detailinformation, die räumlich richtig in die Figur positioniert werden soll semantische Verarbeitung reicht für geforderte Rekognition nicht aus, da Distraktoren semantisch ähnlich sind; daher ist die phonematische Verarbeitung gedächtnisrelevant Information und mnestische Leistung Instruktion Bitte rufen Sie sich jetzt noch einmal die Figuren ins Gedächtnis, die Ihnen vor wenigen Minuten dargeboten wurden. Kreuzen Sie bitte in jeder Zeile die Figur an, die Sie sich zuvor gemerkt haben. In dieser Aufgabe sollen Sie in kurzer Zeit möglichst viele Hauptwörter (Nomen) finden. Ergänzen Sie dazu die unvollständigen Wörter mit einem Buchstaben an jeder Leerstelle und bilden Sie so ein sinnvolles Wort. Umlaute ä, ü, ö zählen als ein Buchstabe. Wenn Sie für eine Vorgabe keine spontane Lösung finden, machen Sie mit einem beliebigen anderen Wort weiter. Bitte schlagen Sie jetzt die letzte Seite auf und füllen Sie diese noch aus. Schließen Sie danach den Testordner. Ich danke Ihnen für Ihre Mitarbeit. Subtest 11 verzögerte Rekognition: Figuren 12 Priming (siehe 1) prospektives Gedächtnis (Fortsetzung A2) - 100 - Halten von Handlungsanweisungen vom Zeitpunkt des Einspeicherns bis zu ihrer Ausführung zu einem festgelegten Zeitpunkt (s. Aufgabe 1) die Hälfte der zu bearbeitenden Wortfragmente ist neutral, die andere Hälfte lässt sich durch Primewörter aus dem Subtest 3 ergänzen; ein Primingeffekt liegt vor, wenn mehr als zu 50 Prozent Primewörter gebildet werden Rekognition zuvor gelernter Figuren aus ähnlichen Distraktoren Information und mnestische Leistung BDNF Gen Val-Val ,029 ,003 ,229 ,932 ,945 ,006 ,018 ,483 ,215 ,000 ,153 ,078 ,016 ,136 ,001 ,000 ,000 ,005 ,087 ,000 ,013 Gesamtscore Kurzzeitgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition verzögerte Reproduktion Text verzögerte Reproduktion Figuren Priming p Alter Geschlecht Bildung Genotyp Variable BDNF Gen Val-Met prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition verzögerte Reproduktion Text verzögerte Reproduktion Figuren Priming Gesamtscore Kurzzeitgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis Alter Geschlecht Bildung Genotyp Variable ,084 ,559 ,115 ,072 ,622 ,250 ,001 ,000 ,001 ,192 ,000 ,112 ,631 ,883 ,084 ,507 ,622 ,451 ,350 ,004 ,262 p A3: Testung auf Normalverteilung innerhalb der interessierenden Polymorphismus-Subgruppen; bei intervallskalierten Variablen mit Hilfe des Kolmogorov-Smirnov Tests für eine Stichprobe, bei nominalen mit Hilfe des Tests auf Binomialverteilung - 101 - BDNF Gen Met-Met ,659 1,00 ,857 ,750 ,944 ,686 ,953 ,949 ,978 ,693 ,231 ,500 ,945 ,540 ,524 ,239 ,002 ,734 ,521 ,032 ,761 Gesamtscore Kurzzeitgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition verzögerte Reproduktion Text verzögerte Reproduktion Figuren Priming p Alter Geschlecht Bildung Genotyp Variable (Fortsetzung A3) - 102 - Met* prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition verzögerte Reproduktion Text verzögerte Reproduktion Figuren Priming Gesamtscore Kurzzeitgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis Alter Geschlecht Bildung Genotyp Variable * Met = Val-Met + Met-Met BDNF Gen ,036 ,408 ,179 ,140 ,624 ,081 ,001 ,000 ,001 ,218 ,000 ,052 ,573 ,999 ,043 ,702 ,793 ,220 ,135 ,012 ,222 p kein ε4* ,010 ,000 ,115 ,745 ,935 ,001 ,023 ,293 ,089 ,000 ,068 ,049 ,005 ,123 ,000 ,000 ,000 ,000 ,049 ,000 ,001 Gesamtscore Kurzzeitgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition verzögerte Reproduktion Text verzögerte Reproduktion Figuren Priming p Alter Geschlecht Bildung Genotyp Variable * kein ε4 = ε2/ε2 + ε2/ε3 + ε3/ε3 APOE Gen (Fortsetzung A3) - 103 - ** ε4 = ε2/ε4 + ε3/ε4 + ε4/ε4 prospektives Gedächtnis Zahlenspanne verbales Arbeitsgedächtnis visuelles Arbeitsgedächtnis Exekutive Kontrolle verbales Lernen visuelles Lernen Paarassoziationslernen verzögerte Rekognition verzögerte Reproduktion Text verzögerte Reproduktion Figuren Priming Gesamtscore Kurzzeitgedächtnis Lernen verzögerter Abruf verbales Gedächtnis visuelles Gedächtnis Alter Geschlecht Bildung Genotyp Variable APOE ε4 Gen ,003 ,853 ,162 ,842 ,182 ,254 ,015 ,000 ,804 ,912 ,000 ,372 ,968 ,963 ,141 ,975 ,871 ,853 ,371 ,648 ,615 p A4: Diagramme der gemittelten Gedächtnisleistungen in Abhängigkeit vom Lebensalter; links: Mittelwerte der Skala Kurzzeit/Arbeitsgedächtnis in der Gruppe „kein ε4“, rechts: Mittelwerte der Skala verzögerter Abruf in der Gruppe „ε4“ - 104 - mit: 6 5 4 3 2 1 Skala r = -,058 p = ,586 † r = 0,61 p = ,572 † r = ,087 p = ,419 † r = -,204 p = ,055 † r = ,084 p = ,433 † r = ,072 p = ,501 † kein Met Geschlecht r = ,102 p = ,347 † r = -,146 p = ,174 † r = -,106 p = ,327 ‡ r = ,068 p = ,528 ‡ r = -,054 p = ,616 † r = -,023 p = ,834 † 6 visuelles Gedächtnis 5 verbales Gedächtnis 4 verzögerter Abruf 3 Lernen r = -,028 p = ,843 † r = -,076 p = ,595 † r = -,076 p = ,594 † r = -,187 p = ,189 ‡ r = -,001 p = ,992 † r = -,062 p = ,668 † Bildung Alter 2 Kurzzeit-/Arbeitsgedächtnis 1 Gesamtscore r = -,060 p = ,578 ‡ r = -,234 p = ,027 ‡ r = -,189 p = ,076 ‡ r = -,004 p = ,969 ‡ r = -,247 p = ,020 ‡ r = -,219 p = ,039 ‡ Alter BDNF r = -,104 p = ,469 † r = ,168 p = ,238 † r = ,128 p = ,370 † r = ,076 p = ,596 † r = -,113 p = ,428 † r = ,026 p = ,857 † Met Geschlecht r = ,007 p = ,964 † r = -,097 p = ,501 † r = -,009 p = ,950 † r = -,152 p = ,292 ‡ r = ,095 p = ,511 † r = -,016 p = ,910 † r = -,117 p = ,200 ‡ r = -,212 p = ,020 ‡ r = -,174 p = ,057 ‡ r = -,131 p = ,151 ‡ r = -,180 p = ,048 ‡ r = -,160 p = ,079 ‡ Bildung Alter r = -,082 p = ,372 † r = ,119 p = ,195 † r = ,137 p = ,135 † r = -,094 p = ,305 † r = ,028 p = ,762 † r = ,120 p = ,191 † kein ε4 Geschlecht r = ,056 p = ,547 † r = -,162 p = ,079 † r = -,094 p = ,307 ‡ r = -,045 p = ,630 ‡ r = -,011 p = ,903 † r = -,042 p = ,648 † r = ,239 p = ,325 † r = -,014 p = ,956 † r = -,031 p = ,898 † r = ,318 p = ,185 † r = -,025 p = ,918 † r = -,002 p = ,992 † Bildung Alter APOE r = -,046 p = ,852 † r = -,043 p = ,862 † r = -,189 p = ,438 † r = -,238 p = ,326 † r = -,134 p = ,586 † r = -,297 p = ,217 † ε4 Geschlecht Bildung r = ,186 p = ,447 † r = ,172 p = ,480 † r = ,157 p = ,520 † r = ,217 p = ,372 † r = ,042 p = ,863 † r = ,233 p = ,336 † A5: bivariate Korrelationen nach Pearson† bzw. Spearman-Rho‡ zwischen den IGD-Skalen und den demographischen Variablen Alter, Geschlecht und Bildung pro dichotomisierten Phänotyp (kein Met, Met und kein ε4, ε4) - 105 - - 106 - 12 Danksagung Im Rahmen dieser Arbeit möchte ich mich herzlich bedanken bei Herrn Prof. Dr. J. Kornhuber für meine Beteiligung am GENES-Projekt, die damit verbundene Möglichkeit zur Promotion und die Unterstützung in der Umsetzung Frau Prof. S. Engel und Herrn PD J.M. Maler für die nette und bereitwillige Übernahme der Funktion als Korreferenten Herrn Dr. P. Alexopoulos für die sehr gute und kollegiale Zusammenarbeit während des Projektes Herrn Dr. P. Trippal für die Durchsicht der molekularbiologischen Kapitel Dem Labor der Psychiatrischen und Psychotherapeutischen Klinik und dem Labor für Klinische Neurochemie des Universitätsklinikums Erlangen für die Genotypisierungen allen Probanden für ihre Teilnahme an der Studie