Präsentation
Werbung
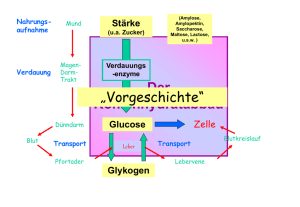
STOFFWECHSEL Präsentation GRUNDLAGEN STÖRUNGEN:Diagnose, Therapie, Prävention • Fettstoffwechsel im Sport 6 Bedeutung der körperlichen Aktivität Glukose 1ATP -> 1ADP Hexokinase Glukose-6-Phosphat Phosphohexoisomerase Fruktose-6-Phosphat Phosphofruktokinase 1ATP -> 1ADP Fruktose-1,6-Biphosphat (jeweils 2 Moleküle) Aldolase Gyzerinaldehyd-3-Phosphat 3-Phosphoglyzerinaldehyddehydrogenase1,3-Biphosphoglyzerinsäure 3-Phosphogyzeratkinase NAD+ -> NADH+H+ 2ADP -> 2ATP 3-Phosphoglyzerinsäure Phosphoglyzeratmutase Enolase 2-Phosphoglyzerinsäure Phosphoenolpyruvat SS: 2008 Dr. Burtscher 2ADP -> 2ATP Pyruvatkinase Pyruvat NADH+H+ -> NAD+ Laktatdehydrogenase Laktat Nettoproduktion: 2 ATP, (2NADH2) Versuchen Sie zu verstehen! STOFFWECHSEL Biologische Oxidation Zitratzyklus und Atmungskette Arginin-Aspartat im Sport Burtscher et al., JSSM 2005 Glykolyse m atrix Zytoplasma cristae Zellkern inner m em brane Mitochondrium Zitratzylus Atmungskette interm em brane space m itochondrion outer m em brane Atmungskette vorrangig in der inneren Membran lokalisiert 1 Aerobe- und anaerobe Energiebereitstellung CH3 – C = O S - CoA CO2 + H2O + ATP 2 Mol ATP LDH PDH PYRUVAT 36 Mol ATP Pyruvat freie Fettsäuren Acetyl-CoA freie Fettsäuren Citrat Oxalacetat NAD+ > NADH+H+ Isocitrat NAD+ > NADH+H+ CO2 Malat Ketoglutarat NAD+ > NADH+H+ CO2 Succinyl-CoA Fumarat FAD > FADH2 GDP > GTP Succinat Zitratzyklus 2 x 18 ATP (36 ATP) Gesamt: 38 (39) ATP Energiebilanz 3 NADH + H+ 9 ATP 2 ATP 1 FADH2 1 GTP 1 ATP -------------------------------12 ATP pro Mol Acetyl CoA Bilanz der Glykolyse C6H12O6 + 2 NAD+ + 2 ADP + 2 P → 2 C3H4O3 + 2 NADH + 2 H+ + 2 ATP (3 ATP) 6 ATP 2 ATP Oxidative Decarboxylierung 2 C3H4O3 + 2 NAD+ + 2 CoA → 2 C2H3O2-CoA + 2 CO2 + 2 NADH + 2 H+ 6 ATP Zitratzyklus C2H3O-CoA + …. → 2 CO2 + 3 NADH + 3 H+ + FADH2 + GTP + CoA 9 ATP 2 ATP 1 ATP = 12 ATP x 2 = 24 ATP Gesamt: 38 (39) ATP 2 NADH + H+ NADH + H+ wird oxidiert 52 kcal/Mol Knallgasreaktion 57 kcal/Mol 21 kcal ATP Synthese 31 kcal Wärme Wirkungsgrad: 40 % Malat Ketoglutarat Glutamat Aspartat Zytosol Mito Malat-Aspartat-Shuttle COO− Matrix H+ + NADH NAD+ + 2H+ 2 e− Q I 2H+ + ½O2 H2O III IV cyt c Intermembrane Space NAD+ FMN C H H C H QH2 COO− C via FAD H COO− H C COO− succinate fumarate Succinate Dehydrogenase (Complex II) NADH+H+ ATP-Synthese FMNH2 (Komplex1) (Komplex2) FADH2 2H+ H Q FAD Ubichinon Ubihydrochinon HämFe3+ Cytochrom b + c1 (Komplex3) HämFe2+ Cytochrom c Fe3+ Atmungskette Cytochrom c Fe2+ Cytochrom a1+a3 Fe3+ H2O (Komplex4) Cytochrom a1+a3 O2- Fe2+ 3 ATP + H2O >>> ADP + Pi + (- 7,3 kcal/mol) 1/2 O2 + H2 >>> H2O + (- 57 kcal) C6H12O6 + 6O2 >>> 6CO2 + 6H2O + (- 686 kcal) Wirkungsgrad der aeroben Glykolyse: 39 ATP >> 285 kcal 285/686 kcal >> 42% Was sind Enzyme Enzyme sind Biokatalysatoren, die die Aktivierungsenergie einer Reaktion herabsetzen können! Wirkungsgrad der Muskelkontraktion: 42 % der Glykolyse: davon 70 % für Muskelkontraktion Rest: Ca++ Pumpe! Gesamt: Ca. 30 % Bewegungsökonomie: Fahrrad: Ca. 25 % Gehen, Laufen, Schwimmen, Klettern ?? Bis < 10 % Enzymkatalysierte Reaktionen • Ein Enzym verändert die Geschwindigkeit einer Reaktion in Richtung des Gleichgewichts. Das Gleichgewicht selbst kann aber nicht verändert werden! Wenn das Gleichgewicht einer Reaktion stark auf einer Seite liegt spricht man von einer nicht umkehrbaren Reaktion. Unterschiede zu anderen Katalysatoren sind: • • • Spezifität für die Substrate (Gruppen) und Reaktionen Kapazität sehr hohe Effizienz (Beschleunigung bis zu 1014-fach) Regulation Aktivität kann an Umweltbedingungen angepasst werden. Gleichgewicht • Hin- und Rückreaktion Ein Enzym kann eine Reaktion in beide Richtungen beschleunigen. Die Reaktion läuft aber immer in Richtung Gleichgewicht ab. ENZYMKINETIK Enzym + Substrat E+S ES Enzymsubstratkomplex ENZYMKINETIK V (Reaktionsgeschwindigkeit) Enzym + Produkt E+P Vmax [E] . [S] K = --------------[ES] K1/2 Vmax = [S] = Km = Michaeliskonstante 1/2 Vmax Km [S] Substratkonz. 4 ENZYMKINETIK V (Reaktionsgeschwindigkeit) ENZYMKINETIK V (Reaktionsgeschwindigkeit) Hexokinase Km = 0,1 mmol (Muskel) Vmax Lineare Darstellung: Lineweaver-Burk-Diagramm Glucokinase Km = 10 mmol (Leber) 1/2 Vmax Bedeutung? Km [S] Substratkonz. 10 • 30 40 50 [Gluc] mmol Cofaktoren Regulation von Enzymen • 20 (Coenzyme, Cosubstrate) Proteinsynthese und Proteinabbau Neusynthese des gewünschten Enzyms; Aktivierung oder Deaktivierung von Genen Konformationsänderung (a) Allosterische Effekte Effektoren (Inhibitoren oder Aktivatoren) binden an regulatorisches Zentrum des Proteins • sind niedermolekulare Hilfsmoleküle • besitzen keine eigene katalytische Wirksamkeit • sind nicht enzymspezifisch, eher reaktionsspezifisch Apoenzyminaktiv + Cofaktor Holoenzymaktiv Es wird unterschieden zwischen: lockere, reversible Bindung an das Enzym Freisetzung vom Enzym nach erfolgter Reaktion Regenerierung erfolgt unabhängig vom Enzym • löslichen Cofaktoren: • prosthetische Gruppe: bleibt am Enzym 5