(1-Acetyl-4-isopropylbenzol) [1]
Werbung
![(1-Acetyl-4-isopropylbenzol) [1]](http://s1.studylibde.com/store/data/002734275_1-0e726be7e54fea681646dd5969a7c4df-768x994.png)
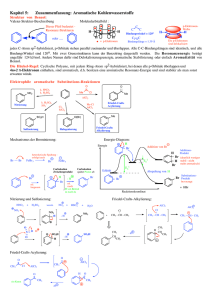
Janine Schneider 05.05.00 Darstellung von 4-Acetylcumol (1-Acetyl-4-isopropylbenzol) [1] Präparat 2 1. Reaktionstyp: Friedel-Crafts-Acylierung 2. Reaktionsgleichung: O O CH3 AlCl3 + Cl CH3 C9H12 C2H3ClO AlCl3 C11H14O M=120.2 g/mol M=78,5 g/mol M=133,3 g/mol M=162,2g/mol 3. Durchführung der Reaktion: 3.1. Berechnung des Ansatzes: In der Versuchsanleitung[1] werden 27,8 g Produkt hergestellt. Da nur 10g produziert werden sollen, müssen alle angegebenen Mengen entsprechend diesem Verhältnis umgerechnet werden. Cumol Acetylchlorid Aluminiumchlorid 4-Acetylcumol Literatur 25,2g (0,21mol) 21,2g (0,27mol) 45,3g (0,34mol) 27,8g (0,17mol) Ansatz 9,1g (0,0756mol) 7,6g (0,0972mol) 16,3g (0,1224mol) 10g (0,0612mol) 1 3.2 Durchführung: In einem 100 ml- Zweihalskolben wurden 16,3 g wasserfreies Aluminiumchlorid in 65 ml wasserfreiem 1,2-Dichlorethan suspendiert und im Eisbad auf 0°C heruntergekühlt. In einem Guss wurden 7,6 g Acetylchlorid zugegeben und unter Rühren mit dem Magnetrührer innerhalb von 30 Minuten 7,6 g Cumol zugetropft. Danach wurde 2 Stunden lang bei Raumtemperatur nachgerührt. Das Reaktiosgemisch wurde dann auf 100 g Eis gegossen und ausgefallenes Al(OH)3 mit etwas konz. HCl wieder in Lösung gebracht. Die Phasen wurden getrennt, die wässrige Phase mit 20 ml Dichlorethan extrahiert. Anschließend wurden die vereinigten organischen Phasen mit H2O gewaschen und über K2CO3 getrocknet. Nach Abziehen des Lösungsmittels unter vermindertem Druck wurde bei 16 mbar fraktioniert destilliert. Nach einigen Tropfen Vorlauf wurde das 4-Acetylcumol als schwach gelbes Öl bei einer Siedetemperatur von 115 °C aufgefangen. Ausbeute: Es wurden 8,3 g 4-Acetylcumol gewonnen (68%), Literaturausbeute[1] :82%. 4. Physikalische Daten des Produktes: Siedepunkt: Literaturwert[2]: 254 °C Gemessener Wert: 252 °C Brechungsindex: Literaturwert[1] : nD20 : 1,5206 Gemessener Wert: nD22 : 1,5200 ⇒ nD20 : 1,5210 2 5. Auswertung des IR-Spektrums (wichtige Banden): Messwerte (siehe beiliegendes Spektrum): Wellenzahl in cm-1 Schwingungstyp 2960 s -C-H-Valenz 1670 s -C=O-Valenz 1590 m aromatische Ringschwingung Literaturwerte[3]: Wellenzahl in cm-1 Schwingungstyp 2970 s -C-H-Valenz 1690 s -C=O-Valenz 1600 m aromatische Ringschwingung 6. Mechanismus: 1.) Bildung des Acylium-Kations Bei der Reaktion des Acetylchlorids mit AlCl3, welches als Lewis-Säure wirkt, koordiniert das AlCl3 an das Carbonyl-Sauerstoffatom. Der so entstandene Komplex liegt im Gleichgewicht mit einem anderen vor, bei dem das AlCl3 an das Chloridatom des Acetylchlorid gebunden ist. Die Komplexe können weiter in das Acylium-Ion dissozieren, wobei dieses in geringer Gleichgewichtskonzentration vorliegt. Die Dissoziation geschieht relativ leicht, da das Produkt resonanzstabilisiert ist. O C CH3 Cl + O AlCl3 O C C CH3 CH3 AlCl3 C O CH3 Cl CH3 C O Cl AlCl3 + AlCl4 Acylium-Ion 3 2.) Elektrophile Substitution Das Acylium-Ion wirkt als Elektrophil und greift nach dem üblichen Mechanismus der elektrophilen aromatischen Substitution das Cumol an. Da der Isopropylrest aktivierend auf das Cumol wirkt, sind prinzipiell der ortho- und der para-Angriff denkbar. Der Angriff an der orthoPosition ist jedoch sterisch gehindert, so dass- insbesondere bei der niedrigen Temperatur, bei der gearbeitet wurde (0°C) nur das para-Produkt 4-Acetylcumol zu erwarten ist. Bei der elektrophilen Substitution bildet sich über den π-Komplex der mesomeriestabilisierte σKomplex. Der σ-Komplex stabilisiert sich unter Abspaltung eines Protons (Rearomatisierung). Dabei liegt wiederum ein π-Komplex als Zwischenstufe vor. H + CH3 C O C O CH3 - Komplex O H H C O C O CH3 CH3 - Komplex C CH3 + H - Komplex Die Carbonylgruppe des bei der Rearomatisierung 4-Acetylcumol bildet mit dem Katalysator AlCl3 einen starken Komplex, durch welchen der Katalysator der Reaktion entzogen wird. Daher muss bei Friedel-Crafts-Acylierungen der Katalysator immer in mindestens stöchiometrischen Mengen eingesetzt werden: AlCl3 O C O CH3 C CH3 + AlCl3 4 Um diesen Komplex zu zerstören und das Keton freizusetzen, wird wässrig aufgearbeitet, wobei sich der Komplex hydrolytisch zersetzt und so das gewünschte Produkt entsteht: AlCl3 O C O C CH3 + 3H2O CH3 + Al(OH)3 + 3 HCl 7. Abfallentsorgung: Das abrotierte 1,2 –Dichlorethan und der Rückstand der fraktionierten Destillation wurden im Behälter für halogenierte Lösungsmittel entsorgt. Literatur: [1] L.F. Tietze/Th. Eicher I-3 S.127-128 [2] Weast and Graselli C&C Handbook of Data on Organic Compounds, 2nd Edition [3] http://webbook.nist.gov/cgi/cbook.cgi?ID=C645135&Units=SI&Mask=80 5

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)