Kapitel 5: Zusammenfassung: Aromatische Kohlenwasserstoffe
Werbung

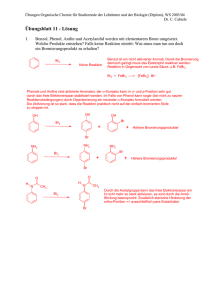
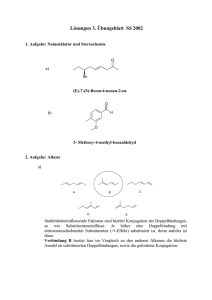
Kapitel 5: Zusammenfassung: Aromatische Kohlenwasserstoffe Struktur von Benzol: Valenz-Struktur-Beschreibung Molekularbitalbild : Dieser Pfeil bedeutet Resonanz-Strukturen H H oder ..... C H C C H Bindungswinkel = 120 o H C = p-Elektronen p-ElektronenWolke H H C H Die p-Elektronen sind delokalisiert Bindungslänge = 1.39 Å jedes C-Atom sp2-hybridisiert, p-Orbitale stehen parallel zueinander und überlappen. Alle C-C-Bindungslängen sind identisch, und alle BindungsWinkel sind 120o. Mit zwei Grenzstrukturen kann der Benzolring dargestellt werden. Die Resonanzenergie beträgt ungefähr 124 kJ/mol. Andere Namen dafür sind Delokalisierungsenergie, aromatische Stabilisierung oder einfach Aromatizität von Benzol. Die Hückel-Regel: Cyclische Polyene, mit jedem Ring-Atom sp2-hybridisiert, bei denen alle p-Orbitale überlappen und 4n+2 π-Elektronen enthalten, sind aromatisch, d.h. besitzen eine aromatische Resonanz-Energie und sind stabiler als man sonst erwarten würde. Elektrophile aromatische Substitutions-Reaktionen O k. HNO3 k. H2 SO4 NO2 Me O Cl Me AlCl3 k. H2 SO4 SO3 Nitrierung Friedel-Crafts Acylierung Me-Cl AlCl3 Cl2 FeCl3 SO3H Me Cl(Br) Sulfonierung Friedel-Crafts Alkylierung Halogenierung Mechanismus der Brominierung: Energie-Diagram: H Br Energie H heterolytische Spaltung erfolgt rasch Br Br FeBr 3 Carbokation Zwischenprodukt H Br + Substitutions- Br Produkt rel. rasch H von Benzol ist noch da bevorzugt + HBr Reaktionskoordinat Friedel-Crafts-Alkylierung: H2 SO4 NO 2 Abspaltung von H + Br Nitrierung und Sulfonierung: HNO 3 Ea 1 Eddukt Br -H Br rel. langasam Carbokation spaltet Proton ab NO 2 + NO2 H HSO 4 + NO2 -H AlCl3 H2 O + Cl Cl CH 3 CH CH3 CH 3 CH CH3 O S O H SO3H O SO3H -H H Friedel-Crafts-Acylierung: O O CH 3 Cl CH 3 AlCl3 AlCl4 H O ein Keton AdditionsProdukt Br (deutlich weniger H stabil - nicht Br mehr aromatisch) Ea 2 FeBr 4 Br Addition von Br CH3 O CH3 -H CH3 CH CH3 H -H CH3 CH CH3 AlCl4 CH 3 CH CH3 Aktivierender oder desaktivierender Einfluss von Substituenten Resonanz und induktive Effekten: Substituenten ziehen Elektronen aus dem Ring heraus oder liefern Elektronendichte hinein und beeinflussen dadurch die Reaktivität des Rings. Resonanz-Effekte sind stärker und reichen über längere Distanzen aus als induktive Effekte. Resonanz-Effekte werden über die p-Orbitalen vermittelt, induktive Effekte über die σ-Orbitalen. Z.B. Die Nitrogruppe ist ein p-Akzeptor-Substituent, und wirkt deswegen deaktivierend und meta-dirigierend: O N O O N O O N O N O O Resonanz-Strukturen Die Amingruppe ist ein p-Donor-Substituent, und wirkt dewegen aktivierend und ortho/para-dirigierend: sp2 H H N H N H H N H N H H Resonanz-Strukturen Ortho, para-dirigierend und aktivierend sind NH-COR R Ar OH OR NH2 NR2 Ortho, para-dirigierend und desaktivierend sind Cl Br I meta-dirigierend und desaktivierend sind COOR SO3H CN NO2 CF3 NR3 CO-R Um die relative Schnelligkeit und die Orientierung bei einer Zweitsubstitutions-Reaktion erklären zu können, muss die Stabilität der verschiedenen möglichen Zwischenprodukte verglichen werden. Die Reaktion läuft am schnellsten über den stabilsten Übergangszustand (d.h. ≈ über die stabilsten Zwischenprodukte) ab - Vgl. Energiediagramm oben und SKRIPT, z.B.: Besonders stabile Resonanzstruktur OH π-Donator ortho Angriff OH OH E E E nicht so rasch OH H H H E E OH H rasch H OH E E OH OH H E E meta Angriff E OH H OH OH OH para Angriff rasch E H E H E H E Besonders stabile Resonanzstruktur Zwischenprodukte Andere Transformationen: Me KMnO4, H3O, Δ COOH NO2 Sn / HCl oder H2 / Pt (kat.) NH2 H

![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)

![(1-Acetyl-4-isopropylbenzol) [1]](http://s1.studylibde.com/store/data/002734275_1-0e726be7e54fea681646dd5969a7c4df-300x300.png)