Zellcyclus und CDKs 2016
Werbung

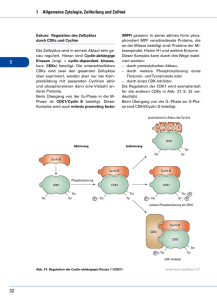
Regulation des Zellcylus Cyclin-abhängige Kinasen (CDKs) Dr. F. Neuschäfer-Rube Cyclin-abhängige Kinasen: Motoren und Schalter des Zellzyclus Dr. F. Neuschäfer-Rube Der Zellzyklus M S Der Zellzyklus M S = DNA-Synthese (Replikation) Der Zellzyklus M = Mitose Verteilung der Chromosomen S = DNA-Synthese Der Zellzyklus: Teilschritte der Mitose Prophase Metaphase Anaphase Telophase Der Zellzyklus M = Mitose G2 S = DNA-Synthese G1 Der Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese S = DNA-Synthese G1 Der Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese S = DNA-Synthese G1 = Zellwachstum Der Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese G1 = Zellwachstum Go = Ruhezustand z.B. ausdifferenzierte Zellen S = DNA-Synthese Kontrollpunkte des Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese G1 = Zellwachstum Wie wird der korrekte Abblauf des Zellzyklus kontrolliert? Go = Ruhezustand S = DNA-Synthese Kontrollpunkte des Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese G1 = Zellwachstum Wie wird der korrekte Abblauf des Zellzyklus kontrolliert? Kontrollpunkte S = DNA-Synthese Go = Ruhezustand Kontrollpunkte des Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese G1 = Zellwachstum Go = Ruhezustand S = DNA-Synthese Restriktionspunkt intrinsisch: Zellgröße erreicht? Kontrollpunkte des Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese G1 = Zellwachstum Go = Ruhezustand S = DNA-Synthese Restriktionspunkt intrinsisch: Zellgröße erreicht? extern: Wachstumsfaktoren? Kontrollpunkte des Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese G1 = Zellwachstum G2-Kontrolle Replikation vollständig? DNA intakt? S = DNA-Synthese Go = Ruhezustand Restriktionspunkt intrinsisch: Zellgröße erreicht? extern: Wachstumsfaktoren? Kontrollpunkte des Zellzyklus M = Mitose G2 = Kontrolle der DNA-Synthese Metaphasen-Kontrolle korrekte Chromosomenanlagerung? G1 = Zellwachstum G2-Kontrolle Replikation vollständig? DNA intakt? S = DNA-Synthese Go = Ruhezustand Restriktionspunkt intern: Zellgröße erreicht? extern: Wachstumsfaktoren? Kontrollpunkte des Zellzyklus M = Mitose G2 G1 Durch welche biochemischen Faktoren wird der Übergang der Zellzyklusphasen reguliert? S Go Zellfusionsexperimente mit synchronisierten HeLa-Zellen G1 S-Phase + G2 S-Phase + G2 G1 + Zellfusionsexperimente mit synchronisierten HeLa-Zellen G1 S-Phase + G2 S-Phase + G2 G1 + Zellfusionsexperimente mit synchronisierten HeLa-Zellen G1 S-Phase + G2 S-Phase + G2 G1 + Zellfusionsexperimente zeigen 3 Phänomene: 1. Nur Zellen in der G1-Phase sind kompetent, um in die S-Phase ( DNA-Replikation) überzugehen 2. Nur Zellen in der S-Phase besitzen einen Aktivator, der die DNA-Replikation in kompetenten Zellen der G1-Phase stimulieren kann. 3. Kerne von Zellen der G2-Phase können keine DNA-Replikation durchführen, solange die Mitose nicht abgeschlossen ist. Auslösen der DNA-Synthese durch löslichen Faktorin der frühen S-Phase G1/S-Phase: S-Phase-promoting- factor (SPF) G2/M-Phase: Mitosis-promoting-factor (MPF) Zellfusionsexperimente zeigen 3 Phänomene: 1. Nur Zellen in der G1-Phase sind kompetent, um in die S-Phase ( DNA-Replikation) überzugehen 2. Nur Zellen in der S-Phase besitzen einen Aktivator, der die DNA-Replikation in kompetenten Zellen der G1-Phase stimulieren kann. 3. Kerne von Zellen der G2-Phase können keine DNA-Replikation durchführen, solange die Mitose nicht abgeschlossen ist. Auslösen der DNA-Synthese durch löslichen Faktorin der frühen S-Phase G1/S-Phase: S-Phase-promoting- factor (SPF) G2/M-Phase: Mitosis-promoting-factor (MPF) Zellfusionsexperimente zeigen 3 Phänomene: 1. Nur Zellen in der G1-Phase sind kompetent, um in die S-Phase ( DNA-Replikation) überzugehen 2. Nur Zellen in der S-Phase besitzen einen Aktivator, der die DNA-Replikation in kompetenten Zellen der G1-Phase stimulieren kann. 3. Kerne von Zellen der G2-Phase können keine DNA-Replikation durchführen, solange die Mitose nicht abgeschlossen ist. Auslösen der DNA-Synthese durch löslichen Faktorin der frühen S-Phase G1/S-Phase: S-Phase-promoting- factor (SPF) G2/M-Phase: Mitosis-promoting-factor (MPF) Zellfusionsexperimente zeigen 3 Phänomene: 1. Nur Zellen in der G1-Phase sind kompetent, um in die S-Phase ( DNA-Replikation) überzugehen 2. Nur Zellen in der S-Phase besitzen einen Aktivator, der die DNA-Replikation in kompetenten Zellen der G1-Phase stimulieren kann. 3. Kerne von Zellen der G2-Phase können keine DNA-Replikation durchführen, solange die Mitose nicht abgeschlossen ist. Auslösen der DNA-Synthese durch löslichen Faktor in der frühen S-Phase G1/S-Phase: S-Phase-promoting- factor (SPF) G2/M-Phase: Mitosis-promoting-factor (MPF) Zellfusionsexperimente zeigen 3 Phänomene: 1. Nur Zellen in der G1-Phase sind kompetent, um in die S-Phase ( DNA-Replikation) überzugehen 2. Nur Zellen in der S-Phase besitzen einen Aktivator, der die DNA-Replikation in kompetenten Zellen der G1-Phase stimulieren kann. 3. Kerne von Zellen der G2-Phase können keine DNA-Replikation durchführen, solange die Mitose nicht abgeschlossen ist. Auslösen der DNA-Synthese durch löslichen Faktor in der frühen S-Phase G1/S-Phase: S-Phase-promoting- factor (SPF) G2/M-Phase: Mitosis-promoting-factor (MPF) Identifizierung von Zellzyklusregulatoren: CDKs Leland H Hartwell Identifizierung von Zellzyklusregulatoren: CDKs Identifizierung Temperatur-sensitiver CDC (Cell-Division-Cycle) Mutanten Modell: Saccharomyces sereviciae Mutagenisierte Zellen 25°C 35°C Identifizierung von Zellzyklusregulatoren: CDKs Identifizierung Temperatur-sensitiver CDC (Cell-Division-Cycle) Mutanten Modell: Saccharomyces sereviciae Mutagenisierte Zellen 25°C 35°C nicht CDC-Mutanten Knospung 35°C Eintritt in den Zellzyklus Identifizierung von Zellzyklusregulatoren: CDKs Identifizierung Temperatur-sensitiver CDC (Cell-Division-Cycle) Mutanten Modell: Saccharomyces sereviciae Mutagenisierte Zellen 25°C 35°C nicht CDC-Mutante CDC-START-Mutante 35°C kein Eintritt in den Zellzyklus Identifizierung von Zellzyklusregulatoren: CDKs Identifizierung des CDC-START Gens CDC-START-Mutante 35°C Wt Gen X Wt CDC-START-Gen 35°C Identifizierung von Zellzyklusregulatoren: CDKs Identifizierung des CDC-START-Gens CDC-START-Mutante 35°C Wt Gen X Wt CDC START Gen Analyse Cyclin-abhängige Kinase (CDK) 35°C Entdeckung Cyclin-abhängiger Kinasen (CDKs): Medizin Nobelpreis 2001 Leland H Hartwell Paul Nurse CDKs der Hefe Tim Hunt Cycline des Seeigels Cyclin-abhängige Kinasen (CDKs): Heterodimere Proteine C.L. Card et al., EMBO Journal 2000 katalytische Untereinheit: CDK regulatorische Untereinheit: Cyclin Cyclin-abhängige Kinasen (CDKs): Heterodimere Proteine C.L. Card et.al., EMBO Journal 2000 katalytische Untereinheit: CDK - Serin/Threonin-Kinasen - Hefe: eine CDK - Säugetiere: CDK1 - CDK7 - hohe Identitität - konservierte Cyclin-Bindungsstelle regulatorische Untereinheit: Cyclin Cyclin-abhängige Kinasen (CDKs): Heterodimere Proteine C.L. Card et.al., EMBO Journal 2000 katalytische Untereinheit: CDK - Serin/Threonin-Kinasen - Hefe: eine CDK - Säugetiere: CDK1 - CDK7 - hohe Identität - konservierte Cyclin-Bindungsstelle regulatorische Untereinheit: Cyclin - Cyclin A-H - heterogene Proteinfamilie - zyklische Konzentrationsänderungen im Zellzyklus - Kernlokalisation CDK/Cyclin-Komplexe im Wirbeltier-Zellzyklus Go M CDK2/CyclinD CDK4/CyclinD CDK6/CyclinD G2 G1 Restriktionspunkt G1/S-Phasen Übergang S CDK2/CyclinE CDK/Cyclin-Komplexe im Wirbeltier-Zellzyklus Go M CDK2/CyclinD CDK4/CyclinD CDK6/CyclinD G2 G1 Restriktionspunkt G1/S-Phasen Übergang S CDK2/CyclinA CDK2/CyclinE CDK/Cyclin-Komplexe im Wirbeltier-Zellzyklus CDK1/CyclinB Go M G2/M-Phasen Übergang CDK2/CyclinD CDK4/CyclinD CDK6/CyclinD G2 G1 Restriktionspunkt G1/S-Phasen Übergang S CDK2/CyclinA CDK2/CyclinE CDKs: Motoren des Zellzyklus Welche "Motorwirkung" haben CDKs im Zellzyklus ? Durch die Phosphorylierung welcher Substrate werden Zellzyklusphasen eingeleitet ? CDK Substrate: Initiation der S-Phase Bedeutung von CDKs bei der Initiation der S-Phase CDK Substrate: Initiation der S-Phase Retinoblastom-Protein (Rb) - Schlüsselsubstrat der S-Phase - nucleäres Protein, 110 kDa NH2- A B -COOH CDK Substrate: Initiation der S-Phase Retinoblastom-Protein (Rb) - Schlüsselsubstrat der S-Phase - nucleäres Protein, 110 kDa NH2- A B Bindung des Transkriptionsfaktors E2F -COOH CDK Substrate: Initiation der S-Phase Retinoblastom-Protein (Rb) - Schlüsselsubstrat der S-Phase - nucleäres Protein, 110 kDa NH2- A B Bindung des Transkriptionsfaktors E2F Rb wirkt als Tumorsupressorgen -COOH CDK Substrate: Initiation der S-Phase Retinoblastom-Protein (Rb) - Schlüsselsubstrat der S-Phase - nucleäres Protein, 110 kDa NH2- A B Bindung des Transkriptionsfaktors E2F E2F: zentraler Transkriptionsfaktor bei der Induktion von S-Phase Genen -COOH CDK Substrate: Initiation der S-Phase Retinoblastom-Protein (Rb) - Schlüsselsubstrat der S-Phase - nucleäres Protein, 110 kDa P NH2- P P P P P P A P P P B Bindung des Transkriptionsfaktors E2F E2F: zentraler Transkriptionsfaktor bei der Induktion von S-Phase Genen Rb wirkt als Tumorsupressorgen -COOH CDK Substrate: Initiation der S-Phase Rb Rb E2F Repression E2F-kontrollierter Gene CDK Substrate: Initiation der S-Phase Cyclin E CDK 2 P P P Rb Rb Rb E2F Repression E2F-kontrollierter Gene E2F Induktion E2F-kontrollierter Gene E2F: Initiator der S-Phase Cyclin E E2F-kontrollierter Gene CDK 2 P P P DNA-Pol I Rb dNTP-Synth. E2F E2F: Initiator der S-Phase Cyclin E E2F-kontrollierter Gene CDK 2 Cyclin E P P P DNA-Pol I Rb dNTP-Synth. E2F E2F positiv autoregulatorischer Verstärkungsmechanismus! E2F: Initiator der S-Phase Cyclin E E2F-kontrollierter Gene CDK 2 Cyclin E P P P DNA-Pol I Rb dNTP-Synth. E2F "Lawinenhafter" Übergang über den Restriktionspunkt E2F positiv autoregulatorischer Verstärkungsmechanismus! S-Phase CDK Substrate: Mitose Bedeutung von CDKs bei der Mitose CDK Substrate: Mitose Ein Teilschritt der Mitose ist die Auflösung der Kernmembran Interphase Mitose CDK Substrate: Mitose Chromatin Kernlamina innere Kernmembran CDK Substrate: Mitose Chromatin Kernlamina Mitose Desintegration der Kernlamina Auflösen der Kernmembran CDK Substrate: Mitose Chromatin Kernlamina ATP Mitose Cyclin B CDK 1 Desintegration der Kernlamina Auflösen der Kernmembran CDK Substrate: Mitose Chromatin Kernlamina Laminnetzwerk Lamintetramer ATP Mitose Cyclin B CDK 1 Desintegration der Kernlamina Auflösen der Kernmembran CDK Substrate: Mitose Chromatin Kernlamina Laminnetzwerk Lamintetramer ATP Mitose Cyclin B ATP CDK 1 Desintegration der Kernlamina -P P-P P- Auflösen der Kernmembran phosphorylierte Lamindimere CDK/Cyclin-Komplexe im Wirbeltier-Zellzyklus CDK1/CyclinB Lamin-P Go M G2/M-Phasen Übergang CDK2/CyclinD CDK4/CyclinD CDK6/CyclinD G2 G1 Restriktionspunkt G1/S-Phasen Übergang S Rb-P E2F CDK2/CyclinA CDK2/CyclinE CDKs: Schalter des Zellzyklus Wie wird die Aktivität der CDKs im Zellzyklus an- und ausgeschaltet? Regulation der CDK-Aktivität inaktiv CDK Regulation der CDK-Aktivität: Cyclinkonzentration Cyclin inaktiv CDK Cyclin CDK inaktiv Regulation der CDK-Aktivität: Cyclinkonzentration Cyclin Cyclin inaktiv CDK CDK inaktiv P ATP Threonin-Kinase (CAK) Cyclin CDK aktiv P T160 P nur CDK-Cyclin Komplexe sind Substrate Veränderungen der CDK Struktur durch Cyclin-Bindung Veränderungen der CDK Struktur durch Cyclin-Bindung + CAK Regulation der CDK-Aktivität: Cyclinkonzentration Cyclin Cyclin inaktiv CDK CDK Cyclinkonzentration inaktiv ATP Threonin-Kinase (CAK) Cyclin CDK aktiv P T160 P Regulation der CDK-Aktivität: Cyclinkonzentration Wie wird die Konzentration der Cycline im Zellzyklus reguliert? Cyclin Regulation der CDK-Aktivität: Cyclinkonzentration Wie wird die Konzentration der Cycline im Zellzyklus reguliert? Neusynthese durch transkriptionelle Induktion Cyclin Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten P WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten P WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten Proteinkinasen TF-OH TF-O-P P WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten Proteinkinasen TF-OH TF-O-P immediate early genes P WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten Proteinkinasen c-jun/c-fos (TF) TF-OH TF-O-P immediate early genes P WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten Proteinkinasen c-jun/c-fos (TF) TF-OH TF-O-P immediate early genes P c-jun c-fos delayed genes WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten Proteinkinasen c-jun/c-fos (TF) Cyclin D Cyclin E CDK2 CDK4 TF-OH TF-O-P immediate early genes P c-jun c-fos delayed genes WF WF-R Regulation der Cyclinkonzentration: transkriptionelle Induktion Beispiel: Induktion durch Wachstumsfaktorsignalketten Cyclin D Cyclin E Proteinkinasen c-jun/c-fos (TF) CDK2 CDK4 TF-OH TF-O-P immediate early genes P c-jun c-fos delayed genes Restriktionspunkt (G1 S-Phase) Regulation der CDK-Aktivität: Cyclinkonzentration Wie wird die Konzentration der Cycline im Zellzyklus reguliert? Neusynthese durch trankriptionelle Induktion Abbau durch Proteolyse Restriktionspunkt (G1 S-Phase) Cyclin Regulation der Cyclinkonzentration: proteolytischer Abbau CDK1-Aktivität Beispiel: Regulation der CDK1-Aktivität durch Abbau von Cyclin B Metaphase G1 S G2 M G1 S Zellzyclus-Phase G2 M Regulation der Cyclinkonzentration: proteolytischer Abbau Beispiel: Regulation der CDK1-Aktivität durch Abbau von Cyclin B CDK1-Aktivität CDK1-Konzentration Metaphase G1 S G2 M G1 S Zellzyclus-Phase G2 M Regulation der Cyclinkonzentration: proteolytischer Abbau Beispiel: Regulation der CDK1-Aktivität durch Abbau von Cyclin B CDK1-Aktivität Metaphase Abbau von CyclinB G1 S G2 M G1 S Zellzyclus-Phase G2 M CyclinB-Konzentration CDK-1 Konzentration Regulation der Cyclinkonzentration: proteolytischer Abbau Cyclin A,B NH2 COOH Destruction-Box Regulation der Cyclinkonzentration: proteolytischer Abbau Cyclin A,B NH2 COOH Destruction-Box NH2 Ubiquitin COOH Regulation der Cyclinkonzentration: proteolytischer Abbau Cyclin A,B NH2 COOH Destruction-Box NH2 Ubiquitin Anaphase-promoting-complex (APC, Ubiquitin-Ligase-Komplex) COOH Regulation der Cyclinkonzentration: proteolytischer Abbau Cyclin A,B NH2 COOH Destruction-Box NH2 Ubiquitin Anaphase-promoting-complex (APC, Ubiquitin-Ligase-Komplex) COOH Markierung für proteolytischen Abbau Regulation der Cyclinkonzentration: proteolytischer Abbau Cyclin A,B NH2 COOH Destruction-Box Ubiquitin NH2 Anaphase-promoting-complex (APC, Ubiquitin-Ligase-Komplex) COOH Markierung für proteolytischen Abbau Proteasom Abbau NH2 COOH Regulation der Cyclinkonzentration: proteolytischer Abbau Wie wird der proteolytische Abbau von Cyclin B reguliert? Regulation der Cyclinkonzentration: proteolytischer Abbau APC inaktiv Cyclin B CDK1 G1-Phase Regulation der Cyclinkonzentration: proteolytischer Abbau Cyclin B Synthese APC inaktiv Cyclin B S, G2-Phase CDK1 G1-Phase Regulation der Cyclinkonzentration: proteolytischer Abbau Metaphase Cyclin B CDK1 P Cyclin B Synthese APC APC inaktiv aktiv Cyclin B S, G2-Phase CDK1 G1-Phase Regulation der Cyclinkonzentration: proteolytischer Abbau Metaphase Cyclin B CDK1 ATP P Cyclin B Synthese APC APC inaktiv aktiv Cyclin B S, G2-Phase CDK1 G1-Phase Regulation der Cyclinkonzentration: proteolytischer Abbau Metaphase Cyclin B CDK1 Polyubiquitinylierung ATP P Cyclin B Synthese Cyclin B APC APC inaktiv aktiv Cyclin B S, G2-Phase CDK1 G1-Phase CDK1 Proteasom Abbau Regulation der Cyclinkonzentration: proteolytischer Abbau Metaphase Cyclin B CDK1 Polyubiquitinylierung ATP P Cyclin B Synthese Cyclin B APC APC inaktiv aktiv CDK1 Cyclin B S, G2-Phase Anaphase CDK1 G1-Phase Proteasom Abbau Regulation der Cyclinkonzentration: proteolytischer Abbau Metaphase negativ autoregulatorischer Mechanismus Cyclin B CDK1 Polyubiquitinylierung ATP P Cyclin B Synthese Cyclin B APC APC inaktiv aktiv CDK1 Cyclin B S, G2-Phase Anaphase CDK1 G1-Phase Proteasom Abbau Regulation der CDK-Aktivität: Cyclinkonzentration Wachstumsfaktoren Autoregulation Neusynthese durch transkriptionelle Induktion Abbau durch Proteolyse Metaphase Anaphase Abschluss der Mitose Restriktionspunkt G1 S-Phase Cyclin Regulation der CDK-Aktivität: Phosphorylierung Cyclin Cyclin inaktiv CDK CDK Cyclinkonzentration inaktiv ATP Threonin-Kinase (CAK) Cyclin CDK aktiv T160 P ATP Threonin/TyrosinKinase Cyclin P T14 P Y15 P CDK inaktiv T160 P Regulation der CDK-Aktivität: Dephosphorylierung Cyclin Cyclin inaktiv CDK CDK Cyclinkonzentration inaktiv P ATP Threonin-Kinase (CAK) Cyclin CDK aktiv T160 P ATP Threonin/Tyrosin Pi P T14 Phosphatase P Y15 P Threonin/TyrosinKinase Cyclin CDK inaktiv T160 P Regulation der CDK-Aktivität: Dephosphorylierung Wie wird die Aktivierung der CDK durch Dephosphorylierung reguliert? Regulation der CDK-Aktivität: Dephosphorylierung von CDK1 CyclinB P T14 G2-Phase P Y15 CDK1 T160 P inaktiv P Threonin/Tyrosin inaktiv Phosphatase G2-Phase Regulation der CDK-Aktivität: Dephosphorylierung von CDK1 CyclinB P T14 G2-Phase CDK1 P Y15 T160 P Mitose inaktiv P P Threonin/Tyrosin aktiv Phosphatase Pi CyclinB Mitose CDK1 T160 P aktiv P Threonin/Tyrosin inaktiv Phosphatase G2-Phase Regulation der CDK-Aktivität: Dephosphorylierung von CDK1 CyclinB P T14 G2-Phase CDK1 P Y15 T160 P Mitose inaktiv P P Threonin/Tyrosin aktiv Phosphatase Pi P CyclinB Mitose CDK1 aktiv Aktivierung T160 P ATP Threonin/Tyrosin inaktiv Phosphatase G2-Phase Regulation der CDK-Aktivität: Dephosphorylierung von CDK1 CyclinB P T14 G2-Phase CDK1 P Y15 T160 P Mitose inaktiv P P Threonin/Tyrosin aktiv Phosphatase Pi CyclinB Mitose CDK1 aktiv positiv autoregulatorischer Verstärkungsmechanismus Aktivierung T160 P ATP Threonin/Tyrosin inaktiv Phosphatase G2-Phase Regulation der CDK-Aktivität: Inhibitoren Cyclin Cyclin inaktiv CDK CDK Cyclinkonzentration CDK-Inhibitoren Cyclin CKI CDK T160 P CDK Phosphorylierung Dephosphorylierung Cyclin Pi P T14 CKI inaktiv ATP ATP aktiv T160 P P Y15 P inaktiv CDK inaktiv T160 P Regulation der CDK-Aktivität: Inhibitoren Beispiel: CKI p21 isosterische Hemmung durch Bindung im aktiven Zentrum Cyclin E CDK 2 CKI p21 G1 S-Phase Regulation der CDK-Aktivität: Inhibitoren Wie wird die Konzentration von CKI p21 reguliert? Regulation der CDK-Aktivität: Induktion des Inhibitors p21 p53 Transkriptionsfaktor, Tumorsupressor-Gen Regulation der CDK-Aktivität: Induktion des Inhibitors p21 p53 Transkriptionsfaktor, Tumorsupressorgen CKI p21 p53 Regulation der CDK-Aktivität: Induktion des Inhibitors p21 p53 Transkriptionsfaktor, Tumorsupressorgen CKI p21 p53 Cyclin E CDK 2 CKI p21 Regulation der CDK-Aktivität: Induktion des Inhibitors p21 p53 Transkriptionsfaktor, Tumorsupressorgen T1/2 = 30 min CKI p21 p53 Cyclin E CDK 2 p53 Abbau CKI p21 Regulation der CDK-Aktivität: Induktion des Inhibitors p21 T1/2 = 150 min T1/2 = 30 min p53 Transkriptionsfaktor, Tumorsupressorgen CKI p21 DNA Schäden p53 Cyclin E CDK 2 p53 Abbau CKI p21 Regulation der CDK-Aktivität: Induktion des Inhibitors p21 T1/2 = 150 min T1/2 = 30 min p53 Transkriptionsfaktor, Tumorsupressorgen CKI p21 DNA Schäden p53 Cyclin E CDK 2 p53 Abbau CKI p21 G1-Phasen Arrest Regulation der CDK-Aktivität: Induktion des Inhibitors p21 T1/2 = 150 min T1/2 = 30 min p53 Transkriptionsfaktor, Tumorsupressorgen CKI p21 DNA Schäden p53 Cyclin E CDK 2 CKI p21 p53 Abbau Zeit für DNA-Reparatur vor der Replikation G1-Phasen Arrest Regulation der CDK-Aktivität: Regulation von p53 p53 Mdm2 p53 Mdm2 Abbau Ubiquitin-Ligase Regulation der CDK-Aktivität: Regulation von p53 P p53 p53 Mdm2 p53 Mdm2 Abbau Regulation der CDK-Aktivität: Regulation von p53 Wachstumsfaktorhyperstimulation P p53 MAPK p53 Mdm2 p53 Mdm2 Abbau Regulation der CDK-Aktivität: Regulation von p53 Wachstumsfaktorhyperstimulation DNA-Schaden P DNA-PK MAPK ATM p53 p53 Mdm2 Proteinkinase p53 Mdm2 Abbau Regulation der CDK-Aktivität: Regulation von p53 Wachstumsfaktorhyperstimulation DNA-Schaden P Mdm2 P p53 DNA-PK MAPK ATM Proteinkinase ATR p53 Mdm2 p53 Mdm2 Abbau Regulation der CDK-Aktivität: Regulation von p53 Wachstumsfaktorhyperstimulation DNA-Schaden P Mdm2 P p53 DNA-PK MAPK ATM ATR p53 Mdm2 p53 Mdm2 Abbau p19/Arf Regulation der CDK-Aktivität: Regulation von p53 Wachstumsfaktorhyperstimulation DNA-Schaden P Mdm2 P p53 DNA-PK MAPK ATM ATR p53 Mdm2 p53 Mdm2 Abbau p19/Arf Mdm2 p19/Arf Regulation der CDK-Aktivität: Regulation von p53 Wachstumsfaktorhyperstimulation DNA-Schaden P Mdm2 P DNA-PK MAPK ATM p53 Induktion von: p21 GADD45 14-3-3- ZellzyklusArrest ATR p53 Mdm2 p53 Mdm2 Abbau p19/Arf Mdm2 p19/Arf Regulation der CDK-Aktivität: Übersicht Cyclin Cyclin inaktiv CDK G1 CDK S Cyclinkonzentration M Cyclin CDK aktiv P T160 P G1 P ATP inaktiv Regulation der CDK-Aktivität: Übersicht Cyclin Cyclin inaktiv CDK G1 CDK S Cyclinkonzentration M G1 ATP G2 Cyclin CDK T160 P M Phosphorylierung Dephosphorylierung ATP aktiv G2 M Cyclin Pi P T14 P Y15 P inaktiv CDK inaktiv T160 P Regulation der CDK-Aktivität: Übersicht Cyclin Cyclin inaktiv CDK G1 CDK S Cyclinkonzentration M G1 ATP G2 CDK-Inhibitoren G1 Cyclin CKI CDK S T160 P CDK M P T14 CKI inaktiv G2 Cyclin Pi T160 P M Phosphorylierung Dephosphorylierung ATP aktiv P Y15 P inaktiv CDK inaktiv T160 P Cyclin-abhängige Kinasen: Motoren und Schalter des Zellzyclus M Dephosphorylierung Cyclinabbau G2 G1 Lamin-P pRb/E2F R Cyclinsynthese S Inhibitoren