5.2 Knochenbildende Tumoren 5.2.1 Benigne Tumoren 5.2.1.1
Werbung
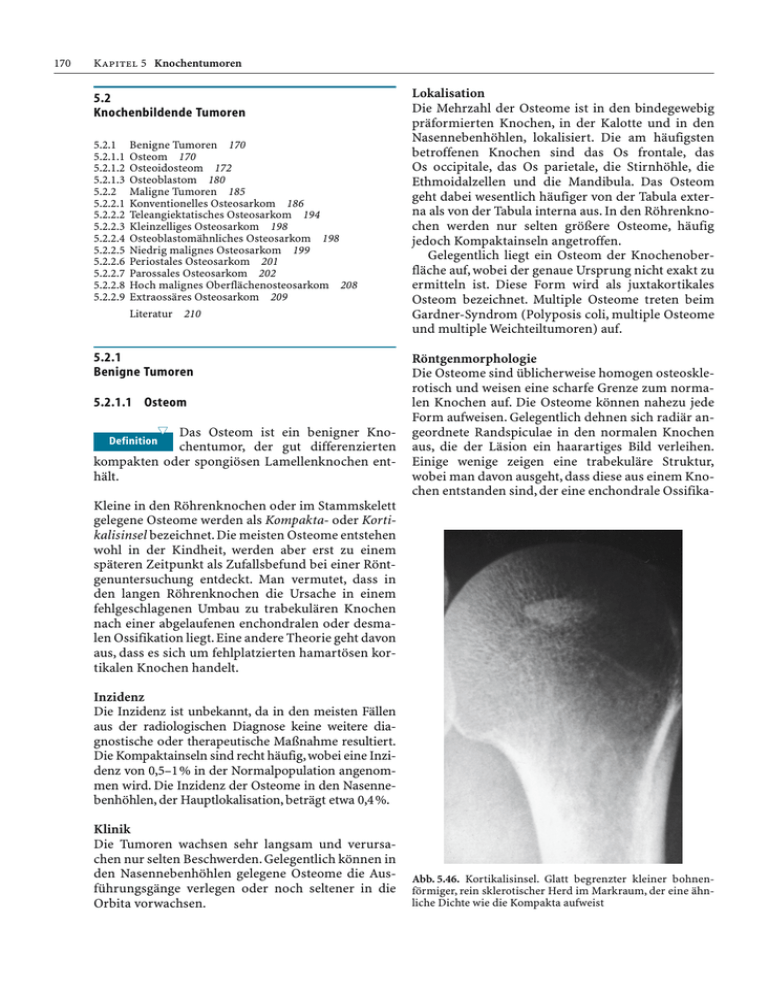
170 Kapitel 5 Knochentumoren 5.2 Knochenbildende Tumoren 5.2.1 5.2.1.1 5.2.1.2 5.2.1.3 5.2.2 5.2.2.1 5.2.2.2 5.2.2.3 5.2.2.4 5.2.2.5 5.2.2.6 5.2.2.7 5.2.2.8 5.2.2.9 Benigne Tumoren 170 Osteom 170 Osteoidosteom 172 Osteoblastom 180 Maligne Tumoren 185 Konventionelles Osteosarkom 186 Teleangiektatisches Osteosarkom 194 Kleinzelliges Osteosarkom 198 Osteoblastomähnliches Osteosarkom 198 Niedrig malignes Osteosarkom 199 Periostales Osteosarkom 201 Parossales Osteosarkom 202 Hoch malignes Oberflächenosteosarkom 208 Extraossäres Osteosarkom 209 Literatur 210 5.2.1 Benigne Tumoren 5.2.1.1 Osteom Definition 왔 Das Osteom ist ein benigner Kno- chentumor, der gut differenzierten kompakten oder spongiösen Lamellenknochen enthält. Lokalisation Die Mehrzahl der Osteome ist in den bindegewebig präformierten Knochen, in der Kalotte und in den Nasennebenhöhlen, lokalisiert. Die am häufigsten betroffenen Knochen sind das Os frontale, das Os occipitale, das Os parietale, die Stirnhöhle, die Ethmoidalzellen und die Mandibula. Das Osteom geht dabei wesentlich häufiger von der Tabula externa als von der Tabula interna aus. In den Röhrenknochen werden nur selten größere Osteome, häufig jedoch Kompaktainseln angetroffen. Gelegentlich liegt ein Osteom der Knochenoberfläche auf, wobei der genaue Ursprung nicht exakt zu ermitteln ist. Diese Form wird als juxtakortikales Osteom bezeichnet. Multiple Osteome treten beim Gardner-Syndrom (Polyposis coli, multiple Osteome und multiple Weichteiltumoren) auf. Röntgenmorphologie Die Osteome sind üblicherweise homogen osteosklerotisch und weisen eine scharfe Grenze zum normalen Knochen auf. Die Osteome können nahezu jede Form aufweisen. Gelegentlich dehnen sich radiär angeordnete Randspiculae in den normalen Knochen aus, die der Läsion ein haarartiges Bild verleihen. Einige wenige zeigen eine trabekuläre Struktur, wobei man davon ausgeht, dass diese aus einem Knochen entstanden sind, der eine enchondrale Ossifika- Kleine in den Röhrenknochen oder im Stammskelett gelegene Osteome werden als Kompakta- oder Kortikalisinsel bezeichnet. Die meisten Osteome entstehen wohl in der Kindheit, werden aber erst zu einem späteren Zeitpunkt als Zufallsbefund bei einer Röntgenuntersuchung entdeckt. Man vermutet, dass in den langen Röhrenknochen die Ursache in einem fehlgeschlagenen Umbau zu trabekulären Knochen nach einer abgelaufenen enchondralen oder desmalen Ossifikation liegt. Eine andere Theorie geht davon aus, dass es sich um fehlplatzierten hamartösen kortikalen Knochen handelt. Inzidenz Die Inzidenz ist unbekannt, da in den meisten Fällen aus der radiologischen Diagnose keine weitere diagnostische oder therapeutische Maßnahme resultiert. Die Kompaktainseln sind recht häufig, wobei eine Inzidenz von 0,5–1% in der Normalpopulation angenommen wird. Die Inzidenz der Osteome in den Nasennebenhöhlen, der Hauptlokalisation, beträgt etwa 0,4%. Klinik Die Tumoren wachsen sehr langsam und verursachen nur selten Beschwerden. Gelegentlich können in den Nasennebenhöhlen gelegene Osteome die Ausführungsgänge verlegen oder noch seltener in die Orbita vorwachsen. Abb. 5.46. Kortikalisinsel. Glatt begrenzter kleiner bohnenförmiger, rein sklerotischer Herd im Markraum, der eine ähnliche Dichte wie die Kompakta aufweist 5.2 Knochenbildende Tumoren tion durchlaufen hat. In den Röhrenknochen erfolgt das Wachstum meist entlang der Knochenachse. Osteome können sich während eines längeren Beobachtungszeitraums durch ablaufende Knochenumbauprozesse in der Größe ändern. Sie können dabei größer oder auch kleiner werden. Kompaktainseln sind nur mehrere Millimeter große, runde, dicht sklerotische Herde im Markraum (Abb. 5.46, Abb. 5.47, Abb. 5.48). Abb. 5.47. Osteom. Rein sklerotischer Herd im Markraum, der einige haarartige sklerotische Ausläufer aufweist Abb. 5.48. Kortikales Osteom. Rein sklerotischer Herd, der der Kompakta aufsitzt und an der Basis mit ihr verschmolzen ist Schnittbildmorphologie Eine Schnittbilddiagnostik ist für die diagnostische Aufarbeitung der Osteome nicht erforderlich. In der CT weisen die Tumoren nahezu identische Dichtewerte wie die Kompakta auf (Abb. 5.49 a, b). In der MRT zeigen die Läsionen sowohl in dem T1- als auch T2-gewichteten Bild eine der Kompakta vergleichbare niedrige Signalintensität. Ein Kontrastmittelenhancement wird nicht beobachtet. Die rein osteosklerotischen Osteome verhalten sich identisch wie die Kompakta. CT und MRT können eingesetzt werden, um in unklaren Fällen ein Osteom von einem Osteoidosteom, bei dem zentral ein Nidus nachweisbar ist, zu differenzieren. In der Skelettszintigraphie sind die meisten Osteome stumm. Einige, besonders die großen, Osteome können jedoch eine deutliche Traceraufnahme zeigen. Differenzialdiagnose Geht ein Osteom von der Tabula externa der Kalotte aus, muss eine fibröse Dysplasie differenzialdiagnostisch abgegrenzt werden. Diese weist jedoch selten eine dichte homogene Sklerose, sondern eine Mattglasmatrix oder eine leicht strukturaufgelockerte Sklerose auf. Weiterhin muss bei einem trabekulären Osteom dieses von einem Hämangiom abgegrenzt werden, das jedoch häufig ein recht charakteristisches Radspeichenmuster der intraläsionalen Trabekel zeigt. Die Differenzialdiagnose des von der Tabula interna ausgehenden Osteoms ist das stark ossifizierte Meningeom. Bei diesem sind auf Schnittbilduntersuchungen weitere meningeale Veränderungen, wie z. B. ein so genannter Kometenschweif, sichtbar. In den Röhrenknochen muss von einem intramedullären Osteom die fibröse Dysplasie abgegrenzt werden, die jedoch meistens eine Mattglasmatrix aufweist und selten homogen osteosklerotisch ist. Weist das Osteom die typischen Randspiculae auf, ist dieses Bild pathognomonisch. Das juxtakortikale Osteom muss von einem juxtakortikalen (parossalen) Osteosarkom differenziert werden, wobei bei letzterem auf Schnittbilduntersuchungen fast immer eine periphere nichtmineralisierte Komponente nachweisbar ist. 171 172 Kapitel 5 Knochentumoren b Abb. 5.49. a Osteom, das der Kompakta enostal aufsitzt. b Der CT-Schnitt durch das Zentrum der Läsion zeigt keine zentrale Osteolyse, wodurch die Abgrenzung zu einem Osteoidosteom möglich ist a Kompaktainseln können bei einem Patienten mit einer Tumorerkrankung mit osteoblastischen Metastasen verwechselt werden. In der Abgrenzung zu anderen osteoblastischen Läsionen und Metastasen ist die Skelettszintigraphie hilfreich. Im Gegensatz zu den anderen differenzialdiagnostisch in Frage kommenden Läsionen zeigen die Osteome und die Kompaktainseln mit wenigen Ausnahmen keine vermehrte Traceraufnahme. Therapie und Prognose Üblicherweise ist keine Therapie erforderlich. Bei Osteomen der Nasennebenhöhlen ist dann eine Resektion erforderlich, wenn sekundäre Komplikationen, wie eine Verlegung des Ausführungsganges oder eine Vorwölbung in die Orbita mit konsekutivem Exophtalmus, vorliegen. Für die Osteome der Röhrenknochen wird ein abwartendes Verhalten mit radiologischen Verlaufskontrollen empfohlen. Zeigt die Läsion eine Größenzunahme von mehr als 25% in drei Monaten oder von mehr als 50% in sechs Monaten wird eine bioptische Abklärung angeraten. Nach Exzision treten keine Rezidive auf. 5.2.1.2 Osteoidosteom Definition 왔 Das Osteoidosteom setzt sich aus ei- nem zentralen Nidus, der aus einem stark vaskularisierten Stroma mit eingelagerten Osteoblasten, Trabekeln aus Osteoid und verkalktem Knochen besteht, und einer umgebenden reaktiven Sklerosezone zusammen. Einen dem Nidus identischen histologischen Aufbau zeigt das Osteoblastom. Bisher ist nicht abschließend geklärt, ob es sich bei den beiden Tumoren um zwei unterschiedliche Tumorentitäten oder um die unterschiedliche Manifestation der gleichen Tumorentität handelt. Definition 왔 Weist der Nidus eine Größe von weni- ger als 15 mm auf, bezeichnet man den Tumor üblicherweise als Osteoidosteom, bei einer Größe über 15 mm als Osteoblastom. Daneben wird diskutiert, ob das Osteoidosteom ein echter Tumor oder eine spezielle Form einer Entzündung ist. Inzidenz Es handelt sich um einen relativ häufigen Knochentumor, der etwa 10% aller benignen Knochentumoren ausmacht. Alter und Geschlecht Die meisten Osteoidosteome treten bei jüngeren Patienten auf. Etwa 90% werden vor dem 30. Lebensjahr klinisch manifest. Die Hälfte aller Tumoren wird in der 2. Lebensdekade diagnostiziert. Männer sind etwa doppelt so häufig wie Frauen betroffen. Klinik Das typische Symptom sind dumpfe Schmerzen, die sich während der Nacht steigern und auf Gabe von Acetylsalicylsäure komplett oder nahezu komplett 5.2 Knochenbildende Tumoren ansprechen. Die Schmerzsymptomatik wird auf eine reiche Innervation des Nidus durch Nervenfasern zurückgeführt. Mit der Zeit lassen die Schmerzen nach und das Ansprechen auf Salizylate kann abnehmen. Gelegentlich liegen eine lokale Berührungsempfindlichkeit oder eine Schwellung vor. Ein in der Wirbelsäule gelegenes Osteoidosteom bewirkt häufig eine schmerzhafte skoliotische Fehlhaltung mit der Konkavität zur Tumorseite. Die Schmerzen können den im Röntgenbild sichtbaren Veränderungen um Monate vorausgehen. Sehr selten kann ein Osteoidosteom asymptomatisch bleiben. Lokalisation Etwa die Hälfte aller Tumoren sind in Femur und Tibia gelegen. Daneben tritt der Tumor noch relativ häufig im Tarsus (9%), den Röhrenknochen von Hand und Fuß (11%), im Humerus (6%) und in der Fibula (5%) auf. Etwa 12% der Tumoren sind in der Wirbelsäule lokalisiert. In den langen Röhrenknochen sind die Osteoidosteome in mehr als der Hälfte der Fälle diaphysär (60%) gelegen. Es folgen eine metaphysäre (18%) und metadiaphysäre (14%) Lage. Eine rein epiphysäre Lokalisation stellt mit etwa 3% eine Rarität dar. Nur knapp 10% der Tumoren sind zentral innerhalb des Knochens gelegen, wobei diese Lage fast ausschließlich in den kleinen Röhrenknochen von Hand und Fuß beobachtet wird. Jeweils etwa 40% sind exzentrisch und intrakortikal, und 10% sind subperiostal lokalisiert. In der Wirbelsäule liegen 90% aller Osteoidosteome im Wirbelbogen und die restlichen 10% sowohl im Wirbelbogen als auch im Wirbelkörper (Abb. 5.50). Abb. 5.50. Statistische Daten zum Osteoidosteom Röntgenmorphologie Der Nidus des Osteoidosteoms stellt sich als rundliche Osteolyse mit einem Durchmesser von einigen Millimetern bis zu 1,5 cm dar. Innerhalb der Osteolysezone sind in etwas mehr als der Hälfte der Fälle mehr oder minder ausgeprägte Verkalkungen oder seltener Verknöcherungen vorhanden. Selten ist der Nidus rein osteosklerotisch. Der Nidus stellt sich nahezu immer als gut abgrenzbare geographische Osteolyse dar und wird in den meisten Fällen von einer reaktiven Sklerose umgeben. Somit wird meist eine Wachstumsgeschwindigkeit vom Grad Lodwick IA, seltener vom Grad Lodwick IB beobachtet (Abb. 5.51, Abb. 5.52, Abb. 5.53 a, b, Abb. 5.54). Subperiostal oder seltener innerhalb einer Gelenkkapsel gelegene Tumoren weisen dagegen keine oder eine nur minimale reaktive Sklerose auf (Abb. 5.55). Die ausgedehntesten reaktiven Sklerosen werden bei exzentrisch oder intrakortikal diaphysär gelegenen Osteoidosteomen in den langen Röhrenknochen angetroffen. Die Sklerose ist meist spindelförmig ausgebildet und entlang der Achse des Knochens angeordnet. Selten ist der gesamte Markraum lokal sklerosiert. In dieser Lage werden häufig reaktive Periostreaktionen in Form einer nichtunterbrochenen lamellären Reaktion angetroffen. Die reaktive Sklerose ist bei einer Lage im Schenkelhals meist geringer, sodass ein hier gelegener Tumor auf dem konventionellen Röntgenbild gelegentlich nicht erkennbar ist. Auch wird keine oder nur eine geringe reaktive Sklerose bei Osteoidosteomen der Phalangen beobachtet. Hier stellt sich lediglich der Nidus als Osteolyse mit meist nur geringen zentralen Verkalkungen im Knochen dar (Abb. 5.56. Abb. 5.57). 173 174 Kapitel 5 Knochentumoren Abb. 5.51. Typisches Osteoidosteom. Die Kompakta des Femurs ist spindelförmig aufgetrieben. Im Zentrum der Auftreibung ist eine kleine Osteolyse abgrenzbar, die dem nichtverkalkten Nidus entspricht Abb. 5.52. Typisches Osteoidosteom. Im Zentrum einer deutlichen, spindelförmigen reaktiven Sklerosezone lässt sich ein kleiner nichtverkalkter Nidus abgrenzen Abb. 5.53 a, b. Kortikales Osteoidosteom. a Im Zentrum der spindelförmigen Auftreibung der Kompakta kann eine kleine Osteolyse erahnt werden. b Im Skelettszintigramm lässt sich eine deutliche Tracerakkumulation in dieser Region nachweisen, die die Aktivität des Prozesses beweist. Durch den positiven Befund im Skelettszintigramm kann eine inaktive, abgelaufene Periostitis ausgeschlossen werden a b 5.2 Knochenbildende Tumoren Abb. 5.54. Osteoidosteom im Os metatarsale III. Der Nidus ist mit Ausnahme einer schmalen Randzone komplett verkalkt. Nur durch die nichtmineralisierte Randzone kann er von der reaktiven Sklerose abgegrenzt werden Abb. 5.55. Subperiostales Osteoidosteom. Als Hinweiszeichen auf die Läsion an der proximalen Tibia liegen lediglich diskrete Periostreaktionen vor. Ein Nidus und eine reaktive Sklerose sind nicht abgrenzbar Abb. 5.56. Osteoidosteom in der Nagelkranzphalanx. Der Nidus ist nicht mineralisiert und demarkiert sich nicht. Neben einer flachen subungualen osteolytischen Destruktion sind lediglich geringe Periostreaktionen und eine diskrete Sklerose des Markraums sichtbar Abb. 5.57. Ungewöhnlich lokalisiertes Osteoidosteom im Acetabulum. Die konventionelle Tomographie zeigt den Nidus als kleine Osteolyse im hinteren Pfeiler des Acetabulums 175 176 Kapitel 5 Knochentumoren In der Wirbelsäule ist der Tumor aufgrund der komplexen Anatomie im konventionellen Röntgenbild nur inkonstant nachweisbar. Ein osteoblastischer Pedikel oder ein kleinerer osteolytischer oder osteoblastischer Herd in einem Wirbelbogen sollten bei einem jungen Patienten an ein Osteoidosteom denken lassen. Neben der Detektion des Tumors ist die entscheidende Aufgabe, den Nidus exakt zu lokalisieren. Dies kann bei Tumoren mit einer ausgeprägten reaktiven Sklerose mittels konventionellem Röntgen schwierig bis unmöglich sein. Während zur Niduslokalisation früher die konventionelle Tomographie durchgeführt wurde, werden heute CT und MRT eingesetzt. Zur Detektion eines Osteoidosteoms kann eine Skelettszintigraphie herangezogen werden, da alle Tumoren eine starke Traceraufnahme zeigen. Dieses Verfahren ist auch dann hilfreich, wenn im Röntgenbild nicht zuverlässig zu unterscheiden ist, ob es sich um eine eher reaktive oder biologisch wenig aktive Läsion oder um ein Osteoidosteom handelt. Eine deutliche Anreicherung favorisiert die letztere Diagnose. Das typische Bild eines Osteoidosteoms in den langen Röhrenknochen ist eine spindelförmige Sklerose mit einer zentralen kleinen gelegentlich mineralisierten Osteolyse, die diaphysär exzentrisch lokalisiert ist und bei Patienten unter 30 Jahren auftritt. Das typische Bild eines Osteoidosteoms in der Wirbelsäule ist eine im Wirbelbogen gelegene kleine Osteolyse mit zentraler Mineralisation, die ebenfalls bei unter 30 Jahre alten Patienten auftritt. Merke a ! Schnittbildmorphologie Die CT ist ein geeignetes Untersuchungsverfahren, einen Nidus in den langen Röhrenknochen und in der Wirbelsäule nachzuweisen. An den langen Röhrenknochen sucht man den Nidus im Zentrum der reaktiven Sklerosezone, dort wo die Sklerose am dicksten ist. Mit dünnen Schnitten, maximal 5 mm, kann der Nidus als reine oder zentral verkalkte Osteolyse nachgewiesen werden. Man muss bei Läsionen, die mit einer Kompaktaverdickung einhergehen, klären, ob eine in der CT sichtbare zentrale Aufhellung eine umschriebene Osteolyse oder ein orthograd getroffenes größeres Gefäßkanälchen ist. Eine longitudinale Rekonstruktion des Datensatzes lässt diese Unterscheidung zweifelsfrei zu, besonders wenn dünne Schichten akquiriert worden sind. In der Wirbelsäule kann die CT den Nidus zuverlässig als kleine Osteolyse im Wirbelbogen einschließlich der Anhangsgebilde nachweisen. Die meisten Nidus weisen mehr oder minder ausgeprägte Matrixverkalkungen oder -verknöcherungen auf. Daneben ist die CT gut geeignet, Osteoidosteome in ungewöhnlichen Lokalisationen, wie dem Hüftgelenk oder im Beckenskelett, nachzuweisen (Abb. 5.58 a, b, Abb. 5.59, Abb. 5.60, Abb. 5.61 a, b). Mit der MRT gelingt ebenfalls die Lokalisation des Nidus. Der Nidus stellt sich in der T1-gewichteten Sequenz mit einer ähnlichen Signalintensität oder etwas signalärmer als die Skelettmuskulatur dar. In der T2-gewichteten Sequenz ist der Nidus seltener mäßig, meist deutlich signalintensiv und kontrastiert zur reaktiven Sklerose, die sich in beiden Wichtungen sehr signalarm, isointens zur Kompakta, darstellt. Der Nidus zeigt ein deutliches Kontrastmittelenhan- b Abb. 5.58 a, b. Osteoidosteom im Talushals. a In der CT stellt sich ein subkortikal gelegener zentral verkalkter Nidus dar, der nur von einer gering ausgebildeten reaktiven Sklerose umgeben ist. b In dem kontrastmittelverstärkten T1-gewichteten SE-Bild ist der Nidus sichtbar, wobei die Peripherie eine deut- liche Kontrastmittelaufnahme zeigt, das Zentrum wegen der Kalzifikation jedoch weitgehend signalarm zur Darstellung kommt. Die Existenz eines Nidus ist in der CT offensichtlicher als in der MRT 5.2 Knochenbildende Tumoren Abb. 5.59. Kortikales Osteoidosteom. Die CT stellt den zentral verkalkten Nidus in der Kompakta der Femurrückseite dar, der von einer eher gering ausgeprägten reaktiven Sklerose umgeben ist Abb. 5.60. Ungewöhnliches Osteoidosteom im Acetabulum. Die CT stellt einen kleinen weitgehend mineralisierten Nidus im Pfannengrund dar (Pfeil), der nur von einer minimalen reaktiven Sklerosezone umgeben ist a b Abb. 5.61 a, b. Osteoidosteom im Wirbelbogen LWK 3. a Die halbschräge Aufnahme zeigt lediglich eine mäßige diffuse Sklerose des rechten Wirbelbogens von LWK 3 (Pfeile). b In der CT ist die reaktive Sklerose ebenfalls sichtbar, wobei sich in Höhe des kleinen Wirbelgelenks ein verkalkter Nidus demarkiert 177 178 Kapitel 5 Knochentumoren a b c d e f Abb. 5.62 a–f. Osteoidosteom. a Das Röntgenbild stellt ein sklerotisches Areal mit einer angedeuteten zentralen Osteolyse am Unterrand des Trochanter minor dar. Die mediale Kompakta ist durch die Anlagerung von mehreren Periostlamellen verdickt. b In der CT kann der nichtmineralisierte Nidus in der Sklerosezone eindeutig abgegrenzt werden. c Im T2-gewichteten SE-Bild ist der Nidus kaum von der ventralen Reaktionszone abgrenzbar. Im Schaft liegt ein deutliches Markraumödem vor. d Das STIR-Bild stellt ein deutliches Markraumödem und ein diskretes extraossäres Ödem dar. e Im T1-gewichteten SE-Bild kann der Nidus in der Reaktionszone erahnt werden. f Das kontrastmittelverstärkte T1-gewichtete SE-Bild stellt den Nidus als kontrastmittelaufnehmende Struktur in der Reaktionszone dar cement. Ist der Nidus zentral stärker verkalkt oder verknöchert, sind nur kleinere oder sogar keine Areale im T2-gewichteten Bild signalintensiv, und er kann nicht sicher von der reaktiven Sklerose abgegrenzt werden. In dieser Konstellation kann der Nidus mittels CT sicherer nachgewiesen werden, da der Mineralisationsgrad im Nidus geringer als in der reaktiven Sklerose ist. Nicht selten werden in der fettgesättigten T2-gewichteten und in der STIR-Sequenz ausgedehnte Ödeme im Markraum oder in den Weichteilen, die den Knochen auch zirkulär umgeben können, beobachtet. Diese reaktiven Veränderungen dürfen nicht als Malignitätszeichen fehlgedeutet werden (Abb. 5.62 a–f). 5.2 Knochenbildende Tumoren b a Abb. 5.63 a, b. Osteoidosteom im Schenkelhals mit einer ausgedehnten sekundären inflammatorischen Reaktion (Flare-Phänomen). a Das Röntgenbild zeigt eine diskrete diffuse Sklerose des Markraums des Schenkelhalses, ohne dass ein Nidus abgrenzbar ist. b Im STIR-Bild stellt sich der Nidus als signalintensive Struktur in der dorsalen Kompakta dar (Pfeil). Es liegen ein ausgedehntes Markraumödem und ein deutlicher Hüftgelenkerguss vor Wenn das Osteoidosteom intraartikulär gelegen ist, kann es eine reaktive Synovialitis und einen Gelenkerguss induzieren, wodurch das Bild einer Arthritis vorgetäuscht wird (Abb. 5.63 a, b). Da die Nidus in der Wirbelsäule häufig mehr oder minder stark verkalkt sind, gelingt die Detektion in der MRT eher etwas schlechter als in der CT. Gelegentlich dominiert ein reaktives perifokales Ödem das Bild. Da die subperiostalen Osteoidosteome keine oder nur sehr selten eine reaktive Sklerose aufweisen, stellen sie sich in der CT und MRT als der Kompakta benachbarte kleine „Weichteiltumoren“ dar, die die Kompakta partiell arrodieren können und nicht selten eine diskrete periostale Reaktion induzieren. Differenzialdiagnose Die wichtigste Differenzialdiagnose ist der BrodieAbszess, der sich ebenfalls als osteolytische Läsion mit reaktiver Sklerosezone darstellt. Der Brodie-Abszess ist jedoch wesentlich häufiger metaphysär in relativ enger Nachbarschaft zur Epiphysenfuge gelegen als das Osteoidosteom. Auch ist der Brodie-Abszess weitaus häufiger zentral im Knochen gelegen, und die reaktive Sklerose ist weniger dicht. Zentrale Verkalkungen oder Ossifikationen gehören nicht zur typischen Morphologie eines Brodie-Abszesses. Die Abgrenzung zum Osteoblastom erfolgt am einfachsten anhand der Nidusgröße. Jeder Nidus, der kleiner als 15 mm ist, ist ein Osteoidosteom. Ist ein Osteoidosteom in einer eher ungewöhnlichen Lokalisation vorhanden, kommen weitere Läsionen in Frage. Bei einer epiphysären Lokalisation kann in Einzelfällen die Abgrenzung zu einer Osteochondrosis dissecans schwierig sein. Bei einer Lage in einer Nagelkranzphalanx unter dem Bild einer reaktionslosen nichtmineralisierten Osteolyse kommt differenzialdiagnostisch der Glomustumor in Frage. Bei einer subperiostalen Lage müssen das juxtakortikale Chondrom, das in der MRT einen läppchenartigen Aufbau zeigt, und seltener eine subperiostale aneurysmatische Knochenzyste, die in der MRT zystische Hohlräume und kontrastmittelaufnehmende Septen bietet, abgegrenzt werden. Ist auf dem konventionellen Röntgenbild kein Nidus, sondern nur die reaktive Sklerose sichtbar, muss die reaktive ossifizierende Periostitis abgegrenzt werden. In diesen Fällen muss mittels CT oder MRT nach dem Nidus gefahndet werden. Therapie und Prognose Das Therapieziel ist die Entfernung oder Devitalisierung des Nidus. Dies kann operativ erfolgen, wobei der Nidus mit einem schmalen Saum aus normalem Gewebe oder reaktiver Sklerose entfernt wird. Alternativ kann der Nidus perkutan nach CT-gesteuerter Nadelplatzierung mittels Hochfrequenzablation oder Alkoholinjektion devitalisiert werden. Bei einer adäquaten Therapie gehen die Beschwerden sofort zurück, und ein Rezidiv ist nicht zu erwarten.Wird der Nidus dagegen nur inkomplett reseziert 179 180 Kapitel 5 Knochentumoren oder devitalisiert, kommt es unweigerlich zu einem Rezidiv, und der Patient behält nach dem Eingriff seine Beschwerden. Bisher sind keine Fälle einer malignen Entartung beschrieben worden. In einigen Fällen wurden spontane Regressionen beobachtet. 5.2.1.3 Osteoblastom Definition 왔 Das Osteoblastom ist ein gutartiger Knochentumor, der aus gut vaskularisiertem Stroma besteht, das eine Vielzahl an Osteoblasten sowie Osteoid und Knochentrabekel enthält. Der histologische Aufbau des Tumors unterscheidet sich nicht wesentlich von dem Nidus des Osteoidosteoms, zeigt allerdings eine etwas stärkere Variationsbreite. Gemäß Definition ist der Nidus > 15 mm. Inzidenz Das Osteoblastom ist seltener als das Osteoidosteom und macht nur etwa 5% der benigen Knochentumoren aus. Alter und Geschlecht Das Osteoblastom tritt überwiegend bei jüngeren Patienten auf. Etwa 90% der Tumoren werden vor dem 30. Lebensjahr diagnostiziert. Knapp die Hälfte der Tumoren wird in der 2. Lebensdekade diagnostiziert. Männer sind etwa doppelt so häufig wie Frauen betroffen. Klinik Das führende klinische Symptom sind Schmerzen, die eher gering und lokalisiert sind und sich langsam steigern. Im Gegensatz zum Osteoidosteom bestehen die Schmerzen den gesamten Tag in gleicher Intensität und sprechen deutlich geringer auf Acetylsalicylsäure an. Häufig wird bei einer oberflächennahen Lokalisation eine lokale Schwellung beobachtet. Bei einer Lage in der Nähe eines Gelenks oder in der Wirbelsäule kann die Beweglichkeit eingeschränkt sein. Bei in der Wirbelsäule oder in den dorsalen Rippenabschnitten lokalisierten Tumoren bildet sich häufig eine reaktive Skoliose aus, wobei die Konkavitität auf der Tumorseite liegt. Dehnt sich der Tumor in den Spinalkanal aus, kann es zu neurologischen Ausfällen bis zur Querschnittslähmung kommen. Bei Diagnosestellung bestehen die Symptome meistens schon einige Monate. Lokalisation Die häufigste Lage ist die Wirbelsäule, in der etwa ein Drittel der Osteoblastome angetroffen werden. Halswirbelsäule, Brustwirbelsäule und Lendenwirbelsäule sind in etwa gleicher Häufigkeit betroffen. In einigen Publikationen wurde dagegen eine bevorzugte Lage im Sakrum angegeben. Weitere häufige Lokalisationen sind der Tarsus (16%), hier fast immer der Talus, und das Femur (13%). In den langen Röhrenknochen sind knapp die Hälfte der Tumoren diaphysär und weitere 20% metadiaphysär lokalisiert. Knapp ein Drittel ist metaphysär gelegen. Eine rein epiphysäre Lage stellt eine Rarität dar. Etwas mehr als die Hälfte der Tumoren sind exzentrisch gelegen und jeweils etwa ein Viertel zentral oder intrakortikal. In der Wirbelsäule sind zwei Drittel der Osteoblastome im Wirbelbogen und weniger als 10% im Wirbelkörper lokalisiert. Ein Viertel sind sowohl im Wirbelbogen als auch im Wirbelkörper gelegen (Abb. 5.64). Abb. 5.64. Statistische Daten zum Osteoblastom 5.2 Knochenbildende Tumoren Röntgenmorphologie Das Osteoblastom stellt sich als osteolytischer Tumor mit scharfen Grenzen dar,der von einer reaktiven Sklerose umgeben sein kann, jedoch nicht sein muss. Die Tumoren bieten eine Wachstumsgeschwindigkeit vom Grad Lodwick IB, seltener IA oder IC. Ein aggressives Wachstum vom Grad Lodwick II bieten knapp 10% der Tumoren. Rund zwei Drittel der Tumoren weisen mehr oder minder ausgeprägte Matrixverkalkungen oder -verknöcherungen auf. In etwa 40% der Fälle ist der Knochen durch die Ausbildung einer Periostschale aufgetrieben. Osteoblastome induzieren in etwa der Hälfte der Fälle lamelläre, selten zusätzliche spikuläre Periostreaktionen (Abb. 5.65, Abb. 5.66, Abb. 5.67, Abb. 5.68). In der Wirbelsäule wächst der Tumor meist expansiv und ist zumindest teilweise von einer verknöcherten Periostlamelle umgeben (Abb. 5.69). Nahezu die Hälfte der Tumoren dehnt sich dabei nach epidural aus, was mittels Schnittbilddiagnostik nachgewiesen werden kann. Matrixmineralisationen sind häufig vorhanden. Im Tarsus ist der Tumor bevorzugt intrakortikal im dorsalen Abschnitt des Processus anterior des Talus gelegen. Dort bewirkt er zunächst eine nur geringe kortikale Resorption, wobei gleichzeitig eine deutliche Weichteilkomponente vorliegt, die eine deutliche Matrixmineralisation aufweisen kann. Reaktiv tritt häufig eine ausgedehnte perifokale Osteopenie auf (Abb. 5.70 a, b). In den Röhrenknochen stellen sich die Osteoblastome als Osteolyse mit zentralen Matrixmineralisationen dar, die häufig von einer mehr oder minder breiten perifokalen Sklerosezone umgeben sind. Periostreaktionen werden fast regelmäßig beobachtet. Sie können auch weit über die eigentliche Läsion Abb. 5.65. Osteoblastom der Fibula. Es liegt ein rein osteolytischer, weitgehend metaphysär gelegener Tumor vor, der ein Wachstum vom Grad Lodwick IB aufweist Abb. 5.66. Osteoblastom des Radius. Es liegt ein rein osteolytischer, diaphysär gelegener Tumor vor, der ein Wachstum vom Grad Lodwick IC aufweist. Der Tumor hat die Kompakta durchbrochen und hat eine diskrete lamelläre Periostreaktion induziert Abb. 5.67. Osteoblastom der Tibia. Der diaphysär gelegene Tumor ist komplett sklerosiert. Er hat den Knochen durch Induktion einer Periostschalenbildung aufgetrieben. Es zeigt unregelmäßige, jedoch weitgehend scharfe Grenzen 181 182 Kapitel 5 Knochentumoren a Abb. 5.68. Aggressiv wachsendes Osteoblastom. Der in der proximalen Fibula lokalisierte Tumor zeigt eine Wachstumsgeschwindigkeit Grad Lodwick II und hat den tumortragenden Knochen nahezu komplett destruiert. Es liegt eine pathologische Fraktur vor b Abb. 5.70 a, b. Osteoblastom des Talus. a Der Tumor stellt sich im Röntgenbild weitgehend osteolytisch dar, wobei die exakten Grenzen kaum ermittelt werden können. An der Fußrückenseite des Talus hat er eine Periostreaktion induziert. b Im T2*gewichteten GRE-Bild mit Fettsättigung stellt sich das Osteoblastom signalintensiv dar, wobei Matrixmineralisationen als fokal signalarme Areale zur Darstellung kommen. Die Auftreibung des tumortragenden Knochens ist deutlich sichtbar hinaus am Knochen sichtbar sein (Abb. 5.71 a, b). Bei einer engen Nachbarschaft der Knochen, wie an der Hand, können Periostreaktionen auch an dem benachbarten Knochen induziert werden. An den kleinen Röhrenknochen von Hand und Fuß kann das Osteoblastom eine deutliche Knochenauftreibung bewirken. In dieser Lokalisation zeigt der Tumor sehr häufig eine Trabekulierung innerhalb der Osteolyse, was in anderen Skelettabschnitten nicht beobachtet wird. Das typische Bild eines Osteoblastoms der langen Röhrenknochen ist eine Osteolyse mit mehr oder minder ausgeprägter Matrixmineralisation, die diaphysär exzentrisch gelegen ist, von einer lamellären Periostreaktion begleitet wird, eine perifokale sklerotische Reaktion aufweist und bei Patienten unter 30 Jahren angetroffen wird. Das typische Bild eines Osteoblastoms der Wirbelsäule ist eine Osteolyse mit mehr oder minder ausgeprägter Matrixmineralisation, die in dem WirbelMerke Abb. 5.69. Osteoblastom im Dornfortsatz von HWK 7. Der Tumor ist teils osteolytisch, teils osteoblastisch und täuscht nahezu eine Mattglasmatrix vor. Er hat den Dornfortsatz deutlich aufgetrieben ! 5.2 Knochenbildende Tumoren Abb. 5.71 a, b. Subperiostales Osteoblastom. a Der Tumor hat die Kompakta von periostal mäßig ausgedünnt und wird durch eine lamelläre, mineralisierte Periostreaktion von den Weichteilen abgegrenzt. b Das kontrastmittelverstärkte T1-gewichtete Bild zeigt einen subperiostalen kontrastmittelaufnehmenden Tumor, der die Kompakta von periostal teilweise destruiert a b bogen oder den Wirbelanhangsgebilden lokalisiert ist und bei unter 30 Jahre alten Patienten angetroffen wird. Schnittbilddiagnostik Der Tumor stellt sich in Abhängigkeit vom Mineralisationsgrad in der T1-Wichtung meistens inhomogen isointens oder signalärmer als die Muskulatur dar. In der T2-Wichtung zeigt der inhomogene Tumor eine mittlere bis hohe Signalintensität und nicht selten ein deutliches perifokales reaktives Ödem. Ebenso wie das Osteoidosteom zeigt der eigentliche Tumor ein starkes Kontrastmittelenhancement. Der Tumor ist häufig durch einen schmalen signalarmen Saum begrenzt, der einem Sklerosesaum entspricht. An der Knochenoberfläche kann dieser einer schmalen Neokompakta oder dem nichtmineralisierten intakten Periost entsprechen. Sind zystische Tumoranteile vorhanden, muss an eine sekundäre aneurysmatische Knochenzyste gedacht werden. Alle Osteoblastome zeigen in der Skelettszintigraphie eine deutliche Traceraufnahme (Abb. 5.72, Abb. 5.73 a, b, Abb. 5.74 a–c). Abb. 5.72. Osteoblastom im Wirbelbogen von LWK 5. Der Tumor liegt im linken Wirbelbogen und zeigt eine deutliche zentrale Matrixmineralisation 183 184 Kapitel 5 Knochentumoren a Abb. 5.73 a, b. Osteoblastom im Wirbelbogen HWK 2. a Die CT stellt einen nichtmineralisierten reaktionslosen osteolytischen Tumor im linken Wirbelbogenabschnitt dar, wobei sich die extraossäre Komponente im Intervertebralforamen aus- a b b breitet. b Im kontrastmittelverstärkten T1-gewichteten SE-Bild zeigt der Tumor ein deutliches Enhancement und kann besser als in der CT abgegrenzt werden c Abb. 5.74 a–c. Osteoblastom in HWK 6. a Das Röntgenbild zeigt einen überwiegend im Wirbelkörper gelegenen teils osteolytischen, teils osteoblastischen Tumor, der den tumortragenden Knochen aufgetrieben hat. Er dehnt sich auch in den Wirbelbogen aus, und ein Befall des grundplattennahen Abschnitts von HWK 5 lässt sich erahnen. b In der CT ist die Ausdehnung in den rechten Wirbelbogen deutlich sichtbar. Der Wirbelbogen ist ebenso wie der Wirbelkörper aufgetrieben. c Das kontrastmittelverstärkte T1-gewichtete SE-Bild zeigt ein deutliches Enhancement des Tumors sowie ein transdiskales Wachstum in den benachbarten HWK 5 5.2 Knochenbildende Tumoren Differenzialdiagnose An der Wirbelsäule sind die wichtigsten Differenzialdiagnosen die aneurysmatische Knochenzyste, das Osteoidosteom und der Riesenzelltumor. Die aneurysmatische Knochenzyste liegt ebenfalls bevorzugt im Wirbelbogen, weist jedoch keine Matrixmineralisationen auf. Die aneurysmatische Knochenzyste kann per continuitatem mehr als ein Segment befallen. In der MRT sind häufig Blutbestandteile, kontrastmittelaufnehmende Septen und Flüssigkeits-Flüssigkeits-Spiegel sichtbar; letzteres kann jedoch auch bei Osteoblastomen auftreten. Daneben muss berücksichtigt werden, dass eine aneurysmatische Knochenzyste als sekundäre Läsion in einem Osteoblastom auftreten kann. Das Osteoidosteom wird anhand der Nidusgröße (≤1,5 cm) differenziert. Der Riesenzelltumor sitzt bevorzugt im Wirbelkörper und hat eine Prädilektion für das Sakrum. In anderen Skelettregionen kann das Osteoblastom wie ein Chondrom, eine chronische Osteomyelitis, eine aneurysmatische Knochenzyste, ein Riesenzelltumor und ein eosinophiles Granulom imponieren. Das Enchondrom sitzt zentral im Knochen, der typische Riesenzelltumor sitzt epimetaphysär, die aneurysmatische Knochenzyste metadiaphysär oder diaphysär. Eine sehr exzentrisch lokalisierte aneurysmatische Knochenzyste kann einem Osteoblastom sehr ähnlich sehen, zeigt jedoch in der MRT die oben genannten Charakteristika. Eosinophile Granulome treten bei noch jüngeren Patienten auf und sind vorwiegend zentral gelegen. In einigen Fällen kann es radiologisch und histologisch extrem schwierig sein, ein aggressiv wachsendes Osteoblastom von einem niedrig malignen osteoblastomähnlichen Osteosarkom zu differenzieren. Merke ! Therapie und Prognose Die Therapie der Wahl besteht in einer chirurgischen Resektion mit einem schmalen Sicherheitssaum aus normalem Gewebe. Bei einer intraläsionalen Resektion sind adjuvante Maßnahmen, wie ein kryochirurgischer Eingriff, erforderlich. Rezidive treten in 10– 15% der Fälle auf. Bei inkompletter Entfernung tritt unweigerlich ein Rezidiv auf. Bei größeren Tumoren in gewichtsbelasteten Skelettabschnitten kann es erforderlich sein, durch weitere chirurgische oder orthopädische Maßnahmen die Stabilität des Knochens zu erhöhen. Es sind einige Fälle eines malignen Osteoblastoms beschrieben worden, die aber heute in die Gruppe der osteoblastomähnlichen Osteosarkome eingeordnet werden. 5.2.2 Maligne Tumoren Definition 왔 Das Osteosarkom ist der eigentliche maligne Tumor des Knochens. Aus einem sarkomatösen Stroma differenzieren sich Osteoblasten aus, die Tumorosteoid und Tumorknochen und eventuell auch Tumorknorpel bilden. Das charakteristische Merkmal ist die Bildung von Tumorosteoid, wobei bereits geringe Mengen in einem überwiegend fibroblastischen oder chondroblastischen Stroma ausreichend sind, die Diagnose eines Osteosarkoms zu stellen. Das Osteosarkom ist nach dem Myelom der zweithäufigste maligne Knochentumor.Allerdings handelt es sich um eine relativ seltene Erkrankung. Es wird von einer Inzidenz von 2–3 Tumoren pro 1 Mio. Einwohner/Jahr ausgegangen. Das Osteosarkom wird in mehrere Subtypen unterteilt (Tabelle 5.14). Daneben treten in wenigen Fällen multizentrische Osteosarkome auf. Hier sind zum Zeitpunkt der Erstdiagnose multiple Osteosarkome vorhanden, ohne dass Lungenmetastasen nachweisbar sind. Allerdings ist die Existenz von multizentrischen Osteosarkomen nicht unumstritten, da mehrere Autoren davon ausgehen, dass es sich hierbei um eine frühe ossäre Metastasierung handelt. Sekundäre Osteosarkome können in einem Morbus Paget und nach Bestrahlung auftreten.Auch wurde eine sekundär maligne Entartung eines anderen vorbestehenden Tumors, wie einer fibrösen Dysplasie, einer aneurysmatischen Knochenzyste oder eines Chondroms, beschrieben. Daneben kann eine Transformation eines Chondrosarkoms in ein Osteosarkom auftreten. Dieser Tumor wird heute allerdings als dedifferenziertes Chondrosarkom angesehen. Tabelle 5.14. Subtypen des Osteosarkoms. (Nach Mulder et al. 1993) Häufigkeit Intraossär Oberflächlich Extraossär Konventionelles Osteosarkom Teleangiektatisches Osteosarkom Kleinzelliges Osteosarkom Osteoblastomähnliches Osteosarkom Niedrig malignes Osteosarkom ca. 90% ca. 5% <1% Parossales Osteosarkom Periostales Osteosarkom Hoch malignes Oberflächenosteosarkom ca. 5% ca. 1% Extraossäres Osteosarkom <1% <1% <1% <1% 185 186 Kapitel 5 Knochentumoren 5.2.2.1 Konventionelles Osteosarkom Dieser Typ ist der häufigste und macht etwa 90% aller Osteosarkome aus. Basierend auf der Röntgenmorphologie kann man radiologisch ∑ ein osteoblastisches (osteosklerotisches), ∑ ein osteolytisches und ∑ ein gemischt osteolytisch-osteoblastisches Osteosarkom differenzieren. Dabei unterscheidet sich das histologische Bild in der prozentualen Zusammensetzung aus nichtmineralisiertem Tumorosteoid und Stroma einerseits und aus mineralisiertem Tumorosteoid und Tumorknochen andererseits. Klinik, Therapie und Prognose sind dagegen nicht wesentlich unterschiedlich. Histologisch kann man die Osteosarkome anhand der dominierenden Tumorkomponente in fibroblastische, chondroblastische und osteoblastische Osteosarkome unterteilen. Alter und Geschlecht Es handelt sich um einen typischen Tumor des Jugendlichen und jungen Erwachsenen. Etwa die Hälfte der Osteosarkome tritt in der 2. Lebensdekade auf, und etwa drei Viertel aller Tumoren werden bis zum 30. Lebensjahr diagnostiziert. Osteosarkome der Kiefer treten etwas später auf. In höheren Altersgruppen werden eine Reihe von sekundären Osteosarkomen beobachtet, die in einem Morbus Paget, einem Knocheninfarkt oder nach Bestrahlung auftreten können. Bei Patienten mit einem Morbus Paget muss in etwa 2% der Fälle mit einer malignen Transformation in ein Osteosarkom gerechnet werden. Nach einer Bestrahlung mit mindestens 30 Gy kann in etwa 0,3‰ der Fälle in dem im Bestrahlungsfeld gelegenen Knochen ein Osteosarkom, seltener ein Fibrosarkom oder Chondrosarkom entstehen. In Knocheninfarkten ist eine sarkomatöse Entartung eher selten. Bei Männern tritt das Osteosarkom etwa 50% häufiger als bei Frauen auf. Klinik Die häufigsten klinischen Beschwerden bestehen in zu Beginn leichten intermittierenden Schmerzen, die rasch zunehmen und zum Dauerschmerz werden. Rasch sind eine tastbare Raumforderung und eine sichtbare Schwellung vorhanden. Meist bestehen die Beschwerden seit 1–2 Monaten, bevor die korrekte Diagnose gestellt wird. Selten liegt bei Diagnosestellung bereits eine pathologische Fraktur vor. Lokalisation Das Osteosarkom manifestiert sich besonders häufig in der Umgebung derjenigen Epiphysen der langen Röhrenknochen, die die stärkste Wachstumstendenz aufweisen. Etwa zwei Drittel aller Osteosarkome finden sich in den Knochen des Kniegelenks. In absteigender Reihenfolge werden folgende Lokalisationen bevorzugt: ∑ ∑ ∑ ∑ ∑ ∑ ∑ distales Femur (40%), proximale Tibia (20%), proximaler Humerus (10%), proximales Femur (5%), proximale Fibula (4%), Gesichtsschädel (5%), Beckenskelett (5%). In den tubulären Knochen sind die Tumoren überwiegend metadiaphysär (42%), metaphysär (22%) und rein diaphysär (21%) lokalisiert. Eine auf dem konventionellen Röntgenbild sichtbare Mitbeteiligung der Epiphyse tritt in etwa 15% der Fälle auf. Sie ist in der MRT jedoch bei nahezu 80% der Tumoren nachweisbar. Eine rein epiphysäre Lokalisation stellt eine Rarität dar. Der Gelenkknorpel stellt eine weitgehend effiziente Barriere dar und wird erst in einem späten Stadium infiltriert. 60% der Tumoren sind zentral und 40% exzentrisch im Knochen lokalisiert (Abb. 5.75). Abb. 5.75. Statistische Daten zum Osteosarkom 5.2 Knochenbildende Tumoren Röntgenmorphologie Das radiologische Bild variiert von der rein osteoblastischen Läsion auf der einen Seite bis zur rein osteolytischen Läsion auf der anderen Seite, die in jeweils einem Viertel der Fälle beobachtet werden. Die Hälfte der Osteosarkome zeigt jedoch ein Mischbild aus osteolytischen und osteoblastischen Tumorarealen. Hier finden sich neben osteolytischen Arealen wolkenartige Matrixverknöcherungen. Mehr als 90% der Osteosarkome bieten ein Wachstumsmuster vom Grad Lodwick II und III (Abb. 5.76, Abb. 5.77, Abb. 5.78, Abb. 5.79, Abb. 5.80, Abb. 5.81). Die Kompakta wird frühzeitig destruiert, und es bilden sich in nahezu 90% der Fälle Periostreaktionen aus. Sie sind meistens unterbrochen lamellär mit oder ohne Codman-Dreieck oder spikulärer Komponente. Seltener wird eine „Sunburst-Reaktion“ (divergierende spikuläre Periostreaktion) beobachtet (Abb. 5.82, Abb. 5.83, Abb. 5.84). Häufig ist auch bereits auf dem konventionellen Röntgenbild eine extraossäre, partiell ossifizierte Tumormasse sichtbar. Die histologisch fast ausschließlich chondroblastischen und fibroblastischen Osteosarkome imponieren dagegen häufig weniger aggressiv als die Tumoren mit dominierender osteoblastischer Komponente. Die multizentrischen Osteosarkome sind radiologisch fast ausschließlich rein osteoblastisch (Abb. 5.85, Ab. 5.86, Abb. 5.87 a, b). Abb. 5.76. Osteoblastisches Osteosarkom. Der rein osteoblastische Tumor ist epimetadiaphysär gelegen. Er zeigt eine Wachstumsgeschwindigkeit vom Grad Lodwick II und hat eine mineralisierte Weichteilkomponente ausgebildet Abb. 5.77. Osteolytisches Osteosarkom. Der rein osteolytische Tumor ist metadiaphysär gelegen und zeigt eine Wachstumsgeschwindigkeit vom Grad Lodwick II. Er hat die Kompakta destruiert, und es sind lamelläre Periostreaktionen vorhanden. Eine Weichteilkomponente ist wegen der fehlenden Mineralisation nicht abgrenzbar Abb. 5.78. Osteolytisches Osteosarkom. Der überwiegend metadiaphysär exzentrisch gelegene Tumor hat die laterale Kompakta komplett destruiert. Eine nichtmineralisierte extraossäre Komponente wird kranial von einem Codman-Dreieck begrenzt. Der Tumor ist bereits diskret in die Epiphyse eingewachsen und zeigt eine Wachstumsgeschwindigkeit vom Grad Lodwick IC 187 188 Kapitel 5 Knochentumoren Abb. 5.79. Osteolytisch-osteoblastisches Osteosarkom. Der metadiaphysär gelegen Tumor besitzt sowohl osteolytische als auch osteoblastische Komponenten und zeigt eine Wachstumsgeschwindigkeit vom Grad Lodwick II. Er hat die mediale Kompakta komplett destruiert. Eine Weichteilkomponente kann nicht abgegrenzt werden, da sie nicht mineralisiert ist Abb. 5.80. Osteolytisch-osteoblastisches Osteosarkom. Der Tumor, der sich in nahezu zwei Dritteln der Tibia ausdehnt, ist überwiegend osteoblastisch. In der distalen Diaphyse besitzt er auch osteolytische Anteile. Hier hat er die Kompakta destruiert und eine diskret mineralisierte Weichteilkomponente ausgebildet, die kranial von einem Codman-Dreieck begrenzt wird Abb. 5.81. Osteosarkom. Der relativ kleine Tumor liegt metaphysär und zeigt sowohl osteolytische als auch osteoblastische Areale. Der epiphysenfugennahe Abschnitt der medialen Kompakta ist komplett penetriert Abb. 5.82. Osteosarkom. Das osteoblastische Osteosarkom ist metadiaphysär gelegen und hat eine mineralisierte Weichteilkomponente ausgebildet. Am Rand der Weichteilkomponente sind Periosterker vorhanden 5.2 Knochenbildende Tumoren Abb. 5.83. Osteosarkom. Das osteoblastische Osteosarkom hat eine deutliche Weichteilkomponente ausgebildet, in der eine Sunburst-Periostreaktion vorhanden ist. Die Spiculae konvergieren auf das Zentrum des Tumors Abb. 5.84. Osteosarkom. Der osteoblastische metaphysär gelegene Tumor zeigt als einzigen Hinweis auf ein aggressives Wachstum eine spikuläre Periostreaktion an der medialen Tibiakompakta. Ohne diese könnte er mit einer chronischen Osteomyelitis verwechselt werden Abb. 5.85. Osteosarkom. Rein osteolytischer, sehr aggressiv wachsender Tumor des Darmbeins Abb. 5.86. Osteosarkom. Rein osteoblastischer aggressiv wachsender Tumor des Darmbeins, der eine mineralisierte extraossäre Komponente ausgebildet hat 189 190 Kapitel 5 Knochentumoren Abb. 5.87 a, b. Multizentrisches Osteosarkom. Der Patient wies simultan ein osteoblastisches Osteosarkom im distalen Femur (a) und im proximalen Humerus auf (b). Lungenmetastasen lagen nicht vor a b Das typische Bild eines Osteosarkoms ist ein gemischt osteolytisch-osteoblastischer oder rein osteoblastischer aggressiv wachsender Tumor, der in der Kniegelenkregion oder im proximalen Humerus metadiaphysär oder metaphysär zentral gelegen ist, unterbrochene Periostreaktionen zeigt und in der 2.Lebensdekade angetroffen wird. Merke ! Schnittbildmorphologie In der diagnostischen Aufarbeitung eines Osteosarkoms ist die CT durch die MRT ersetzt worden. In der CT sind je nach Mineralisationsgrad des Tumors mehr oder minder ausgedehnte Ossifikationen der Tumormatrix nachweisbar. Ein Durchbruch durch die Kompakta ist sicher erkennbar. Verglichen mit Makroschnitten lässt sich die intraossäre Ausdehnung bis auf etwa 2 cm genau bestimmen. Problematisch ist jedoch die exakte Abgrenzung einer nicht oder nur wenig mineralisierten Weichteilkomponente von der umgebenden Muskulatur, da in vielen Fällen auch in der Kontrastmittel-CT kein optimaler Kontrast zwischen beiden zu erzielen ist. Wie bei allen malignen Knochentumoren ist mit der CT ein peritumorales Ödem nicht nachweisbar. Basierend auf dem vorherrschenden Bild eines osteolytisch-osteoblastischen Tumors stellen sich die Osteosarkome in der MRT meist inhomogen dar. Auf dem T1-gewichteten Bild zeigen sie meistens eine der Skelettmuskulatur vergleichbare Signalintensität, wobei mehr oder minder große signalärmere Areale vorhanden sind. Auf dem T2-gewichteten Bild sind sie meist deutlich signalintensiv, wobei signalarme Areale eingestreut sind, die mineralisiertem Tumorosteoid und Tumorknochen entsprechen. Rein osteo- blastische Tumoren zeigen in allen Sequenzen eine sehr niedrige Signalintensität, die ähnlich der der Kompakta ist. Rein osteolytische Tumoren stellen sich weitgehend homogen und im T2-gewichteten Bild signalintensiv dar. Chondroblastische Areale, zystische Bezirke und fokale Einblutungen sind auf dem T2-gewichteten Bild sehr signalintensiv. Verglichen mit Makroschnitten lässt sich die intraossäre Ausdehnung bis auf etwa 5 mm genau bestimmen. Die Tumoren zeigen fast immer eine Weichteilkomponente, die in der T2-Wichtung häufig signalintensiver als die intraossäre Tumormasse zur Darstellung kommt, da sie geringer mineralisiert und ossifiziert ist. Meist sind ein ausgedehntes extraossäres und ein deutliches intraossäres peritumorales Ödem nachweisbar. Nach Kontrastmittelgabe zeigen die nicht stark mineralisierten Tumorareale ein deutliches Enhancement. Divergierend spikuläre Periostreaktionen (Sunburst) sind in der Weichteilkomponente gelegentlich deutlich sichtbar (Abb. 5.22). Mittels MRT findet man eine Tumorausdehnung in die Epiphyse in einem deutlich höheren Prozentsatz als auf den konventionellen Bildern. Dabei kann der Tumor auch die noch offene Epiphysenfuge durchwachsen (Abb. 5.88 a–f, Abb. 5.89 a–c, Abb. 5.90 a, b). Allerdings kann in der MRT auch fälschlicherweise ein epiphysärer Befall vermutet werden. In diesen Fällen wurde in Nachbarschaft zu einem metaphysären Osteosarkom in der Epiphyse Blutbildungsmark gefunden. Bei gelenknahen Tumoren sind reaktive Synovialitiden und Gelenkergüsse nicht selten. Sie dürfen jedoch nicht als Zeichen einer Gelenkinvasion angesehen werden. 5.2 Knochenbildende Tumoren a d b c e f Abb. 5.88 a–f. Osteosarkome. a Das T1-gewichtete SE-Bild zeigt einen metadiaphysär gelegenen signalarmen Tumor. b Im kontrastmittelverstärkten T1-gewichteten SE-Bild ist ein deutliches Enhancement im Tumor nachweisbar. Daneben demarkiert sich eine medial gelegene Weichteilkomponente. c Im kontrastmittelverstärkten T1-gewichteten SE-Bild mit Fettsättigung kommt die extraossäre Komponente deutlich zur Darstellung. Sie wird durch eine Periostlamelle umgeben, die allerdings an einigen Stellen schon penetriert ist. Außerhalb der Periostreaktion ist ein deutliches, kontrastmittelaufneh- mendes peritumorales Ödem sichtbar. d Das T1-gewichtete SE-Bild eines anderen Tumors stellt ebenfalls einen überwiegend signalarmen epimetadiaphysär gelegenen Tumor dar, der dorsal eine extraossäre Komponente ausgebildet hat. e Im T2-gewichteten SE-Bild ist der Tumor signalintensiv und nur gering inhomogen. f Auf dem kontrastmittelverstärkten T1gewichteten SE-Bild lässt sich im kaudalen Abschnitt eine Nekrosezone abgrenzen, die im Gegensatz zum Tumor kein Enhancement zeigt. Der Tumor ist in den Gelenkraum eingebrochen und ist zwischen den Kreuzbändern nachweisbar Eine Infiltration des benachbarten Gefäß-NervenBündels, die nicht sehr häufig auftritt, ist auch mit der MRT nicht selten nur sehr schwer zu beurteilen. Die Diagnose kann nur bei einem eindeutigen Befund – der Tumor und nicht das Ödem umgeben das GefäßNerven-Bündel – gestellt werden. Der Ausschluss einer Infiltration ist mit der MRT zuverlässig möglich. Die intraossäre Ausdehnung des Tumors wird auf T1-gewichteten Bildern genauer als auf STIR-Bildern abgebildet, wobei auf STIR-Bildern die Ausdehnung häufig überschätzt wird. Zum Nachweis von Skipmetastasen (vom Tumor entfernt lokalisierte weitere Herde im tumortragenden Knochen oder im transartikulären Knochen), die in weniger als 2% der Tumoren auftreten, erfolgt eine Abbildung des gesamten tumortragenden Knochens, mit einer T1-gewichteten SE- und/oder einer STIR-Sequenz. Skipmetastasen weisen auf eine schlechte Prognose hin (Abb. 5.91). In der Skelettszintigraphie zeigen die Osteosarkome immer eine starke Traceraufnahme. Dieses Untersuchungsverfahren trägt jedoch zur eigentlichen Diagnosestellung wenig bei (Abb. 5.92 a, b). 191 192 Kapitel 5 Knochentumoren a c b Abb. 5.89 a–c. Osteosarkom. a Im Röntgenbild zeigt das fast rein osteoblastische epimetadiaphysär gelegene Osteosarkom keine eindeutige mineralisierte extraossäre Komponente. b Im T1-gewichteten SE-Bild lässt sich neben der ausgedehnten intraossären auch eine deutliche medial gelegene extraossäre Tumorkomponente abgrenzen. c Im T2-gewichteten SE-Bild zeigt die extraossäre Komponente eine hohe Signalintensität, während die intraossäre Komponente wegen der starken Matrixmineralisationen recht signalarm ist Abb. 5.90 a, b. Osteosarkom. a Anhand des Röntgenbildes scheint der osteolytisch-osteoblastische Tumor nicht in die Epiphyse eingewachsen zu sein. b In der MRT kann auf dem T1-gewichteten SE-Bild jedoch eine eindeutige Infiltration der Epiphyse nachgewiesen werden. Daneben ist auch eine mediale extraossäre Komponente abgrenzbar a b 5.2 Knochenbildende Tumoren Abb. 5.91. Skipmetastase. Neben dem osteoblastischen Osteosarkom in Schaftmitte ist ein weiterer kleiner osteoblastischer Herd in der distalen Femurdiaphyse vorhanden, der einer intraossären Metastase entspricht Differenzialdiagnose Die Diagnose eines malignen Knochentumors lässt sich fast immer sicher stellen. Liegt das typische Mischbild eines osteolytisch-osteoblastischen Tumors vor, kann fast immer eine korrekte Artdiagnose gestellt werden. Nur selten wird ein benigner Tumor vermutet. Rein osteoblastische Tumoren können, besonders dann, wenn sie klein sind, relativ scharfe Grenzen aufweisen. In diesen Fällen besteht eine Verwechslungsgefahr mit einem Osteom. Bei osteolytischen Osteosarkomen ist die Liste der möglichen Differenzialdiagnosen länger. Gelegentlich wird der Tumor mit einem Chondrosarkom verwechselt, wenn der Tumor nicht hoch aggressiv wächst (Lodwick IC und II) und nur einige Verkalkungsareale sichtbar sind. Bei einem sehr aggressiv wachsenden osteolytischen Tumor (Lodwick III) ohne sichtbare Verkalkungen und Verknöcherungen ist die Abgrenzung zu einem Ewing-Sarkom äußerst schwierig. Bei einem nur mäßig schnell wachsenden rein osteolytischen Tumor ohne Matrixmineralisationen besteht die Verwechslungsgefahr mit einem Fibrosarkom oder einem malignen fibrösen Histiozytom. Wie bei den meisten malignen Knochentumoren kann bei älteren Patienten die Abgrenzung von Metastasen schwierig sein. Bei Patienten mit einer Osteogenesis imperfecta treten Osteosarkome häufiger als bei Gesunden auf. Problematisch ist, dass bei der Osteogenesis imperfecta ein massiv überschießender Frakturkallus wie ein Osteosarkom imponieren kann. Abb. 5.92 a, b. Osteosarkom. a Der hoch aggressiv wachsende Tumor zeigt lediglich eine partielle mediale Kompaktadestruktion sowie eine lamelläre Periostreaktion an der lateralen Kompakta. Es ist keine geographische Destruktion erkennbar, eine permeative Komponente kann allenfalls erahnt werden (Lodwick Grad III). b In der Skelettszintigraphie ist eine deutliche Tracerakkumulation im proximalen Femurschaft nachweisbar a b 193 194 Kapitel 5 Knochentumoren Therapie und Prognose Eine alleinige Tumorresektion führt dazu, dass mehr als die Hälfte der Patienten innerhalb von sechs Monaten Lungenmetastasen und mehr als 80% der Patienten ein Lokalrezidiv entwickeln. Daher besteht das übliche Behandlungskonzept in einer multimodalen Therapie aus systemischer Chemotherapie und lokaler Tumorresektion. Randomisierte Studien haben gezeigt, dass eine adjuvante Chemotherapie in der Verhütung einer Metastasierung und eines Lokalrezidivs effektiv ist. Besteht radiologisch der Verdacht auf ein Osteosarkom, muss eine MRT der betroffenen Skelettregion, wenn immer möglich bereits vor der Probeentnahme, für das lokale Staging durchgeführt werden. Beim Staging sollte der gesamte tumortragende Knochen zumindest mit einer T1-gewichteten Sequenz in longitudinaler Schnittführung dargestellt werden, um die selten auftretenden Skipmetastasen nachweisen zu können. Der Ausschluss von Lungenmetastasen erfolgt mittels Thorax-CT und der von Knochenmetastasen mittels Skelettszintigraphie. Zum Zeitpunkt der Diagnosestellung sind radiologisch bereits bei 10–20% der Patienten Metastasen nachweisbar, die in etwa 90% der Fälle in der Lunge lokalisiert sind. Die zweithäufigste Metastasenlokalisation ist die in anderen Knochen. Die Existenz von multiplen Knochenmetastasen deutet auf eine sehr schlechte Prognose hin.Viszerale Metastasen können mineralisieren. Die Diagnosesicherung basiert auf einer offenen Probeexzision. Diese sollte von dem Orthopäden oder Chirurgen durchgeführt werden, der auch die definitive Operation vornimmt, damit der Biopsiekanal bei der nachfolgenden Operation entfernt werden kann. Wird ein falscher Biopsiezugang gewählt kann ein extremitätenerhaltender Eingriff gefährdet werden. CAVE Osteosarkoms auf die Chemotherapie abhängig. Hat bei metastasenfreien Patienten das Osteosarkom gut auf die präoperative Chemotherapie angesprochen (weniger als 10% vitale Tumorzellen im Resektat), beträgt die Fünfjahresüberlebensrate etwa 80%, bei schlechtem Ansprechen um 50%. Eine Abnahme des Tumorvolumens korreliert nicht mit einem guten Ansprechen. Daher sind viele Versuche unternommen worden, mittels konventionellem Röntgen, Skelettszintigraphie, CT, Angiographie und MRT das Ansprechen des Tumors vor der definitiven Operation zu beurteilen. Zur Zeit scheinen dynamische kontrastmittelverstärkte MRTUntersuchungen und die Skelettszintigraphie die für die Beantwortung dieser Frage am besten geeigneten Untersuchungsverfahren zu sein. Jedoch wurde bisher kein Parameter gefunden, der eine sichere Vorhersage des Ansprechens erlaubt. Haben die Patienten bereits zum Zeitpunkt der Diagnosestellung Lungenmetastasen, beträgt die Fünfjahresüberlebensrate unter den heutigen Therapieregimen etwa 40%. Dabei ist die Prognose bei unilateralen und wenigen Metastasen besser als bei bilateralen und vielen Metastasen. Die Lungenmetastasen sollten, wenn eben möglich, sämtlich exstirpiert werden. Patienten mit Knochenmetastasen haben eine sehr schlechte Prognose. Nach erfolgreicher Therapie manifestiert sich ein Rezidiv meist als Lungenmetastasen. Falls diese komplett entfernt werden können, kann eine Drei- bis Fünfjahresüberlebensrate von 20–40% erzielt werden. 5.2.2.2 Teleangiektatisches Osteosarkom Das teleangiektatische Osteosarkom ist ein hoch maligner Tumor und macht etwa 5% der Osteosarkome aus. ! Vor der definitiven Operation werden mehrere Zyklen Chemotherapie nach einem standardisierten COSS-(Cooperative Osteosarcoma Study Group-) Protokoll durchgeführt. In Abhängigkeit von dem Ergebnis der MRT wird ein extremitätenerhaltender operativer Eingriff angestrebt, wobei die Resektionsränder weit im Gesunden geführt werden müssen. Die präoperative Chemotherapie erhöht die Anzahl der Patienten, die mittels extremitätenerhaltender Operation anstatt einer Amputation therapiert werden können. Etwa 70– 90% der Osteosarkome der Extremitäten können heute extremitätenerhaltend operiert werden. Danach erfolgen mehrere Zyklen postoperative Chemotherapie. Die Prognose ist vom Ansprechen des Definition 왔 Die Diagnose basiert auf dem Nach- weis von multiplen zystischen Arealen, die mit geronnenem Blut gefüllt sind, und dem Nachweis von vitalem Tumorgewebe, das Tumorosteoid bildet. Alter und Geschlecht Der Tumor wird meist bei Jugendlichen und jungen Erwachsenen angetroffen. Etwa die Hälfte der Tumoren tritt während der 2. Lebensdekade und etwa drei Viertel bis zum 30. Lebensjahr auf. Männer sind etwa doppelt so häufig wie Frauen betroffen. Klinik Die Klinik entspricht der des konventionellen Osteosarkoms. Häufiger besteht jedoch bereits bei Diagnosestellung eine pathologische Fraktur. 5.2 Knochenbildende Tumoren Lokalisation Etwa die Hälfte der teleangiektatischen Osteosarkome wird im Femur und ein weiteres Viertel in der Tibia angetroffen. Nahezu zwei Drittel der Tumoren finden sich um das Kniegelenk. Im Humerus liegen etwa 12% der Tumoren. Die bevorzugte intraossäre Lokalisation ist metadiaphysär (45%), gefolgt von metaphysär (20%) und rein diaphysär (20%). 60% der Tumoren sind zentral gelegen (Abb. 5.93). ein schnelles Wachstum (Lodwick II) und nur in 20% ein sehr schnelles Wachstum (Lodwick III). Es sind sogar einige Fälle beobachtet worden, bei denen eine geographische Osteolyse von einem inkompletten sklerotischen Randsaum begrenzt war. Die Kompakta wird in mehr als der Hälfte der Fälle destruiert. In zwei Dritteln der Fälle werden Periostreaktionen, vom lamellären und/oder spikulären Typ, beobachtet (Abb. 5.94, Abb. 5.95, Abb. 5.96 a, b). Röntgenmorphologie Drei Viertel der Tumoren sind rein osteolytisch, ein Fünftel osteolytisch-osteoblastisch, der kleine Rest überwiegend osteoblastisch. Die Tumoren wachsen tendenziell eher etwas langsamer als die konventionellen Osteosarkome. In einem Drittel zeigen sie nur ein mäßiges Wachstum [Lodwick (IB bis) IC], in 40% Das typische Bild ist ein osteolytischer, aggressiv imponierender Tumor, der keine Matrixmineralisationen aufweist, metadiaphysär zentral lokalisiert ist, mitunter unterbrochene lamelläre Periostreaktionen bietet und in der 2. Lebensdekade auftritt. Abb. 5.93. Statistische Daten zum teleangiektatischen Osteosarkom Abb. 5.94. Teleangiektatisches Osteosarkom eines 2-jährigen Jungen. Der metadiaphysär gelegene Tumor ist rein osteolytisch und zeigt eine Wachstumsrate vom Grad Lodwick II. Medial ist eine partiell durchbrochene lamelläre Periostreaktion abgrenzbar Merke ! 195 196 Kapitel 5 Knochentumoren Schnittbildmorphologie Das teleangiektatische Osteosarkom weist – ähnlich der aneurysmatischen Knochenzyste – multiple, mit Flüssigkeit gefüllte Hohlräume auf, die auch Flüssigkeits-Flüssigkeits-Spiegel aus Blut und seröser Flüssigkeit aufweisen können. Hämorrhagische Komponenten weisen dabei sowohl in der T1- als auch in der T2-gewichteten Sequenz hohe Signalintensitäten auf. Daneben werden fast regelmäßig solide Komponenten angetroffen, die ein kräftiges Kontrastmittelenhancement zeigen (Abb. 5.97 a–c). Ist bereits eine pathologische Fraktur eingetreten, dominieren die sekundären Veränderungen mit ausgedehnten Ödemen das Bild. In der Skelettszintigraphie zeigen die Tumoren häufig eine deutliche periphere Traceraufnahme, sie sind im Zentrum jedoch photopenisch (Donut-Zeichen). Abb. 5.95. Teleangiektatisches Osteosarkom. Der rein osteolytische metadiaphysär gelegene Tumor zeigt eine Wachstumsrate vom Grad Lodwick II. Es sind diskrete Periostreaktionen vorhanden Abb. 5.96 a, b. Teleangiektatisches Osteosarkom. a Der rein osteolytische diaphysär gelegene Tumor zeigt eine Wachstumsrate vom Grad Lodwick IB. Er hat die mediale Kompakta von enostal gering arrodiert. Der Tumor imponiert eher benigne als maligne. b Ein Jahr später ist der Tumor wesentlich größer geworden und imponiert aggressiver. Eine pathologische Fraktur ist eingetreten. Erst zu diesem Zeitpunkt ist die Diagnose gestellt worden a b 5.2 Knochenbildende Tumoren b a c Abb. 5.97 a–c. Teleangiektatisches Osteosarkom. a Im T1-gewichteten SE-Bild lassen sich innerhalb des Tumors signalreiche Areale angrenzen, die Blutungsherden entsprechen. b Im FS T2gewichteten SE-Bild stellt sich der Tumor recht inhomogen dar. Der Tumor hat die Epiphysenfuge durchbrochen, besitzt jedoch zum metaphysären Markraum eine Pseudokapsel. Es liegt ein ausgedehntes intraossäres peritumorales Ödem vor. c Im FS kontrastmittelverstärkten T1-gewichteten SE-Bild zeigt der Tumor ein ausgedehntes überwiegend flächenförmiges Enhancement. An einigen Stellen ist ein septales Enhancement vorhanden Differenzialdiagnose Die Diagnose eines malignen Tumors kann in mehr als der Hälfte der Fälle korrekt gestellt werden.Wegen der prädominierenden osteolytischen Morphologie ohne Matrixmineralisationen sind das Fibrosarkom und das Ewing-Sarkom die Differenzialdiagnosen unter den malignen Tumoren. In der MRT ist dann der Nachweis von multiplen flüssigkeitsgefüllten Hohlräumen häufig diagnostisch wegweisend. Da das Wachstum nicht selten nur mäßig schnell ist, kommen die aneurysmatische Knochenzyste und der Riesenzelltumor, in seltenen Fällen sogar die solitäre Knochenzyste differenzialdiagnostisch in Frage. Die Differenzialdiagnose zur aneurysmatischen Knochenzyste ist dabei besonders wichtig, da das teleangiektatische Osteosarkom auch histologisch Ähnlichkeiten mit dieser aufweisen kann. Auch in der MRT sehen beide Läsionen ähnlich aus. Der a b Abb. 5.98. a–c Differenzialdiagnose teleangiektatisches Osteosarkom vs.c aneurysmatische Knochenzyste.Alle drei Tumoren sind in der gleichen engen Alterspanne 7–8 Jahre aufgetreten, sind überwiegend metaphysär exzentrisch lokalisiert und wachsen nicht durch die offene Epiphysenfuge. Sie sind rein osteolytisch und zeigen teilweise Septen (b, c). Sie bieten eine c Wachstumsrate vom Grad Lodwick IC, wobei die Übergangszone zwischen Tumor und normalem Knochen bei den Osteosarkomen breiter als bei der aneurysmatischen Knochenzyste ist. Eine sichere Differenzierung der beiden Entitäten ist nicht möglich. Je aggressiver eine derartige Läsion wächst, umso eher muss an ein teleangiektatisches Osteosarkom gedacht werden 197 198 Kapitel 5 Knochentumoren Nachweis von größeren soliden kontrastmittelaufnehmenden Komponenten spricht dabei eher für ein teleangiektatisches Osteosarkom. Die aneurysmatische Knochenzyste zeigt üblicherweise nur ein septales Enhancement. Diskrete, meist nur in der CT sichtbare Osteoidverkalkungen sowie eine extraossäre Komponente sprechen ebenfalls für ein teleangiektatisches Osteosarkom (Abb. 5.98 a–c). Therapie und Prognose Die Behandlung entspricht der des konventionellen Osteosarkoms.Allerdings ist die Prognose eher etwas schlechter. 5.2.2.3 Kleinzelliges Osteosarkom Das kleinzellige Osteosarkom ist ein sehr seltener Subtyp, der nur etwa 1% der Osteosarkome ausmacht. Definition 왔 Der Tumor enthält Rundzellen, ähn- lich dem Ewing-Sarkom, produziert jedoch Osteoid. Das Manifestationsalter unterscheidet sich nicht wesentlich von dem des konventionellen Osteosarkoms. Das Femur, der Humerus und das Beckenskelett sind die am häufigsten betroffenen Knochen. In den langen Röhrenknochen sind die meisten Tumoren metaphysär und epimetaphysär gelegen. Die Röntgenmorphologie unterscheidet sich nicht wesentlich von der des konventionellen Osteosarkoms. Weist der Tumor Matrixossifikationen auf, kann er radiologisch als Osteosarkom identifiziert werden. Wenn der Tumor keine Osteoidmineralisation bietet, kann er radiologisch nicht vom EwingSarkom differenziert werden. Die Therapie entspricht der des konventionellen Osteosarkoms, wobei die Prognose deutlich schlechter ist (Abb. 5.99 a, b). 5.2.2.4 Osteoblastomähnliches Osteosarkom Es ist seit langem bekannt, dass einige ansonsten gutartige Osteoblastome ein aggressives lokales Wachstum zeigen und sogar metastasieren können. Diese werden heute als osteoblastomähnliche Osteosarkome klassifiziert. Bisher sind nur wenige Fälle beschrieben worden. Die Tumoren waren rein osteolytisch oder gemischt osteolytisch-osteoblastisch. Einzelne waren rein osteolytisch und zeigten eine ausgeprägte periostale Knochenneubildung, wodurch sie das Bild eines Osteoidosteoms imitierten. Der Tumor wird wie ein konventionelles Osteosarkom therapiert (Abb. 5.100). Abb. 5.99 a, b. Kleinzelliges Osteosarkom. Der überwiegend diaphysär gelegene Tumor weist eine ossifizierte Matrix auf. Er hat die Kompakta ventral durchbrochen und besitzt eine extraossäre Komponente. In der Metaphyse liegen einige kleinste osteoblastische Herde, die wie Skipmetastasen imponieren, jedoch auch möglichen Mineralisationsherden eines sich im Markraum ausbreitenden Tumors entsprechen können a b 5.2 Knochenbildende Tumoren Abb. 5.100. Osteoblastomähnliches Osteosarkom. Der überwiegend osteoblastische Tumor breitet sich in nahezu drei Vierteln der Ulna aus. In Schaftmitte liegt eine unregelmäßig begrenzte osteolytische Komponente vor, die deutlich aggressiver als der Nidus eines Osteoblastoms imponiert Abb. 5.101. Niedrig malignes Osteosarkom. Der in der Diaphyse des Radius gelegene Tumor hat den Knochen aufgetrieben und bietet mit Ausnahme der osteolytischen Areale eine mattglasartige Matrix, ähnlich wie eine fibröse Dysplasie. Die osteolytischen Areale, besonders die distal gelegenen kleinen Osteolysen sprechen jedoch gegen eine fibröse Dysplasie 5.2.2.5 Niedrig malignes Osteosarkom Röntgenmorphologie Der Tumor imponiert entweder gemischt osteolytisch-osteoblastisch, osteolytisch mit deutlichen Trabekulierungen oder einer Mattglasmatrix, rein osteolytisch oder rein osteoblastisch. Die Wachstumsgeschwindigkeit ist geringer als beim konventionellen Osteosarkom. Die Hälfte der Tumoren bietet das Bild einer geographischen Osteolyse mit scharfem, teilweise sogar mit inkomplettem Sklerosesaum (Lodwick IB bis IC). Die andere Hälfte wächst unter dem Bild einer geographischen Osteolyse mit Mottenfraßrand (Lodwick II). Die Kompakta wird durch den Tumor häufig zumindest fokal destruiert, gelegentlich nur ausgedünnt. Periostschalen werden häufig, lamelläre oder spikuläre Periostreaktionen seltener beobachtet (Abb. 5.101, Abb. 5.102, Abb. 5.103). Definition 왔 Unter den Osteosarkomen existiert eine kleine Gruppe von Tumoren, die Osteoid produzieren, jedoch weder das typische anaplastische histologische Bild noch die typische Röntgenmorphologie eines malignen Tumors aufweisen. Auch ist die Metastasierungsfrequenz geringer. Seit einer Publikation von Unni et al. (1977) werden diese Tumoren als eigenständige Untergruppe geführt. Sie macht nur etwa 1% der Osteosarkome aus. Die Patienten sind etwas älter als die mit einem konventionellen Osteosarkom. Etwa drei Viertel der Tumoren treten in der 2. und 3. Lebensdekade auf. Die Lokalisation variiert nicht wesentlich von der des konventionellen Osteosarkoms. Etwas mehr als die Hälfte der Tumoren sind im distalen Femur und in der proximalen Tibia gelegen. Etwa zwei Drittel der Tumoren sind metaphysär lokalisiert, und die meisten wachsen nach Wachstumsfugenschluss in die Epiphyse ein. Mehr als 80% der Tumoren sind zentral gelegen. 199 200 Kapitel 5 Knochentumoren Abb. 5.102. Niedrig malignes Osteosarkom. Der in der proximalen Fibula gelegene Tumor zeigt Zeichen eines langsamen Wachstums. Hinweise auf ein aggressives Wachstum liegen nicht vor a b Abb. 5.104 a–c. Niedrig malignes Osteosarkom. a Im Röntgenbild ist lediglich eine diskrete unregelmäßige osteoblastische Reaktion in der medialen Epimetaphyse sichtbar, wobei subkortikal eine kleine Osteolyse abgrenzbar ist. b In der Skelettszintigraphie ist eine starke Tracerakkumulation an der Medialseite Abb. 5.103. Niedrig malignes Osteosarkom. Der in der Fibuladiaphyse gelegene Tumor hat die Ausbildung einer Periostschale induziert.Als Hinweis auf ein mäßig aggressives Wachstum finden sich nicht exakt definierte Übergangszonen zwischen Tumor und normalem Knochen sowie eine Penetration in die Kompakta und in die Periostschale c der proximalen Tibia nachweisbar, die einen aktiven Knochenumbauprozess beweist. c Im T1-gewichteten SE-Bild kann die Haupttumorkomponente in der Metaphyse nachgewiesen werden, wobei kleinere Ausläufer in die Epiphyse ziehen. Es ist bereits eine diskrete extraossäre Komponente vorhanden 5.2 Knochenbildende Tumoren Schnittbildmorphologie Auch in der MRT imponieren diese Tumoren weniger aggressiv als die konventionellen Osteosarkome. Peritumorale Ödeme werden eher selten, Weichteilkomponenten jedoch in nahezu der Hälfte der Fälle angetroffen. Die Tumoren grenzen sich nicht selten recht scharf zu den umgebenden normalen Geweben ab und können in der MRT eher wie ein benigner als ein maligner Tumor imponieren (Abb. 5.104 a–c). Differenzialdiagnose Das niedrig maligne Osteosarkom wird nicht selten als benigner Tumor fehlinterpretiert. Es kann irrtümlich als fibröse Dysplasie missgedeutet werden, zeigt jedoch bei subtiler Bildanalyse eine höhere Wachstumsgeschwindigkeit. Bei einer rein osteolytischen Morphologie ist die Abgrenzung zu einem Knorpeltumor nahezu unmöglich. Rein osteolytische Tumoren mit deutlichen Trabekulierungen können das Bild eines desmoplastischen Fibroms vortäuschen. Ist der Tumor in die Epiphyse eingewachsen, kann er mit einem Riesenzelltumor verwechselt werden. Therapie und Prognose Die empfohlene Behandlung besteht in einer Resektion mit einem ausreichenden Sicherheitsabstand und einer Chemotherapie. Bei adäquater Therapie ist die Prognose wesentlich besser als die des konventionellen Osteosarkoms. 5.2.2.6 Periostales Osteosarkom Definition Röntgenmorphologie Der Tumor weist eine charakteristische Morphologie auf. Er stellt sich als der Kompakta außen aufsitzender Weichteiltumor dar, der mehr oder minder, bevorzugt in den zentralen kompaktanahen Abschnitten, kalzifiziert oder ossifiziert. Die peripheren Abschnitte sind deutlich geringer mineralisiert. Die Matrixmineralisationen zeigen häufig einen streifigen oder einen radiären auf das virtuelle Tumorzentrum auf der Kompakta konvergierenden Verlauf. Die Kompakta kann lokal ausgedünnt sein, kann aber auch durch eine reaktive Knochenneubildung verdickt sein. Bei größeren Tumoren sind an den Rändern häufig Ossifikationen vorhanden, die Codman-Dreiecken ähnlich sehen. Auf den konventionellen Röntgenaufnahmen kann eine mögliche Invasion in den Markraum, die die Prognose verschlechtert, nicht zuverlässig nachgewiesen werden. Für die Beantwortung dieser Fragestellung muss die MRT eingesetzt werden. Schnittbildmorphologie In der MRT kann der Tumor in der T2-gewichteten Sequenz einen läppchenartigen Aufbau und eine hohe Signalintensität zeigen. Nach Kontrastmittelgabe reichern septale Strukturen deutlich an, sodass der Tumor wie ein Knorpeltumor imponieren kann. Wenn große zelluläre Knorpelareale vorhanden sind, kann ein homogenes Enhancement vorhanden sein. Größere Tumormineralisationen stellen sich sehr signalarm dar. Mittels MRT ist eine Infiltration des Markraums sicher nachweisbar (Abb. 5.105 a, b). 왔 Das periostale Osteosarkom ist ein hoch malignes, überwiegend chondroblastisches Osteosarkom und unterscheidet sich von dem eher niedrig malignen parossalen Osteosarkom. Es entsteht wohl im Periost und wächst in die Kompakta ein. a Ähnlich wie beim Chondrosarkom ist der Tumorknorpel läppchenartig angeordnet und von Periost umgeben. Daneben werden ein sarkomatöses Stroma und Tumorosteoid angetroffen. Der Tumor ist selten und macht nur etwa 1% aller Osteosarkome aus. Alter und Geschlecht Die meisten Tumoren werden in der 2. Lebensdekade angetroffen. Männer sind etwa 50% häufiger als Frauen betroffen. b Lokalisation Die am häufigsten befallenen Knochen sind Femur und Tibia. Die bei weitem bevorzugte intraossäre Lokalisation ist die Diaphyse. Abb. 5.105 a, b. Periostales Osteosarkom. a Die LauensteinAufnahme stellt einen der Kompakta aufsitzenden Tumor dar, der kompaktanah spikuläre Ossifikationen aufweist. Daneben ist eine fokale Destruktion der Kompakta erkennbar. b Das T2gewichtete SE-Bild stellt die wahre Tumorausdehnung dar. Die Kompakta ist ventral partiell destruiert 201 202 Kapitel 5 Knochentumoren Differenzialdiagnose Die Diagnose einer malignen Läsion lässt sich in den meisten Fällen stellen. Bei einem geringen Mineralisationsgrad kommen differenzialdiagnostisch das juxtakortikale Chondrom und das juxtakortikale Chondrosarkom in Frage. Bei kleineren Tumoren muss differenzialdiagnostisch die Myositis ossificans abgegrenzt werden. Diese bewirkt jedoch keine Kompaktaverdickung, obgleich jedoch Periostreaktionen induziert werden können. Die Verknöcherungen sind bei der Myositis ossificans in der Peripherie ausgeprägter als im Zentrum, bei dem periostalen Osteosarkom dagegen im Zentrum am deutlichsten. Therapie und Prognose Die Prognose ist etwas besser als beim konventionellen Osteosarkom. Die Therapie besteht in einer weiträumigen Tumorresektion. Eine Chemotherapie wird nur selten durchgeführt. 5.2.2.7 Parossales Osteosarkom Das parossale Osteosarkom ist ein relativ seltener Tumor, der etwa 5% der Osteosarkome und etwa 1% der malignen Knochentumoren ausmacht. Definition 왔 Er geht von der äußeren Kompaktao- berfläche aus, ist gut differenziert und wächst langsam. Er besitzt fibroblastische, osteoblastische und oft auch chondroblastische Elemente. Der Tumor hat einen niedrigeren Malignitätsgrad als das konventionelle Osteosarkom. In 10–20% der Fälle entsteht jedoch im Tumor eine hoch maligne Tumorkomponente. Dieser Subtyp wird als dedifferenziertes parossales Osteosarkom bezeichnet. Auf der anderen Seite des Spektrums existiert ein sehr seltener niedrig maligner Subtyp, der histologisch einem Osteochondrom ähnlich sieht und osteochondromähnliches parossales Osteosarkom genannt wird. Alter und Geschlecht Das parossale Osteosarkom tritt besonders in der 2. bis 4. Lebensdekade auf. In dieser Altersgruppe werden etwa 80% der Tumoren diagnostiziert. Die Patienten sind im Schnitt älter als die mit einem konventionellen Osteosarkom. Es liegt keine Geschlechtspräferenz vor. Klinik Die Symptome sind meist nur gering. Häufig bemerkt der Patient eine langsam zunehmende Schwellung, die gelegentlich zu einer Einschränkung der Beweglichkeit führen kann. Die Dauer der Symptome kann zwischen wenigen Monaten und mehreren Jahren variieren. Lokalisation Das parossale Osteosarkom wird in mehr als der Hälfte der Fälle am distalen Femur, hier besonders häufig an der Rückfläche angetroffen. Weitere häufige Lokalisationen sind die proximale Tibia (15%) und der proximale Humerus (15%). Der Tumor ist in etwa der Hälfte der Fälle metadiaphysär lokalisiert. Es folgen in abnehmender Häufigkeit eine diaphysäre (17%), metaphysäre (15%) und epimetadiaphysäre (12%) Lage. Eine rein epiphysäre und epimetaphysäre Lage sind Raritäten (Abb. 5.106). Röntgenmorphologie Das parossale Osteosarkom stellt sich als extraossäre Raumforderung dar,die entweder nahezu komplett homogen ossifiziert ist oder nur einzelne Areale mit dichter Ossifikation aufweist. In vielen Fällen ist die Ossifikation in den zentralen, knochennahen Abschnitten ausgeprägter als in der Peripherie. Die dichten Areale repräsentieren Bezirke mit einem ausgedehnt mineralisierten Osteoid, die weniger dichten Areale Bezirke mit größeren fibroblastischen und chondrogenen Tumoranteilen. 90% der Tumoren sind rein sklerotisch, 10% zeigen größere osteolytische Komponenten. Abb. 5.106. Statistische Daten zum parossalen Osteosarkom 5.2 Knochenbildende Tumoren Abb. 5.107. Klassisches parossales Osteosarkom. Der stark mineralisierte Tumor liegt der Kompakta des distalen Femurs auf und wächst in der Fossa poplitea. Der Mineralisationsgrad nimmt zur Peripherie hin ab. Es besteht der dringende Verdacht auf eine Infiltration des Markraums, da dieser tumornah osteoblastisch imponiert Abb. 5.108. Klassisches parossales Osteosarkom. Der Tumor wächst auf der Kompakta der Femurrückfläche und zeigt im kaudalen Abschnitt eine gut ausgereifte Ossifikation, die fast trabekulär imponiert. Im mittleren Abschnitt ist die Ossifikation inhomogener. Im kranialen Abschnitt liegt eine inkomplett mineralisierte Weichteilkomponte vor. Es besteht kein Hinweis auf eine Markrauminfiltration Abb. 5.109. Parossales Osteosarkom. Im Röntgenbild ist ein typisches parossales Osteosarkom erkennbar, dessen Mineralisationsgrad zur Peripherie hin abnimmt. Eine beginnende Infiltration des Markraums ist zu vermuten Abb. 5.110. Parossales Osteosarkom. Der Tumor, der eine inhomogene Ossifikation aufweist, wächst auf der dorsalen Kompakta der proximalen Tibia. Es liegt sicher eine Infiltration des Markraums vor, da die Kompakta enostal deutlich verdickt und unregelmäßig ist 203 204 Kapitel 5 Knochentumoren Abb. 5.111 a, b. Parossales Osteosarkom vs. Variation der Insertion des M. gastrocnemius. a Der distalen Femurkompakta aufsitzend lässt sich eine etwas inhomogene Ossifikation nachweisen, die diskret unscharfe äußere Grenzen zeigt. b Die Differenzialdiagnose zu einer produktiven Veränderung des Ansatzes des M. gastrocnemius ist äußerst schwierig. Diese zeigt jedoch häufiger eine trabekuläre Matrix a b Abb. 5.112. Parossales Osteosarkom. Der lateralen Kompakta des Humerus sitzt ein inhomogen sklerosierter Tumor auf, dessen Mineralisationsgrad zur Peripherie hin abnimmt Der Tumor sitzt der Kompakta entweder breitflächig oder nur schmalbasig auf, wobei im letzteren Fall das Bild eines Stiels imitiert wird. Der Tumor wächst häufig entlang der Knochenachse des Schaftes, wobei in etwa der Hälfte der Fälle eine schmale Grenzzone zur Kompakta hin besteht, die dem Periost entspricht. Die Grenzen des Tumors zu den Weichteilen können scharf oder unscharf sein und sind im ersteren Fall häufig lobuliert. Gelegentlich werden von dem Haupttumor separierte weitere Ossifikationsherde gefunden. Der Tumor wächst zwar meistens entlang der Knochenachse, kann den Knochen jedoch auch zirkulär umwachsen. Die Region der Kompakta, die in Kontakt mit dem Tumor steht, kann auf der äußeren Oberfläche verdickt sein. Eine Verdickung der inneren Oberfläche kann ein Zeichen einer Markrauminvasion durch den Tumor sein (Abb. 5.107, Abb. 5.108, Abb. 5.109, Abb. 5.110, Abb. 5.111 a, b, Abb. 5.112). Eine Markrauminvasion muss mittels MRT nachgewiesen werden. Lamelläre Periostreaktionen werden nur in etwa einem Fünftel der Fälle beobachtet. Eine zentrale Osteolyse kann das Zeichen eines hoch malignen Areals sein, was als Dedifferenzierung bekannt ist. Diese tritt in 10–20% der Fälle auf (Abb. 5.113, Abb. 5.114). Das typische Bild eines parossalen Osteosarkoms ist ein der Kompakta aufsitzender Tumor, der zentral betont kräftig mineralisiert ist, an der Rückfläche des distalen Femurs metadiaphysär lokalisiert ist und bei einem Patienten in der 2. bis 4. Lebensdekade angetroffen wird. Merke ! 5.2 Knochenbildende Tumoren Abb. 5.113. Dedifferenziertes parossales Osteosarkom. In dem stark sklerosierten extraossären Tumor sind im unteren Drittel und am kranialen Rand Osteolysen sichtbar, die dedifferenzierten Anteilen entsprechen Abb. 5.114. Parossales Osteosarkom. Der in der Umgebung der Spina iliaca anterior inferior gelegene Tumor kann mit einem alten Apophysenabriss der Spina verwechselt werden. Die Läsionsgröße spricht jedoch eher für einen Tumor Schnittbilddiagnostik Die entscheidende Aufgabe von CT und MRT ist die exakte Ausdehnungsbestimmung des Tumors. Mit der CT kann eine Invasion des Markraums nachgewiesen werden. Hier zeigt sich eine osteoblastische Tumorkomponente innerhalb des Markraums oder als Frühzeichen eine wellige, unregelmäßige enostale Begrenzung der Kompakta. Allerdings kann die Ausdehnung der extraossären peripher nichtossifizierten Weichteilkomponente nicht immer richtig bestimmt werden. In der MRT können durch eine longitudinale Schnittführung in T1-Wichtung und durch eine axiale Schnittführung in T2-Wichtung sowohl die Invasion des Markraums als auch die Ausdehnung der Weichteilkomponente zuverlässig demonstriert werden. Die mineralisierten Tumorbezirke zeigen in der T1- und in der T2-Wichtung eine sehr niedrige Signalintensität vergleichbar mit der der Kompakta. Die nichtmineralisierten Areale zeigen in dem T1-gewichteten Bild eine muskelisointense und in dem T2gewichteten Bild eine hohe Signalintensität sowie ein kräftiges Kontrastmittelenhancement. Gelegentlich kann durch das infiltrative Wachstum etwas Fett im Tumor eingeschlossen sein, das sich im T1-gewichteten Bild signalintensiv darstellt (Abb. 5.115, Abb. 5.116 a–d, Abb. 5.117 a, b). Abb. 5.115. Parossales Osteosarkom. Die CT demonstriert das typische Bild dieses Tumors, der kompaktanah stärker als in der Peripherie mineralisiert ist. Die feine nichtmineralisierte Zone zwischen Tumor und Kompakta entspricht dem Periost 205 206 Kapitel 5 Knochentumoren Abb. 5.116 a–d. Parossales Osteosarkom. a Im Röntgenbild ist ein die proximale Tibia umgebender osteoblastischer Tumor abgrenzbar. b Die CT stellt den Tumor übersichtlich dar und demonstriert eine Infiltration des Markraums. c, d Im T1-gewichteten SE-Bild ist der Tumor in Relation zur Muskulatur deutlich signalärmer. Die ursprüngliche Kompakta ist nicht mehr abgrenzbar, und der Markraum ist fokal infiltriert a b c d 5.2 Knochenbildende Tumoren Abb. 5.117 a, b. Parossales Osteosarkom. a Im Röntgenbild ist ein parossales Osteosarkom nachweisbar, das eine größere kaum mineralisierte Weichteilkomponente besitzt. b Das T1-gewichtete SE-Bild stellt die Ausdehnung der Tumors in der Fossa poplitea klar dar und zeigt eine deutliche Infiltration des Markraums a Differenzialdiagnose In der Mehrzahl der Fälle, besonders wenn die Rückfläche des distalen Femurs betroffen ist, kann eine korrekte Artdiagnose gestellt werden. Ist neben einer größeren extraossären Komponente auch eine deutliche intraossäre vorhanden, muss das konventionelle Osteosarkom differenzialdiagnostisch in Erwägung gezogen werden. Die radiologische Differenzialdiagnose zu einem periostalen Osteosarkom ist dann nicht möglich, wenn der Mineralisationsgrad eher gering ist. In der MRT zeigt das periostale Osteosarkom zumindest fokal ein vergleichbares Bild wie ein Knorpeltumor. Wichtig ist jedoch die Abgrenzung zu einem Osteochondrom. Bei einem Osteochondrom zieht der trabekuläre Knochen ohne Unterbrechung durch die Kompakta vom Markraum in den ossären Stiel, und im Stiel sind mehr oder minder große Areale mit normalem trabekulären Knochen vorhanden. In der MRT ist im ossären Stiel Fettmark vorhanden, was beim parossalen Osteosarkom nicht der Fall ist. Diese Kriterien sind auch hilfreich, das osteochondromähnliche parossale Osteosarkom von einem Osteochondrom zu differenzieren (Abb. 5.118 a, b). Eine Myositis ossificans, die in enger Nachbarschaft zur Kompakta lokalisiert ist, kann differenzialdiagnostische Probleme bereiten. Sie sitzt jedoch meistens in Oberschenkelmitte und zeigt in der Peripherie eine stärkere Ossifikation als im Zentrum. Schwierig ist die Abgrenzung eines kleinen parossalen Osteosarkoms von einer unregelmäßigen ossären Insertion des M. gastrocnemius am distalen Femur. In diesem Fall muss mittels MRT nach einer Weichteilkomponente gefahndet werden. b Therapie und Prognose Die Diagnosesicherung erfolgt mittels Probeexzision, wobei darauf zu achten ist, dass der Zugangsweg bei der definitiven Operation mit entfernt wird, um keine Implantationsmetastasen zurückzubehalten. Vor der definitiven Operation ist ein lokales Staging mittels MRT erforderlich, da eine mögliche Markrauminvasion nachgewiesen werden muss. Bei fehlender Markrauminfiltration besteht die Therapie in einer En-bloc-Resektion des betroffenen Knochens unter Mitnahme der extraossären Komponente in ihrem anatomischen Kompartiment. Dabei muss auf eine komplette Entfernung des Tumors geachtet werden. Verbleibende Tumorzellen führen früher oder später zu einem Tumorrezidiv, das häufig nicht mehr extremitätenerhaltend operiert werden kann. Auch kann das Rezidiv einen höheren Malignitätsgrad aufweisen. Rezidive können viele Jahre nach der Primäroperation auftreten. Bei einer nachgewiesenen Markrauminvasion sind radikalere Eingriffe vergleichbar mit denen beim konventionellen Osteosarkom erforderlich. Das parossale Osteosarkom wächst langsam und metastasiert spät. Bei einer korrekten Therapie ist die Prognose wesentlich besser als beim konventionellen Osteosarkom. Die Untergruppe des dedifferenzierten parossalen Osteosarkoms weist dagegen eine schlechtere Prognose auf. 207 208 Kapitel 5 Knochentumoren Abb. 5.118 a, b. Osteochondromähnliches parossales Osteosarkom. Der Tumor imponierte histologisch primär wie ein Osteochondrom. a Im Röntgenbild kann jedoch ein Osteochondrom ausgeschlossen werden. Der Tumor zeigt ein recht charakteristisches Wachstumsmuster wie ein parossales Osteosarkom. Der Mineralisationsgrad nimmt zur Peripherie hin deutlich ab. b Im kontrastmittelverstärkten T1-gewichteten SE Bild kommt nur ein diskretes Enhancement in der Peripherie und ein deutliches im kaudalen Drittel zur Darstellung b a 5.2.2.8 Hoch malignes Oberflächenosteosarkom Definition 왔 Dieser Tumor entsteht an der Kno- chenoberfläche und ist hoch maligne. Histologisch unterscheidet sich der Tumor nicht von einem konventionellen Osteosarkom. Er verhält sich wesentlich aggressiver als ein periostales und parossales Osteosarkom. Der Tumor ist äußerst selten und macht weniger als 1% der Osteosarkome aus. Alter und Lokalisation variieren nicht wesentlich von denen des konventionellen Osteosarkoms. Die Tumoren sind allerdings fast ausschließlich diaphysär lokalisiert. Das radiologische Bild ist dem des periostalen Osteosarkoms ähnlich, wobei jedoch der Mineralisationsgrad fast immer geringer ist. Meist dominieren wenig mineralisierte extraossäre Komponenten. Häufig liegt eine Destruktion und nicht eine Verdickung der benachbarten Kompakta vor. Spikuläre, lamelläre Periostreaktionen und Codman-Dreiecke werden häufig angetroffen. Nach einer Markrauminvasion, die nicht selten eintritt, muss mittels MRT gefahndet werden. Eine differenzialdiagnostische Abgrenzung von einem periostalen Osteosarkom ist radiologisch meist nicht möglich (Abb. 5.119 a, b, Abb. 5.120). Die Tumoren werden wie konventionelle Osteosarkome behandelt, wobei die Prognose vergleichbar ist. 5.2 Knochenbildende Tumoren Abb. 5.119 a, b. Hochmalignes Oberflächenosteosarkom. a Der Tumor sitzt der Kompakta auf und zeigt deutlich ausgeprägte Matrixmineralisationen, die einer Myositis ossificans ähnlich sind, jedoch zur Peripherie an Intensität abnehmen. b Im FS kontrastmittelverstärkten T1-gewichteten SE-Bild ist ein ausgedehntes peritumorales Ödem um den nur septal kontrastmittelaufnehmenden Tumor nachweisbar a Abb. 5.120. Hochmalignes Oberflächenosteosarkom. Der Tumor sitzt der Kompakta auf und ist nur gering mineralisiert. b 5.2.2.9 Extraossäres Osteosarkom Osteosarkome der Weichteile sind sehr selten, wobei nur etwas mehr als 100 Fälle bisher publiziert worden sind. Einige sind nach einer Strahlentherapie aufgetreten. Die Klinik unterscheidet sich nicht von der von anderen malignen Weichteiltumoren. Die meisten Patienten sind älter als die mit einem konventionellen Osteosarkom. Histologisch unterscheidet sich dieser Tumor nicht von einem konventionellen Osteosarkom. Die untere Körperhälfte, besonders Gesäß und Oberschenkel, sind bevorzugt betroffen. Radiologisch stellen sie sich als Weichteiltumoren dar, die in der überwiegenden Anzahl der Fälle Matrixossifikationen aufweisen, die zentral betont sind. Der Tumor kann am besten in der MRT dargestellt werden. Er stellt sich im T1-gewichteten Bild nahezu isointens zur Muskulatur und im T2-gewichteten Bild hyperintens dar. Hämorrhagische Komponenten und signalarme Areale als Zeichen einer stärkeren Matrixossifikation können vorhanden sein. Die Abgrenzung zu einer Myositis ossificans kann schwierig sein, gelingt jedoch, wenn diese die typischen peripher betonten Verkalkungen und Ossifikationen aufweist. Bei Synovialsarkomen sind die Verkalkungen nur punktförmig und gering. Die Therapie ist vergleichbar mit der eines konventionellen Osteosarkoms. Eine Metastasierung erfolgt pulmonal und lymphogen. 209 210 Kapitel 5 Knochentumoren Literatur Aboulafia AJ, Malawer MM (1993) Surgical management of pelvic and extremity osteosarcoma. Cancer 71 S:3358–3366 Azous EM, Koslowski K, Marton CF et al. (1986) Osteoid-osteoma and osteoblastoma of the spine in children. Report of 22 cases with brief literature review. Padiat Radiol 16:25–31 Bacci G, Briccoli A, Mercuri M et al. (1998 a) Osteosarcoma of the extremities with synchronous lung metastases: longterm results in 44 patients treated with neoadjuvant chemotherapy. J Chemother 10:69–76 Bacci G, Ferrari S, Mercuri M, et al. (1998 b) Predictive factors for local recurrence in osteosarcoma: 540 patients with extremity tumors followed for minimum 2.5 years after neoadjuvant chemotherapy. Acta Orthop Scand 69:230–236 Bane BL, Evans HL, Ro JY, Carrasco CH et al. (1990) Extraskeletal osteosarcoma. A clinicopathological review of 26 cases. Cancer 65:2762–2770 Bertoni F, Present D, Hudson T, Enneking WF (1985) The meaning of radiolucencies in parosteal osteosarcoma. J Bone Joint Surg Am 67:901–910 Beyer WF, Kuhn H (1983) Can an osteoblastoma become malignant? Virchows Arch 408:297–305 Biagini R, Ruggieri P, De Cristofaro R et al. (1991) Multicentric osteosarcoma. Report of 5 cases. Chir Organi Mov 76: 113–122 Bielack S, Kempf-Bielack B, Schwenzer D et al. (1999) Neoadjuvant therapy for localized osteosarcoma of extremities. Results from the Cooperative Osteosarcoma Study Group COSS of 925 patients. Klin Padiatr 211:260–270 Bloem Jl, Kroon MK (1993) Osseous lesions. Radiol Clin North Am 31:261–278 Capanna R, Avala A, Bertoni F et al. (1986 a) Sacral osteoid osteoma and osteoblastoma: a report of 13 cases.Arch Orthop Trauma Surg 1985:347–350 Capanna R, van Horn JR, Avala A, Picci P, Bettelli G (1986 b) Osteoid osteoma and osteoblastoma of the talus.A report of 40 cases. Skeletal Radiol 15:360–364 Daffner RH, Kennedy SL, Fox KR et al. (1997) Synchronous multicentric osteosarcoma: the case for metastases. Skeletal Radiol 26:569–578 Dorfman HD,Weiss SW (1984) Borderline osteoblastic tumors: problems in the differential diagnosis of aggressive osteoblastoma and low grade osteosarcoma. Semin Pathol 1:215–234 Dubec JJ, Munk PL, O’Connell JX et al. (1997) Soft tissue osteosarcoma with telangiectatic features: MR imaging findings in two cases. Skeletal Radiol 26:732–736 Earwaker J (1993) Paranasal sinus osteomas: a review of 46 cases. Skeletal Radiol 22:417–423 Floman Y, Milgrim C, Kenan S et al. (1983) Spongious and cortical osteoblastoma of the axial skeleton. Orthopedics 8: 1478–1484 Geirnaerdt MJ, Bloem JL, van der Woude HJ et al. (1998) Chondroblastic osteosarcoma: characterisation by gadoliniumenhanced MR imaging correlated with histopathology. Skeletal Radiol 27:145–153 Gillespy T, Manfrini M, Ruggeri P et al. (1988) Staging of intraosseous extent of osteosarcoma: correlation of preoperative CT and MR imaging with pathologic macroslides. Radiology 167:765–767 Goldman AB, Schneider R, Pavlov H (1993) Osteoid osteomas of the femoral neck: report of four cases evaluated with isotopic bone scanning, CT, and MR imaging. Radiology 186:227–232 Greenspan A (1993) Benign bone-forming lesions: osteoma, osteoid osteoma, and osteoblastoma. Clinical, imaging, pathologic, and differential considerations. Skeletal Radiol 22:485–500 Greenspan A, Klein MJ (1996) Giant bone island. Skeletal Radiol 25:67–69 Greenspan A, Steiner G, Knutzon R (1991) Bone island (enostosis): clinical significance and radiologic and pathologic correlation. Skeletal Radiol 20:85–90 Griffith JF, Kumta SM, Chow LT, Leung PC, Metreweli C (1998) Intracortical osteosarcoma. Skeletal Radiol 27:228–232 Healey JH, Ghelman B (1986) Osteoid osteoma and osteoblastoma. Current concepts and recent advances. Clin Orthop 189:76–85 Herrlin K, Ekelund L, Lövdahl R, Persson B (1982) Computed tomography in suspected osteoid osteomas of tubular bones. Skeletal Radiol 9:92–97 Jelinek JS, Murphey MD, Kransdorf MJ et al. (1996) Parosteal osteosarcoma: value of MR imaging and CT in the prediction of histologic grade. Radiology 201:837–842 Kaste SC, Pratt CB, Cain AM, Jones-Wallace DJ, Rao BN (1999) Metastases detected at the time of diagnosis of primary pediatric extremity osteosarcoma at diagnosis: imaging features. Cancer 86:1602–1608 Kavanagh TG, Cannon SR, Pringle J, Stoker DJ, Kemp HB (1990) Parosteal osteosarcoma. Treatment by wide resection and prosthetic replacement. J Bone Joint Surg Br 72: 959–965 Kenan S, Floman Y, Robin CC, Laufer A (1985) Aggressive osteoblastoma: a case report and review of the literature. Clin Orthop 179:294–298 Khalfallah M, Malca S, Roche PH et al. (1997) Primary spinal osteosarcomas. Neurochirurgie 43:28–34 Kirwan EG, Hutton PA, Pozo JL, Ransford AO (1984) Osteoid osteoma and benign osteoblastoma of the spine. Clinical presentation and treatment. J Bone Joint Surg Br 66:21–26 Kransdorf MJ, Stull MA, Gilkey FW, Moser RP Jr (1991) Osteoid osteoma. Radiographics 11:671–696 Kroon HM, Schuurmans J (1990) Osteoblastoma: clinical and radiologic findings in 98 new cases. Radiology 175:783–790 Kurt AM, Unni KK, Mc Leod R, Pritchard DJ (1990) Low grade intraosseous osteosarcoma. Cancer 65:1418–1428 Kyriakos M, Gilula LA, Becich MJ, Schoenecker PL (1992) Intracortical small cell osteosarcoma. Clin Orthop 279: 269–80 Levine E, De Smet AA, Huntrakoon M (1985) Juxtacortical osteosarcoma: a radiologic and histologic spectrum. Skeletal Radiol 14:38–46 Lin J, Yao L, Mirra JM, Bahk WJ (1998) Osteochondromalike parosteal osteosarcoma: a report of six cases of a new entity. AJR Am J Roentgenol 170:1571–1577 Lindell MM Jr, Shirkhoda A, Raymond AK, Murray JA, Harle TS (1987) Parosteal osteosarcoma: radiologic-pathologic correlation with emphasis on CT. AJR Am J Roentgenol 148: 323–328 Lingg G, Roessner A, Telgmann CL et al. (1986) Zur Röntgenmorphologie und pathologischen Anatomie des Osteoblastoms. RöFo 145:49–56 Markhija MC, Stein IH (1983) Bone imaging in osteoblastoma. Clin Nucl Med 8:141–147 Masciocchi C, Fascetti E, Gallucci M et al. (1988) Osteosarcoma. A new diagnostic approach in presurgical loco-regional staging. Radiol Med 76:249–254 McLeod RH, Dahlin DC, Beabout JW (1976) The spectrum of osteoblastoma. AJR Am J Roentgenol 126: 321–335 Mervak TR, Unni KK, Pritchard DJ, McLeod RA (1991) Teleangiectatic osteosarcoma. Clin Orthop 270:135–139 Mirra JM, Gold RH, Ignatti G, Remotti F (1988) Compact osteoma of the iliac bone. Case report 497. Skeletal Radiol 17: 437–442 Müller-Miny H, Erlemann R, Wuisman P, Bosse A, Peters PE (1991) Röntgenmorphologie des parossalen Osteosarkoms (POS). Röfo 155:165–170 5.2 Knochenbildende Tumoren Mulder JD, Schütte HE, Kroon HM, Taconis WK (1993) Radiological atlas of bone tumors. Elsevier, Amsterdam Muren C, Hoglund M, Engkvist O, Juhlin L (1991) Osteoid osteomas of the hand. Report of three cases and review of the literature. Acta Radiol 32:62–66 Murphey MD, Robbin MR, McRae GA et al. (1997) From the archives of the AFIP. The many faces of osteosarcoma. Radiographics 17:1205–1231 Nakajima H, Sim FH, Bond JR, Unni KK (1997) Small cell osteosarcoma of bone. Review of 72 cases. Cancer 79:2095–2106 Norton KI, Hermann G, Abdelwahab IF et al. (1991) Epiphyseal involvement in osteosarcoma. Radiology 180:813–816 O’Flanagan SJ, Stack JP, McGee HM, Dervan P, Hurson B (1991) Imaging of intramedullary tumour spread in osteosarcoma. A comparison of techniques. J Bone Joint Surg Br 73:998–1001 Okada K, Frassica FJ, Sim FH (1994) Parosteal osteosarcoma. A clinicopathological study. J Bone Joint Surg Am 76:366–378 Olson PN, Prewitt L, Griffiths HJ, Cherkna B (1991) Case report 703: Multifocal osteosarcoma. Skeletal Radiol 20:624–627 Onikul E, Fletcher BD, Parham DM, Chen G (1996) Accuracy of MR imaging for estimating intraosseous extent of osteosarcoma. AJR Am J Roentgenol 167:1211–1215 Papanicolauo N, Treves N (1984) Bone scintigraphy in the preoperative evaluation of osteoid osteoma and osteoblastoma of the spine. Ann Radiol 27:104–110 Parlier-Cuau C, Champsaur P, Nizard R, Hamze B, Laredo JD (1998) Percutaneous removal of osteoid osteoma. Radiol Clin North Am 36:559–566 Pettine KA, Klassen RA (1986) Osteoid osteoma and osteoblastoma of the spine. J Bone Joint Surg Am 68:354–361 Peyser AB, Makley JT, Callewart CC et al. (1996) Osteoma of the long bones and the spine. A study of eleven patients and a review of the literature. J Bone Joint Surg Am 78:1172–1180 Picci P, Gherlinzoni F, Guerra A (1983) Intracortical osteosarcoma: rare entity or early manifestation of classical osteosarcoma. Skeletal Radiol 9:255–258 Pieterse AS, Vernon Roberts B, Paterson DC et al. (1983) Osteoid osteoma transforming to aggressive (low grade malignant) osteoblastoma: a case report and review of the literature. Histopathology 7:787–800 Raskas DS, Graziano GP, Herzenberg JE, Heidelberger KP, Hensinger RN (1992) Osteoid osteoma and osteoblastoma of the spine. J Spinal Disord 5:204–211 Raymond AK (1991) Surface osteosarcoma. Clin Orthop 270:140–148 Rosenberg ZS, Lev S, Schmahmann S et al. (1995) Osteosarcoma: subtle, rare, and misleading plain film features.AJR Am J Roentgenol 165:1209–1214 Sadry F, Hessler C, Garcia J (1988) The potential aggressivness of sinus osteomas. A case report of two cases. Skeletal Radiol 17:427–430 Sans N, Morera-Maupome H, Galy-Fourcade D et al. (1999) Percutaneous resection under computed tomography guidance of osteoid osteoma. Mid-term follow-up of 38 cases. J Radiol 80:457–465 Shaikh MI, Saifuddin A, Pringle J, Natali C, Sherazi Z (1999) Spinal osteoblastoma: CT and MR imaging with pathological correlation. Skeletal Radiol 28:33–40 Sordillo PP, Hajdu SI, Magill GB, Golbey RB (1983) Extraosseous osteogenic sarcoma. A review of 48 patients. Cancer 51:727–735 Unni KK, Dahlin DC, McLeod RA, Pritchard DJ (1977) Intraosseous well-differentiated osteosarcoma. Cancer 40:1337– 1347 Wioland M, Sergent-Alaoui A (1996) Didactic review of 175 radionuclide-guided excisions of osteoid osteomas. Eur J Nucl Med 23:1003–1011 Wold LE, Unni KK, Beabout JW, Pritchard DJ (1984) High grade surface osteosarcoma. Am J Surg Pathol 8:181–186 Woods ER, Martel W, Mandell SH, Crabbe JP (1993) Reaktive soft tissue mass with osteoid-osteoma: correlation of MR imaging features with pathologic findings. Radiology 186: 221–225 211