Atome und ihre Bindungen
Werbung

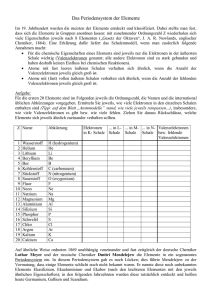
Atome und ihre Bindungen Atomaufbau • Im Atomkern befinden sich die Protonen (positiv geladen) und die Neutronen (neutral). P und N sind ungefähr gleich schwer und machen 99% der Atommasse aus. • Um den Kern kreisen die Elektronen (negativ geladen). Die Elektronen sind fast Massefrei. • Das Atom hat gleich viele Elektronen () wie Protonen (+) und ist nach aussen hin neutral. Bohrsches Atommodell • Im Bohrschen Atommodell kreisen die Elektronen (-) in Schalen mit zunehmendem Abstand um den Kern. • Die erste Schale kann 2 Elektronen aufnehmen. • Die jeweils äusserste Schale kann max. 8 Elektronen aufnehmen. • Die Elektronen in der äussersten Schale nennt man „freie Elektronen“ oder Valenzelektronen. • Weil 8 Elektronen in der äussersten Schale zu einem energetisch günstigen Zustand führt, streben die Atome diesen Zustand an. Man nennt das Edelgaskonfiguration. Atome im PSE • Im Periondensystem findet man in den Spalten der Hauptgruppen die Anzahl der Valenzelektronen. – Na – Al – Cl 1 Valenzelektron 3 Valenzelektron 7 Valenzelektron • Die Zeilen geben die Anzahl Schalen an. – O – Mg – Ti 2 Schalen 3 Schalen 4 Schalen Atome im PSE • • In den Nebengruppen werden die unteren Schalen weiter aufgefüllt, weshalb diese Atome 0, 1 oder 2 Valenzelektronen besitzen (Liste). Die Ordnungszahl gibt die totale Anzahl der Elektronen in einem Atom an. – H – F – Al • total 1 Elektron total 9 Elektronen total 13 Elektronen Die Anzahl der Valenzelektronen bestimmt das Bindungsverhalten der Atome. Atombindung • Bei der Atombindung gehen Atome zusammen, welche die äusserste Schale fast voll haben. Das sind die Nichtmetalle. • Die Atome teilen sich 1, 2 oder 3 Valenzelektronen um die Edelgaskonfiguration zu erhalten. • Dazu müssen sie nahe zusammenrücken. • Es wirken starke Bindungskräfte in der Atombindung. • Ist eines der Atome grösser, so zieht es die Valenzelektronen stärker an sich und das Molekül wirkt nach aussen hin Polarisiert (Dipol). Bsp. Wasser https://www.youtube.com/watch?v=MMZEVIrZRds Fluor gehört in die Hauptgruppe 7 und braucht nur noch 1 Valenzelektron zur Edelgaskonfiguration. Jedes Atom gibt ein Elektron zum Teilen her. Silizium brauch noch 4 Elektronen und Wasserstoff noch 1 Elektron um die Edelgaskonfiguration zu erreichen. 4 Wasserstoffatome geben je ein Elektron und Silizium jeder seiner 4 Valenzelektronen zum Teilen. Ionenbindung • Bei der Ionenbindungen gehen Atome welche wenige Valenzelektronen abgeben wollen mit Atomen zusammen, welche wenige VE aufnehmen wollen. • Das sind Nichtmetalle mit Metallen. Es entstehen Salze. • Atome die Elektronen abgeben, nennt man Kationen (+) und Atome die Elektronen aufnehmen, nennt man Anionen (-). • Positive und Negative Ladungen ziehen sich in alle Richtungen an. Daher folgt die Anordnung der Atome im Kristall. https://www.youtube.com/watch?v=AW5WkC0yx6E Metallbindung • Bei der Metallbindung gehen Atome aus der Metallgruppe unter sich zusammen. • Metallatome haben wenige Valenzelektronen und möchten diese gerne abgeben. • • Bei der Metallbindung haben die Metallkationen ihre Valenzelektronen abgegeben. Diese können sich frei in einem Elektronengas um die Kationen herum bewegen. Das Elektronengas (-) hält die Kationen (+) zusammen in einer Gitteranordnung. https://www.youtube.com/watch?v=C1PluI74Um4 Metallcharakter • • • Charakteristische Eigenschaften der Metallen sind die elektrische Leitfähigkeit, die mit steigender Temperatur abnimmt, der metallische Glanz (normalerweise silberweiß), die Formbarkeit (Duktilität), sie sind wenig flüchtig (teils hohe Schmelz- und Siedepunkte)und wärmeleitend. Als chemische Eigenschaft sei ihr elektropositiver Charakter anzuführen. Diese Charakteristischen Eigenschaften der Metalle sind durch die besondere Beweglichkeit der Valenzelektronen in der Metallbindung zu erklären. Je lieber ein Element seine Valenzelektronen abgibt, umso stärker ist sein metallischer Charakter ausgeprägt. Metallcharakter • • • Der Metallcharakter nimmt von links nach rechts ab, weil mit zunehmender Anzahl Elektronen die Kernladung und somit die Kernanziehungskraft steigt. Zudem geben die Atome ihre Valenzelektronen weniger gern ab, je mehr sie davon haben. Der Metallcharakter nimmt nach unten hin zu, weil mit zunehmender Anzahl Schalen die Valenzelektronen durch den zunehmenden Atomradius weniger stark durch Anziehungskräfte des Kerns gebunden sind. Die starke Oxidierbarkeit der Metalle lässt sich ebenfalls durch die freie Beweglichkeit der Valenzelektronen erklären. Metalle wirken Elektronenabgebend und der Sauerstoff nimmt Elektronen auf und bindet sich so an die Oberfläche der Metallschicht.