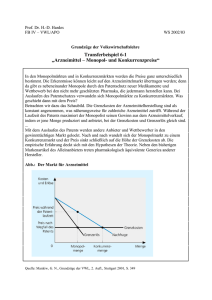
Bull. Arzneimittelsich. 2012 - Paul-Ehrlich
Werbung

BULLETIN ZUR ARZNEIMITTELSICHERHEIT Informationen aus BfArM und PEI INHALT Ausgabe 1 | März 2012 Asthmatherapie mit Montelukast: Diskussion zu psychiatrischen Nebenwirkungen ARZNEIMITTEL IM BLICK 03 Hepatotoxische Reaktionen im Zusammenhang mit der Anwendung von Pelargonium-haltigen Arzneimitteln06 Langzeitdaten zur Sicherheit Somatropin-haltiger Arzneimittel – die SAGhE-Studie08 Ausflockungen in Adsorbatimpfstoffen12 PHARMAKOVIGILANZ TRANSPARENT Daten zur Pharmakovigilanz von Impfstoffen aus dem Jahr 200917 Risikomanagement-System – ein proaktives Instrument der Pharmakovigilanz 25 FORSCHUNG Fettgewebsforschung für eine verbesserte Diabetesbehandlung30 NEUES IN KÜRZE Meldungen aus BfArM und PEI 34 Hinweise auf Rote-Hand-Briefe und Sicherheitsinformationen 36 AKTUELLE RISIKOINFORMATIONEN Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) Das BfArM überprüft die Qualität, Wirksamkeit und Unbedenklichkeit von Arzneimitteln in der Anwendung beim Menschen. Es reguliert die klinische Prüfung, die Zulassung und Registrierung von Arzneimitteln sowie deren Sicherheit nach der Zulassung. Zu dem Verantwortungsbereich gehören ferner der Betäubungsmittel- und Grundstoffverkehr sowie die Genehmigung klinischer Prüfungen von Medizinprodukten und die Erfassung und Bewertung von Risiken bei ihrer Anwendung. Paul-Ehrlich-Institut (PEI) Das Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel überprüft die Qualität, Wirksamkeit und Unbedenklichkeit von Human- und Veterinärimpfstoffen sowie von anderen biomedizinischen Arzneimitteln für den Menschen. Zu den Aufgaben gehören die Genehmigung klinischer Prüfungen, Zulassung, staatliche Chargenprüfung sowie die Bewertung der Sicherheit biomedizinischer Arzneimittel. ZIEL Das vierteljährlich erscheinende Bulletin zur Arzneimittelsicherheit informiert aus beiden Bundesoberbehörden zu aktuellen Aspekten der Risikobewertung von Arzneimitteln. Ziel ist es, die Kommunikation möglicher Risiken von Arzneimitteln zu verbessern und die Bedeutung der Überwachung vor und nach der Zulassung (Pharmakovigilanz) in den Blickpunkt zu rücken. MELDUNG VON VERDACHTSFÄLLEN Das Meldesystem von Verdachtsfällen von Nebenwirkungen ist eines der wichtigsten Früherkennungssysteme im Bereich der Arzneimittelsicherheit nach der Zulassung. Daher ist das Melden von Nebenwirkungen im klinischen Alltag ein wichtiger Beitrag für die Sicherheit von Arzneimitteln. Beide Behörden rufen alle Angehörigen von Heilberufen nachdrücklich dazu auf, Verdachtsfälle auf Arzneimittelnebenwirkungen bzw. Impfkomplikationen nach der Zulassung zu melden. Weitere Informationen unter www.bfarm.de und www.pei.de. IMPRESSUM HERAUSGEBER Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM, Bonn) und Paul-Ehrlich-Institut (PEI, Langen) Beide Institute sind Bundesoberbehörden im Geschäftsbereich des Bundesministeriums für Gesundheit. REDAKTION Dr. Christian Behles, BfArM Tel.: +49-(0)228-99-307-3278 E-Mail: [email protected] Dr. Walburga Lütkehermölle, Pharmakovigilanz BfArM Dr. Corinna Volz-Zang, Pressestelle PEI Tel.: +49-(0)6103-77-1093 E-Mail: [email protected] Dr. Karin Weisser, Pharmakovigilanz PEI LAYOUT FOCON GmbH 52062 Aachen DRUCK Druckerei Eberwein oHG 53343 Wachtberg-Villip VERTRIEB UND ABONNENTENSERVICE Das Bulletin zur Arzneimittelsicherheit erscheint viermal jährlich als Print- und PDF-Version. Die Printversion kann bestellt oder abonniert werden bei: Pressestelle BfArM Tel.: +49-(0)228-99-307-3256 Fax: +49-(0)228-99-307-3195 E-Mail: [email protected] Die PDF-Version kann auf der Homepage beider Institute abgerufen (http://www.bfarm.de/DE/ Arzneimittel/Pharmakovigilanz/Bulletin/_node.html und www.pei.de/bulletin-sicherheit) oder unter [email protected] abonniert werden. ISSN (Print) 2190-0779 ISSN (Internet) 2190-0787 NACHDRUCK mit Quellenangabe gestattet, jedoch nicht zu werblichen Zwecken. Belegexemplar erbeten. AUFFORDERUNG ZUR MELDUNG VON VERDACHTSFÄLLEN UNERWÜNSCHTER ARZNEIMITTELWIRKUNGEN ODER IMPFKOMPLIKATIONEN Das Spontanmeldesystem ist eines der wichtigsten Instrumente bei der Früherkennung von Verdachtsfällen von Nebenwirkungen im Bereich der Arzneimittelsicherheit nach der Zulassung. Es kann wertvolle Hinweise (Signale) auf seltene, bislang unbekannte Nebenwirkungen, auf eine Erhöhung der Häufigkeit von bekannten Nebenwirkungen, auf durch Qualitätsmängel hervorgerufene Häufungen bestimmter Nebenwirkungen oder auf Veränderungen der Art oder Schwere bekannter Nebenwirkungen geben. Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und das PaulEhrlich-Institut (PEI) möchten alle Angehörigen von Heilberufen auffordern, Verdachts­fälle von unerwünschten Arzneimittelwirkungen oder Impfkomplikationen zu melden, wobei die Zuständigkeiten und damit die Adressaten solcher Meldungen nach dem Arzneimittelgesetz unterschiedlich verteilt sind: Das Paul-Ehrlich-Institut ist im Bereich der Human-Arzneimittel zuständig für Impfstoffe, Sera (einschließlich monoklonaler Antikörper, Antikörperfragmente oder Fusionsproteine mit einem funktionellen Antikörperbestandteil), Blut-, Knochenmarkund Gewebezubereitungen, Allergene, Arzneimittel für neuartige Therapien und gentechnisch hergestellte Blutbestandteile. Für alle anderen Arzneimittel ist das BfArM zuständig. Beide Bundesoberbehörden haben nach der Feststellung von medizinisch nicht vertretbaren Risiken u. a. die Möglichkeit, durch behördlich angeordnete Anwendungsbeschränkungen – ggf. bis zum Widerruf einer bereits erteilten Arzneimittelzulassung – den sicheren Umgang mit Arzneimitteln zu unterstützen. Das BfArM und das PEI arbeiten dabei mit den entsprechenden Behörden der anderen EU-Mitgliedstaaten sowie mit der Europäischen Arzneimittelagentur (EMA) zusammen. Die Meldung von Verdachtsfällen ist also im Sinne des Verbraucherschutzes unverzichtbar. Angehörige der Heilberufe haben berufsrechtliche Verpflichtungen zur Meldung von Nebenwirkungen an die Arzneimittelkommission der jeweiligen Standesorganisationen (Arzneimittelkommission der deutschen Ärzteschaft – AkdÄ: www.akdae.de, Arzneimittelkommission Zahnärzte – AKZ: www.bzaek.de bzw. Arzneimittelkommis­ sion der Deutschen Apotheker – AMK: www.abda-amk.de). Darüber hinaus ist die Meldung von Verdachtsfällen von Impfkomplikationen (Verdacht einer über das übliche Ausmaß einer Impfreaktion hinausgehenden gesundheitlichen Schädigung) im Infektionsschutzgesetz vorgeschrieben (IfSG). Die namentliche Meldung durch einen Arzt ist hierbei an das Gesundheitsamt zu richten, das wiederum den gemeldeten Verdacht einer Impfkomplikation der zuständigen Landesbehörde und dem Paul-Ehrlich-Institut zuleitet. Meldepflichten im Zusammenhang mit unerwünschten Reaktionen oder Nebenwirkungen nach Anwendung von Blutprodukten und gentechnisch hergestellten Plasmaproteinen sind im Transfusionsgesetz geregelt. MELDUNG EINES VERDACHTSFALLES Die Verwendung der neutralen Begriffe „Patient“, „Arzt“ etc. umfasst grundsätzlich weibliche und männliche Personen. Die zu einzelnen Wirkstoffen genannten Präparate stellen aufgrund des Umfangs zugelassener Arzneimittel teilweise nur eine Auswahl dar, der keine Bewertung zugrunde liegt. Via Internet: Seit April 2009 haben BfArM und PEI ein gemeinsames OnlineErfassungssystem. Die Eingabemaske ist über https://humanweb.pei.de erreichbar. Schriftlich: Es ist jederzeit möglich, Verdachtsfälle per Brief oder Fax zu senden. Dafür stehen bei beiden Behörden Meldeformulare im PDF-Format bereit: www.bfarm.de/UAW-Meldebogen www.pei.de/meldeformulare-human // ARZNEIMITTEL IM BLICK // 03 // Asthmatherapie mit Montelukast: Diskussion zu psychiatrischen Nebenwirkungen // A. BLUMBERG (BfArM) Der Wirkstoff Montelukast wird zur Asthmatherapie eingesetzt und ist zur Anwendung ab dem sechsten Lebensmonat zugelassen. Psychiatrische Nebenwirkungen sind seit Längerem bekannt und in den Produktinformationen angegeben. Seit zwei bis drei Jahren stehen insbesondere das Risiko für derartige Nebenwirkungen bei Kindern und Jugendlichen sowie Daten zur Suizidalität im Fokus der Diskussion. MARKTÜBERSICHT UND BISHERIGE DISKUSSION Montelukast ist zur (Zusatz-)Therapie bei leichtem bis mittelgradigem Asthma indiziert. Die Substanz gehört zur Gruppe der Leukotrien-Rezeptorantagonisten. Montelukast bindet mit hoher Affinität und Selektivität an den Cysteinyl-Leukotrien-Typ-1-Rezeptor (CysLT1) und beeinflusst Leukotrien-vermittelte Wirkungen wie die Verengung der Bronchien, die Schleimsekretion, die Gefäßpermeabilität und die Anreicherung von eosinophilen Granulozyten. Der Wirkstoff wurde in Deutschland erstmals 1998 zugelassen. In Deutschland gibt es 144 Zulassungen von insgesamt 37 pharmazeutischen Unternehmern (Stand Februar 2012). Den höchsten Bekanntheitsgrad dürften die Präparate des Originators MSD haben, die unter dem Namen Singulair® vermarktet werden. 2010 wurden in Deutschland ca. 30,6 Millionen Tagesdosen Singulair® verordnet.1 Zum Vergleich: Für Budesonid, dem in Deutschland am häufigsten angewendeten inhalativen Kortikoid, lagen die Verordnungszahlen im gleichen Jahr bei 133,7 Millionen Tagesdosen. In den letzten Jahren gab es wiederholt Diskussionen um neuropsychiatrische Nebenwirkungen unter der Therapie mit Montelukast. In den Zulassungsstudien waren diesbezüglich nur Schwindel und Schlaflosigkeit aufgefallen. Nach Markteinführung zeigten sich relativ schnell weitere unerwünschte Effekte wie verändertes Träumen, Benommenheit sowie Ruhelosigkeit und Reizbarkeit. Im Jahr 2008 hatte die FDA Studiendaten zum Risiko neuropsychiatrischer Effekte, insbesondere Daten zu Suizidgedanken/-versuchen, gefordert. Nach Auswertung der Daten wurden 2009 die Produktinformationen in den USA überarbeitet.2 In der EU waren die psychiatrischen Nebenwirkungen zu diesem Zeitpunkt bereits aufgeführt. DATENLAGE IN DEUTSCHLAND In der Datenbank des BfArM zu unerwünschten Arzneimittelwirkungen liegen aus Deutschland insgesamt 309 Berichte zu Montelukast vor, in denen 1.005 Reaktionen gemeldet wurden (Stand 30.01.2012). 89 Berichte (190 Reaktionen) davon betreffen psychiatrische Nebenwirkungen. Einen Überblick über die am häufigsten berichteten psychiatrischen Nebenwirkungen gibt die Tabelle auf der folgenden Seite. Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 04 Tabelle: Die am häufigsten gemeldeten psychiatrischen Nebenwirkungen in Deutschland unter Montelukasttherapie (Symptomnennung in vier oder mehr Berichten) Nebenwirkung Anzahl der Meldungen Aggressionen 18 Unruhe 14 Albträume 11 Schlafstörungen 10 Halluzinationen 8 Depressionen 7 Suizidgedanken 7 Erregung 6 Aufmerksamkeitsstörungen 5 Schreien 5 Reizbarkeit 5 Schlaflosigkeit 4 Selbsttötungsversuch 4 AKTUELLE DISKUSSION UND AUSBLICK Die Diskussion in der EU fokussiert sich derzeit insbesondere auf zwei Fragen: • Haben Kinder und Jugendliche ein besonderes Risiko für psychiatrische Nebenwirkungen? • Welche Daten zu Suizidalität unter Montelukasttherapie gibt es und wie kann die Datenlage verbessert werden? Psychiatrische Reaktionen werden besonders häufig bei Kindern und Jugendlichen gemeldet, ohne dass dies durch ein erhöhtes Verordnungsvolumen in dieser Altersgruppe erklärt werden kann. Besonders viele Berichte liegen aus den USA vor. Auch in Schweden ist die Zahl auffällig hoch. In Deutschland betreffen 49 der 89 o.g. Berichte Kinder und Jugendliche bis zum 15. Lebensjahr. Prinzipielle Unterschiede hinsichtlich der Art der gemeldeten Reaktionen bei Kindern und Jugendlichen und bei Erwachsenen bestehen nicht. Bei der Bewertung dieser Daten ist zu beachten, dass aus den Spontanberichtszahlen keine Häufigkeiten errechnet werden können und dass ein Berichtsbias vermutet wird (höhere Meldebereitschaft von Nebenwirkungen bei Kindern). 05 Eine Häufung psychiatrischer Nebenwirkungen im Kindesalter konnte nach Durchführung verschiedener statistischer Analysen allerdings nicht belegt werden, auch in klinischen Studien gab es hierfür keinen Anhalt. Umfassende Diskussionen in der Pharmakovigilanz-Arbeitsgruppe (PhVWP) des Ausschusses für Humanarzneimittel (CHMP) führten zu der Schlussfolgerung, dass derzeit ein erhöhtes Risiko für psychiatrische Nebenwirkungen im Kindes- und Jugendalter nicht eindeutig belegt ist. Allerdings ist diese Frage weiterhin Gegenstand intensiver Beobachtungen. Der Originator ist außerdem aufgefordert, weitere Daten zur Anwendung im Kindesalter vorzulegen.3 Um das Risiko für suizidale Handlungen unter Montelukast besser beurteilen zu können, wurde in der PhVWP die Durchführung einer prospektiven Kohortenstudie oder einer pharmakoepidemiologischen Studie erwogen. Beide Optionen wurden wegen der schwierigen Durchführbarkeit und der zu erwartenden geringen beziehungsweise fraglichen Datenqualität verworfen. Aussagekräftigere Daten zu dieser Problematik erhofft man sich längerfristig aus dem sogenannten STOP-Projekt (Suicidality: Treatment Occuring in Paediatrics). Dieses wurde von Experten im Rahmen des European Child and Adolescent Paediatric Network (ECAPN) initiiert.4 Ziel des Projektes ist die Entwicklung einer webbasierten Methodik zum Monitoring und zur Bewertung der Suizidalität bei Kindern und Jugendlichen. Die Methode soll bei pädiatrischen Patienten erprobt werden, die entweder atypische Antipsychotika, Fluoxetin oder Montelukast erhalten. FAZIT Signale aus Nebenwirkungsberichten bezüglich eines erhöhten Risikos für psychiatrische Nebenwirkungen bei Kindern und Jugendlichen unter Behandlung mit Montelukast können derzeit nicht eindeutig belegt werden. Die EMA und die nationalen Arzneimittelagenturen der EU beobachten und bewerten Daten zu dieser Thematik weiterhin intensiv. Weiterführende Erkenntnisse zur Suizidalität unter Montelukasttherapie werden aus dem STOP-Projekt erwartet. REFERENZEN 1. Lemmer B: Bronchospasmolytika und Antiasthmatika. In: Schwabe U, Paffrath D (Hrsg.): ArzneiverordnungsReport 2011. Springer, Berlin 2011 2. Food & Drug Administration (FDA): Drug Safety Information – Leukotriene Inhibitors: Montelukast (marketed as Singulair), Zafirlukast (marketed as Accolate), and Zileuton (marketed as Zyflo and Zyflo CR). 12.06.2009 (aktualisiert 28.08.2009) 3. Pharmacovigilance Working Party (PhVWP): EMA/CHMP/PhVWP/132783/2011, 24 February 2011 (www.ema.europa.eu/docs/en_GB/ document_library/Report/2011/02/ WC500102322.pdf) 4. STOP Suicidality: Treatment Occuring in Paediatrics. www.stop-study.com Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 06 // Hepatotoxische Reaktionen im Zusammenhang mit der Anwendung von Pelargonium-haltigen Arzneimitteln // A. FRIEMEL Aufgrund des Anstiegs von Verdachtsmeldungen von leberspezifischen unerwünschten Arzneimittelwirkungen (UAW) im Zusammenhang mit der Anwendung von Pelargoniumhaltigen Arzneimitteln zur Behandlung der akuten Bronchitis leitete das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) im Oktober 2011 ein Stufenplanverfahren der Stufe I mit dem Ziel des Informationsaustausches mit den pharmazeutischen Unternehmern ein. Derzeit prüft das BfArM adäquate Maßnahmen zur Risikominimierung. B. SACHS (BfArM) Arzneimittel, die Wurzelextrakte aus der südafrikanischen Kapland-Pelargonie – Pelargonium sidoides – enthalten (z.B. Umckaloabo®), befinden sich seit über 40 Jahren in Deutschland im Verkehr und sind hier zur Behandlung der akuten Bronchitits für Kinder ab einem Jahr und Erwachsene zugelassen.1 Die Behandlungsdauer ist auf maximal drei Wochen beschränkt. Als Wirkmechanismus werden immunmodulierende, antibakterielle, antivirale sowie mukolytische Wirkungen diskutiert.2,3 Die Verkaufszahlen sind mit ca. 32 Millionen verkauften Tagesdosen jährlich sehr hoch.4 In den klinischen Studien und Anwendungsbeobachtungen mit Pelargonium-haltigen Arzneimitteln wurden gelegentlich Erhöhungen der Leberenzyme beobachtet; schwerwiegendere Fälle von Leberschädigungen traten in den klinischen Alter / Geschlecht Anwendungsdauer Zeit bis zum Auftreten der UAW Histologischer Befund 54 Jahre / männlich 16 Tage 3 Wochen akute Hepatitis mit sog. Mottenfraß-Nekrosen, Ursache am ehesten toxische Störung 55 Jahre / männlich 2 Tage 2 Tage möglicherweise medikamentös induzierte Hepatitis mit Granulombildung 40 Jahre / männlich ca. 2–3 Wochen 3–4 Wochen medikamentös bedingte Hepatitis mit kanalikulärer Cholestase ohne Nekrosen 46 Jahre / weiblich 6 Tage 8 Tage Hepatitis mit Cholestase und Nekrose 64 Jahre / männlich – – Hepatitis mit schwerer entzündlicher Aktivität mit beginnender Fibrose, Nekrosen, hepatozellulärer und kanalikulärer Cholestase (medikamentös-toxischer Leberparenchymschaden) 46 Jahre / männlich – – portal akzentuierte Hepatitis mit geringer Steatose, sehr geringer Cholestase sowie geringer Portalfibrose Tabelle: Biopsieergebnisse zu Verdachtsmeldungen von Hepatitiden im Zusammenhang mit der Anwendung von Pelargonium-haltigen Arzneimitteln, bei denen der Kausalzusammenhang als möglich oder wahrscheinlich bewertet wurde 07 Studien nicht auf. Erhöhungen der Leberwerte sind daher als gelegentlich auftretende Nebenwirkungen in der Fach- und Gebrauchsinformation aufgeführt. Des Weiteren ist die Anwendung bei Patienten mit schweren Lebererkrankungen kontraindiziert.5 Den ersten Spontanbericht einer leberspezifischen UAW im Zusammenhang mit der Anwendung von Pelargonium-haltigen Arzneimitteln erhielt das BfArM im Jahr 2004. Im Januar 2012 lagen dem BfArM insgesamt 30 Fallberichte zu leberspezifischen UAW vor. Zusätzlich zu Erhöhungen der Leberenzyme wurden die folgenden Symptome/Diagnosen berichtet: Hepatitiden (elf Fälle), Ikterus (acht Fälle) und Leberschädigungen (drei Fälle). Bei einer Patientin war eine Lebertransplantation erforderlich. Für sechs Fälle von Hepatitiden, bei denen der Kausalzusammenhang mit Pelargonium als möglich oder wahrscheinlich bewertet wurde, zeigten die verfügbaren Biopsieergebnisse kein durchgehend homogenes Bild (siehe Tabelle). In der Mehrheit der Fallberichte zu leberspezifischen UAW kamen Komedikationen zum Einsatz, die ihrerseits hepatotoxische Reaktionen auslösen können (Paracetamol, Ibuprofen, ASS u.a.), was die Beurteilung des Kausalzusammenhanges erschwert. Eine weitere Problematik bei der Beurteilung der Ätiologie von Leberschädigungen ist die multifaktorielle Genese. Neben der medikamentös-toxischen Schädigung können virale Infektionen, autoimmunologische Reaktionen und bestimmte Systemerkrankungen (Hämochromatose, Morbus Wilson u.a.) zum Krankheitsbild einer Hepatitis führen. Wichtig für die Diagnose einer arzneimittelbedingten Leberschädigung ist daher insbesondere der zeitliche Zusammenhang zwischen der Einnahme des Arzneimittels und dem Auftreten der Symptome sowie dem Rückgang der Symptomatik nach Absetzen des Medikaments. Zudem sollten andere erkennbare Ursachen ausgeschlossen werden, weshalb eine gute Qualität der Falldokumentation bei Leberschädigungen besonders wichtig ist. FAZIT Auf Grundlage der verfügbaren Daten muss der Zusammenhang zwischen der Einnahme Pelargonium-haltiger Arzneimittel und dem Auftreten von Leberschäden, Hepatitiden und Ikterus zumindest als möglich eingestuft werden, in Einzelfällen wurde der Kausalzusammenhang als wahrscheinlich bewertet. REFERENZEN 1. AMIS-Datenbank (Arzneimittelinformationssystem des Bundes), Abfrage am 14.02.2012 2. de Boer HJ et al.: Allergic reactions derived from Pelargonium species. Drug Saf. 2007;30:667-680 3. Timmer A et al.: Pelargonium sidoides extract for acute respiratory tract infections. Cochrane Database Syst Rev. 2008;3:CD006323 4. Uhl D: Umckaloabo® mit lebertoxischem Potenzial? DAZ. 2011;29:52 5. ISO-Arzneimittel: Fachinformation Umckaloabo. Stand März 2010 Bei Pelargonium-haltigen Arzneimitteln handelt es sich um rezeptfreie Arzneimittel, welche vor allem im Rahmen der Selbstmedikation eingesetzt werden. Es ist somit zu vermuten, dass die tatsächliche Anzahl der Nebenwirkungen höher ist. Daher ruft das BfArM Ärzte und Apotheker dazu auf, Verdachtsfälle von leberspezifischen UAW im Zusammenhang mit der Anwendung von Pelargonium-haltigen Arzneimitteln zu melden. Hierdurch soll die Datenlage zum hepatotoxischen Risiko von Pelargonium verbessert werden. Dabei sind gut dokumentierte Fälle einschließlich serologischer, sonografischer und histologischer Untersuchungsergebnisse besonders hilfreich. In Zusammenarbeit mit der europäischen Pharmakovigilanz-Arbeitsgruppe (PhVWP) und dem Ausschuss für pflanzliche Arzneimittel (HMPC) der Europäischen Arzneimittelagentur stimmt das BfArM derzeit Maßnahmen zur Minimierung des hepatotoxischen Risikos von Pelargonium ab. Das BfArM wird in einer der zukünftigen Ausgaben des Bulletins zur Arzneimittelsicherheit über diese Maßnahmen informieren. Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 08 // Langzeitdaten zur Sicherheit Somatropin-haltiger Arzneimittel – die SAGhE-Studie // V. STRASSMANN H. HILLEN M. WEISE (BfArM) Somatropin wird als wachstumsförderndes Hormon zur Behandlung von mit Wachstumshormonmangel und Kleinwuchs einhergehenden Erkrankungen angewendet. Die europaweit durchgeführte SAGhE-Studie (Safety and Appropriateness of Growth hormone treatments in Europe) untersucht zurzeit die Langzeitwirkungen einer Behandlung mit Wachstumshormon in der Kindheit. Im Dezember 2010 wurden erste Ergebnisse des französischen Teils der Studie veröffentlicht. Diese weisen auf eine erhöhte Gesamtmortalität bei mit Somatropin behandelten Patienten im Vergleich zur Normalbevölkerung hin. Daraufhin wurde ein europäisches Risikobewertungsverfahren für Somatropin-haltige Arzneimittel gestartet. Im Dezember 2011 wurde das Verfahren mit dem Ergebnis abgeschlossen, dass das Nutzen-Risiko-Verhältnis Somatropin-haltiger Arzneimittel als weiterhin positiv anzusehen ist. HINTERGRUND Somatropin ist ein Hormon mit wachstumsfördernder Wirkung, das in der rekombinant hergestellten Form analog zum im Hypophysenvorderlappen freigesetzten humanen Wachstumshormon seit den 1980-er Jahren in der Europäischen Union (EU) verfügbar ist. Somatropin fördert das Wachstum bei Kindern und Jugendlichen und hat außerdem Einfluss auf den Protein-, Fett- und Kohlenhydratstoffwechsel des Körpers. Es wird zur Behandlung verschiedener mit verzögertem Wachstum und Kleinwuchs einhergehender Erkrankungen angewendet. Die zugelassenen Anwendungsgebiete variieren zwischen einzelnen Somatropin-haltigen Produkten und umfassen die Behandlung von Wachstumsstörungen bei Kindern und Jugendlichen mit Wachstumshormonmangel, Turner-Syndrom oder Prader-Willi-Syndrom, die Behandlung von Kindern mit Wachstumsstörungen durch chronische Niereninsuffizienz sowie die Behandlung von Kindern mit Kleinwuchs als Folge einer intrauterinen Wachstumsverzögerung (SGA=small for gestational age) sowie die Substitution bei Erwachsenen mit endogenem Wachstumshormonmangel. SICHERHEITSDATEN NACH DER ZULASSUNG – REGISTER UND KOHORTENSTUDIEN Somatropin-haltige Arzneimittel könnten wegen ihrer wachstumsfördernden Eigenschaften eine Bedeutung für die Pathogenese und Progression von Krebserkrankungen haben.1, 2 Daher gibt es Bedenken, dass eine Therapie mit Wachstumshormon mit einem höheren Risiko von Tumorrezidiven oder der Entstehung neuer Neoplasien beziehungsweise eines schnelleren Wachstums vorbestehender Tumoren assoziiert sein könnte. Mehrere Kohortenstudien untersuchten die Langzeiteffekte einer Somatropinbehandlung bei Patienten, die in der Kindheit eine Krebserkrankung hatten. Die Ergebnisse dieser Studien sind jedoch nicht einheitlich und werden kontrovers diskutiert. Weiterhin wird die Interpretation dieser Studien durch zahlreiche methodische Probleme, wie zum Beispiel fehlende Kontrollgruppen und eine niedrige Ereignisrate bei langer Beobachtungszeit, erschwert.3–6 Die aktuellen Fachinformationen Somatropin-haltiger Arzneimittel enthalten den Hinweis, dass Somatropin nicht angewendet werden darf, wenn Anzeichen einer Tumoraktivität vorliegen. Weiterhin wird darauf hingewiesen, dass intrakranielle Tumore inaktiv und Tumorbehandlungen abgeschlossen sein müssen, bevor eine Therapie mit Wachstumshormonen begonnen werden darf. Patienten mit vollständiger Remission nach einer malignen Erkrankung sollen auf das Auftreten von Rezidiven hin überwacht werden. Zur Sicherheit rekombinant 09 Tabelle 1: Standardisiertes Mortalitätsverhältnis (SMR) nach ICD-9-Schlüssel und Todesursachen (Auswahl) im französischen Teil der SAGhE-Studie (entnommen aus Carel JC et al.11) hergestellter Somatropin-haltiger Arzneimittel wurden Daten nach der Zulassung in verbeobachtete erwartete ICD-9-Kategorie SMR 95 % CI schiedenen herstellerinitiierten Todesfälle Todesfälle Registern gesammelt und ausNeubildungen 7 6,89 2,86 0,57 –8,35 gewertet.7–10 Aus den Analysen • bösartige Neubildungen des lymphatischen dieser Registerdaten ergeben 2 1,36 1,47 0,17 –5,31 und hämatopoetischen Gewebes sich bisher keine schwerwie• bösartige Neubildung der Knochen und genden Sicherheitsbedenken 3 0,6 5,0 1,01 –14,61 Gelenkknorpel zur Somatropintherapie. Die • andere Neubildungen 2 4,93 0,41 0,05 –1,46 Register sind jedoch überwieKrankheiten des Kreislaufsystems 9 2,93 3,07 1,40 –5,83 gend so konzipiert, dass nach • andere Krankheiten des Kreislaufsystems 1 0,66 1,53 0,02 –8,49 Beendigung einer Therapie mit • andere Herzerkrankungen 4 1,19 3,37 0,91 –8,64 Somatropin eine Nachbeobach2 0,28 7,11 0,80 –25,67 tung nur über einen begrenzten ÿ davon Kardiomyopathie und Kardiomegalie Zeitraum erfolgt. Zusätzlich Krankheiten des zerebrovaskulären Systems 4 0,76 5,29 1,42 –13,55 beruht die Sammlung von • subarachnoidale Blutungen, intrazerebrale Daten zu unerwünschten Blutungen und andere nicht traumatische 4 0,6 6,66 1,79 –17,05 Arzneimittelwirkungen (UAW) intrakraniale Blutungen auf Spontanmeldungen der Endokrinopathien, Ernährungs- und Stoffwechsel2 0,31 6,50 0,73 –23,46 teilnehmenden Ärzte und nicht krankheiten sowie Störungen des Immunsystems auf systematischen ErhebunKrankheiten des Blutes und der blutbildenden Organe 1 0,88 1,13 0,01 –6,30 gen. Die Register schließen psychiatrische Krankheiten 1 1,32 0,75 0,01 –4,20 lediglich behandelte Patienten Krankheiten des Nervensystems und der Sinnesorgane 3 2,71 1,11 0,22 –3,24 ein. Daher ist bei der DatenKrankheiten der Atmungsorgane 2 1,08 1,85 0,21 –6,66 auswertung eine sorgfältige Abwägung notwendig, ob und welche Daten als Grundlage für Vergleiche verwendet werden können. Insbesondere Fragen zur Langzeitsicherheit nach Beendigung einer Somatropintherapie können mit den in diesen Registern gesammelten Daten nur begrenzt beantwortet werden. DIE SAGHE-STUDIE Die SAGhE-Studie (Safety and Appropriateness of Growth hormone treatments in Europe) ist ein von der Europäischen Kommission im Rahmen des 7. Rahmenprogramms für Forschung und technologische Entwicklung gefördertes Projekt. Die in acht verschiedenen EU-Ländern durchgeführte Studie untersucht die Auswirkungen einer Therapie mit Wachstumshormon im Kindesalter auf die Gesundheit und Lebenssituation der Behandelten im Erwachsenenalter. Diese Studie ist geeignet, mehr Daten zu den Langzeitwirkungen einer Somatropintherapie zu erheben, insbesondere über die Wirkungen nach Beendigung der eigentlichen Somatropinbehandlung. Darüber hinaus wird die Studie durch die hohe Anzahl eingeschlossener Behandelter (etwa 30.000 Patienten) auch Erkenntnisse zum Auftreten seltener Nebenwirkungen liefern können. Erste Ergebnisse des französischen Teils der Studie wurden 2010 vorgelegt und veranlassten den Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) dazu, ein Risikobewertungsverfahren für Somatropin-haltige Arzneimittel einzuleiten. Die Ergebnisse des französischen Teils der Studie sind im Januar 2012 gemeinsam mit vorläufigen Daten aus Belgien, Schweden und den Niederlanden publiziert worden.11,12 Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 10 Tabelle 2: Aufgetretene Todesfälle im Rahmen der SAGhE-Studie in Belgien, Schweden und den Niederlanden (entnommen aus Sävendahl L et al.12) IGDH: isolated GH deficiency (isolierter Wachstumshormonmangel) SGA: small for gestational age; ISS: idiopatic short stature (idiopathischer Kleinwuchs) Land Diagnose Todesursache Belgien IGHD Verkehrsunfall Belgien IGHD Mord Belgien IGHD Verkehrsunfall Niederlande IGHD Lungenentzündung Niederlande SGA Verkehrsunfall Schweden IGHD Selbstmord Schweden IGHD andere endokrine Dysfunktion Schweden IGHD primäre Kardiomyopathie Schweden IGHD Verkehrsunfall Schweden IGHD Vergiftung Schweden IGHD Vergiftung Schweden IGHD Vergiftung Schweden IGHD Selbstmord Schweden IGHD humorale Immunschwäche Schweden IGHD Unfall Schweden ISS Gerinnungsstörung Schweden ISS Unfall SAGHE-DATEN AUS FRANKREICH Der in Frankreich durchgeführte Teil der Studie stützt sich auf die Daten eines in Frankreich verpflichtenden nationalen Registers (Association France Hypophyse), aus dem 6.928 Patienten, die zwischen 1985 und 1996 mit rekombinant hergestelltem Somatropin behandelt worden waren, in die Studie eingeschlossen werden konnten. Die Studie berücksichtigt nur Patienten, für die das Mortalitätsrisiko als gering eingestuft worden war: idiopathischer isolierter Wachstumshormonmangel, idiopathischer Kleinwuchs, Kleinwuchs als Folge einer intrauterinen Wachstumsverzögerung (SGA) oder isolierter, mit geringfügiger kraniofazialer Missbildung einhergehender Wachstumshormonmangel. Für diese Patienten wurden Daten über Vitalstatus und Todesursachen vom nationalen Sterberegister und aus den Daten der gesetzlichen Krankenversicherung erhoben und mit Daten der französischen Normalbevölkerung verglichen. Die Autoren errechneten, dass die Gesamtmortalität bei den Behandelten im Vergleich zur Normalbevölkerung erhöht war. Das standardisierte Mortalitätsverhältnis (Standardized Mortality Ratio, SMR) lag bei 1,33; 95%-Konfidenzintervall: 1,08–1,64). Es wurde außerdem eine erhöhte Mortalität durch Knochentumoren oder durch kardiovaskuläre und zerebrovaskuläre Erkrankungen, insbesondere durch subarachnoidale und intrazerebrale Blutungen beobachtet (siehe Tabelle 1, Seite 9). Weitere multivariate Analysen zeigten ein höheres Risiko bei Dosierungen von über 50 μg/kg Körpergewicht pro Tag (SMR 2,94; 95%-Konfidenzintervall: 1,22–7,07; Hazard Ratio 2,79; 95%-Konfidenzintervall: 1,14–6,82). SAGHE-DATEN AUS BELGIEN, SCHWEDEN UND DEN NIEDERLANDEN Wegen der durch die französischen Daten ausgelösten Bedenken zur Sicherheit der Therapie mit Wachstumshormon beschlossen die Studienleiter in Belgien, den Schweden ISS Verkehrsunfall Niederlanden und Schweden, die ihnen verfügbaren Daten in einer ZwischenausSchweden ISS Selbstmord wertung zu analysieren und zu veröffentlichen, wenn auch die Analyse der Daten durch die geringe Ereignisrate erschwert wird. Dieser Teil der Studie schloss Patienten ein, die als Kinder zwischen 1985 und 1997 mit rekombinantem Wachstumshormon behandelt worden waren. Patienten REFERENZEN mit isoliertem Wachstumshormonmangel, idiopathischem Kleinwuchs oder Kleinwuchs auf Grund einer 1. Cohen P et al.: Does the GH-IGF intrauterinen Wachstumsverzögerung (SGA) wurden aus nationalen Registern und klinischen Studien axis play a role in cancer pathogenesis? Growth Horm IGF Res. eingeschlossen. Daten zu Vitalstatus und Todesursachen wurden über nationale Bevölkerungsregister, To2000;10:297-305 desursachenregister oder aus Patientenakten zusammengetragen. Für insgesamt 2.543 Patienten konnten 2. Rosenfeld RG et al.: Long-term surdie erforderlichen Daten ermittelt werden und so Daten über eine Beobachtungszeit von 46.556 Persoveillance of growth hormone therapy. J nenjahren gesammelt werden. Die Autoren identifizierten insgesamt 21 Todesfälle, davon zwölf auf Grund Clin Endocrinol Metab. 2012;97:68-72 von Unfällen, vier Suizide und jeweils einen Todesfall wegen Pneumonie, endokriner Dysfunktion, primärer 3. Swerdlow AJ et al.: Growth hormoKardiomyopathie, defizienter humoraler Immunität und Gerinnungsstörungen. ne treatment of children with brain Schweden ISS Selbstmord tumors and risk of tumor recurrence. J Clin Endocrinol Metab. 2000;85:44444449 4. Sklar CA et al.: Risk of disease recurrence and second neoplasms in survivors of childhood cancer treated with growth hormone: a report from the Childhood Cancer Survivor Study. J Clin Endocrinol Metab. 2002;87:31363141 Die Autoren stellten fest, dass der größte Anteil der Todesfälle auf Unfälle oder Suizide zurückzuführen ist, welches grundsätzlich die häufigsten Todesursachen in dieser Alterskategorie sind. Keiner der Todesfälle trat wegen kardiovaskulärer Erkrankungen oder Krebserkrankungen auf. Weiterhin wurde keine der verstorbenen Personen mit einer Dosierung von mehr als 50 μg/kg Körpergewicht pro Tag behandelt. Die Daten dieser Studie können demnach das im französischen Teil der Studie identifizierte Risiko nicht weiter erhärten. Die Autoren geben jedoch zu bedenken, dass hierfür auch methodische Aspekte, eine nicht ausreichende Fallzahl oder nationale Unterschiede verantwortlich sein können und weisen darauf 11 5. Ergun-Longmire B et al.: Growth hormone treatment and risk of second neoplasms in the childhood cancer survivor. J Clin Endocrinol Metab. 2006;91:34943498 6. Mackenzie S et al.: Long-term safety of growth hormone replacement after CNS irradiation. J Clin Endocrinol Metab. 2011;96:2756-2761 7. Wilton P et al.: Growth hormone treatment in children is not associated with an increase in the incidence of cancer: experience from KIGS (Pfizer International Growth Database). J Pediatr. 2010;157:265-270 8. Luger A et al.: Lessons learned from 15 years of KIMS and 5 years of ACROSTUDY. Horm Res Paediatr. 2011;76(1):33-38 9. Bell J et al.: Long-term safety of recombinant human growth hormone in children. J Clin Endocrinol Metab. 2010;95:167-177 10. Child CJ et al.: Prevalence and incidence of diabetes mellitus in GH-treated children and adolescents: analysis from the GeNeSIS observational research program. J Clin Endocrinol Metab. 2011;96: E1025-1034 11. Carel JC et al.: Long-Term Mortality after Recombinant Growth Hormone Treatment for Isolated Growth Hormone Deficiency or Childhood Short Stature: Preliminary Report of the French SAGhE Study. J Clin Endocrinol Metab. 2012;97:416-425 12. Sävendahl L et al.: Long-Term Mortality and Causes of Death in Isolated GHD, ISS, and SGA Patients Treated with Recombinant Growth Hormone during Childhood in Belgium, The Netherlands, and Sweden: Preliminary Report of 3 Countries Participating in the EU SAGhE Study. J Clin Endocrinol Metab. 2012;97: E213-217 13. Pressemitteilung der EMA vom 16.12.2010: Update on somatropin-containing medicines. Review of somatropin officially started. Doc Ref.: EMA/ CHMP/820649/2010; www.ema.europa. eu/docs/en_GB/document_library/Press_ release/2010/12/WC500099936.pdf 14. Pressemitteilung der EMA vom 15.12.2011: European Medicines Agency confirms positive benefit-risk balance of somatropin-containing medicines. Prescribers reminded to strictly follow approved indications and doses. Doc Ref.: EMA/CHMP/965945/2011 Rev. 1; www.ema.europa.eu/docs/en_GB/do cument_library/Press_release/2011/12/ WC500119189.pdf hin, dass dies die Notwendigkeit weiterer Untersuchungen unterstreicht. Die vollständigen Ergebnisse der EU-weiten SAGhE-Studie werden in etwa zwei Jahren erwartet. EUROPÄISCHES RISIKOBEWERTUNGSVERFAHREN ZU DEN BISHERIGEN ERGEBNISSEN DER SAGHE-STUDIE Nachdem im Dezember 2010 die französische Behörde Afssaps (Agence française de sécurité sanitaire des produits de santé) über die aus Frankreich stammenden Ergebnisse der SAGhE-Studie informiert worden war, wurde auf europäischer Ebene ein Risikobewertungsverfahren für Somatropin-haltige Arzneimittel initiiert.13 In diesem Bewertungsverfahren wurden vom Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) unter Einbezug der Pharmakovigilanz-Arbeitsgruppe (PhVWP) des CHMP neben den Daten der epidemiologischen Studie alle verfügbaren Daten zur Sicherheit von Somatropin aus klinischen Studien, Registern, Kohorten und Spontanberichten bewertet. Dabei wurde festgestellt, dass der französische Teil der SAGhE-Studie methodische Mängel aufweist. So wird die Bewertung der Ergebnisse unter anderem dadurch erschwert, dass unklar ist, ob die untersuchte Patientenpopulation ein mit der Normalbevölkerung vergleichbares Sterberisiko besitzt und der Vergleich mit dieser als aussagekräftig anzusehen ist. Hinzu kommt, dass lediglich Daten zur Mortalität bewertet wurden, die Ereignisraten sehr niedrig sind und Daten zur Morbidität, die die Mortalitätsdaten bestätigen könnten, bisher nicht verfügbar sind. Die übrigen vom CHMP betrachteten Daten konnten ein mögliches Risiko einer erhöhten Mortalität nach Somatropingabe nicht bestätigen. Das Nutzen-Risiko-Verhältnis Somatropin-haltiger Arzneimittel wird daher vom CHMP in der Gesamtheit als weiterhin positiv bewertet.14 Im Rahmen des Verfahrens wurde der Wortlaut für Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen Somatropin-haltiger Arzneimittel harmonisiert. Es wird darauf hingewiesen, dass Somatropin nicht angewendet werden darf, wenn Anzeichen einer Tumoraktivität bestehen, und dass die empfohlenen maximalen Tagesdosen nicht überschritten werden sollten. Die im französischen Teil der SAGhE-Studie beobachteten Signale werden weiterhin im Rahmen von kontinuierlich einzureichenden Periodischen Sicherheitsberichten evaluiert und in den Risikomanagement-Plänen Somatropin-haltiger Arzneimittel adressiert. Die nationale Umsetzung der Maßnahmen erfolgt nach der abschließenden bindenden Beschlussfassung durch die Europäische Kommission. FAZIT Somatropin wird als wachstumsförderndes Hormon zur Behandlung von mit Wachstumshormonmangel und Kleinwuchs einhergehenden Erkrankungen angewendet. Die europaweit durchgeführte SAGhE-Studie (Safety and Appropriateness of Growth hormone treatments in Europe) untersucht zurzeit die Langzeitwirkungen einer Behandlung mit Wachstumshormonen in der Kindheit. Erste veröffentlichte Ergebnisse des französischen Teils der europaweit durchgeführten SAGhE-Studie wiesen auf eine erhöhte Gesamtmortalität bei mit Somatropin behandelten Patienten im Vergleich zur Normalbevölkerung hin. Ein daraufhin gestartetes europäisches Risikobewertungsverfahren beurteilte im Dezember 2011 das Nutzen-Risiko-Verhältnis Somatropin-haltiger Arzneimittel als weiterhin positiv und harmonisierte den Wortlaut für Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen dieser Arzneimittel. Insbesondere wird darauf hingewiesen, dass Somatropin nicht angewendet werden darf, wenn Anzeichen einer Tumoraktivität bestehen, und dass die empfohlenen maximalen Tagesdosen nicht überschritten werden sollten. Die vollständigen Ergebnisse der EU-weiten SAGhE-Studie werden in etwa zwei Jahren erwartet. Die Risikosignale der SAGhE-Studie sowie deren künftige Ergebnisse werden weiterhin im Rahmen der Periodischen Sicherheitsberichte evaluiert und in den Risikomanagement-Plänen adressiert. Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 12 // Ausflockungen in Adsorbatimpfstoffen // W. MATHEIS A. MERKLE (PEI) Immer wieder erhält das Paul-Ehrlich-Institut Anfragen von Ärzten zum Thema Ausflockungen in Impfstoffen. Deuten doch Ausflockungen und Trübungen in flüssigen Arzneimitteln normalerweise auf Verkeimung oder andere Qualitätsmängel hin. Bei Adsorbatimpfstoffen handelt es sich jedoch um Suspensionen, deren unlösliche Partikel die wirksamen Bestandteile des Impfstoffs beinhalten. Im Folgenden werden ausgehend von Fallbeispielen einige Merkmale von Adsorbatimpfstoffen sowie Besonderheiten im Umgang mit ihnen vorgestellt. KEINE HINWEISE AUF QUALITÄTSMÄNGEL Fallbeispiel 1: Im September 2011 wurde das Paul-Ehrlich-Institut über eine Arzneimittelbeanstandung zu einer Charge eines (adsorbierten) Pneumokokken-Konjugat-Impfstoffs durch eine Kinder- und Jugendarztpraxis informiert. Es waren wiederholt weiße Flocken im Impfstoff beobachtet worden (siehe Abbildung 1 unten). Diese hatten sich auch nach längerem Schütteln (>10 Minuten) nicht aufgelöst. Bei der deutschen Niederlassung des Zulassungsinhabers waren ebenfalls Meldungen zu Ausflockungen bei der entsprechenden Impfstoffcharge eingegangen. Die neuerliche Prüfung der Herstellungsunterlagen, der Testergebnisse sowie die erneute Testung von Rückstellmustern beim Hersteller ergaben keinen Hinweis auf Qualitätsmängel. Sämtliche Spezifikationen wurden eingehalten. Auch das Reklamationsmuster konnte homogen aufgeschüttelt werden. Der Inhalt wurde als partikelfrei und das Aussehen der Suspension als produkttypisch eingestuft. Als mögliche Ursache für die schwer resuspendierbaren Agglomerate wurden ungünstige Lagerungsbedingungen (Lagerung bei <2°C) vermutet. Fallbeispiel 2: Vor einiger Zeit sorgte die Beobachtung eines Arztes, dass bei einem adsorbierten Kombinationsimpfstoff (DTaP-IPV + Hib) nach der Mischung der lyophilisierten Komponente (Hib) mit der flüssigen Komponente (DTaP-IPV) das Adsorbat oben aufschwimmt, zunächst für Irritationen bei der Zulassungsbehörde und dem Hersteller des Präparats. Untersuchungen beim Hersteller und dem Paul-Ehrlich-Institut zeigten jedoch, dass dieses Phänomen nach kräftigem Schütteln des Gemischs vor der Applikation nicht erneut auftrat. Diese Beobachtung wird mit dem Einschluss kleiner Luftbläschen im Lyophilisatpellet erklärt: Sie lagern sich an die Adsorbatpartikel an und lassen sie oben aufschwimmen. Dieses Verhalten in Suspensionen wird als Flotation (Aufschwimmen) bezeichnet. Durch intensives Schütteln können die nicht sichtbaren Luftbläschen von den Adsorbatpartikeln getrennt werden, was daran zu erkennen ist, dass sich das Adsorbat danach wie erwartet absetzt (siehe Abbildung 2). Dies sind nur zwei Beispiele für Auffälligkeiten, die sich aus den besonderen Eigenschaften der Adsorbatimpfstoffe ableiten lassen, jedoch nicht auf einem Qualitätsmangel beruhen. Oft sind es jedoch Unkenntnis im Umgang mit Impfstoffen oder eine nicht adäquate Lagerung, die dann tatsächlich zu Beeinträchtigungen der Qualität von Impfstoffen führen können. Es gibt eine Untersuchung in den USA, die zeigt, dass in 44 Prozent aller Impfpraxen mindestens ein Problem bei der Lagerung dokumentiert wurde.1 Als wichtigste Risikofaktoren wurden in diesem Zusammenhang eine mangelhafte Temperaturkontrolle sowie die Nutzung von Kühl-/Gefrierkombinationsgeräten mit ungenügender Trennung oder zu kleinem Kühl- oder Gefrierraum ausgemacht. Neben der Beschaffung geeigneter Kühl- und Gefriergeräte und der Temperaturkontrolle während des Betriebs wird der Aufklärung des Personals über den Umgang mit den unterschiedlichen Impfstoffen eine besondere Bedeutung zugesprochen. 13 Abbildung 1: Aussehen von Adsorbatimpfstoffen Fertigspritze eines Adsorbatimpfstoffs kurz nach Entnahme aus dem Kühlschrank mit dem typischen Sediment (unten) und nach kräftigem Schütteln (oben, 20-mal sehr kräftig geschüttelt; es entsteht eine homogene applikationsfähige Suspension) Quelle: PEI ADSORBATIMPSTOFFE KRÄFTIG SCHÜTTELN Adsorbatimpfstoffe werden durch Mischung von Antigenen mit Aluminiumhydroxid- oder Aluminiumphosphatgelen hergestellt. In den Gelen liegen die Aluminiumverbindungen als feine Partikel suspendiert vor. Die Partikelgrößen liegen in der Regel unter einem Mikrometer beziehungsweise im Bereich zwischen einem und fünf Mikrometern. Antigene werden durch Adsorption an die Aluminiumpartikel gebunden. Diese verstärken als Adjuvans die immunologische Wirkung. Der fertige Adsorbatimpfstoff ist eine Suspension, daher ist eine sichtbare Trübung normal. Die Partikel in der Suspension setzen sich beim Stehenlassen ab. Mit der Zeit bilden sich dann ein klarer Überstand und ein Sediment (siehe Abbildung 2c). Das ist ein normaler Vorgang, da die Partikel in Suspensionen aus thermodynamischen Gründen bestrebt sind, sich zusammenzulagern. Je nach Formulierung des Impfstoffs kann es darüber hinaus auch zur Bildung von größeren Agglomeraten (größere „Flocken“, siehe Abbildung 1, unten) kommen, die sich dann vollständig am Boden einer klaren Flüssigkeit absetzen. Durch Schütteln der Fertigspritzen oder Ampullen sollte vor der Applikation aber wieder eine homogene Suspension erzeugt werden können. Dabei kann in der Tat sehr kräftiges oder auch längeres Schütteln nötig sein. Ist dies nicht möglich, ist der Impfstoff zu verwerfen. Es ist wichtig, eine homogene, von sichtbaren Partikeln freie Suspension vor der Applikation zu erzeugen (siehe Abbildung 2b), damit kein Wirkstoff in der Ampulle oder Fertigspritze verbleibt oder verstärkte Lokalreaktionen erzeugt werden. Um diese weiter zu minimieren, ist eine tief intramuskuläre und handwarme Applikation ratsam. a b c Abbildung 2: Phänomen der vorübergehenden Flotation (Aufschwimmen): Drei bis fünf Minuten nach Rekonstitution eines Lyophilisats in einer flüssigen Adsorbatimpfstoff-Komponente schwimmt das Adsorbat oben auf (Abbildung 2a). Nach kräftigem Schütteln entsteht eine homogene applikationsfähige Suspension (Abbildung 2b). Das Adsorbat setzt sich nach einiger Zeit wieder normal am Boden der Flüssigkeit ab (Abbildung 2c, etwa eine Stunde nach kräftigem Schütteln). Quelle: PEI Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 14 EINFRIEREN ZERSTÖRT ADSORBIERTEN IMPFSTOFF Adsorbatimpfstoffe sollen bei 2–8°C gelagert werden. Besonders sensibel reagieren diese Präparate jedoch auf zu kalte Lagerung. Das Einfrieren (auch kurzzeitig) zerstört die physikochemische Struktur der Adsorbate. Es bilden sich größere Partikel, die bei einer Applikation zu erheblich verstärkten Lokalreaktionen und außerdem zur Verringerung der Wirksamkeit führen.2 Einmal eingefrorene Adsorbatimpfstoffe dürfen deshalb nicht mehr appliziert werden und sind zu verwerfen. Frostschäden können beispielsweise bei entsprechenden Außentemperaturen im Winter auftreten, wenn die Impfstoffe nicht unter kontrollierten Bedingungen gelagert und transportiert werden. Vor einigen Jahren musste eine größere Menge Impfstoff, der für Deutschland bestimmt war, aufgrund versehentlicher Zwischenlagerung bei zu tiefen Temperaturen im unkontrollierten Frachtbereich des Flughafens vernichtet werden. Die Auswertung verschiedener Studien zur Einhaltung der Kühlkette vom Hersteller bis zum Arzt ergab, dass es sich um ein weltweites Problem handelt.3 Auch der Kühlschrank stellt ein potenzielles Risiko für Frostschäden dar. Je nach Konstruktion des Kühlschranks, der Beladung und der Stelle im Kühlschrank, wo die Präparate gelagert werden, können unterschiedliche Temperaturen bis hin zu unter 0°C herrschen. Neben der regelmäßigen Temperaturkontrolle empfiehlt es sich, am besten bereits bei Inbetriebnahme des Kühlschranks die Temperatur an verschiedenen Stellen bei voller Beladung und im leeren Zustand zu messen, um ungeeignete Stellen für die Lagerung von Impfstoffen zu erkennen. Vorsicht ist bei der Lagerung zu nahe an der Kühlschlange (i.d.R. an der Rückwand) oder den Türfächern geboten. MIT EINFACHEN TESTS FROSTSCHÄDEN ERKENNEN Im einfachsten, aber eher seltenen Fall ist das Präparat noch gefroren, wenn es dem Kühlschrank entnommen wird, sodass der Frostschaden direkt erkennbar ist. Gibt es darüber hinaus den Verdacht, dass ein Adsorbatimpfstoff bei zu tiefer Temperatur gelagert worden ist, können zwei einfache Tests durchgeführt werden, die auf eine Schädigung der Präparate hinweisen. Voraussetzung bei beiden Tests ist, dass eine korrekt gelagerte Vergleichsprobe des Impfstoffs (idealerweise von derselben Charge) vom gleichen Hersteller verfügbar ist. Möglicherweise kann die örtliche Apotheke bei der Beschaffung behilflich sein. a b Abbildung 3: Schütteltest zur Erkennung von Frostschäden Etwa 30 Minuten nach dem Aufschütteln ist das Sediment der über Nacht bei – 2°C bis –5°C gelagerten Spritze eines Adsorbatimpfstoffs (Abbildung 3a, rechts) deutlich kompakter im Vergleich zu der bei 2 – 8°C (empfohlene Temperatur) gelagerten Spritze des gleichen Impfstoffs (Abbildung 3a, links). Die Sedimentation erfolgt im falsch gelagerten Impfstoff wesentlich schneller und ist ein deutlicher Hinweis auf den Frostschaden. Der Frostschaden ist auch mikroskopisch nachweisbar (Abbildung 3b links: normale Lagerung; Abbildung 3b rechts: nach Frostschaden) Quelle: PEI 15 Bei dem sogenannten Schütteltest4 wird die Sedimentation einer korrekt gelagerten Probe mit der Sedimentation der verdächtigen Probe nach kräftigem Schütteln verglichen. Dabei setzen sich die nach dem Einfrieren größeren Teilchen deutlich schneller und üblicherweise kompakter ab (siehe Abbildung 3a). Es handelt sich hierbei um eine zerstörungsfreie Prüfung. Zumindest die Vergleichsprobe kann noch verimpft werden. Die gröbere Körnung der Partikel eines eingefrorenen Adsorbatimpfstoffs im Vergleich zur bei 2–8°C gelagerten Probe ist auch im Lichtmikroskop gut erkennbar (siehe Abbildung 3b). Der Nachteil dieses Tests ist, dass die Proben anschließend nicht mehr nutzbar sind. Er ist eher als Bestätigung des Schütteltests zu sehen, insbesondere, wenn es um die Entscheidung geht, größere Mengen Impfstoff mit Auffälligkeiten zu vernichten. FACH- UND GEBRAUCHSINFORMATION BEACHTEN Generell werden in der Fach- und Gebrauchsinformation impfstoffspezifische Hinweise und Erläuterungen gegeben. In der Fachinformation sind diese Hinweise in folgenden Kapiteln zu finden: Das Aussehen wird in Kapitel 3 beschrieben. Informationen zur Haltbarkeit und, falls notwendig, der Haltbarkeit im Gebrauch befinden sich in Kapitel 6.3. Dort wird beispielsweise auch auf die Stabilität Tabelle: Anforderungen an Transport und Lagerung von Impfstoffen* (modifiziert nach Quast et al.2) Impfstoff Lagerung (°C) Transport (Kühlkettenpflicht) Lebendimpfstoffe (z.B. MMR-, Varizellen-, Gelbfieber-, Typhus-Lebendimpfstoff) 2–8 ja nicht adsorbierte Totimpfstoffe (z.B. einige Influenza-, Tollwut-, Meningokokken- und Pneumokokken-Polysaccharid-Impfstoffe, Typhus-Polysaccharid-Impfstoffe) 2–8 nein Adsorbatimpfstoffe (z.B. DTaP-Kombinationsimpfstoffe, FSME-, Meningokokken- und Pneumokokken-Konjugatimpfstoffe) Folgen fehlerhafter Temperatur zu warm: mangelnde Wirksamkeit zu warm: möglicherweise eingeschränkte Wirksamkeit zu warm: möglicherweise schlechtere Wirksamkeit 2–8 nein * Die in der Fachinformation genannten Lagerbedingungen sind einzuhalten. zu kalt: schlechtere Verträglichkeit und eingeschränkte Wirksamkeit durch die irreversible Bildung größerer Partikel Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 16 nach Rekonstitution eingegangen, wenn der Impfstoff vor der Applikation erst aus einem Lyophilisat hergestellt werden muss. Die Lagerbedingungen werden in Kapitel 6.4 behandelt. Hinweise zur Beseitigung und zur Handhabung des entsprechenden Impfstoffs werden in Kapitel 6.6 gegeben. Dort finden sich die Informationen zur Vorgehensweise beim Herstellen der Suspension beziehungsweise Instruktionen zum Mischen von Komponenten. Es wird beispielsweise auf die Kontrolle von Fremdpartikeln aufmerksam gemacht und es werden mögliche physikalische Veränderungen sowie notwendige Maßnahmen erläutert. LAGERUNG UND TRANSPORT VERSCHIEDENER IMPFSTOFFE Je nach Art des Impfstoffs können sich die Lagerungs- und Transportbedingungen unterscheiden (siehe Tabelle, Seite 13). Die Einhaltung dieser Bedingungen ist die Voraussetzung dafür, dass die Impfstoffe neben der Wirksamkeit auch eine gute Verträglichkeit aufweisen. In diesem Zusammenhang sei darauf hingewiesen, dass die Impfstoffe nicht mit Kühlschranktemperatur, sondern handwarm angewendet werden sollten. Lebendimpfstoffe sollten in der Regel jedoch sehr zeitnah nach Entnahme aus dem Kühlschrank appliziert werden, da die Erregermenge – und damit die Wirksamkeit – bei erhöhter Temperatur drastisch abfallen kann. Dagegen sind bei Totimpfstoffen auch nach einer Aufbewahrung über mehrere Stunden bei Temperaturen um 15°C keine Auswirkungen auf die Wirksamkeit oder Verträglichkeit zu erwarten.5 Abweichende Hinweise und Erläuterungen in der Fachinformation sind unbedingt zu beachten. HINWEISE ZU ADSORBATIMPFSTOFFEN • Aussehen: trübe Suspension, deren Partikel sich auch (insbesondere nach längerer Lagerung) als flockiges Sediment am Boden eines klaren Überstandes abgesetzt haben können. Nach dem Schütteln sollte in jedem Fall eine homogene Trübung entstehen. REFERENZEN 1. Bell KN et al.: Risk factors for improper vaccine storage and handling in private provider offices. Pediatrics. 2001;107(6):E100 2. Quast U, Thilo W, Fescharek R: Impfreaktionen. Hippokrates Verlag, Stuttgart 1997 3. Matthias DM et al.: Freezing temperatures in the vaccine cold chain: A systematic literature review. Vaccine 25. 2007;3980-3986 4. Kartoglu U et al.: Validation of the shake test for detecting freeze damage to adsorbed vaccines. Bull World Health Organ. 2010;88(8):624-631 5. Quast U, Ley-Köllstadt S., Arndt U: Schwierige Impffragen. 2. Aufl. Verlag im Kilian, Marburg 2008 • Handhabung: nicht einfrieren, bei Verdacht auf zu kühle Lagerung Impfstoff verwerfen. • Applikation: als homogene Suspension, vor Applikation kräftig schütteln, handwarm verabreichen, tief intramuskulär injizieren. • Spezielle Hinweise der Fach- und Gebrauchsinformation beachten. Dort werden Informationen zum Aussehen, der Lagerung, Handhabung und der Stabilität im Gebrauch gegeben. • Bei Lagerung im Kühlschrank Temperaturverteilung im Kühlschrank beachten und Temperatur überwachen (cave: Einfrieren!). Weitere allgemeine Hinweise zur Verabreichung von Impfstoffen sind in den Impfempfehlungen der STIKO enthalten, die auf der Homepage des Robert Koch-Instituts abgerufen werden können und einmal jährlich im Epidemiologischen Bulletin des Robert Koch-Instituts veröffentlicht werden. 17 // Daten zur Pharmakovigilanz von Impfstoffen aus dem Jahr 2009 // D. MENTZER B. KELLERSTANISLAWSKI (PEI) Impfungen sind eine effektive Maßnahme zur Erhaltung der Gesundheit aller Bevölkerungsgruppen. In den letzten Jahren ist in vielen Staaten, unter anderem auch in Deutschland, eine wachsende Sorge hinsichtlich realer und vermeintlicher Risiken von Impfungen zu beobachten. Impfstoffe sind, wie alle anderen wirksamen Arzneimittel auch, nicht völlig frei von Nebenwirkungen. Um mögliche neue Arzneimittelrisiken zeitnah erkennen zu können, ist es besonders wichtig, unerwünschte Reaktionen, bei denen ein Verdacht auf das Vorliegen einer „Impfkomplikation“ besteht, zu melden und zu erfassen. Im Folgenden wird eine Übersicht der im Jahr 2009 gemeldeten Verdachtsfälle von Impfnebenwirkungen/Impfkomplikationen sowie ihre Bewertung vorgestellt. MELDEPFLICHTEN Der Inhaber der Zulassung beziehungsweise der pharmazeutische Unternehmer (PU) hat nach § 63b Arzneimittelgesetz (AMG) eine gesetzlich geregelte Meldeverpflichtung gegenüber der Bundesoberbehörde (für Impfstoffe das Paul-Ehrlich-Institut, PEI). Ärzte und Apotheker haben standesrechtliche Verpflichtungen zur Meldung des Verdachts einer unerwünschten Reaktion (UAW) an die jeweilige Arzneimittelkommission, die entsprechend der Zuständigkeit mit dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) und dem PEI Informationen zu UAW austauschen. Darüber hinaus besteht nach § 6 Abs.1 Nr. 3 Infektionsschutzgesetz (IfSG) eine Meldeverpflichtung bei dem Verdacht einer über das übliche Maß einer Impfreaktion hinausgehenden gesundheitlichen Schädigung. Eine namentliche Meldeverpflichtung für Ärzte und Heilpraktiker an das örtliche Gesundheitsamt besteht bereits dann, wenn es einen Verdacht gibt, dass nach einer Impfung auftretende Krankheitserscheinungen in einem ursächlichen Zusammenhang mit der Impfung stehen könnten und die gesundheitliche Schädigung das übliche Ausmaß einer Impfreaktion überschreitet. Die Gesundheitsämter sind nach § 11 Abs.2 IfSG verpflichtet, die gemeldeten Verdachtsfälle unverzüglich der zuständigen Landesbehörde und dem PEI in pseudonymisierter Form zu melden (Abbildung 1). § 11 IfSG Abbildung 1: Meldeverpflichtungen von Verdachtsfällen von Nebenwirkungen und Impfkomplikationen; rot: gesetzliche Meldeverpflichtungen Arzneimittelkommission der deutschen Ärzteschaft: AkdÄ, Arzneimittelkommission der Apotheker: AMK, Arzneimittelgesetz: AMG, Infektionsschutzgesetz: IfSG §§ 6, 8 IfSG AKdÄ Arzt Gesundheitsamt AMK § 63 b AMG Apotheker Zulassungsinhaber/pharmazeutischer Unternehmer Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 18 METHODIK DER BEWERTUNG Es wurden alle Meldungen des Verdachts einer unerwünschten Reaktion/Impfkomplikation, die dem PEI im Jahr 2009 berichtet wurden, ausgewertet. Verdachtsmeldungen zu pandemischen InfluenzaA/H1N1-Impfstoffen wurden nicht berücksichtigt, da sie schon zusammengefasst veröffentlicht wurden (Bulletin 1/2010; www.pei.de/bulletin-sicherheit). Die Gesamtzahl der Einzelmeldungen kann die Zahl der Verdachtsfälle übersteigen, da der gleiche Verdachtsfall von mehr als einer Quelle gemeldet werden kann (beispielsweise Meldung durch Gesundheitsamt und gleichzeitig durch den Zulassungsinhaber). Die Auswertung der Meldungen umfasst fallbezogene Auswertungen (auf der Ebene eines betroffenen Patienten) als auch reaktionsbezogene Auswertungen (auf der Ebene der einzelnen unerwünschten Reaktionen zu einem Fall), da eine Meldung mehrere unerwünschte Reaktionen in zeitlichem Zusammenhang bei einem Patienten enthalten kann. Der ursächliche Zusammenhang des Verdachtsfalls einer Impfkomplikation mit dem verabreichten Impfstoff wird im PEI nach den Kriterien der WHO von „gesichert“ bis „nicht zu beurteilen“ bewertet. Dieses Vorgehen wurde bereits an anderer Stelle ausführlich beschrieben.1 Da auch Reaktionen gemeldet wurden, die zum Teil weit vor dem 1.1.2009 lagen, wurde auf eine Kalkulation einer Melderate verzichtet. Neben der qualitativen Analyse jedes einzelnen Falles werden im PEI zusätzlich quantitative Methoden zur Signaldetektion eingesetzt. Ein Signal ist definiert als ein unerwünschtes Ereignis, bei dem der Verdacht vorliegt, dass ein kausaler Zusammenhang zu einem oder mehreren Arzneimitteln besteht. Das PEI wendet dazu eine Methode der Disproportionalitätsanalyse, die Berechnung der sogenannten Proportional Reporting Ratio (PRR), an. Die Methode basiert auf der Überlegung, dass eine von einem bestimmten Wirkstoff (Impfstoff) spezifisch verursachte Nebenwirkung (Ereignis) im Zusammenhang mit diesem Wirkstoff häufiger auftritt als im Zusammenhang mit anderen Wirkstoffen.2 Es gilt dabei folgende Beziehung: untersuchtes Ereignis alle anderen Ereignisse gesamt untersuchtes Arzneimittel A B A+B alle anderen Arzneimittel C D C+D gesamt A+C B+D A+B+C+D Die Maßzahl PRR berechnet sich wie folgt: PRR: A(C+D) C(A + B) Dieser Quotient vergleicht die Proportionalität des Ereignisses im Vergleich zu anderen Arzneimitteln und ist unabhängig von dem Ausmaß der tatsächlichen Exposition mit dem Arzneimittel. Ein Wert von 1 für PRR stellt kein Signal dar, da die Kombination aus untersuchtem Ereignis und untersuchtem Arzneimittel genauso häufig vorkommt wie die Kombination aus untersuchtem Ereignis und allen anderen Arzneimitteln. Je größer der PRR-Wert ist, desto stärker ist die statistische Assoziation und desto größer die Wahrscheinlichkeit, dass ein Signal vorliegt. Von einem Signal kann dann ausgegangen werden, wenn PRR einen vorher definierten Schwellenwert überschreitet. Ein zu niedriger Schwellenwert führt 19 zu vielen falsch-positiven Signalen, während ein zu hoher Schwellenwert tatsächliche Signale übersieht. Der am häufigsten verwendete Schwellenwert für PRR ist 2. Nach Evans et al.1 besteht ein Hinweis auf ein Signal, wenn ein PRR-Wert von mindestens zwei und ein Chi-Quadrat-Wert als Maß für die Verlässlichkeit des Ergebnisses von mindestens vier vorliegen und dabei drei oder mehr Meldungen für das zu untersuchende Ereignis vorhanden sind. Die Analyse der Meldungen aus dem Jahr 2009 erfolgte auf Basis des Informationsstands zu den einzelnen Fällen im Juni 2011. AUSWERTUNG Im Jahr 2009 erhielt das PEI insgesamt 1.804 Einzelfallmeldungen über Verdachtsfälle von Nebenwirkungen beziehungsweise Impfkomplikationen (ausgenommen der Meldungen zu pandemischen Influenza-A/H1N1-Impfstoffen, siehe Methodik). Dabei ist zu beachten, dass bei 439 Meldungen das Impfdatum und bei 323 Meldungen das Datum des Auftretens der UAW vor dem 1.1.2009 lagen. Bei 148 Meldungen waren das Impfdatum und das Datum des Auftretens der UAW unbekannt. Die Aufteilung der Meldungen nach Altersgruppen ist Tabelle 1 zu entnehmen. Tabelle 1: Meldungen über Verdachtsfälle von Impfkomplikationen bzw. Nebenwirkungen an das PEI im Jahr 2009 in den einzelnen Altersgruppen und berichteter Ausgang der unerwünschten Ereignisse gesamt Fälle (gesamt) 1.804 Erwachsene Erwachsene Kinder 18–59 Jahre ≥ 60 Jahre 0–23 Monate 619 223 schwerwiegende 1.281 (71%) 418 (67,5%) 140 (62,8%) Fälle Kinder Kinder 447 123 342 354 (79,2%) 86 (69,9%) 240 (70,2%) ≥ 2< 6 Jahre ≥ 6<18 Jahre Alter (Median) 17 Jahre 38 Jahre 70 Jahre 9 Monate 3 Jahre 14 Jahre weiblich 59,1% 67% 65,9% 40% 49,6% 71,1% männlich 37,9% 31,8% 34,1% 53,9% 50,4% 26,0% Geschlecht unbekannt 3% 1,1% 3,6% 6% 0 2,9% Todesfälle 24 (1,3%) 2 (0,3%) 8 (3,6%) 11 (2,5%) 0 2 (0,6%) bleibender Schaden 22 (1,2%) 9 (1,5%) 1 (0,7%) 4 (0,9%) 0 6 (1,8%) Allgemeinzustand 67 (3,7%) verbessert* 38 (6,1 %) 9 (4%) 7 (1,6%) 4 (3,3%) 8 (3,3%) wiederhergestellt 820 (45,5%) 227 (36,7 %) 73 (32,7%) 264 (59,1%) 74 (60,2%) 171 (50,0%) nicht 496 (27,5%) wiederhergestellt* 92 (41,3%) 88 (21,1%) 26 (21,1%) 88 (25,7%) 40 (17,9%) 73 (16,3%) 19 (15,4%) 67 (19,6%) unbekannt 198 (32%) 375 (20,8%) 145 (23,4%) * Zum Zeitpunkt der Meldung noch nicht wiederhergestellt Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 20 MELDUNGEN DER GESUNDHEITSÄMTER NACH DEM INFEKTIONSSCHUTZGESETZ 746 der 1.804 gemeldeten Verdachtsfälle wurden über die Gesundheitsämter mitgeteilt. Die Zahl der Verdachtsfälle je Bundesland ist in Abbildung 2 dargestellt. Bezogen auf die Bevölkerungsgröße bestehen deutliche Unterschiede bei den Melderaten der Bundesländer (z.B. 2,9 Verdachtsfälle einer Impfkomplikation pro 100.000 Einwohner in Thüringen und 0,18 Meldungen auf 100.000 Personen in Berlin). Die Mehrzahl der Meldungen erhielt das PEI über den PU (n=1.277). BEWERTUNG DES MÖGLICHEN URSÄCHLICHEN ZUSAMMENHANGS ZWISCHEN UNERWÜNSCHTER REAKTION UND IMPFUNG Der ursächliche Zusammenhang zwischen der unerwünschten Reaktion und der Impfung wurde in 29% der Fälle als „wahrscheinlich“, in 35% der Fälle als „möglich“ und in 7% der Fälle als „unwahrscheinlich“ bewertet. In 29 % der Fälle war keine abschließende Beurteilung möglich, da weitere Informationen noch angekündigt wurden oder die Informationen unvollständig waren. In keinem Fall wurde der ursächliche Zusammenhang als „gesichert“ bewertet. Wichtig ist, dass sich die Bewertung eines Einzelfalles mit dem wachsenden wissenschaftlichen Erkenntnisstand ändern kann. Unabhängig von der Bewertung im PEI zählt jede Meldung im Rahmen der Detektion neuer möglicher Risikosignale. Abbildung 2: Zahl der Meldungen von Impfkomplikationen 2009 durch die Gesundheitsämter (n= 746) MELDUNGEN ÜBER TÖDLICHE VERLÄUFE VON VERDACHTSFÄLLEN EINER NEBENWIRKUNG/ IMPFKOMPLIKATION Bei 1,3 Prozent der Verdachtsfälle (24/1.804) wurde ein tödlicher Ausgang berichtet. In einem Literaturbericht wurden vier Kasuistiken einer ANCA(antineutrophil cytoplasmatic antibodies)-assoziierten Vaskulitis3 nach saisonaler Grippeimpfung beschrieben, von denen zwei tödlich verliefen. Der ursächliche Zusammenhang mit einer Grippeimpfung wurde vom PEI in Übereinstimmung mit den Autoren in den vier Fällen als „möglich“ beurteilt. Bei 21 Meldungen mit tödlichem Ausgang sah das PEI keinen ursächlichen Zusammenhang mit der Impfung. Ein Fall, der nicht durch einen Angehörigen eines Gesundheitsberufes bestätigt wurde, konnte wegen lückenhafter Information nicht bewertet werden. Die Berichte über Todes­ fälle im zeitlichen Zusammenhang mit verschiedensten Impfungen, die 2009 berichtet wurden, sind: • N=2 Literaturberichte einer Wegener-Granulomatose (WG) beziehungsweise Exazerbation einer WG nach Grippeimpfung. • N=9 SIDS/SUD (sudden infant death syndrome/sudden unexplained deaths) bei Säuglingen im Alter von neun Wochen bis acht Monaten (Median drei Monate). Die Kinder hatten bis auf eine Ausnahme DTaP-Hib-IPV/HepB und einen Pneumokokkenkonjugatimpfstoff erhalten. Die plötzlichen Todesfälle (SIDS/SUD) traten im Median drei Tage nach der Impfung auf (acht Stunden bis elf Tage). Zahlreiche epidemiologische Studien haben bisher keinen Hinweis auf ein erhöhtes Risiko für SIDS nach Gabe von Kinderimpfstoffen ergeben. • N=3 SUD bei Erwachsenen im Alter von 60, 68 und 90 Jahren ein bis drei Tage nach einer Grippeund/oder Pneumokokkenpolysaccharidimpfung. In zwei Fällen handelte es sich um multimorbide Patienten. 21 Tabelle 2: Auflistung der 30 am häufigsten gemeldeten unerwünschten Reaktionen aus dem Jahr 2009 • N=9 Fälle, bei denen eine andere Todesursache festgestellt wurde: Kohlenmonoxidvergiftung bei defektem Gasboiler; Pneumokokkenpneumonie nach der ersten Pneumokokkenkonjugatimpfung, d.h., ein Impfschutz konnte noch nicht ausgebildet sein. Bei dem Erreger handelt es sich um einen nicht im Impfstoff enthaltenen Serotyp; tödlicher Asthmaanfall bei bekanntem Asthma; plötzlicher Herztod bei bekanntem Diabetes mellitus und Hypertonus; Staphylokokkenpneumonie; Aspirationspneumonie bei Ovarialkarzinom mit Peritonealkarzinose; Lungenembolie; Lungenentzündung; Lungenödem. Anzahl der gemeldeten Reaktionen (%)* 341 4,6 Fieber 205 2,8 Erythem an der Injektionsstelle 185 2,5 Kopfschmerz 165 2,2 Krampfanfall 110 1,5 Schmerz in einer Extremität MELDUNGEN MIT BLEIBENDEM SCHADEN NACH IMPFUNG 109 1,5 Erbrechen 108 1,5 Parästhesie 106 1,4 Übelkeit 103 1,4 Schwindelgefühl 82 1,1 Arthralgie 76 1 Diarrhoe 76 1 Asthenie 75 1 Ausschlag 64 0,9 Myalgie 64 0,9 Hypoästhesie Insgesamt wurden dem PEI 22 Meldungen (zehn Kinder, zehn Erwachsene und zwei Meldungen ohne Altersangabe) über einen bleibenden Schaden nach Impfung berichtet, dabei konnte kein bestimmtes UAW-Muster erkannt werden. Auch wurden verschiedenste Impfstoffe angeschuldigt. Drei Fälle wurden vom PEI in einem möglichen Zusammenhang mit der Impfung gesehen. Es handelte sich um eine leukozytoklastische Vaskulitis mit Alopezie und Polyarthritis nach Influenzaimpfung und um zwei Fälle einer Plexusneuritis nach Influenza- beziehungsweise FSME-Impfung. In zehn Fällen konnte wegen lückenhafter Information der ursächliche Zusammenhang zwischen Impfung und dem unerwünschten Ereignis nicht ausreichend beurteilt werden: 64 0,8 Schwellung an der Injektionsstelle 62 0,8 Synkope 61 0,8 Ermüdung 60 0,8 peripheres Ödem 58 0,8 Schwellung 54 0,7 Schmerz 54 0,7 Unwohlsein 53 0,7 Schüttelfrost 52 0,7 Urtikaria 51 0,7 lokale Reaktion 49 0,7 Kreislaufkollaps 48 0,7 Pruritus 46 0,6 Muskelschwäche 45 0,6 Schmerzen an der Injektionsstelle 43 0,6 Dyspnoe berichtete Reaktion** *Prozent der Gesamtzahl der gemeldeten Reaktionen (n=7.380) ** Kodierung der berichteten Reaktionen erfolgt nach MedDRA (Medical Dictionary for Regulatory Activities) auf der „Preferred Term“-Ebene • N=1 Bericht durch einen Freund des Verstorbenen mit fehlenden Angaben zur Todesursache im unklaren zeitlichen Zusammenhang mit einer FSME-Impfung. • Drei Meldungen nach HPV-Impfung, in denen über eine juvenile Spondarthritis bei HLA-B27-positivem Befund, eine Immunthyreoiditis 7,5 Monate nach Impfung sowie eine Multiple Sklerose ca. 6,5 Monate nach Impfung berichtet wurde. • Zwei Meldungen zu FSME-Impfungen bei Erwachsenen. Bei der einen Meldung handelte es sich um ein unklares Krankheitsbild mit Ermüdbarkeit und Kopfschmerzen. Im zweiten Fall handelte es sich um eine aseptische Meningitis unklarer Ursache, die zu einem apallischen Syndrom führte. • Ein Fall einer vermuteten Petit-mal-Epilepsie bei einem achtjährigen Jungen nach Meningokokkenkonjugatimpfung; eine Enzephalitis nach DTaP-IPV-Hib-HepBImpfung (Sechsfachimpfung) und eine Pneumokokkenpneumonie mit hämolytisch urämischem Syndrom bei unklarer Serogruppe nach Pneumokokkenkonjugatimpfung. • Eine Meldung über ein Schmerzsyndrom unklarer Genese nach Grippeimpfung bei einer 47-jährigen Frau. • Bei einem Fall wurde eine Reihe von Symptomen wie Rückenschmerzen, Lymphadenopathie, Parästhesie, Temperaturintoleranz nach FSME-Impfung berichtet. Es handelte sich um einen Off-Label-Use. In neun Fällen wurde der Zusammenhang mit „unwahrscheinlich“ bewertet, da eine andere Grunderkrankung wahrscheinlicher war, erste Symptome schon vor der Impfung bestanden oder der zeitliche Verlauf der unerwünschten Ereignisse nach der Impfung biologisch nicht plausibel war. Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 22 DIE HÄUFIGSTEN GEMELDETEN UNERWÜNSCHTEN REAKTIONEN Insgesamt sind im Jahr 2009 dem PEI 7.380 unerwünschte Reaktionen gemeldet worden. Diese Zahl übersteigt die Anzahl der Verdachtsfälle, da mehrere unerwünschte Reaktionen/Symptome zu einem Fall berichtet werden können. Die 30 häufigsten berichteten Reaktionen sind in Tabelle 2 (Seite 21) dargestellt. Insgesamt handelt es sich um bekannte unerwünschte Reaktionen nach Impfungen. Bei 146 Patienten wurde über Konvulsion berichtet (insgesamt 165 unerwünschte Ereignisse). 79 Patienten erlitten einen Fieberkrampf (78 Kinder bis zum Alter von sechs Jahren und ein Erwachsener). Fieberkrämpfe sind bei Säuglingen, die jünger als sechs Monate alt sind, selten. Der Altersgipfel liegt etwa bei 18 Monaten. Fieberkrämpfe haben eine blande Prognose, sie sind bekannte Reaktionen nach Impfungen von Kindern. Bei 16 Impflingen wurden Konvulsionen im Zusammenhang mit Synkopen beziehungsweise Kreislaufkollaps berichtet (drei Erwachsene, 13 Kinder und Jugendliche). Bei drei Kindern wurde eine Konvulsion im Rahmen einer hypotonen hyporeaktiven Episode (HHE) beschrieben. SIGNALE Im Jahr 2009 wurden insgesamt zehn Fälle einer Invagination nach Rotavirusimpfstoffen bei Kindern ≤2 Jahren gemeldet. Eine altersstratifizierte PRR-Berechnung ergab für beide Rotavirusimpfstoffe zusammen einen Wert von 3,11 (95%-Konfidenzintervall: 1,33–7,26; Chi2 >4). VASKULITIS NACH INFLUENZAIMPFUNG Die 2009 publizierten Meldungen einer ANCA-assoziierten Vaskulitis nach saisonaler Grippeimpfung veranlassten das PEI, eine systematische Auswertung der Verdachtsmeldungen zu Vaskulitiden nach saisonaler und pandemischer Influenzaimpfung im Vergleich zu anderen Impfstoffen durchzuführen. Dabei wurden Auswertungen von 2001 bis 2010 durchgeführt. In die Datenbankabfrage wurden die folgenden „Preferred Terms“ nach MedDRA (Medical Dictionary for Regulatory Activities) einbezogen: Vaskulitis (allgemein), leukozytisch leukoklastische Vaskulitis, Wegener-Granulomatose, Purpura Schönlein-Henoch, diffuse Vaskulitis, nekrotisierende Vaskulitis, nodulare Vaskulitis, Vaskulitis zerebral, Vaskulitis Niere. Tabelle 3: Meldungen einer Vaskulitis nach Impfstoffen an das PEI im Zeitraum 2001–2010 Werte in Klammern beziehen sich auf Meldungen nach Impfung mit pandemischem Influenza-A/ H1N1-Impfstoff Preferred Term (MedDRA) Reaktionen (alle Impfstoffe) Reaktionen (nur Grippeimpfstoffe) 2001 –2010 2009 2010 2001 –2010 2009 2010 Vaskulitis 63 (8) 13 (7) 12 (1) 21 (8) 4 (7) 5 (1) leukozytisch leukoklastische Vaskulitis 28 (5) 9 (5) 3 13 (5) 3 (5) 1 Wegener-Granulomatose 4 4 0 4 4 0 Purpura Schönlein-Henoch 36 (9) 3 (2) 10 (7) 2 (9) 0 (2) 2 (7) diffuse Vaskulitis 1 1 0 0 0 0 nekrotisierende Vaskulitis 0 0 0 0 0 0 nodulare Vaskulitis 0 0 0 0 0 0 Vaskulitis zerebral 3 0 1 0 0 0 Vaskulitis Niere 1 0 1 0 0 0 Fälle gesamt 136 (22) 30 (14) 27 (8) 40 (22) 11 (14) 8 (8) 23 Tabelle 4: Berechnungen der Maßzahl PRR (gesamt und altersstratifiziert) für das gemeldete Ereignis Vaskulitis nach einer Influenzaimpfung im Vergleich zu allen anderen Impfungen für den Zeitraum 2001 bis 2010 sowie einzeln für die Jahre 2009 und 2010 (CI: Konfidenzintervall; Chi2: Maß für die Homogenität der Verteilung) altersstratifiziertes PRR (95% CI, Chi2) saisonale Influenzaimpfung altersstratifiziertes PRR (95% CI, Chi2) saisonale Influenzaimpfung + H1N1/ A-Impfung PRR (95% CI, Chi2) saisonale Influenzaimpfung PRR (95% CI, Chi2) saisonale Influenzaimpfung + H1N1/ A-Impfung PRR2009 2,5 (1,2 – 5,1; Chi2 > 4) 1,0 (0,5–1,6; Chi2 < 4) 2,5 (1,2–5,6; Chi2 > 4) 1,0 (0,6–1,8; Chi2 < 4) PRR2010 1,6 (0,7 – 3,5; Chi2 < 4) 0,7 (0,5–1,1; Chi2 < 4) 1,3 (0,5–2,8; Chi2 < 4) 1,3 (0,9–1,8; Chi2 < 4) PRR 2001-2010 2,0 (1,4 – 2,8; Chi2 > 4) 1,5 (1,1–2,1; Chi2 > 4) 2,4 (1,6–3,5; Chi2 > 4) 1,4 (0,9–2,0; Chi2 > 4) altersstratifiziert: ausschließliche Berücksichtigung der Verdachtsmeldungen von Personen im Alter von mindestens 18 Jahren Eine Übersicht der Zahl der Meldungen, die das PEI von 2001 bis 2010 mit mindestens einer dieser Reaktionen erhalten hat, ist in Tabelle 3 dargestellt. Im Zeitraum von 2001 bis 2010 wurden dem PEI 158 Fälle einer Vaskulitis nach Impfstoffen berichtet (einschließlich pandemische Influenza-A/H1N1Impfung). Davon betrafen 91 Meldungen (einschließlich 14 Fälle nach pandemischer Grippeimpfung) Erwachsene im Alter von 18 Jahren oder älter. Dabei sollte beachtet werden, dass es sich auch hier um Verdachtsfälle handelt, bei denen nicht automatisch auf einen ursächlichen Zusammenhang zwischen Impfung und dem unerwünschten Ereignis geschlossen werden kann. Der PRR-Wert für die Kombination von Vaskulitis und Influenzaimpfstoffen im Vergleich zu allen anderen Impfstoffen schwankte unter Berücksichtigung des Alters, des Zeitraums der Auswertung und bei Einbeziehung der Meldungen nach pandemischer Influenzaimpfung zwischen 1,0 und 2,5 (Tabelle 4). ZUSAMMENFASSUNG Seit dem Inkrafttreten des Infektionsschutzgesetzes im Jahr 2001 ist die Zahl der Verdachtsmeldungen von Impfkomplikationen beziehungsweise Impfnebenwirkungen bis 2009 stetig angestiegen4, was auf die Aufnahme zusätzlicher Impfungen in den Impfkalender (z.B. HPV), die Ausweitung der FSME-Endemiegebiete und die Zulassung von neuen Impfstoffen wie zum Beispiel Rotavirusimpfstoffe zurückzuführen ist. Im Vergleich zu den Berichtsjahren 2004 und 2005 ergab sich kein wesentlicher Unterschied hinsichtlich der prozentualen Verteilung des Ausgangs der Impfreaktion. Bemerkenswert ist lediglich ein leichter Rückgang der Meldungen mit tödlichem Ausgang (3,8 bzw. 4,9% der Meldungen im Jahr 2004 bzw. 20054 und 1,2% im Jahr 2009). Die Mehrzahl der Verdachtsmeldungen einer Impfkomplikation/Nebenwirkung erhielt das PEI im Jahr 2009 – wie auch in den Vorjahren – vom Inhaber der Zulassung. Ein vergleichsweise geringer Anteil wird dem PEI über die Gesundheitsämter gemeldet, wobei hinsichtlich der Melderate Unterschiede zwischen den einzelnen Bundesländern bestehen. Einzelfallberichte einer Vaskulitis nach Influenzaimpfung wurden mehrfach in der Literatur veröffentlicht.5,6 Ob es sich um einen ursächlichen Zusammenhang handelt, ist bis heute nicht geklärt. Von Interesse ist eine retrospektive Studie an 230 Patienten mit ANCA-assoziierter Vaskulitis (AAV), in der Ausgabe 1 | März 2012 // ARZNEIMITTEL IM BLICK // 24 keine Zunahme der AAV-Schubrate festgestellt werden konnte. Ganz im Gegenteil: Die Schubrate pro 100 Patienten war mit 3,4 niedriger bei den Patienten, die innerhalb des letzten Jahres geimpft worden waren im Vergleich zu 6,3 bei den nicht geimpften Patienten.7 Eine Analyse des PEI zur Disproportionalität der Vaskulitismeldungen nach Influenzaimpfung ergab im Vergleich zu allen anderen Impfstoffen für die Zeit vom Inkrafttreten des Infektionsschutzgesetzes bis 2010 kein konsistentes Signal. Wenn man berücksichtigt, dass vom PEI pro Influenzasaison zwischen 20 und 30 Millionen Dosen trivalente inaktivierte Grippeimpfstoffe freigegeben werden, so erscheint die Zahl der Meldungen einer Vaskulitis (n = 40 in den Jahren 2001–2010) sehr gering. Das PEI wird die Analyse auch für die Folgejahre fortsetzen und Verdachtsfälle ganz besonders intensiv recherchieren. Nach kritischer Bewertung der wissenschaftlichen Daten zu allen Verdachtsfällen von Impfnebenwirkungen beziehungsweise Impfkomplikationen, die dem PEI im Jahr 2009 spontan gemeldet wurden, wurden zehn Fälle einer Invagination nach Rotavirusimpfstoffen als Signal aufgefasst. Das Paul-EhrlichInstitut hat bereits im Bulletin zur Arzneimittelsicherheit (Ausgabe 4/2010, S. 8 ff.) über die Ergebnisse epidemiologischer Studien zur Assoziation zwischen Rotavirusimpfung und Invagination berichtet. Untersuchungen aus Mexiko und Brasilien sowie Australien haben gezeigt, dass insbesondere nach der ersten Impfung (vornehmlich innerhalb von sieben Tagen nach Impfung) ein geringfügig erhöhtes Risiko für Invaginationen nach den beiden zugelassenen Rotavirusimpfstoffen anzunehmen ist.8 – 10 FAZIT Im Jahr 2009 wurden dem Paul-Ehrlich-Institut insgesamt 1.804 Verdachtsfälle von Impfnebenwirkungen beziehungsweise Impfkomplikationen gemeldet. Als Risikosignal wurde Invagination nach Rotavirusimpfungen detektiert. Inzwischen haben epidemiologische Studien eine Assoziation zwischen Rotavirusimpfung und Invagination, insbesondere innerhalb von sieben Tagen nach der ersten Dosis, gezeigt. Aufgrund der Spontanberichte aus dem Jahr 2009 gibt es keinen Hinweis auf eine Änderung des positiven Nutzen-Risiko-Verhältnisses der in Deutschland zugelassenen Impfstoffe. REFERENZEN 1. Keller-Stanislawski B et al.: Verdachtsfälle von Impfkomplikationen nach dem Infektionsschutzgesetz und Verdachtsfälle von Nebenwirkungen nach dem Arzneimittelgesetz vom 1.1.2001 bis zum 31.12.2003. BGBI. 2004;47(12):1151-1164 2. Evans SJ et al.: Use of proportional reporting ratios (PRRs) for signal generation from spontaneous adverse drug reaction reports. Pharmacoepidemiol Drug Saf. 2001;10(6):483-486 3. Birck R et al.: ANCA-associated vasculitis following influenza vaccination. Causal Association or Mere Coincidence? J Clin Rheumatol. 2009;15:289-291 4. Weißer K et al.: Verdachtsfälle von Impfkomplikationen nach dem Infek- tionsschutzgesetz und Verdachtsfälle von Nebenwirkungen nach dem Arzneimittelgesetz vom 1.1.2004 bis zum 31.12.2005. Bundesgesundheitsbl Gesundheitsforsch Gesundheitsschutz. 2007;50:1404-1417 5. Ulm S et al.: Leukocytoclastic vasculitis and acute renal failure after influenza vaccination in an elderly patient with myelodysplastic syndrome. Onkologie. 2006;29:470-472 6. Tavadia S et al.: Leucocytoclastic vasculitis and influenza vaccination. Clin Exp Dermatol. 2003;28(2):154-156 7. Stassen PM et al.: Influenza vaccination does not result in an increase in relapses in patients with ANCAassociated vasculitis. Nephrol Dial Transplant. 2008;23(2):654-658 8. Patel MM et al.: Intussusception risk and health benefits of rotavirus vaccination in Mexico and Brazil. N Engl J Med. 2011;364:2283-2292 9. Greenberg HB: Rotavirus vaccination and intussusception-act two. N Engl J Med. 2011;364(24):2354-2355 10. Buttery JP et al.: Intussusception following rotavirus vaccine administration: post-marketing surveillance in the National Immunization Program in Australia. Vaccine. 2011;29:30613066 // PHARMAKOVIGILANZ TRANSPARENT // 25 // Risikomanagement-System – ein proaktives Instrument der Pharmakovigilanz // K. WEISSER (PEI) W. LÜTKEHERMÖLLE (BfArM) Bereits seit 2005 wird sowohl von der Europäischen Arzneimittelagentur EMA als auch von den nationalen Zulassungsbehörden für bestimmte Arzneimittel, wie zum Beispiel neuartige oder biotechnologisch hergestellte Arzneimittel, bei der Zulassung die Implementierung eines Risikomanagement-Systems (RMS) verlangt. Das Ziel ist es, Arzneimittelrisiken frühzeitig zu erkennen, zu bewerten und gegebenenfalls geeignete risikominimierende Maßnahmen zu ergreifen. Das RMS war bisher bei national zugelassenen Arzneimitteln gemäß § 22 AMG eine Kann-Vorschrift. Basierend auf der entsprechenden Änderung in der EU-Gesetzgebung ist es im Kabinettsentwurf der sogenannten 16. AMG-Novelle als verpflichtender Bestandteil der Zulassungsunterlagen vorgesehen. Auf Verlangen der Behörden ist es auch bei zugelassenen Arzneimitteln vorzulegen. Das RMS stellt ein wichtiges proaktives Instrument der Pharmakovigilanz dar. Wesentliche Inhalte und Beispiele sowie bisherige Erfahrungen werden im Folgenden vorgestellt. HINTERGRUND Zum Zeitpunkt der Zulassung eines neuartigen Arzneimittels ist die Kenntnis über Nebenwirkungen auf Ergebnisse aus klinischen Prüfungen mit einer begrenzten Anzahl von Personen (Patienten und gegebenenfalls gesunde Probanden) beschränkt. Diese Personen sind nach bestimmten Kriterien für die Teilnahme an der jeweiligen klinischen Prüfung ausgewählt worden. Diese Auswahl ist notwendig, um für eine maximale Sicherheit der Studienteilnehmer in klinischen Prüfungen zu sorgen und um die Aussagekraft der Studienergebnisse zu erhöhen. In den letzten Jahrzehnten hat das Spontanmeldesystem von Verdachtsfällen unerwünschter Arzneimittelwirkungen (UAW) wesentlich dazu beigetragen, Risiken von Arzneimitteln, die erst bei der breiten Anwendung nach der Zulassung auftreten, zu erkennen und geeignete Maßnahmen zur Risikominimierung einzuleiten (siehe auch Bulletin 4/2010, S. 18 ff.). Um frühzeitig Pharmakovigilanz-Aktivitäten für ein Arzneimittel planen sowie mögliche Risiken besser bewerten und minimieren zu können, wurde ab 2005 mit dem Risikomanagement-System (RMS) ein neues Instrument in die Pharmakovigilanz eingeführt. Durch die neue EU-Gesetzgebung wurde im Bereich der Pharmakovigilanz dieses wichtige Instrument deutlich gestärkt.1 Mit dem Zulassungsantrag für neue Substanzen, Biosimilars, Generika (falls zusätzliche Risikominimierungs-Aktivitäten beim Originator bestehen), Arzneimittel für Kinder (Paediatric Use Marketing Authorisation – PUMA), bei signifikanten Änderungen einer Zulassung (neue Arzneiformen, neue Art der Anwendung oder signifikante Änderung in der Indikation, Patientenpopulation) sowie auf Anfrage der Zulassungsbehörde hat der Antragsteller eine detaillierte Beschreibung des vorgesehenen RMS bei der Behörde vorzulegen. Das RMS besteht aus einem Katalog von Pharmakovigilanz-Aktivitäten und -Maßnahmen, die der Identifizierung, Charakterisierung, Verhütung oder Minimierung von arzneimittelbedingten Risiken dienen. Dies schließt auch eine Bewertung der Effektivität dieser Maßnahmen ein, um bei Bedarf entsprechende Vorkehrungen nachzubessern oder anzupassen. Die detaillierte Beschreibung dieses Systems muss in Form eines Risikomanagement-Plans (RMP) der zuständigen Behörde vorgelegt werden. Ausgabe 1 | März 2012 // PHARMAKOVIGILANZ TRANSPARENT // 26 Mit der 14. und 15. Novelle des Arzneimittelgesetzes (AMG) wurden die europäischen Vorgaben in das deutsche Arzneimittelrecht umgesetzt. Dabei kann nun nicht nur im Rahmen von Neuzulassungsanträgen ein Risikomanagement-System etabliert und beschrieben werden, die zuständige Bundesoberbehörde kann auch ausdrücklich bei bereits erteilten Zulassungen von Zulassungsinhabern die Etablierung eines RMS für ein Arzneimittel fordern.2 Mit der „16. AMG-Novelle“ wird die neue EU-Gesetzgebung voraussichtlich im Juli 2012 in deutsches Recht umgesetzt. Hierdurch sowie durch die neue EU-Verordnung Nr. 1235/2010 vom 15.12.2010 wird u.a. auch die Transparenz im Bereich der Pharmakovigilanz deutlich erhöht. So wird in Zukunft u.a. eine Kurzdarstellung der Risikomanagement-Pläne in einem von der Europäischen Zulassungsagentur EMA bereitgestellten Internetportal der allgemeinen Öffentlichkeit zugänglich gemacht. RISIKOMANAGEMENT-PLAN – WAS STEHT DRIN? Der Risikomanagement-Plan beschreibt das Risikomanagement-System und ist Teil der Zulassung. Struktur und Inhalt eines RMP sind ausführlich in den Richtlinien für die praktische Umsetzung der EUAnforderungen beschrieben.3 Der RMP ist in zwei Teile geteilt. Gliederung eines EU-Risikomanagement-Plans Teil I: • Sicherheitsspezifikation • Pharmakovigilanz-Plan Teil II: • Bewertung der Notwendigkeit von Risikominimierungs-Maßnahmen, sowie – falls nötig – Risikominimierungs-Plan Im ersten Teil (Sicherheitsspezifikation und Pharmakovigilanz-Plan) werden die Erkenntnisse zu präklinischen und klinischen Untersuchungen und gegebenenfalls auch die Erfahrungen zur Sicherheit aus dem Bereich nach der Zulassung beschrieben. Dabei sind sowohl identifizierte und potenzielle Risiken bei der Anwendung des Arzneimittels als auch fehlende Daten, zum Beispiel bei bestimmten Patientengruppen, darzustellen. Hierzu gehören auch das Risiko eines Off-Label-Use – insbesondere bei Kindern, aber auch Schwangeren und Stillenden – sowie das Risiko von Infektionsübertragungen, die vor allem bei biologischen Arzneimitteln eine wichtige Rolle spielen. Ein weiterer Bestandteil ist die Beschreibung zusätzlicher Studien zur Schließung von Wissenslücken, sofern diese erforderlich sind. Diese können bei Bedarf auch behördlich angeordnet werden. Weitere Studien können zum Beispiel nötig werden, wenn präklinische beziehungsweise klinische Fragen oder Sicherheitsfragen bei bestimmten Patientengruppen offen geblieben sind. Sofern das Arzneimittel in der Langzeitbehandlung einer Erkrankung eingesetzt wird, können diese Fragen auch im Rahmen von Beobachtungsstudien (Post Authorisation Safety Studies, PASS) untersucht werden. Besondere Beachtung finden hierbei spezifische Aspekte bei der Anwendung bei Kindern. So wird beispielsweise geprüft, ob es Fragen zur Sicherheit des Arzneimittels im Hinblick auf Wachstum und Entwicklung der Kinder gibt. Die geplanten Untersuchungen sind dabei detailliert zu beschreiben und zu begründen (Pharmakovigilanz-Plan, Beispiel siehe Kasten 1). Meilensteine sowie genaue Zeitangaben zur Durchführung 27 und Berichterstattung sind festzulegen. Zwar ist es nicht für jedes Arzneimittel notwendig, nach der Zulassung zusätzliche Studien zur Sicherheit durchzuführen. Obligatorisch bleibt jedoch in jedem Fall die sogenannte Routinepharmakovigilanz. Für Arzneimittel für neuartige Therapien (Advanced therapy medicinal products, ATMP) sind zusätzliche spezifische Anforderungen an den RMP zu beachten, die in einer speziellen EMA-Guideline beschrieben werden.4, 5 Dazu gehört u.a. ein Plan zur Langzeitüberwachung der Wirksamkeit und Sicherheit. Kasten 1: Beispiele für zusätzliche Pharmakovigilanz-Aktivitäten Detaillierte Fragebogen zu bestimmten unerwünschten Ereignissen Statistische Analysen zur Häufigkeit von UAW (z.B. „Observed versus expected“-Analyse, Vergleich der erwarteten mit den gemeldeten Fällen) Register (Schwangerschafts-, Erkrankungs-, Behandlungs- oder Verschreibungsregister) Zusätzliche klinische und epidemiologische Studien: – Studien in Subpopulationen – Interaktionsstudien – Studien zur Hintergrundinzidenz einer Erkrankung Arzneimittelspezifische Besonderheiten z.B. bei Impfstoffen: Studien zu: Kombinierter Anwendung mit anderen Impfstoffen Langzeitschutz Infektionssurveillance (Enhancement) Erstellung von Schulungsmaterialien (sog. Educational Material), Checklisten, Therapiepässe etc. für Angehörige der Heilberufe (Ärzte, Apotheker) und/oder Patienten Im zweiten Teil des RMP (Risikominimierung) ist darzulegen, ob und welche Maßnahmen zur Risikominimierung notwendig sind. Grundsätzlich kommen als Maßnahmen zum Beispiel die Einschränkung der Indikation, Kontraindikationen und Warnhinweise in der Fachinformation in Betracht. Zu weiteren Maßnahmen gehören besondere Monitormaßnahmen, wie beispielsweise regelmäßige MRT-Untersuchungen bei Tysabri® oder Schwangerschaftstests vor jeder Verordnung bei gebärfähigen Frauen unter Thalidomid-/Lenalidomidtherapie. Schließlich können auch spezielle Bedingungen für die Verschreibung gefordert werden (siehe Kästen 2 und 3). Gelegentlich wird auch die Einführung eines Therapiepasses (patient alert card) notwendig, um alle behandelnden Ärzte über die spezielle Behandlung des Patienten zu informieren. Die Therapiebesonderheiten und das Risikoprofil sollen hierdurch berücksichtigt werden. Durch das Kreditkartenformat des Therapiepasses, welches ein permanentes Mitführen unterstützt, soll auch in Notfallsituationen die Information der behandelnden Ärzte gewährleistet werden. Die Effektivität der durchgeführten Maßnahmen wird im RMP laufend überwacht. Alle Pharmakovigilanz-Aktivitäten und Risikominimierungs-Maßnahmen sind mit Fristen und der Definition von Meilensteinen versehen. So soll sichergestellt werden, dass neue Erkenntnisse zeitnah berichtet und bewertet werden und so eine notwendige Anpassung der Maßnahmen zeitnah erfolgt. Ausgabe 1 | März 2012 // PHARMAKOVIGILANZ TRANSPARENT // 28 Kasten 2: Maßnahmen zur Risikominimierung bei der Zulassung des monoklonalen Antikörpers Natalizumab (Tysabri®) zur Behandlung der Multiplen Sklerose Eingeschränkte Indikation Vorgaben hinsichtlich des Abbruchs der Therapie Behandlung nur durch Experten Therapiepass (Patient alert card) als Hinweis auf das mögliche Risiko einer Progressiven Multifokalen Leukenzephalopathie (PML) Fortbildungsprogramm für behandelnde Neurologen Durchführung von Beobachtungsstudien (PASS) durch den Zulassungsinhaber Kasten 3: Maßnahmen zur Risikominimierung von Thalidomid- und Lenalidomidhaltigen Arzneimitteln Einschränkung der Indikation Etablierung eines Schwangerschaftsverhütungsprogramms Etablierung eines kontrollierten Vertriebssystems Verpflichtende Abgabe von Informationsmaterialien: • Informationsbroschüre (einschließlich einer Beschreibung des Schwangerschaftsverhütungsprogramms) jeweils für Angehörige der Heilberufe und Patienten • Formblatt zum Therapiebeginn (sog. Checkliste) • Aufklärungsbogen zum Therapiebeginn • Fachinformation für Angehörige der Heilberufe • Therapiepass sowie andere relevante Hinweise gemäß der offiziellen Gebrauchsinformation für Patientinnen und Patienten Eingeschränkte Abgabemodalitäten und definierte maximale Behandlungsdauer pro ärztliches Rezept Führen eines Schwangerschaftsregisters Einrichtung bundesweiter Maßnahmen, um die Effektivität und die Einhaltung des Schwangerschaftsverhütungsprogramms beurteilen zu können Überwachung des Off-Label-Use (BfArM und pharmazeutischer Unternehmer) Halbjährliche Berichterstattung an die Europäische Arzneimittelagentur (EMA) hinsichtlich: • Schätzung des Verbrauchs in Deutschland • Status der Implementierung des Schwangerschaftsverhütungsprogramms 29 Abbildung: Lebenszyklus eines Arzneimittels vor Zulassung Zulassung Phase 3 nach Zulassung Risikominimierung Phase 2 Phase 1 Erkenntnisse zur Sicherheit eines Arzneimittels RMP 1 RMP n Pharmakovigilanz-Spezifikation Pharmakovigilanz-Planung Meilensteine ¨ ¨ PROAKTIV FÜR MEHR SICHERHEIT REFERENZEN 1. Richtlinie 2010/84/EU zur Änderung der Richtlinie 2001/83/EG 2. §22 und §28 Abs. 3a AMG 3. The Rules Governing Medicinal Products in the European Union-Notice to Applicants –Vol 9A: Guidelines on Pharmacovigilance for Medicinal Products for Human Use, January 2007 4. Verordnung (EG) 1394/2007 (ATMPVerordnung) 5. Guideline on safety and efficacy follow-up – risk management of advanced therapy medicinal products (EMEA/149995/2008) 6. www.ema.europa.eu/ema/index. jsp?curl=pages/medicines/landing/ epar_search.jsp&mid=WC0b01ac05 8001d125 7. Giezen TJ et al.: Evaluation of PostAuthorization Safety Studies in the First Cohort of EU Risk Management Plans at Time of Regulatory Approval. Drug Saf. 2009;32(12):1175-1187 Die beschriebenen Elemente des Risikomanagement-Systems sollen es ermöglichen, nicht nur auf Arzneimittelrisiken zu reagieren, sondern diese möglichst frühzeitig und proaktiv zu erkennen, zu mindern beziehungsweise nach Möglichkeit zu vermeiden. Der RMP stellt sicher, dass schon zum Zeitpunkt der Zulassung eine strukturierte Planung der Risikominimierungs-Maßnahmen und weiterführender Untersuchungen existiert. Zudem werden die Maßnahmen während des gesamten „Lebenszyklus“ eines Arzneimittels aktualisiert. Neue Erkenntnisse werden aufgenommen und neue Risiken weiterverfolgt (siehe Abbildung). Die Inhalte der RMP, die bereits zu neueren zentralen Zulassungen der EMA vorliegen, können in zusammengefasster Form als Bestandteil des öffentlichen Bewertungsberichts (EPAR, European public assessment report) auf der Homepage der EMA eingesehen werden.6 AUSBLICK Inzwischen ist eine Evaluation dieses neuen Tools publiziert worden.7 Die bisher gemachten Erfahrungen haben u.a. zu nachfolgenden Änderungen in der EU-Gesetzgebung geführt, die bis Juli 2012 in deutsches Arzneimittelrecht umgesetzt werden sollen: • • • • • verpflichtende RMP für alle neuen Arzneimittel angemessene Diskussion und Bewertung von identifizierten und potenziellen Risiken Schaffung ausreichender Transparenz durch Verpflichtung zur webbasierten Veröffentlichung im RMP definierter Maßnahmenkatalog bestimmt die Zulassung/Zulassungsmodalitäten Verpflichtung zur Überwachung der Effektivität der etablierten Maßnahmen zur Risikominimierung durch alle europäischen Arzneimittelbehörden (d. h. in Deutschland durch BfArM und PEI), die Europäische Arzneimittelagentur (EMA) und die pharmazeutischen Unternehmer Die Änderungen in der neuen Gesetzgebung zur Pharmakovigilanz zielen darauf ab, die Risikomanagement-Pläne im Lebenszyklus eines Arzneimittels als proaktives und planendes Instrument weiter zu stärken, insbesondere, um die frühzeitige Risikominimierung voranzutreiben. Dazu trägt auch die frühe und verbesserte Zusammenführung der Sicherheitsprofildaten bei. Weiterhin wird die Effektivität der etablierten Maßnahmen durch regelmäßige Überprüfungen sichergestellt. Ausgabe 1 | März 2012 // FORSCHUNG // 30 // Fettgewebsforschung für eine verbesserte Diabetesbehandlung // P. MAYER B. HAAS (BfArM) Die Adipositasprävalenz ist in den Industrienationen in den letzten Jahren dramatisch angestiegen. Adipositas ist insbesondere durch die Zunahme des Fettgewebes charakterisiert, das in weißes und braunes Fett unterteilt wird. Während weißes Fett hauptsächlich der Speicherung und Freisetzung von Lipiden dient, ist braunes Fett durch seinen hohen Gehalt an Mitochondrien in der Lage, gespeicherte Energie in Wärme umzuwandeln. Das Verständnis der Prozesse, die die Ausbildung dieser beiden Fettgewebsarten und deren Funktionen regulieren, eröffnet die Möglichkeit der Entwicklung neuer, sicherer Wirkstoffe, die gezielt die Funktion der Fettzellen (Adipozyten) steuern. Am Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) werden hierzu verschiedene Forschungsprojekte durchgeführt. BRAUNES UND WEISSES FETTGEWEBE Die beiden Fettgewebsarten des menschlichen Körpers – weißes und braunes Fett – haben unterschiedliche Funktionen1: Weißes Fett speichert überschüssige Energie in Form von Triglyzeriden (Lipiden), die bei hohem Energiebedarf wieder gespalten werden. Zusätzlich kommt dem weißen Fett die Rolle eines Isolators zu (subkutanes Fettgewebe) und es dient ebenso als Trenngewebe zwischen Organen (viszerales Fettgewebe). Darüber hinaus produzieren und sezernieren die Zellen des weißen Fettgewebes als größtes endokrines Organ des Körpers mehrere Zytokine wie Adiponektin, Leptin, Resistin, Tumornekrosefaktor alpha (TNF-α) und Interleukine. Die Freisetzung dieser proinflammatorischen Faktoren spielt eine wichtige Rolle bei der Entstehung der Insulinresistenz und ist mitverantwortlich für das erhöhte Diabetesrisiko bei Adipösen. Die erst kürzlich auf Grund ihrer Nebenwirkungen in die Schlagzeilen geratene Arzneistoffgruppe der Glitazone (Thiazolidindione, TZD) beeinflusst das Differenzierungsverhalten und die Zytokinausschüttung der weißen Fettzellen und kann dadurch die Insulinwirkung verbessern. Im Gegensatz zum weißen Fett ermöglicht das braune Fett die direkte (zitterfreie) Erzeugung von Wärme durch Verstoffwechselung der gespeicherten Lipide. Diese Funktion macht sich vor allem der Körper der Neugeborenen zur Aufrechterhaltung der Körpertemperatur zunutze. Man bezeichnet diesen Vorgang auch als adaptive Thermogenese. Ein wesentliches funktionelles Merkmal von braunen Adipozyten ist die Expression des Uncoupling Protein 1 (UCP1), eines Transmembranproteins in den Mitochondrien. UCP1 sorgt dafür, dass der Protonengradient über die innere Mitochondrienmembran entkoppelt und zur Thermogenese genutzt wird. Kürzlich konnten mehrere Arbeitsgruppen funktionelles braunes Fett auch in Erwachsenen nachweisen.2–5 Aufgrund der inversen Korrelation zwischen der Masse an braunem Fettgewebe und dem Body-Mass-Index wurde postuliert, dass es eine wichtige Rolle bei der Regulation des Energiehaushalts in Erwachsenen spielen könnte.4 Die Identifizierung von Arzneistoffen, die das Differenzierungsverhalten und die Aktivierung des braunen Fettgewebes positiv beeinflussen, könnte einen Beitrag zur Bekämpfung von Adipositas und Typ-2-Diabetes leisten. FORSCHUNGSPROJEKTE DES BFARM ZUM BRAUNEN FETTGEWEBE Die Grundlage für einen Therapieansatz zur Beeinflussung der Aktivität des braunen Fettgewebes ist das Verständnis der Signalwege, die es steuern. Kältereize zum Beispiel führen über das sympathische Nervensystem (Adrenalin, Noradrenalin) zur Aktivierung des braunen Fettgewebes. 31 In Zusammenarbeit mit dem Institut für Pharmakologie und Toxikologie der Universität Bonn (Prof. Alexander Pfeifer) konnten BfArM-Wissenschaftler einen neuen, durch zyklisches Guanosinmonophosphat (cGMP) vermittelten Mechanismus aufklären, der zur Aktivierung des braunen Fettgewebes führt.6 Der „second messenger“ cGMP reguliert eine Vielzahl biologischer Prozesse. Mit Hilfe moderner molekularpharmakologischer Werkzeuge gelang es den Wissenschaftlern, die cGMP-Signalkaskade in braunen Adipozyten aufzuklären: Eine Aktivierung der cGMP-abhängigen Proteinkinase I (PKGI) durch cGMP führt zu einer Steigerung der Mitochondrienzahl (erhöhte mitochondriale Biogenese) und UCP1-Expression an isolierten braunen Wildtyp-Adipozyten. Im Gegensatz dazu haben PKGI-defiziente Zellen eine verringerte mitochondriale Biogenese und UCP1-Expression. Wie die Forscher zeigen konnten, führt die Aktivierung der PKGI zu einer Phosphorylierung des kleinen G-Proteins RhoA, das zur Ras-Superfamilie gehört. Im Gegenzug führt ein Verlust der PKGI zu gesteigerter RhoA/ROCK (Rho-associated protein kinase)-Aktivität. ROCK phosphoryliert das Insulinrezeptorsubstrat-1 (IRS-1) inhibitorisch und hemmt somit den Insulinsignalweg in braunen Adipozyten (Insulinresistenz). Die verminderte Insulinsensitivität der PKGI-defizienten Zellen verhindert die Differenzierung zu reifen braunen Adipozyten. Die gestörte Entwicklung des braunen Fettgewebes resultiert in vivo in einer deutlich verringerten thermogenen Aktivität und in einer erniedrigten Körpertemperatur der Mäuse, was mit Hilfe der Infrarotthermografie an lebenden Tieren nicht invasiv gezeigt werden konnte (Abbildung 1). Abbildung 1: Thermografische Aufnahme einer Wildtyp-Maus (links) und einer PKGI-knock-out-Maus (PKGI-/-) (rechts) Man beachte die geringere Wärmeproduktion des braunen Fettdepots zwischen den Schulterblättern (interskapulär) der Knock-out-Tiere im Vergleich zum Wildtyp. Quelle: Haas B et al.6 Der so aufgeklärte Signalweg (Abbildung 2, Seite 32) liefert einen neuen Ansatzpunkt zur Aktivierung des braunen Fettgewebes und damit neue Therapieansätze zur Behandlung von Adipositas und Typ-2Diabetes. FORSCHUNGSPROJEKTE DES BFARM ZUM WEISSEN FETTGEWEBE Glitazonartige Wirkung von Sulfonylharnstoffen auf primäre humane Adipozyten Sulfonylharnstoffe sind weitverbreitete orale Antidiabetika, die die Insulinsekretion im Pankreas stimulieren. Darüber hinaus wurden auch extrapankreatische Wirkungen berichtet. Daher hat die BfArM-Forschungsgruppe untersucht, ob die beiden Sulfonylharnstoffe Glimepirid und Glibenclamid die Adipozyten ähnlich wie die Glitazone beeinflussen. So konnte an primär kultivierten humanen Adipozyten (isoliert aus Material von Fettabsaugungen) gezeigt werden, dass diese beiden häufig in der Diabetestherapie eingesetzten Sulfonylharnstoffe die Adipozyten fast im gleichen Umfang zur Einlagerung von Triglyzeriden stimulieren wie Pioglitazon (Abbildung 3, Seite 32).7 Repaglinid, das ebenso wie die Sulfonylharnstoffe die insulinproduzierenden Zellen des Pankreas stimuliert, hatte auf die Fettzelldifferenzierung (Adipogenese) keinen wesentlichen Einfluss. Ausgabe 1 | März 2012 // FORSCHUNG // 32 Abbildung 2: Schematische Darstellung der Aktivierung der braunen Adipozyten durch die NO/cGMP/PKG- und Insulin-Signalwege. NO: nitric oxide; sGC: soluble guanylyl cyclase; PKGI: protein kinase G I; RhoA: ras homolog gene family member A; ROCK: rho-associated coiled-coil containing kinase; IRS-1: insulinreceptor substrate-1; PI3K: phosphoinositide-3kinase; Akt: Akt proto-oncogene (= protein kinase B); Rac: ras-related C3 botulinum substrate; p38: p38 mitogenactivated protein kinase; CREB: cAMP response element-binding protein Quelle: Haas B et al.6 Abbildung 3: Durch Pioglitazon, Glimepirid und Glibenclamid induzierte Fettzelldifferenzierung Mikroskopische Aufnahmen von primär kultivierten humanen Präadipozyten (Vorläufer der Fettzellen), die mit den genannten Substanzen behandelt wurden. Unter Pioglitazon und den Sulfonylharnstoffen zeigt sich eine deutliche Einlagerung von Triglyzeriden, sichtbar an den gefärbten Fetttröpfchen im Inneren der Zellen (Fettfärbung mit Oil Red O). Quelle: Mayer P et al.7 33 Die Lipidakkumulation in den Adipozyten wird von charakteristischen Änderungen der Genexpression begleitet (Induktion der Expression von Adipozytenmarkern, Reduktion der Zytokinexpression), die den Effekten von Pioglitazon und den Sulfonylharnstoffen entsprechen. REFERENZEN 1. Spiegelman BM et al.: Obesity and the regulation of energy balance. Cell. 2001;104:531-534 2. Cypess AM et al.: Identification and importance of brown adipose tissue in adult humans. N Engl J Med. 2009;360:1509-1517 3. Saito M et al.: High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes. 2009;58:1526-1531 4. van Marken Lichtenbelt WD et al.: Cold-activated brown adipose tissue in healthy men. N Engl J Med. 2009;360:1500-1508 5. Virtanen KA et al.: Functional brown adipose tissue in healthy adults. N Engl J Med. 2009;360:1518-1525 6. Haas B et al.: Protein kinase G controls brown fat cell differentiation and mitochondrial biogenesis. Sci Signal. 2009;2(99):ra78 7. Mayer P et al.: Glitazone-like action of glimepiride and glibenclamide in primary human adipocytes. Diabetes Obes Metab. 2011;13:791-799 8. Lee G et al.: T0070907, a selective ligand for peroxisome proliferatoractivated receptor gamma, functions as an antagonist of biochemical and cellular activities. J Biol Chem. 2002;277:19649-19657 9. Choi JH et al.: Anti-diabetic drugs inhibit obesity-linked phosphorylation of PPARgamma by Cdk5. Nature. 2010;466:451-456 10. Heilbronn LK et al.: Adipose tissue macrophages, low grade inflammation and insulin resistance in human obesity. Curr Pharm Des. 2008;14:12251230 Es lag also die Vermutung nahe, dass Sulfonylharnstoffe – wie die Glitazone – PPARγ aktivieren können. PPAR – Peroxisom-Proliferator-aktivierte Rezeptoren – sind intrazelluläre Rezeptoren, die nach Aktivierung durch einen Liganden als Transkriptionsfaktoren die Expression einer Vielzahl von Genen regulieren. Tatsächlich ließen sich mit dem PPARγ-Antagonisten T0070907 sowohl die Wirkungen des Pioglitazons als auch die der beiden Sulfonylharnstoffe blockieren.7,8 Umgekehrt hemmte Diazoxid, der Antagonist der Sulfonylharnstoffe am ATP-abhängigen Kaliumkanal, die Fettzelldifferenzierung nicht. Die Konzentrationen von Glibenclamid und Glimepirid, die in vitro die Fettzelldifferenzierung induzierten, lagen im Bereich der therapeutischen Plasmakonzentrationen. Die Konzentration im Fettgewebe entspricht nicht notwendigerweise der Plasmakonzentration; dennoch ist es zum jetzigen Zeitpunkt nicht auszuschließen, dass zumindest einige Sulfonylharnstoffe ähnliche pharmakologische Wirkungen wie die Glitazone zeigen. Effekte von Antidiabetika auf die Phosphorylierung des Transkriptionsfaktors PPARγγ Glitazone werden wegen ihrer Nebenwirkungen zunehmend kritisch betrachtet. Ihr Wirkmechanismus, die Aktivierung des Transkriptionsfaktors PPARγ, führt zu Adipogenese und Gewichtszunahme, was zu den beobachteten kardiovaskulären Problemen beiträgt. Dies könnte aus den dargelegten Gründen auch für Sulfonylharnstoffe gelten. Es wurde kürzlich publiziert, dass möglicherweise nicht die gesteigerte Adipogenese, sondern eine veränderte Phosphorylierung von PPARγ die erwünschte Verbesserung der Insulinwirkung bringt.9 Der Einfluss von oralen Antidiabetika auf den Phosphorylierungsgrad von PPARγ und die klinischen Auswirkungen wurden bislang nicht untersucht. Glitazone und Sulfonylharnstoffe induzieren nicht nur Adipozytenmarker, sondern supprimieren auch Zytokine, wobei Letzteres die Insulinresistenz günstig beeinflussen sollte.10 Diese beiden Wirkungen, Adipogenese und Zytokinsuppression, könnten über eine geeignete Modulation des Phosphorylierungsmusters separierbar sein. Dadurch wäre gegebenenfalls eine Entwicklung von PPARγ-Liganden mit einem im Vergleich zu Glitazonen günstigeren Nutzen-Risiko-Verhältnis möglich. Am BfArM soll untersucht werden, ob bestimmte orale Antidiabetika oder strukturverwandte Substanzen das Phosphorylierungsmuster von PPARγ verändern und – wenn ja – welchen Einfluss dies auf die Zytokinexpression und Insulinsensitivität von humanen Adipozyten hat. FAZIT Die beschriebenen und geplanten Forschungsprojekte tragen zu einem weitergehenden Verständnis der molekularen Mechanismen der Fettzelldifferenzierung bei. Hierdurch können neue, möglicherweise unvorteilhafte Wirkungen auf dem Markt befindlicher Diabetesmedikamente erkannt und gezielt weiter untersucht werden. Gleichzeitig könnten sich auch Strategien für eine Optimierung des pharmakologischen Profils oder neue Ansatzpunkte für die Therapie des Diabetes mellitus und der Adipositas ergeben. Ausgabe 1 | März 2012 NEUES IN KÜRZE 34 RISIKOBEWERTUNGSVERFAHREN FÜR EISENHALTIGE INJEKTIONSMITTEL EINGELEITET – RISIKO FÜR ALLERGISCHE REAKTIONEN Gegenstand des europäischen Risikobewertungsverfahrens nach Artikel 31 ist ein möglicherweise erhöhtes Risiko für das Auftreten von schweren allergischen Reaktionen nach parenteraler Verabreichung von Eisenpräparaten. Das Bewertungsverfahren wurde eingeleitet, nachdem eine erhöhte Melderate von schweren allergischen Reaktionen im Anschluss an parenterale Gaben von niedermolekularem Eisendextran in Frankreich verzeichnet worden war. Eisendextran (Cosmofer®, in einigen anderen Mitgliedstaaten auch FERRISAT® genannt) ist ein nicht zentral zugelassenes Arzneimittel zur Behandlung eines Eisenmangels bei nachfolgenden Indikationen: •wenn orale Eisenpräparate nicht angewendet werden können, z.B. aufgrund von Unverträglichkeit oder bei nachgewiesener mangelnder Wirksamkeit einer oralen Eisentherapie sowie •bei klinischer Notwendigkeit zur raschen Auffüllung der Eisenspeicher. Eine Überprüfung der Berichtshäufigkeit im Zeitraum Februar 2004 bis März 2010 ergab, dass die Melderate für schwere allergische Reaktionen nach parenteraler Gabe von niedermolekularem Eisendextran weltweit bei 0,009 Fällen/1.000 DDD (definierte Tagesdosis) lag. Im Vergleich dazu war in Frankreich die Melderate des dort erst seit März 2008 auf dem Markt befindlichen Arzneimittels (Ferrisat®) mit 0,1 Fällen/1.000 DDD 100-mal höher. Im Zuge des hierzu begonnenen Risikobewertungsverfahrens möchte das BfArM noch einmal alle Ärzte auffordern, Verdachtsfälle von allergischen Reaktionen nach parenteraler Gabe von Eisenpräparaten gemäß den geltenden Verpflichtungen zu melden. Erforderliche Links zur Meldung von Verdachtsfällen finden Sie auf Seite 2 des Bulletins. ANGABEN ZUR INZIDENZ DER PROGRESSIVEN MULTIFOKALEN LEUKENZEPHALOPATHIE UNTER NATALIZUMAB (TYSABRI®) IN DEN USA UND EUROPA Anlass für einige Anfragen an das Paul-Ehrlich-Institut war eine aktuelle Änderung der US-amerikanischen Produktinformation zu dem monoklonalen Antikörper Natalizumab (Tysabri®) vom Januar 2012: Darin wird für eine Therapiedauer von 25 bis 48 Monaten bei Vorliegen aller Risikofaktoren (Anti-JCV-Antikörperstatus positiv und vorangegangene immunsuppressive Therapie) eine Inzidenz der progressiven multifokalen Leukenzephalopathie (PML) von elf auf 1.000 behandelte Patienten angegeben.1 Diese Berechnung beruht auf der Gesamtzahl aller internatio- nal erfassten PML-Fälle und unterscheidet sich damit nicht von der Art der Berechnung, die bereits früher in der EU durchgeführt und vom CHMP bewertet worden ist (April 2011). Auf der Basis der zu diesem Zeitpunkt vorliegenden Fälle wurde für die Gruppe der Patienten, die zuvor eine immunsuppressive Therapie erhalten hatten und mehr als 24 Monate behandelt worden waren, eine PML-Häufigkeit von neun auf 1.000 Patienten berechnet und in die europäische Fachinformation aufgenommen (Fachinformation Tysabri®, Stand: Juni 2011). Der Unterschied zu den aktuellen amerikanischen Angaben beruht also nicht auf einer unterschiedlichen Berechnungsweise, sondern darauf, dass zwischenzeitlich weitere PML-Fälle berichtet worden sind. Davon unabhängig weisen die Daten im internationalen Vergleich zurzeit darauf hin, dass die Häufigkeit von PML nach Tysabri® in Europa etwas höher ist als in den USA. Ein Grund dafür könnte der Unterschied des Anteils der Patienten mit immunsuppressiver Vorbehandlung in den USA und Europa sein. 1. www.tysabri.com/en_US/tysb/ site/pdfs/TYSABRI-pi.pdf MELDUNG VON SCHWERWIEGENDEN TRANSFUSIONSREAKTIONEN UND ZWISCHENFÄLLEN NUN AUCH ONLINE MÖGLICH Zukünftig können Meldungen zu schwerwiegenden Transfusionsreaktionen und schwerwiegenden Zwischenfällen nach der Gabe von Arzneimitteln aus Blut via Internet direkt an das Paul-Ehrlich-Institut gemeldet werden. Die Meldungen erfolgen über eine gesicherte elektronische Verbindung mit dem System humanweb.pei.de, das seit April 2009 schon zur Meldung von Verdachtsfällen unerwünschter Arzneimittelwirkungen und Impfkomplikationen zur Verfügung steht. Die elektronisch eingegangenen Meldungen werden direkt an die Hämovigilanz-Datenbank des PEI weitergeleitet und ausschließlich von Mitarbeitern des Paul-Ehrlich-Instituts bearbeitet. „Wir haben in den vergangen drei Jahren in der Pharmakovigilanz sehr gute Erfahrungen mit der anwenderfreundlichen Online-Meldung gemacht. Diese Form der Meldung von Verdachtsfällen ist für die Nutzer weniger aufwendig, da Ausdruck, Unterschrift sowie Versand per Fax oder Brief entfallen“, erläutert Prof. Klaus Cichutek, Präsident des PaulEhrlich-Instituts. „Wir sind deshalb zuversichtlich, mit Hilfe der Online-Meldung auch in der Hämovigilianz die Meldebereitschaft bei den Angehörigen der Gesundheitsberufe weiter zu steigern und damit einen Beitrag leisten zu können, die Arzneimittelsicherheit weiter zu verbessern“, so Cichutek. Wer die Adresse nicht von Hand eingeben will, findet den Link zu humanweb.pei. de mit dem Online-Formular in der Rubrik „Meldepflichtige“ auf den Internetseiten des PEI in der rechten Spalte unter „Meldedatenbanken“. Nach wie vor können auch die Meldeformulare, die unter www.pei.de/ haemovigilanz-formulare zur Verfügung stehen, genutzt und per Post oder als PDF-Datei per E-Mail verschickt werden. Zur Dokumentation des gemeldeten Falls können die PDF-Daten auf dem Server des Meldenden abgespeichert werden. Bei einer Folgemeldung (Formblatt 2a, 2b, 2c) sollte die vergebene PEI-Nummer eingetragen werden, um eine schnelle Zuordnung zu ermöglichen. 35 EMA PRÜFT KARDIOVASKULÄRE RISIKEN UNTER MS-THERAPIE MIT FINGOLIMOD (GILENYA®) Im Dezember 2012 wurde vom Zulassungsinhaber für Fingolimod (Gilenya®) eine UAW-Meldung mit tödlichem Ausgang bekannt gegeben. Es handelte sich um eine 59-jährige US-Amerikanerin mit Multipler Sklerose (MS), die 24 Stunden nach der ersten Einnahme des Immunsuppressivums Fingolimod verstarb. Der Kausalzusammenhang ist nicht eindeutig geklärt. Daraufhin hat die Europäische Zulassungsagentur (EMA) im Ausschuss für Humanmedizin (CHMP) und in der Pharmakovigilanz-Arbeitsgruppe (PhVWP) die erneute Überprüfung des Nutzen-Risiko-Profils unter besonderer Berücksichtigung der unerwünschten kardiovaskulären Wirkungen von Fingolimod veranlasst. Insgesamt wurden unter Therapie mit Fingolimod bisher 15 Todesfälle (MS-Patienten im Alter zwischen 33 und 59 Jahren) gemeldet, darunter fünf Patienten mit vorbestehenden kardio-vaskulären Risikofaktoren. Die jeweiligen Todesursachen der Patienten waren: drei Myokardinfarkte, ein Fall von Arrhythmie infolge von hypertensiver kardiovaskulärer Erkrankung, ein Schlaganfall, sechs Fälle ungeklärter Ursache, zwei Fälle von Ertrinken, zwei Fälle von Tod während des Schlafes. Ein möglicher Zusammenhang zwischen der Einnahme von Fingolimod und den berichteten plötzlichen Todesfällen wird derzeit untersucht. Fingolimod (Gilenya®) ist seit März 2011 in Europa für die Behandlung von hochaktiver schubförmig-remittierend verlaufender Multipler Sklerose bei Nichtansprechen auf Beta-Interferon oder bei rasch fortschreitendem, schwerem Verlauf zugelassen. Es ist das erste auf dem Markt verfügbare oral einzunehmende Arzneimittel für die Behandlung von MS. Fingolimod ist ein Antagonist der Sphingosin-1-Phosphat-Rezeptoren (S1P-Rezeptoren), die als transmembranäre, G-Protein-gekoppelte Oberflächenrezeptoren unterschiedliche Effekte im Körper vermitteln. Dazu gehören die Migration der Lymphozyten aus dem peripheren lymphatischen Gewebe. Durch die antagonistische Wirkung des Fingolimods wird die Infiltration pathogener Lymphozyten ins ZNS verringert und somit auch der dadurch vermittelten neuronalen Entzündung und Zerstörung von Nervengewebe bei der Multiplen Sklerose entgegengewirkt. S1P-Rezeptoren sind auch an der Regelung der Herzfrequenz und des vaskulären Tonus beteiligt. Eine Therapie mit Fingolimod führt insbesondere in den ersten sechs Stunden zu Beginn der Therapie zu einer vorübergehenden Senkung der Herzfrequenz, Verzögerung der AV-Überleitung und zu AV-Blockaden. Nach Markteinführung wurden 25 Fälle von AV-Blockaden (davon fünf AV-Blockaden III° und 17 AV-Blockaden II°, drei weitere nicht klassifiziert) berichtet. Alle AV-Blockaden traten in den ersten sechs Stunden nach Therapiebeginn auf. Die genauen Mechanismen der Wirkungen von Fingolimod auf den Sinus- und AV-Knoten sind noch nicht geklärt. Infolge der aufgetretenen Todesfälle und der kardiovaskulären Risiken wird derzeit von der EMA empfohlen, die Überwachung für alle mit Fingolimod behandelten Patienten während der ersten sechs Stunden nach der ersten Einnahme zu intensivieren. Diese Überwachung beinhaltet ein EKG-Monitoring für sechs Stunden bei allen Patienten und zusätzlich stündliche Kontrollen von Blutdruck und Herzfrequenz. Bei Auftreten kardiovaskulärer Symptome sollte das intensive Monitoring fortgesetzt werden, bis diese abgeklungen sind. Da auch MS-Patienten ohne kardiovaskuläre Vorerkrankungen von Nebenwirkungen wie AV-Blockaden betroffen sind, ist diese Überwachung für alle Patienten vorgeschrieben. Die Einnahme von Herzfrequenz senkenden Arzneimitteln, wie Betablockern und CaAntagonisten, scheint das Risiko kardialer Nebenwirkungen zu erhöhen. Für Patienten mit kardiovaskulären Risiken sind bereits Warnhinweise in der Produktinformation enthalten. Die Hinweise zur Intensivierung der Überwachung der Patienten wurden in einem Rote-Hand-Brief den behandelnden Ärzten mitgeteilt. Folgende Veränderungen der Fach- und Gebrauchsinformationen werden derzeit diskutiert: •die Aufnahme zusätzlicher Kontraindikationen bezüglich Patienten mit kardiovaskulären Vorerkrankungen •die Verlängerung der Intensiv­ü ber­ wachung auf bis zu 24 Stunden •die Aufnahme zusätzlicher Warnhinweise zum Auftreten von AV-Blockaden III°. Von noch nicht abgeschlossenen Langzeitstudien werden weitere Daten zur kardiovaskulären Sicherheit erwartet. Zusätzliche Studien zur Untersuchung von Patienten mit kardialen Vorerkrankungen sowie zur Dosistitration zu Therapiebeginn werden derzeit als weitere Maßnahmen diskutiert beziehungsweise geplant. Die Ergebnisse der weiteren Risikobewertung von Gilenya® und ein Beschluss der EMA über zusätzliche Maßnahmen sind voraussichtlich noch im März zu erwarten. NEUE INFORMATIONEN ZU PSURS (PERIODIC SAFETY UPDATE REPORTS) IM BEREICH PHARMAKOVIGILANZ DER BFARM-HOMEPAGE Seit dem 31.01.2012 gibt es im Bereich Pharmakovigilanz der BfArM-Homepage die neue Rubrik „Periodic Safety Update Reports (PSURs)“. Hier finden Sie Hinweise und FAQs zur Einreichung von PSURs sowie Informationen zum europäischen PSUR-Worksharing Verfahren (WSP). Besonders hinweisen möchten wir auf die hier veröffentlichten Core Safety Profiles (CSPs) aus abgeschlossenen WSPVerfahren. www.bfarm.de AKTUELLE RISIKOINFORMATIONEN 12.03.2012 VFEND® 200 MG PULVER ZUR HERSTELLUNG EINER INFUSIONSLÖSUNG (VORICONAZOL): LIEFERENGPASS Pfizer Pharma GmbH berichtet in einem Informationsbrief über einen vorübergehenden Lieferengpass und empfiehlt, den Einsatz des Produktes auf Patienten ohne alternative Therapiemöglichkeiten zu beschränken. 08.03.2012 ONGLYZA® (SAXAGLIPTIN): RISIKO SCHWERWIEGENDER ÜBEREMPFINDLICHKEITSREAKTIONEN UND AKUTER PANKREATITIS Bristol-Myers Squibb/ Astra Zeneca EEIG berichten in einem Informationsbrief über Fälle von schwerwiegenden Überempfindlichkeitsreaktionen, einschließlich Angioödemen und anaphylaktischen Reaktionen, sowie Fälle von akuter Pankreatitis im Zusammenhang mit der Anwendung von Onglyza®. Die Produktinformation wurde entsprechend angepasst. 06.03.2012 BENLYSTA® (BELIMUMAB): VERZÖGERTE SCHWERE ÜBEREMPFINDLICHKEITSREAKTIONEN GlaxoSmithKline informiert in einem Rote-Hand-Brief über das zeitlich verzögerte (mehrere Stunden) Auftreten von schweren Überempfindlichkeitsreaktionen nach der Infusion von Benlysta®. Auch das Wiederauftreten signifikanter Reaktionen nach initial angemessener symptomatischer Behandlung wurde beobachtet. Benlysta® darf nur in geeigneten Einrichtungen unter verlängerter klinischer Aufsicht der Patienten angewendet werden. 05.03.2012 HALAVEN® (ERIBULIN): GEFAHR VON DOSIERUNGSFEHLERN Eisai GmbH berichtet in einem Informationsbrief über die Gefahr von Dosierungsfehlern bei der Behandlung mit Halaven®, da die Dosisangaben für das Arzneimittel in einigen Regionen außerhalb der EU und in manchen Publikationen von den Produktinformationen in der EU abweichen. Bei der Verordnung und Abgabe in der EU ist die hier geltende Produktinformation mit einer empfohlenen Halaven®-Dosis von 1,23 mg/m2 zu beachten, die sich auf die Base des Wirkstoffs Eribulin bezieht. 27.02.2012 05.01.2012 RASILEZ®, RASILEZ HCT® UND RASILAMLO® (ALISKIREN): POTENZIELLES RISIKO FÜR KARDIOVASKULÄRE ODER RENALE UNERWÜNSCHTE EREIGNISSE Novartis Pharma GmbH informiert in zwei Rote-Hand-Briefen über das mögliche Auftreten von kardiovaskulären oder renalen unerwünschten Ereignissen bei Patienten mit Typ-2-Diabetes und Nierenfunktionsstörungen und/oder kardiovaskulären Erkrankungen, die mit Aliskiren-haltigen Arzneimitteln behandelt werden. Aufgrund der Erkenntnisse aus der vorzeitig beendeten ALTITUDE-Studie wurde die Fachinformation aktualisiert durch Aufnahme neuer Gegenanzeigen und Warnhinweise bezüglich der Anwendung von Aliskiren-haltigen Arzneimitteln in Kombination mit ACE-Hemmern oder Angiotensin-Rezeptor-Blockern. 24.02.2012 VICTRELIS® (BOCEPREVIR): ARZNEIMITTELINTERAKTIONEN MIT RITONAVIR-GEBOOSTERTEN HIV-PROTEASEINHIBITOREN MSD Sharp & Dohme GmbH informiert in einem Rote-Hand-Brief über die Resultate einer pharmakokinetischen Studie bei gesunden Freiwilligen. Die gleichzeitige Anwendung von Boceprevir mit Ritonavir(Rtv)-geboostertem Atazanavir, Darunavir oder Lopinavir führte zu einer deutlichen Abnahme der Plasmakonzentrationen dieser HIV-Proteaseinhibitoren. Die Plasmakonzentrationen von Boceprevir nahmen bei gleichzeitiger Anwendung mit Lopinavir/Rtv um 45% sowie bei gleichzeitiger Anwendung mit Darunavir/Rtv um 32% ab. Dagegen führte die gleichzeitige Anwendung von Atazanavir/Rtv und Boceprevir zu keiner nennenswerten Änderung der Plasmakonzentration von Boceprevir. Die Fachinformation von Victrelis® wurde entsprechend aktualisiert. 09.02.2012 28.11.2011 02.02.2012 UKRAIN: VERBOT IN DEUTSCHLAND Das BfArM stuft Ukrain als bedenkliches Arzneimittel ein. Nach aktuellem wissenschaftlichem Sachstand besteht der begründete Verdacht, dass Ukrain bei dem vom Hersteller vorgesehenen Gebrauch schädliche Wirkungen hat, die über ein vertretbares Maß hinausgehen. Diese Einstufung hat zur Folge, dass Ukrain in Deutschland weder als Arzneimittel in Verkehr gebracht noch bei Patienten angewendet werden darf. Das BfArM weist insbesondere Angehörige von Heilberufen darauf hin, dass damit auch der Import von Ukrain verboten ist. Ausführlichere Informationen finden Sie in der Risikoinformation des BfArM zu Ukrain vom 28.11.2011. MIRCERA® (METHOXY-POLYETHYLENGLYCOL-EPOETIN BETA): MÖGLICHE LIEFERENGPÄSSE Roche Pharma AG berichtet in einem Informationsbrief über mögliche Lieferengpässe von Mircera® 100 MCG ab dem 15.02.2012. Die Fachkreise werden aufgefordert, für Patienten, die derzeit eine Behandlung mit Mircera® 100 MCG erhalten, ein anderes Erythropoetin-stimulierendes Arzneimittel (ESA) zu verschreiben und neuen Patienten kein Mircera® 100 MCG zu verordnen. Der Grund ist ein Produktionsproblem in der Herstellungsstätte der Polyethylenglykol-Komponente. 16.01.2012 VELCADE® (BORTEZOMIB): APPLIKATION DARF NUR INTRAVENÖS ERFOLGEN JANSSEN-Cilag GmbH weist in einem Informationsbrief darauf hin, dass die Verabreichung von Bortezomib ausschließlich intravenös erfolgen darf. Hintergrund für den Informationsbrief ist, dass seit der Erstzulassung von VELCADE® in den USA 2003 weltweit drei Fälle einer versehentlichen intrathekalen Applikation mit tödlichem Ausgang berichtet wurden. Mehr zu Risikoinformationen sowie aktuelle Veröffentlichungen aus dem Bundesanzeiger finden Sie auf den Seiten zu Risikoinformationen der beiden Bundesinstitute: BfArM: www.bfarm.de --> Pharmakovigilanz (Arzneimittelsicherheit) --> Risikoinformationen; PEI: www.pei.de/rhb LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG LINK ZUM BEITRAG