Der HIV-Resistenz auf der Spur
Werbung

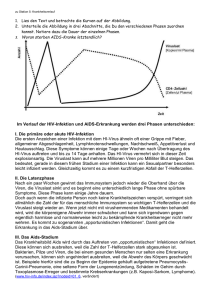
Diagnostik im Dialog • Ausgabe 45 • 12/2014 | HIV-Resistenz | Medizin Der HIV-Resistenz auf der Spur Dipl. Biotech. Anja Seffner, Dr. rer. nat. Michael Weizenegger und Dr. med. Jan Bartel, MVZ Labor Dr. Limbach und Kollegen, Heidelberg fotolia/ivan kmit Unter dem Selektionsdruck eingenommener Medikamente können sich resistente HIVMutanten entwickeln. Retroviren wie das HI-Virus besitzen keine Proof-Reading-Aktivität in ihren Replikationssystemen, d. h. falsch eingebaute Nukleotide werden nicht entfernt. Mutationen sind häufig und so entstehen permanent Gemische aus genetisch unterschiedlichen Viren. Unter dem Selektionsdruck eingenommener Medikamente bilden sich resistente Mutanten. Das Ziel der Therapie ist daher, die Replikation der Viren zu unterdrücken. Der Erfolg lässt sich über den quantitativen Nachweis der HIVRNA kontrollieren. Kommt es unter Therapie zum erneuten Anstieg der Viruslast, hilft die Sequenzierung der Viren-RNA bei der Frage, ob sich resistente Mutanten gebildet haben und gegebenenfalls ein Medikamentenwechsel angezeigt ist. Bei dieser wichtigen Diagnostik ist das „Next Generation Sequencing“ (NGS) mit seiner höheren Sensitivität der traditionellen Sanger-Methode überlegen. In Deutschland leben aktuell etwa 80 000 Menschen mit einer HIV-Infektion. Davon befinden sich ca. 50 000 in einer antiviralen Therapie.1 Seit Beginn der Epidemie sind weltweit mehr als 30 Millionen Menschen an den Folgen einer AIDS-Erkrankung gestorben.2 HI-Viren können sich nur innerhalb einer Wirtszelle vermehren. Die Infektion der humanen Zellen geschieht durch Anlagerung von Virushüllproteinen an die CD4Rezeptoren von T-Helferzellen. Zwei Chemokin-Rezeptoren (CCR5 oder CXCR4) unterstützen als Co-Rezeptoren den Eintritt des Virus in die Zelle. Sie überführen die viralen Hüllproteine in eine für die Membranfusion günstige Konformation. Die eingeschleuste Virus-RNA wird von der Reversen Transkriptase in DNA umgeschrieben und anschließend von der viralen Integrase in das humane Genom im Zellkern integriert. Behandlung von HIV-Infektionen Die Behandlung der HIV-Infektion erfolgt mithilfe einer „Hochaktiven antiretroviralen Therapie“ (HAART). Ihr Ziel: die vollständige Hemmung der Virusreplikation und somit die Senkung der Viruslast unter die diagnostische Nachweisgrenze. Das erste, für die HIV-Behandlung zugelassene, antivirale Medikament kam Ende der 1980er Jahre auf den Markt. Allerdings entwi- ckelten die Patienten unter dieser Monotherapie schnell Resistenzen. Inzwischen wird mit einer Kombination aus mehreren anti-retroviralen Wirkstoffen behandelt, um den Prozess des Viruseintritts und der Virusvermehrung zu hemmen. Anhand ihres Angriffsortes im viralen Replikationszyklus werden folgende Medikamentenklassen unterschieden: OProteasehemmer OReverse-Transkriptase- (RT-) Hemmer mit einer weiteren Unterteilung in Nukleosidische (NRTI) und Nicht-Nukleosidische Reverse-Transkriptase-Hemmer (NNRTI) OIntegrasehemmer OEntry Inhibitoren, die den Eintritt der Viren in die humanen Zellen blockieren. Etablierte Therapieregimes kombinieren zwei NNRTI mit jeweils einem Proteasehemmer oder einem NRTI.3 Seit einiger Zeit kommen zusätzlich Kombinationen mit Integrasehemmern und Entry-Inhibitoren zum Einsatz. Je effektiver die Hemmung der Virusreplikation gelingt, umso besser kann sich das Immunsystem erholen und die Progression zu AIDS verlangsamt werden. 13 Medizin | HIV-Resistenz | Diagnostik im Dialog • Ausgabe 45 • 12/2014 Roche Next Generation Sequencing detektiert sensitiv medikamentenresistente Virusvarianten. Das ermöglicht frühzeitige Therapieanpassungen bzw. optimiert das initiale Therapieregime. Die Replikation des Virusgenoms ist keiner Korrektur durch eine Exonuklease unterworfen. Damit wird der Einbau eines nicht-komplementären Nukleotids nicht korrigiert. Nach den Ergebnissen verschiedener Studien liegt alleine die Fehlerrate der RT bei etwa 3x10-5. Pro Replikation des 10-kB-Virusgenoms ergeben sich somit ca. 0,3 Nukleotidaustausche.4 Dabei entstehen mehrheitlich „defekte“, nicht vermehrungsfähige Viren. Resistenzen können entstehen, wenn die Konzentration der Medikamente am Wirkort zu niedrig ist. Eine Ursache hierfür kann die mangelnde Adhärenz des Patienten bei der Medikamenteneinnahme sein. Auf molekularer Ebene sind Punktmutationen in den Genen der viralen Replikationsenzyme für die Resistenzen verantwortlich. Dadurch kann sich die Konformation der Enzyme ändern. Als Folge versagt die therapeutische Wirksamkeit der Medikamente und die HI-Viruslast im Blut steigt an. Je länger dann mit geringerer antiviraler Wirkung therapiert wird, desto mehr kann sich diese Virus-Variante genetisch anpassen (kompensatorische Mutationen) und in der Gesamtpopulation ausbreiten. Werden bei 14 zwei aufeinanderfolgenden Viruslastbestimmungen Viren im Blut nachgewiesen, wird dies als „virologisches Therapieversagen“ bezeichnet (Abb. 1).3 Die Wirkstoffklassen unterscheiden sich in ihrem Vermögen, Resistenzen zu provozieren. Während bei einigen NNRTI eine einzelne gezielte Virus-Mutation für den Verlust der therapeutischen Wirksamkeit ausreicht, zeigen die Proteaseinhibitoren eine höhere genetische Barriere. Sie werden erst dann unwirksam, wenn ein Virus gleichzeitig mehrere Resistenzmutationen aufweist. Goldstandard zur Identifizierung der für das Therapieversagen verantwortlichen Gensequenzen ist bislang die Sanger-Sequenzierung. Hierbei werden allerdings Virusgemische sequenziert. Dadurch lassen sich nur Virusvarianten mit einem Anteil von mindestens 20 % an der Gesamtpopulation erfassen. Hier bieten die neuen NGS-Techniken, z. B. auf dem GS Junior Resistenzbildung bei HIV Medikamenten-sensitive HI-Viren Resistente Viren Resistenztestung HIV-Resistenzen können übertragen oder erworben werden. In Deutschland beträgt die Neuinfektionsrate mit bereits resistenten Viren etwa 10 %.5 Die Leitlinien der Deutsch-Österreichischen AIDS-Gesellschaft (Stand Mai 2014) enthalten daher folgende Empfehlungen für den Zeitpunkt einer genotypischen Resistenztestung: Oprimäre oder kürzliche Infektion Ochronische Infektion, vor Therapiebeginn Ovor Therapiewechsel Oin oder nach einer Therapiepause Obei umfangreicher antiretroviraler Vorbehandlung, nach Therapieversagen. Therapiebeginn Viruslast Medikamentenresistenzen Nachweisgrenze Zeit Abb. 1: Resistenzentwicklung im Krankheitsverlauf. Mit Beginn der Therapie fällt die Viruslast ab, da Medikamenten-sensitive Viren verschwinden. Im Therapieverlauf können sich resistente Viren ausbreiten und die Viruslast wieder steigen lassen. Diagnostik im Dialog • Ausgabe 45 • 12/2014 | HIV-Resistenz | Medizin System, deutliche Vorteile. Mithilfe der klonalen Amplifizierung und hochparallelen Sequenzierung wird für jedes einzelne Virus der Population eine Sequenz erzeugt. Theoretisch können damit alle vorhandenen Varianten und Minoritäten (bis hin zu einem einzigen Virusgenom) detektiert werden. Ein eventueller Resistenznachweis gelingt somit wesentlich früher. Für NNRTI wurde gezeigt, dass auch Virus-Minoritäten unterhalb der Detektionsgrenze der Sangersequenzierung klinische Relevanz haben können.6 Das sehr kompakte GS Junior System produziert im Schnitt circa 100 000 Sequenzen gleichzeitig, sodass mehrere Proben parallel mit mehrfach tausendfacher „Abdeckung“ sequenziert werden können. Jeder Probe wird während der vorbereitenden PCRSchritte eine spezifische Barcodesequenz angehängt. Auf dieser Basis werden die generierten Sequenzen nach Proben sortiert und gegen eine Referenz aligniert. So lassen sich Unterschiede zum Wildtyp-Genom finden. Um technische Artefakte zu eliminieren, fordert die Analysesoftware sowohl die Bestätigung einer Mutation durch eine Mindestanzahl von Einzelsequenzen als auch das Auftreten der Mutation in beiden komplementären Strängen. Zuletzt bringt der Abgleich der gefundenen Mutationen mit einer Datenbank die Klassifizierung in resistenzrelevante und andere Co-Mutationen. Die behandelnden Ärzte erhalten einen Befund, der die nachgewiesenen Mutationen auflistet und nach ihrer Resistenzrelevanz klassifiziert. Zusätzlich enthält der Befund Informationen, welche Medikamente diese Resistenzmutation beeinflusst und welche Medikamente alternativ zur Verfügung stehen. Fazit Die Forschung setzt NGS seit mehreren Jahren extensiv ein. In Diagnostiklaboratorien steht die Technologie noch am Anfang ihrer Anwendung. Doch auch hier wird das NGS für immer mehr Indikationen entdeckt. Im Falle der HIV-Infektion detektiert die Methode der ultratiefen DNA-Sequenzierung medikamentenresistente Virusvarianten in therapieerfahrenen Patienten früher und mit höherer Sensitivität. Das ermöglicht frühzeitige Therapieanpassungen. Im Falle von behandlungsnaiven Patienten lässt sich die initiale Wahl des Therapieregimes verbessern. Literatur 1Epidemiologisches Bulletin, Robert Koch-Institut: Ausgabe 11. Nov 2013 / Nr. 45 2http://www.unaids.org/en/media/unaids/contentassets/ documents/document/2011/20110204_HLM_Brochure_ en.pdf 3Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion (Stand Mai 2014) 4Boyer J et al.: Proc. Natl. Acad. Sci. USA (1992); 89:6919– 6923 5Knyphausen F et al.: PloS ONE 9(5): e95956. Doi:10.1371/ journal.pone.0095956 6Simen et al.: JID 2009; 199:693–701 Das MVZ Labor Dr. Limbach & Kollegen in Heidelberg ist ein führender Anbieter laboratoriumsmedizinischer Diagnostik. 1979 gegründet, betreuen mehr als 50 Ärzte und Naturwissenschaftler am Standort Heidelberg mit ihren Mitarbeitern Krankenhäuser und niedergelassene Kollegen in den Fachbereichen. OMikrobiologie OImmunologie OInfektionsepidemiologie OTransfusionsmedizin OAnalytische Chemie OHygiene OUmweltmedizin Das MVZ Dr. Limbach und Kollegen ist Teil der „Limbach Gruppe“ mit 30 Standorten deutschlandweit. Damit kann eine bundesweite, dezentralisierte Diagnostik der Maximalversorgung angeboten werden. Korrespondenzadressen Anja Seffner Leiterin Sequencing Unit Labor Limbach [email protected] Dr. rer. nat. Michael Weizenegger Leiter PCR-Diagnostik / Molekulare Genetik Dr. med. Jan Bartel Ärztlicher Leiter Abteilung für Immunologie, Infektionsserologie und Genetik Medizinisches Versorgungszentrum, Labor Dr. Limbach und Kollegen, Im Breitspiel 15, 69126 Heidelberg 15