DRI® Thyroxin (T4)-Assay - Thermo Fisher Scientific
Werbung

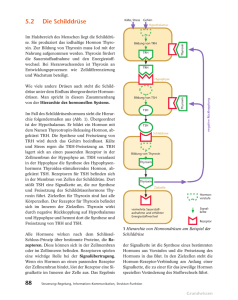
DRI® Thyroxin (T4)-Assay Zur In-vitro-Diagnostik 0454 (100 ml-Kit) 10013070 (500 ml-Kit) Verwendungszweck Thyroxin ist lichtempfindlich. Bewahren Sie alle Thyroxin enthaltenden Reagenzien (Enzymkonjugatoren, Kalibratoren, Kontrollproben und Patientenproben) so auf, dass sie weitgehend vor direktem Sonnenlicht geschützt sind. Zusammenfassung und Erläuterung des Tests Falls angelieferte Packungen beschädigt sind, wenden Sie sich an Ihren Ansprechpartner für Technischen Support. Dieser homogene Thyroxin-Enzym-Immuno-Assay dient zur quantitativen Bestimmung des Gesamt-Thyroxins im Humanserum oder Humanplasma. Thyroxin (T4) wird in den Follikeln der Schilddrüse gebildet und über ein komplexes Regelungssystem in das Blut abgegeben 1. Die Schilddrüse wird durch das von der Hirnanhangdrüse gebildete Thyreoidea-stimulierende Hormon (TSH) reguliert. Produktion und Abgabe von TSH durch die Hirnanhangdrüse erfolgt durch das vom Hypothalamus freigesetzte Thyreotropin Releasing Hormon (TRH). Das meiste Thyroxin im Blut ist in erster Linie an Thyroxin-bindendes Globulin (TBG) und in geringeren Mengen an Thyroxin-bindendes Albumin und Thyroxin-bindendes Präalbumin gebunden2,3. Lediglich weniger als 1 % des Thyroxins liegt ungebunden als freies T4 im Blut vor. Ein erhöhter Gesamt-Thyroxin-Gehalt kann auf eine Hyperthyreose hinweisen, bei der ein Überangebot an Schilddrüsenhormonen im Blut vorliegt, und ein verringerter Gesamt-ThyroxinGehalt kann auf eine Hypothyreose hinweisen, bei der es zu einer Unterversorgung mit Thyroxin kommt. Eine anormale Thyroxin-Konzentration im Blut wird primär durch eine Funktionsstörung der Schilddrüse oder andere Krankheiten verursacht, die sich auf das Regelungssystem Schilddrüse-Hirnanhangdrüse-Hypothalamus auswirken. Die Messung der Gesamt-ThyroxinKonzentration (freies plus Protein-gebundenes) ist eines der am meisten genutzten Verfahren für die Einschätzung des Zustands der Schilddrüse eines Menschen4. Vorbereitung und Lagerung der Reagenzien Die Reagenzien sind gebrauchsfertig. Eine Aufbereitung von Reagenzien ist nicht erforderlich. Alle Komponenten des Assays sind bei ordnungsgemäßer Lagerung bei 2 bis 8 °C bis zu dem auf dem Etikett angegebenen Verfallsdatum stabil. Probennahme und -handhabung Für diesen Assay kann Serum oder Plasma verwendet werden. Es wurde festgestellt, dass Antikoagulanzien wie Heparin, Zitrate, Oxalat und EDTA den Assay nicht beeinträchtigen. Es sollten bevorzugt frische Serumproben verwendet werden. Ist keine sofortige Analyse der Probe möglich, kann die Probe im Kühlschrank bis zu einer Woche lang oder tiefgefroren bis zu einem Monat lang aufbewahrt werden. Wiederholtes Einfrieren und Auftauen der Probe ist zu vermeiden. Es sind Maßnahmen zu ergreifen, um Proben frei von groben Verschmutzungen zu halten. Es wird empfohlen, Proben vor der Analyse mit hoher Geschwindigkeit zu zentrifugieren. Alle Serum- und Plasmaproben sind wie potenziell infektiöses Material zu behandeln.5 Beim DRI® Thyroxin-Assay handelt es sich um einen homogenen Enzym-Immuno-Assay anhand gebrauchsfertiger flüssiger Reagenzien. Bei diesem Assay wird das Thyroxin mit Hilfe von 8-Anilinonaphthalin-1-sulfonsäure (ANS) von den Transportproteinen im Plasma abgespaltet. Das abgespaltete Thyroxin in der Probe lässt man mit einem mit dem Enzym Glucose-6-phosphatdehydrogenase (G6PDH) markierten Thyroxin um eine fest bekannte Menge an Thyroxinspezifischen Antikörper-Bindungsstellen in der Lösung konkurrieren. Liegt in der Probe kein Thyroxin vor, wird das G6PDH-markierte Thyroxin an den spezifischen Antikörper gebunden, wodurch die Enzymaktivität unterdrückt wird. Durch dieses Phänomen entsteht eine Beziehung zwischen der Thyroxin-Konzentration in der Probe und der Enzymaktivität. Die Aktivität des Enzyms G6PDH wird anhand der spektrophotometrischen Messung (bei 340 nm) seiner Fähigkeit zur Umsetzung von Nicotinamid-Adenin-Dinucleotid (NAD) zu NADH bestimmt. Hilfsmittel Packungsinhalt Qualitätskontrolle und Kalibrierung Antikörper-/Substratreagenz: Enthält monoklonale anti-Thyroxin-Antikörper, 8-AnilinonaphthalinSulfonsäure (ANS), Glukose-6-Phosphat (G6P) und Nicotinamid-Adenin-Dinucleotid (NAD) in Tris-Puffer mit Natriumazid als Konservierungsmittel. Enzymkonjugatreagenz: Enthält mit Glucose-6-phosphat-dehydrogenase (G6PDH) markiertes Thyroxin in Tris-Puffer mit Natriumazid als Konservierungsmittel. Kalibratoren (gesondert zu erwerben) Thyroxin-Kalibrator-Kit (Kat.-Nr. 0476): Enthält jeweils 2 ml negative, 2 µg/dl, 4 µg/dl, 8 µg/dl, 12 µg/ dl und 20 µg/dl Thyroxin-Kalibratoren in Humanserum mit Natriumazid als Konservierungsmittel. Zur Durchführung dieses homogenen Enzym-Immuno-Assays können Analysegeräte für die klinische Chemie verwendet werden, die funktional in der Lage sind, die Temperatur konstant zu halten, Proben zu pipettieren, Reagenzien zu mischen, die Geschwindigkeit der Enzymaktivitäten bei 340 nm zu messen und die Reaktionszeiten genau einzuhalten. Durchführung des Assays Für die Durchführung dieses homogenen Enzym-Immuno-Assays eignen sich Analysegeräte für die klinische Chemie, die die oben aufgeführten Eigenschaften aufweisen. Informieren Sie sich vor der Durchführung eines Assays anhand der speziellen Anwendungsanleitung zum Assay und über die konkreten Parameter für das jeweilige Analysegerät. Gute Laborpraxis sieht vor, Kontrollproben zu untersuchen, um die Kalibrierung zu validieren und um sicherzustellen, dass der Assay richtige Ergebnisse liefert. Zu diesem Zweck steht eine Vielzahl von Kontrollproben im Handel zur Verfügung. Vergewissern Sie sich, dass die Kontrollergebnisse innerhalb des vorgegebenen Bereichs liegen. Das System ist erneut zu kalibrieren, wenn neue Reagenzien verwendet werden oder wenn die Kontrollwerte außerhalb des vorgegebenen Bereichs liegen. Alle Qualitätskontrollen müssen in Übereinstimmung mit den örtlich geltenden Gesetzen und Bestimmungen bzw. Zulassungsbestimmungen durchgeführt werden. Ergebnisse und Interpretation der Daten Vorsichtsmaßnahmen und Warnhinweise Dieser Test ist ausschließlich für die In-vitro-Diagnostik vorgesehen. Die Reagenzien sind bei Verschlucken gesundheitsschädlich. GEFAHR: Der DRI Thyroxin (T4)-Assay enthält ≤ 0,1 % Rinderserumalbumin (BSA). H317 – Kann allergische Hautreaktionen verursachen. H334 – Kann bei Einatmen Allergie, asthmaartige Symptome oder Atembeschwerden verursachen. Einatmen von Staub/Rauch/Gas/Nebel/Dampf/Aerosol vermeiden. Kontaminierte Arbeitskleidung nicht außerhalb des Arbeitsplatzes tragen. Schutzhandschuhe/ Schutzkleidung/Augenschutz/Gesichtsschutz tragen. Bei unzureichender Belüftung Atemschutz tragen. Bei Berührung mit der Haut: Mit viel Wasser und Seife waschen. Bei Einatmen: Bei Atembeschwerden an die frische Luft bringen und in einer Position ruhigstellen, die das Atmen erleichtert. Bei Hautreizung oder -ausschlag: Ärztlichen Rat einholen/ärztliche Hilfe hinzuziehen. Bei Symptomen der Atemwege: Giftinformationszentrum oder Arzt anrufen. Kontaminierte Kleidung vor erneutem Tragen waschen. Inhalt/Behälter gemäß lokalen/ regionalen/nationalen/internationalen Vorschriften der Entsorgung zuführen. Die Reagenzien des Assays enthalten ≤ 0,09 % Natriumazid. Kontakt mit Haut und Schleimhäuten vermeiden. Betroffene Stellen mit viel Wasser spülen. Bei Augenkontakt oder Verschlucken sofort einen Arzt aufsuchen. Natriumazid kann mit Blei- oder Kupferrohren reagieren und potenziell explosive Metallazide bilden. Bei der Entsorgung solcher Reagenzien ist immer mit großen Mengen Wasser nachzuspülen, um eine Ansammlung von Aziden zu verhindern. Freiliegende Metallflächen mit 10 %iger Natriumhydroxidlösung reinigen. Nach Ablauf des Haltbarkeitsdatums dürfen die Reagenzien nicht mehr verwendet werden. Die Ergebnisse für die Thyroxin-Konzentration in der Probe werden vom Analysegerät für die klinische Chemie automatisch berechnet. Es ist keine zusätzliche Bearbeitung von Daten erforderlich. Proben mit einer Konzentration größer als 20 μg/dl können als „> 20 μg/dl“ aufgeführt oder mit Hilfe des negativen Kalibrators verdünnt werden. Der Wert für die verdünnte Probe wird durch Multiplizieren des Ergebnisses mit dem Verdünnungsfaktor ermittelt. Die Zusammenhänge zwischen der Thyroxin-Konzentration im Serum bzw. Plasma und der klinischen Symptomatik des Patienten können durch eine Vielzahl von Faktoren beeinflusst werden. Dazu gehören Geschlecht, Alter und Gesundheitszustand des Patienten, eine Behandlung mit bestimmten Medikamenten, nicht unmittelbar mit der Schilddrüse in Zusammenhang stehende Krankheiten, Schwangerschaft, Einnahme von Östrogen oder Kontrazeptiva und eine genetische bedingte Überhöhung oder Unterschreitung der Konzentration an Thyroxin-bindendem Globulin (TBG). Unter den oben aufgeführten Umständen sollte die Bestimmung des Gesamt-Thyroxins lediglich als einleitendes Screening-Verfahren eingesetzt werden.1 Eine exakte Diagnose des Zustands der Schilddrüse muss durch andere diagnostische Tests wie FTI (Freies-T4-Index), TSH, T3, TRH usw. ergänzt werden und die klinische Bewertung durch den Arzt erfolgen. Erwartete Werte Der Bereich für die T4-Konzentration bei offensichtlich gesunden Menschen wurde auf 4,5 bis 12 μg/dl festgelegt. Da „Normalbereiche“ von Alter, Geschlecht, Ernährungsweise, geografischer Lage und weiteren Faktoren abhängig sind, sollte jedes Labor seine eigenen Erwartungswerte für dieses Verfahren aufstellen. Literatur Einschränkungen 1.Ingbar SH, Woeber KA. The Thyroid Gland. In: Text Book of Endocrinology. Williams RH. ed. Philadelphia, PA; WB Saunders Company, 95 (1974) 2. Robbins J. „Thyroxine-Binding Protein in Serum“ In: Laborator Diagnosis of Endocrine Disease. Saunderman and Saunderman eds., St. Louis, MO; Warren H. Green, Inc., 221 (1971) 3. Larsen PR, et al. „Imunoassay of Thyroxine in Unextracted Human Serum“ J. Clin. Endocrinol. Metal., 37, 177 (1973) 4. Penney M, O’Sullivan J. Total or Free Thyroxine as a Primary Test of Thyroid Function. Clin. Chem., 33, 170 (1987) 5.Centers for Disease Control/National Institutes of Health manual „Biosafety in Microbiological and Biomedical Laboratories“, 1988 Die Sensitivität, definiert als die geringste Konzentration, die mit einer Verlässlichkeit von 95 % vom Negativkalibrator unterschieden werden kann, beträgt 0,7 µg/dl. Dieses Assay ist ausschließlich auf die Bestimmung von Thyroxin in Serum oder Plasma ausgelegt, nicht für die Thyroxinbestimmung in Vollblutproben. In seltenen Fällen weisen Patienten Auto-Antikörper auf, die den Assay beeinträchtigen und zu fälschlicherweise zu niedrigen Testergebnissen führen. Typische Leistungsdaten Die folgenden typischen Leistungsdaten wurden mit dem Analysegerät Hitachi 717 für klinische Chemie gewonnen: Präzision Die Wiederholpräzision und Laborpräzision wurden anhand von T4-Serum-Kontrollproben mit drei verschiedenen Konzentrationen ermittelt. Anhand eines modifizierten CLSI-Protokolls zur Präzision wurden je 6 identische Proben je Durchlauf zweimal täglich und an 5 Tagen getestet, wodurch sich ein N = 60 ergibt. Konzentration Wiederholpräzision Laborpräzision n = 60 Mittelwert (μg/dl) SD (μg/dl) CV % SD (μg/dl) CV % 1 4,1 0,14 3,4 0,28 6,9 2 11,0 0,41 3,7 0,81 7,4 3 16,2 0,62 3,8 1,05 6,5 Sensitivität Die Sensitivität, definiert als die geringste Konzentration, die mit einer Verlässlichkeit von 95 % vom Negativkalibrator unterschieden werden kann, beträgt 0,7 µg/dl. Genauigkeit Es wurden 108 klinische Proben mit T4-Konzentrationen von 1,3 μg/dl bis 87,1 μg/dl mit dem DRI Thyroxin EIA-Assay und einem in Handel erhältlichen T4-Assay analysiert. Es wurden eine Korrelation mit einer Regressionsgleichung von DRI (y) = 1,02 (x) - 0,63 und ein Korrelationskoeffizient (r) von 0,993 ermittelt. Spezifität Es wurden Verbindungen mit einer chemischen Struktur ähnlich zu der von Thyroxin und bestimmte gleichzeitig verwendete Verbindungen auf mögliche Kreuzreaktivität im ThyroxinAssay getestet. Die Kreuzreaktivität in % wurde als Prozent der beobachteten äquivalenten T4-Konzentration bei Hinzugabe der getesteten Konzentration des Kreuzreaktanten zu einem T4-Negativ-Serum ermittelt. Verbindung Konzentr. getestet (μg/dl) Kreuzreaktivität % Triiodothyronin (T3) 10 3,2* Tiratricol (Triiodessigsäure) 10 0,5* Tetraiodessigsäure 10.000 25,3* 3,5-Diiodothyronin 10.000 0,0 3,5-Diiodotyrosin 10.000 0,0 Iodotyrosin 10.000 0,0 Methimazol 10.000 0,0 Phenylbutazon 10.000 0,0 Phenytoin 10.000 0,0 Propylthiouracil 10.000 0,0 Tyrosin 10.000 0,0 Paracetamol 100.000 0,0 Acetylsalicylsäure 100.000 0,0 Microgenics Corporation 46500 Kato Road Fremont, CA 94538 USA Kundenbetreuung und technischer Support in den USA: 1-800-232-3342 * Die getesteten Konzentrationen lagen deutlich über den normalen Serumkonzentrationen dieser Verbindungen. Aus diesem Grund ist die Kreuzreaktivität klinisch nicht relevant. Hämolysierte (bis zu 800 mg/dl Hämoglobin), lipämische (bis zu 1.000 mg/dl Triglyceride oder 400 mg/dl Cholesterol) und ikterische (bis zu 30 mg/dl Bilirubin) Proben zeigten keine klinisch signifikante Wechselwirkung mit dem Assay. Microgenics GmbH Spitalhofstraße 94 D-94032 Passau, Deutschland Tel.: +49 851 886890 Fax: +49 851 8868910 Aktualisierungen der Packungsbeilage finden Sie unter: www.thermoscientific.com/diagnostics Andere Länder: Bitte wenden Sie sich an die Thermo Fisher Scientific Vertretung in Ihrer Region. 0475-7 2015 09 2