Methoden - BIOspektrum
Werbung
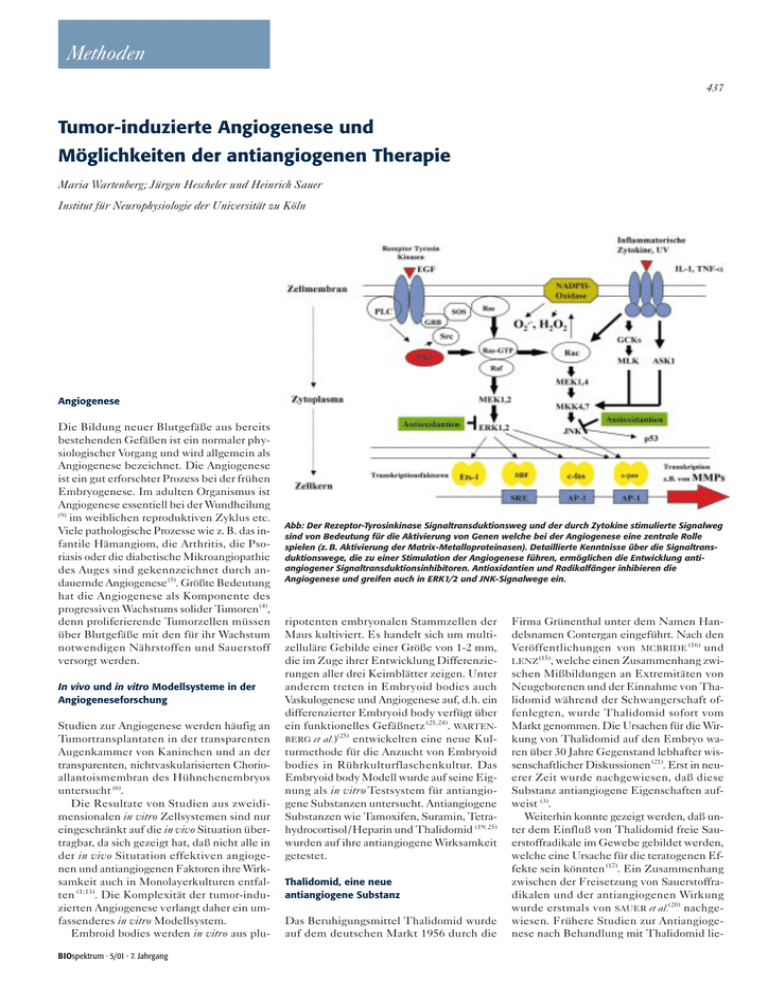
Methoden 437 Tumor-induzierte Angiogenese und Möglichkeiten der antiangiogenen Therapie Maria Wartenberg; Jürgen Hescheler und Heinrich Sauer Institut für Neurophysiologie der Universität zu Köln Angiogenese Die Bildung neuer Blutgefäße aus bereits bestehenden Gefäßen ist ein normaler physiologischer Vorgang und wird allgemein als Angiogenese bezeichnet. Die Angiogenese ist ein gut erforschter Prozess bei der frühen Embryogenese. Im adulten Organismus ist Angiogenese essentiell bei der Wundheilung (9) im weiblichen reproduktiven Zyklus etc. Viele pathologische Prozesse wie z. B. das infantile Hämangiom, die Arthritis, die Psoriasis oder die diabetische Mikroangiopathie des Auges sind gekennzeichnet durch andauernde Angiogenese (5). Größte Bedeutung hat die Angiogenese als Komponente des progressiven Wachstums solider Tumoren (4), denn proliferierende Tumorzellen müssen über Blutgefäße mit den für ihr Wachstum notwendigen Nährstoffen und Sauerstoff versorgt werden. In vivo und in vitro Modellsysteme in der Angiogeneseforschung Studien zur Angiogenese werden häufig an Tumortransplantaten in der transparenten Augenkammer von Kaninchen und an der transparenten, nichtvaskularisierten Chorioallantoismembran des Hühnchenembryos untersucht (6). Die Resultate von Studien aus zweidimensionalen in vitro Zellsystemen sind nur eingeschränkt auf die in vivo Situation übertragbar, da sich gezeigt hat, daß nicht alle in der in vivo Situtation effektiven angiogenen und antiangiogenen Faktoren ihre Wirksamkeit auch in Monolayerkulturen entfalten (1; 13). Die Komplexität der tumor-induzierten Angiogenese verlangt daher ein umfassenderes in vitro Modellsystem. Embroid bodies werden in vitro aus pluBIOspektrum . 5/01 . 7. Jahrgang Abb: Der Rezeptor-Tyrosinkinase Signaltransduktionsweg und der durch Zytokine stimulierte Signalweg sind von Bedeutung für die Aktivierung von Genen welche bei der Angiogenese eine zentrale Rolle spielen (z. B. Aktivierung der Matrix-Metalloproteinasen). Detaillierte Kenntnisse über die Signaltransduktionswege, die zu einer Stimulation der Angiogenese führen, ermöglichen die Entwicklung antiangiogener Signaltransduktionsinhibitoren. Antioxidantien und Radikalfänger inhibieren die Angiogenese und greifen auch in ERK1/2 und JNK-Signalwege ein. ripotenten embryonalen Stammzellen der Maus kultiviert. Es handelt sich um multizelluläre Gebilde einer Größe von 1-2 mm, die im Zuge ihrer Entwicklung Differenzierungen aller drei Keimblätter zeigen. Unter anderem treten in Embryoid bodies auch Vaskulogenese und Angiogenese auf, d.h. ein differenzierter Embryoid body verfügt über ein funktionelles Gefäßnetz (25, 24). WARTEN(25) BERG et al.) entwickelten eine neue Kulturmethode für die Anzucht von Embryoid bodies in Rührkulturflaschenkultur. Das Embryoid body Modell wurde auf seine Eignung als in vitro Testsystem für antiangiogene Substanzen untersucht. Antiangiogene Substanzen wie Tamoxifen, Suramin, Tetrahydrocortisol/Heparin und Thalidomid (19; 25) wurden auf ihre antiangiogene Wirksamkeit getestet. Thalidomid, eine neue antiangiogene Substanz Das Beruhigungsmittel Thalidomid wurde auf dem deutschen Markt 1956 durch die Firma Grünenthal unter dem Namen Handelsnamen Contergan eingeführt. Nach den Veröffentlichungen von MCBRIDE (16) und (15) LENZ , welche einen Zusammenhang zwischen Mißbildungen an Extremitäten von Neugeborenen und der Einnahme von Thalidomid während der Schwangerschaft offenlegten, wurde Thalidomid sofort vom Markt genommen. Die Ursachen für die Wirkung von Thalidomid auf den Embryo waren über 30 Jahre Gegenstand lebhafter wissenschaftlicher Diskussionen (21). Erst in neuerer Zeit wurde nachgewiesen, daß diese Substanz antiangiogene Eigenschaften aufweist (3). Weiterhin konnte gezeigt werden, daß unter dem Einfluß von Thalidomid freie Sauerstoffradikale im Gewebe gebildet werden, welche eine Ursache für die teratogenen Effekte sein könnten (17). Ein Zusammenhang zwischen der Freisetzung von Sauerstoffradikalen und der antiangiogenen Wirkung wurde erstmals von SAUER et al.(20) nachgewiesen. Frühere Studien zur Antiangiogenese nach Behandlung mit Thalidomid lie- Methoden 438 ferten keine Aussagen zum molekularen Wirkungsmechanismus. Von grundsätzlicher Bedeutung war die Feststellung von SAUER et al.(20), daß hochreaktive Hydroxylradikale nach Behandlung von Embroid bodies mit Thalidomid gebildet wurden. Thalidomid und seine Metabolite verhindern in Embroid bodies die Ausbildung kapillärer Netzwerke. Bei gemeinsamer Inkubation von Thalidomid mit spezifischen Radikalfängern für Hydroxylradikale (Mannitol, 2-Mercaptoethanol) kann dieser Effekt jedoch aufgehoben werden. Reaktive Sauerstoffintermediate (RSI) und Angiogenese Unter physiologischen Bedingungen entstehen Superoxidanionen und Wasserstoffperoxid in der Zelle und greifen als sekundäre Botenmoleküle in Signalwege ein. Ein niedriger Spiegel an Superoxidanionen und Hydrogenperoxid fördert Prozesse wie Zellproliferation und Differenzierung bei vaskulärem Zellwachstum (7). Zum Zelltod (Apoptose) führen hohe Konzentrationen an RSI, eine besondere Bedeutung haben hier die hoch reaktiven Hydroxylradikale. Mit einem Redox-Potential von +2V sind Hydroxylradikale in biologischen Systemen sehr toxisch, da sie mit fast jeder Art Molekül reagieren. Im Gegensatz zu der oben beschriebenen Wirkung der Hydroxylradikale ist für Wasserstoffperoxid eine Förderung verschiedener an der Angiogenese beteiligter Faktoren beschrieben. An isolierten Endothelzellen konnte eine Stimulation der Zellteilung und der Tubenbildung unter dem Einfluß niedriger (nano- bis mikromolarer) Konzentrationen Hydrogenperoxid festgestellt werden (14). Ein Transkriptionsfaktor, Ets-1 , wurde aktiviert, welcher die Expression verschiedener für die Angiogenese bedeutungsvoller Gene aktiviert, z.B. die der Matrix- Metalloproteinasen (MMP) (26). Die Transkriptionsfaktoren c-Jun und NF-kB waren an der Steuerung der Morphogenese Mikrovaskulärer Strukturen beteiligt. Der für die Angiogenese wichtige Wachstumsfaktor VEGF bindet an Rezeptor-Tyrosin Kinasen Flt-1 oder KDR/Flk-1 und aktiviert einen Signaltransduktionsweg an dem MAPKinasen beteiligt sind (18). Da es im weiteren zu einer Aktivierung des Transkriptionsfaktors Ets-1 kommt, besteht die Möglichkeit, daß RSI auf dem Signalweg zwischen den Rezeptor- Tyrosinkinasen und der Ets-1 Aktivierung über MAP-Kinasen eine regulatorische Funktion ausüben. Für zahlreiche Wachstumsfaktoren (EGF, NGF, PDGF) konnte eine Einbindung von RSI als sekundäre Boten in den Signalweg nachgewiesen werden, erstaunlicherweise ist dieser Schritt für VEGF bisher ungeklärt. Der Promotor des VEGF-Gens hat verschiedene potentielle Bindungsstellen für Sp1, AP-1 und AP-2 (23). Eine neue Gruppe zytostatischer Therapeutika sind Signaltransduktionsinhibitoren, welche gezielt die Funktion von Onkogenen blockieren (12). Dazu gehören z.B Herceptin und ras Farnesyltransferaseinhibitoren. Gezielt inhibitorisch auf die Angiogenese wirken auch Matrix-Metalloproteinase-Inhibitoren wie Maristamat. KERBEL et al.(11) verwendete in Tierversuchen an Mäusen neutralisierende Antikörper gegen den VEGFRezeptor als antiangiogene Therapiekomponente und niedrige Dosen von Vinblastin in einer kontinuierlichen Kombinationsbehandlung. Die Behandlung führte zu einem dauerhaften Rückgang der Tumoren ohne zusätzliche Belastung des Wirtsorganismus durch die Toxizität der Therapeutika. Innerhalb von 6 Monaten kontinuierlicher Behandlung wurden keine Anzeichen für eine erworbene Resistenz festgestellt. Eine Kombination der antiangiogenen Therapie mit konventioneller Chemotherapie wurde bereits von TEICHER et al.(22) vorgeschlagen und stellt gegenwärtig das hoffnungsvollste Konzept dar. Einordnung der Antiangiogenese in das Feld therapeutischer Strategien Eine Verhinderung der Angiogenese während der Tumortherapie ist sinnvoll, da durch diese Maßnahme das Wachstum der Tumoren eingeschränkt oder gestoppt wird und eine weitere Metastasierung verhindert wird. Die antiangiogene Therapie umgeht das Problem der erworbenen Chemotherapeutikaresistenz, welches häufig in Folge von Chemotherapie auftritt. Tumorzellen haben eine hohe genetische Instabilität und bilden in Folge der Chemotherapie Subpopulationen resistenter und weniger resistenter Zellen(10). Endothelzellen in tumorassoziierten Gefäßen sind genetisch stabil, wodurch eine Resistenzentwicklung gegenüber antiangiogenen Therapeutika verhindert wird (2). Ein weiterer bedeutender Vorteil der antiangiogenen Therapie ist die gute Zugänglichkeit aller Gefäße für die Therapeutika. Chemotherapeutika gelangen in großen soliden Tumoren häufig nicht an ihren Zielort, da sie in peripheren gut kapillarisierten Schichten des Tumors stark akkumulieren, jedoch in tiefere Schichten des Tumors, in welchen ein erhöhter Gewebedruck herrscht, gar nicht eindiffundieren können(8). Mit einer durchdachten Kombination aus Chemotherapie und antiangiogener Therapie könnte ein neuer, für den Patienten verträglicherer Weg, bei der Behandlung solider Tumore gegangen werden. Literatur [1] Blood, C. H. and Zetter, B. R. (1990): Tumor interactions with the vasculature: angiogenesis and tumor metastasis. Biochim. Biophys. Acta, 1032: 89-118. [2] Boehm, T., Folkman, J., Browder, T. and O'Reilly, M. S. (1997): Antiangiogenic therapy of experimental cancer does not induce acquired drug resistance. Nature, 390: 404-407. [3] D’Amato, R. J., Loughnan, M. S., Flynn, E. and Folkman, J. (1994): Thalidomide is an inhibitor of angiogenesis. Proc. Natl. Acad. Sci .U.S.A, 91: 4082-4085. [4] Folkman, J. (1976): The vascularization of tumors. Sci. Am., 234: 58-3. [5] Folkman, J. and Shing, Y. (1992): Angiogenesis. J. Biol. Chem., 267: 10931-10934. [6] Gimbrone, M. A., Jr., Cotran, R. S., Leapman, S. B. and Folkman, J. (1974): Tumor growth and neovascularization: an experimental model using the rabbit cornea. J. Natl. Cancer Inst., 52: 413-427. [7] Irani, K. (2000): Oxidant signaling in vascular cell growth, death, and survival: a review of the roles of reactive oxygen species in smooth muscle and endothelial cell mitogenic and apoptotic signaling. Circ. Res., 87: 179-183. [8] Jain, R. K. (1994): Barriers to drug delivery in solid tumors. Sci. Am., 271: 58-65. BIOspektrum . 5/01 . 7. Jahrgang Methoden 439 [9] Jang, Y. C., Arumugam, S., Gibran, N. S. and Isik, F. F. (1999): Role of alpha(v) integrins and angiogenesis during wound repair. Wound. Repair Regen., 7: 375-380. [10] Kerbel, R. S. (1997): A cancer therapy resistant to resistance. Nature, 390: 335-336. [11] Kerbel, R. S., Viloria-Petit, A., Klement, G. and Rak, J. (2000): ‘Accidental’ anti-angiogenic drugs. anti-oncogene directed signal transduction inhibitors and conventional chemotherapeutic agents as examples. Eur. J. Cancer, 36: 1248-1257. [12] Kerbel, R. S., Viloria-Petit, A., Okada, F. and Rak, J. (1998): Establishing a link between oncogenes and tumor angiogenesis. Mol. Med., 4: 286-295. [13] Kim, K. J., Li, B., Winer, J., Armanini, M., Gillett, N., Phillips, H. S. and Ferrara, N. (1993): Inhibition of vascular endothelial growth factor-induced angiogenesis suppresses tumour growth in vivo. Nature, 362: 841-844. [14] Lelkes, P. I., Hahn, K. L., Sukovich, D. A., Karmiol, S. and Schmidt, D.H. (1998): On the possible role of reactive oxygen species in angiogenesis. Adv. Exp. Med. Biol., 454: 295-310. [15] Lenz W. (1962): Thalidomide and congenital abnormalities. Lancet, 1: 45 [16] McBride, W. G. (1961): Thalidomide and congenital abnormalities. Lancet, 2: 1358 BIOspektrum . 5/01 . 7. Jahrgang [17] Parman, T., Wiley, M. J. and Wells, P.G. (1999): Free radical-mediated oxidative DNA damage in the mechanism of thalidomide teratogenicity. Nat. Med., 5: 582-585. [24] Vittet, D., Prandini, M. H., Berthier, R., Schweitzer, A., Martin-Sisteron, H., Uzan, G. and Dejana, E. (1996): Embryonic stem cells differentiate in [18] Sato, Y., Abe, M., Tanaka, K., Iwasaka, C., vitro to endothelial cells through successive maturation steps. Blood, 88: 3424-3431. Oda, N., Kanno, S., Oikawa, M., Nakano, T. and Igarashi, T. (2000): Signal transduction and transcrip- tional regulation of angiogenesis. Adv. Exp. Med. Biol., 476: 109-115. [19] Sauer, H., Gunther, J., Hescheler, J. and Wartenberg, M. (2000): Thalidomide inhibits angiogenesis in embryoid bodies by the generation of hydroxyl radicals. Am. J. Pathol., 156: 151-158. [20] Sauer, H., Gunther, J., Hescheler, J. and Wartenberg, M. (2000): Thalidomide inhibits angiogenesis in embryoid bodies by the generation of hydroxyl radicals. Am. J. Pathol., 156: 151-158. [21] Stephens, T. D. (1988): Proposed mechanisms of action in thalidomide embryopathy. Teratology, 38: 229-239. [22] Teicher, B. A., Sotomayor, E. A. and Huang, Z. D. (1992): Antiangiogenic agents potentiate cytotoxic cancer therapies against primary and metastatic disease. Cancer Res., 52: 6702-6704. [23] Tischer, E., Mitchell, R., Hartman, T., Silva, M., Gospodarowicz, D., Fiddes, J. C. and Abraham, J. A. (1991): The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing. J. Biol. Chem., 266: 11947-11954. [25] Wartenberg, M., Gunther, J., Hescheler, J. and Sauer, H. (1998): The embryoid body as a novel in vitro assay system for antiangiogenic agents. Lab Invest, 78: 1301-1314. [26] Yasuda, M., Ohzeki, Y., Shimizu, S., Naito, S., Ohtsuru, A., Yamamoto, T. and Kuroiwa, Y. (1999): Stimulation of in vitro angiogenesis by hydrogen peroxide and the relation with ETS-1 in endothelial cells. Life Sci., 64: 249-258. Korrespondenzadresse Dr. Heinrich Sauer Institut für Neurophysiologie Robert-Koch-Str. 39 D-50931 Köln Tel.: (0221) 478 69 76 Fax: (0221) 34 45 27











