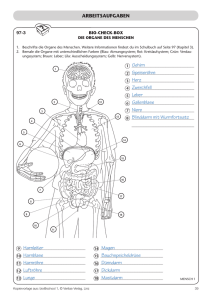
Notizen: Isolierung von Glycerinaldehyd
Werbung

464 N O T IZ E N OH OH O N Ho > -C H a N (O H — N' NH y \ N/ H Acetoin H N A c e to in ■CH, OH N NH O N' I Rib. E ib . II Ill stanz: 0,12; Riboflavin 0,28. Die G-Komponente wurde eluiert und nach dem Eindampfen 25 cm3 Nährmedium zugesetzt (350 Imp./min/ml). Beim Bebrüten mit E. ashbyii wurden 70% der G-Komponente zurückgewon­ nen. Höchstens 1% kann in Riboflavin umgewandelt sein. Synthetisch dargestelltes Diaminouracil (4-14C, lOmC/mMol) II [Rib = H ] wie auch Orotsäure 6 (4-14C, 3 mC/mMol) wurden durch E. ashbyii ebenfalls nicht in Riboflavin umgewandelt. Aus radioaktivem Threonin entsteht kein Acetoin. Damit war durch unsere Versuche das Schema der Biosynthese von Riboflavin nach M a s u d a nicht zu be­ stätigen. In Übereinstimmung mit diesem Befund steht eine neue Arbeit von M c N u t t und F o r r e s t 7, die aus einem offenbar anderen Stamm von E. ashbyii ein bis­ her unbekanntes 2.4-Dihydroxy-pteridin isolieren konn­ ten, das jedoch mit dem von M a s u d a gefundenen, wel­ ches auch in unserer Kultur entstand, nicht identisch ist. Dieses Pteridin (Substanz A ) wird bei Einsatz von 14C-Guanin radioaktiv. Aus ihm entsteht bei Bebrütung mit E. ashbyii ebenfalls kein Riboflavin. Die Vermu­ tung, daß Pteridine in Riboflavin umgewandelt wer­ den können8, ließ sich bisher experimentell nicht be­ stätigen. Eine ausführliche Beschreibung erfolgt an an­ derer Stelle. Isolierung von G lycerinaldehyd-D ehydrogenase um 1, welches durch das Enzym 1-Phosphofructaldolase (Leber, N ie re 2,3) in Dihydroxyacetonphosphat und D-Glycerinaldehyd gespalten wird. aus R attenleber Z u r Biochemie des Fructosestoffwechsels Von W alther L amprecht und F ritz H ein z Organisch-chemisches Institut der Technischen Hochschule München (Z. Naturforsehg. 13 b, 464— 465 [1958] ; eingegangen am 10. A p ril 1958) Es wird das Enzym „Glycerinaldehyd-Dehydrogenase“ beschrieben, w el­ ches unter DPN-Hs-Bildung d - und DL-Glycerinaldehyd zu Glycerinsäure oxydiert. Damit wird eine unter Umgehung des klassischen E m b d e n M e y e r h o f - Weges speziell für den glykolytischen Fructoseabbau exi­ stierende Enzymkette der Leber geschlossen, die den Ketozucker in vier Reaktionsschritten direkt zu 3-Phosphoglycerinsäure umsetzt. Seit den Arbeiten L e u t h a r d t s weiß man, daß bereits die ersten enzymatischen Reaktionen der Fructose nicht dem klassischen E m b d e n - M e y e r h o f - W eg fol­ gen. Während Glucose mittels Adenosintriphosphat (A T P ) und Hexokinase als Glucose-6-phosphat in den glykolytischen Abbau eintritt, setzt sich der Ketozucker mit Fructo- oder Ketokinase zu Fructose-l-phosphat 1 F. L e u t h a r d t , E. T e s t a u . H. P. W o l f , Helv. chim. 36,227 [1953]. 2 F. L e u t h a r d t u . H. P. W o l f , Helv. chim. Acta 36, [1953]. 3 H. P. W o l f u . F. L e u t h a r d t , Helv. chim. Acta 40, [1957], 4 H . G. H e r s u . T. K u s a k a , Biochim. biophysica Acta sterdam] 11,427 [1953]. Acta u . W. P a u l u s , Diplomarbeit, Bonn 1958; K . S t ö Diplomarbeit, Bonn 1958. 7 W. S. M c N u t t u . H . S. F o r r e s t , J. Amer. chem. Soc. 80, 951 [1958]. 8 H . A. N a t h a n u . S. H . H u t n e r , Nature [London] 178, 741 [1956], 6 F. K r ik o Zur Verw ertung des D-Glycerinaldehydes im Stoff­ wechsel der Leber sind derzeit folgende Reaktions­ möglichkeiten beschrieben: 1. Phosphorylierung mit A T P (in R attenleber) zu 3-Phosphoglycerinaldehyd (H ers und K u s a k a 4) . Diese Versuche bedürfen einer Bestätigung. 2. Reduktion mit Glycerindehydrogenase und D P N -H 2 zu G lycerin ( L euthardt und W o l f 5). G lycerindehydrogenase ist identisch mit der A lk oh ol­ dehydrogenase der Leber (H olzer und S chneider 6), allerdings soll L-Glycerinaldehyd bevorzugt umgesetzt w e rd e n 5. 3. Disproportionierung zu Glycerin und D-Glycerinsäure, katalysiert durch Glycerindehydrogenase ( A l ­ koholdehydrogenase) und G r e e n scher Aldehydmutase1’ 7) 8. L euthardt hat bei bestimmten Versuchs­ bedingungen nach Fructosegaben aus Leber D-Glycerinsäure is o lie rt1. W ir sind dagegen von der Annahme ausgegangen, die Leberzelle könne D-Glycerinaldehyd über D-Glycerin5 1463 6 1033 7 [Am ­ örte , 8 H. P. W o l f u . F. L e u t h a r d t , Helv. chim. Acta, 36, 1463 [1 9 53 ] ; F. L e u t h a r d t u . H. P. W o l f , Helv. chim. Acta 37, 1732 [1954]. H . H o l z e r u . S . S c h n e i d e r . Angew. Chem. 67, 276 [1955] ; Klin. Wschr. 33, 1006 [1955]. H . H o l z e r u . A. H o l l d o r f , Biochem. Z. 329, 283 [1957]. E. G r e e n , D . M. N e e d h a m u . J. G . D e w a n , Biochem. J. 31, 2327 [1937]. Unauthenticated Download Date | 2/13/17 11:01 PM NOTIZEN säure zu 3-D-Phosphoglycerinsäure umsetzen 9>10; wir konnten auch die für die beiden Schritte verantwortli­ chen Enzyme aus Rattenleber anreichern. Über eines dieser Enzyme, welches Glycerinsäure mittels A T P zu 3-Phosphoglycerinsäure umsetzt, wurde inzwischen von I c h i h a r a und G r e e n b e r g 11, B l a c k und W r i g h t 12 sowie von H o l z e r und H o l l d o r f 13 berichtet („Glyceratkinase“ ) . Aus Rattenleber-Extrakten reicherten wir eine Pro­ teinfraktion an, welche d - und DL-Glycerinaldehyd unter DPN-H2-Bildung zu Glycerinsäure oxydiert. Das Enzym findet sich bei der Ammoniumsulfat-Fraktionierung (mit „Periston“ aufgeschlossene Leber) in der Fraktion zwi­ schen 0 und 0,4 Ammonsulfatsättigung. Die Protein­ fraktion zeigt nach der Dialyse gegen neutrale 0,001-m. Äthylendiamintetraacetat-Lösung und nach mehrmali­ gem Umfällen keine Alkoholdehydrogenase-Aktivität mehr. Lösungen des Enzyms (Wasser oder Ammon­ sulfat) sind nach den ersten Salzfällungen, besonders solange sie noch mit viel Fremdprotein verunreinigt sind, sehr instabil; nach 24 Stdn. (2 °) sinkt die Aktivi­ tät auf wenige Prozente des Ausgangswertes. W ir nennen das Enzym in Anlehnung an L e u t h a r d t 1 „Glycerinaldehyddehydrogenase“ . Es oxydiert in Gegen­ wart von DPN® ebenso Acetaldehyd, das Verhältnis der Umsatzzahlen Glycerinaldehyd zu Acetaldehyd ist 1,50. Die Dehydrase scheint mit der von R a c k e r an­ gereicherten Aldehydoxydase identisch zu sein14, wenn­ gleich die Glycerinaldehydoxydation mittels dieser Oxydase useres Wissens nie beschrieben wurde. Ein nach R a c k e r dargestelltes Aldehydoxydase-Präparat ergab ein Verhältnis der Umsatzzahlen Glycerinaldehyd zu Acetaldehyd von 1,55. Die M i c h a e l i s - Konstante der Glycerinaldehyd­ dehydrogenase ist für D- und DL-Glycerinaldehyd Ky[ = 2 • 10-4 Mol// (pn = 9,15). Km konnte für Acet­ aldehyd nicht bestimmt werden, denn die Proportio­ 465 nalität der Reaktionsgeschwindigkeiten bei variierender Substrat- oder Enzymkonzentration ist nur innerhalb sehr enger Bereiche gewahrt, die Sättigungsgrenze des Enzym-Substrat-Komplexes war nicht meßbar. Die Aldehydoxydase R a c k e r s kann daher auf Grund dieser Kinetik nur eine charakteristische „Glycerinaldehydoxydase“ (besser „Glycerinaldehyddehydro­ genase“ ) sein, wobei Umsätze mit Acetaldehyd oder anderen Aldehyden dann unspezifische Reaktionen wären. M it dem Nachweis der Glycerinaldehyddehydrogen­ ase wird eine — unter Umgehung des E m b d e n M e y e r h o f - Weges — speziell für den glykoly ti­ schen Fructoseabbau existierende Enzymkette der Leber vervollständigt; der Ketozucker kann in vier Reaktionsschritten direkt zu 3-Phosphoglycerinsäure umgesetzt werden (vgl. Schema). Wenn Fructose auf diesem Wege abgebaut wird, umgeht sie vor allem (zumindest mit 1/2 M ol) den im Glucosestoffwechsel oft limitierenden Schritt der Substratphosphorylierung auf der Stufe der Triosephosphatdehydrierung9>10. Die oft bevorzugte Stellung der Fructose bei pathologischen Stoffwechselsituationen könnte somit in vielen Fällen deutbar werden. Nach früheren Untersuchungen von H elmreich , H ol­ L amprecht und G oldschmidt 15 enthält die Leber diabetischer oder hungernder Ratten nur noch 23% der normalen D P N -H 2-Konzentration, sie bleibt nach G lu­ cosezufuhr unverändert, nach Fructosegaben erreicht D P N -H 2 w ieder den Norm alwert. Das Gleichgewicht der Reaktion Glycerinaldehyd/Glycerinsäure liegt auf seiten der Säure, also der D P N -H 2-Bildung. Danach bevorzugt das glykolytische System der Leberzelle im Zuge des Fructoseabbaues aus den zur Verwertung des D-Glycerinaldehyds konkurrierenden Enzymmecha­ nismen die einzige D P N -H 2-liefernde Reaktion, eben die der Glycerinaldehyddehydrogenase. zer , G lu c o s e 1 Glucose-6-phosphat 11 F ru c to se F ructose-6-phosphat Fructose-l-phosphat Fructose-1.6-diphosphat U t t t t Dihydroacetonphosphat I a-Glycerophosphat — _ u . Glycerin 11i D -G ly c e rin a ld e h y d D -G ly c e rin s ä u re Phosphoglycerinaldehyd 11 1.3-Diphosphoglycerinsäure U 3-Phosphoglycerinsäure Brenztraubensäure r a u t s c h o l d , Dissertation, Techn. Hochschule München 1958. 10 W. L a m p r e c h t u . I . T r a u t s c h o l d , Hoppe-Seyler’s Z. physiol. Chem. 311, 245 [1958]. 11 A. I c h i h a r a u . D. M. G r e e n b e r g , J. biol. Chemistry 225, 949 [1957]. 9 I. T 12 S. B l a c k u . N. G . W r i g h t , Fed. Proc. 15, 222 [1956] u. J. biol. Chemistry 221, 171 [1956], 13 H . H o l z e r u . A. H o l l d o r f , Biochem. Z. 329, 292 [1957]. 14 E. R a c k e r , J. biol. Chemistry 177, 883 [1949]. 15 E. H e l m r e i c h , H . H o l z e r , W . L a m p r e c h t u . S t . G o l d s c h m id t , Hoppe Seyler’s Z. physiol. Chem. 292, 113 [1954]. Unauthenticated Download Date | 2/13/17 11:01 PM